Способы консервации органов. Методы консервации органов
Добавил пользователь Валентин П. Обновлено: 21.01.2026
1) при хранении плотного вирусного материала (кусочки органов или тканей) часто используют глицерин (50%-ный раствор на физиологическом растворе), который обладает бактериостатическим действием и в то же время защищает вирусы. В этом случае вирус можно хранить при 4°С несколько месяцев;
2) чаще всего вирусы хранят в холодильниках, обеспечивающих температуру минус 20, минус 30, минус 70 °С. При этой температуре некоторые вирусы без добавки защитных веществ сравнительно быстро теряют инфекционность. Известно, что чем меньше белка в вируссодержащей взвеси, тем меньше стабильность вирусов, поэтому очищенные вирусы быстро теряют свою биологическую активность. Хорошее защитное действие при замораживании и хранении вирусов оказывает добавка одного из следующих компонентов: инактивированной сыворотки крови, обезжиренного молока (от 10 до 30 %), желатина (0,5-1,5 %), ДМСО (10 %) и др. При быстром замораживании вируса до минус 196 °С (жидкий азот) с последующим хранением при этой температуре титр вируса в течение нескольких месяцев не снижается. Вирусы, чувствительные к низким значениям рН, следует замораживать в жидкостях, не содержащих однозамещенных фосфатов (NaH2PO4 или КН2РО4), которые обладают кислой реакцией и имеют более низкую точку замерзания, чем двузамещенные фосфаты (Na9HPO4 или К2НРО4) с щелочной реакцией.
Скорость оттаивания вируса существенно не влияет на его активность. Размораживать вирусы можно как при комнатной температуре, так и в водяной бане при температуре 37 °С. Во избежание частого замораживания и оттаивания одного и того же вируссодержащего материала необходимо хранить его маленькими порциями, достаточными для одноразового титрования или использования, например для реакции нейтрализации;
3) лиофилизация, т. е. высушивание в замороженном состоянии в условиях вакуума, - очень хороший способ консервирования вирусов. Для лиофилизации необходимы соответствующая аппаратура, определенный (в зависимости от вида вируса) наполнитель и тщательное выполнение процедуры сушки. На стойкость лиофилизированного вируса влияет не только выбор соответствующего наполнителя, но и состав газа в ампуле (уже 0,5 % кислорода вызывают быструю гибель вируса, в то время как влажность в границах 2-3 % существенно не влияет) и температура хранения лиофилизата - не выше 4 °С. Лиофилизацию лучше проводить в учреждениях, хорошо знакомых с этой методикой. В лиофилизированном виде вирусы могут храниться несколько лет.
Вирусологическая лаборатория должна иметь следующую документацию:
- журнал вирусологических исследований (экспертиз, сельхозучета, формы № 13-вет);
- журнал учета зараженных животных;
- журнал учета выделенных вирусов и их уничтожения;
- журнал учета движения производственных или музейных штаммов и другие книги учета согласно утвержденной инструкции.
Задания:
1. Ознакомиться с вирусологической лабораторией и ее основным оборудованием.
КОНСЕРВИРОВАНИЕ КРОВИ
КОНСЕРВИРОВАНИЕ КРОВИ (лат. conservare хранить, сохранять) — методы хранения крови вне организма в состоянии ее биологической и функциональной полноценности. При консервировании кровь не утрачивает стерильности, жидкостных свойств в течение определенного срока, что позволяет заготавливать и применять ее для переливания с леч. целью.
Русский ученый В. В. Сутугин впервые в 1865 г. высказал идею К. к. с целью последующего использования ее при военной травме. В 1867 г.
B. Раутенберг предложил предотвращать свертывание крови с помощью добавления углекислого натрия. Планомерное изучение проблемы К. к. в СССР началось в 1926 г. в Москве, в первом в мире Научно-исследовательском ин-те гематологии и переливания крови. Большой вклад в разработку этой проблемы внесли Д. Н. Беленький, C. И. Спасокукоцкий, А. А. Багдасаров, С. Д. Балаховский, А. Н. Филатов, С. Е. Северин, Ф. Р. Виноград-Финкель, П. М. Максимов и многие другие.
В 30-х гг. для К. к. начали применять жидкость ЦИПК — 5% р-р цитрата для малого разведения (1:9) и глюкозоцитратный консервант ЦИПК № 1.
К 1940 г. в СССР были разрешены основные задачи проблемы К. к. и установлена леч. эффективность такой крови, что позволило широко внедрить в практику ее массовую заготовку. В период 1941 — 1945 гг. были разработаны способы предотвращения бактериального загрязнения крови при ее массовой заготовке и хранении, а также новые консервирующие среды с лимоннокислым цитратом натрия и антисептиками. Это значительно повысило качество К. к. и снизило опасность гемотрансфузионных осложнений.
В последующие годы продолжались теоретические и практические изыскания, направленные на удлинение сроков хранения крови при температурах выше и ниже 0° — в жидком и замороженном состоянии.
Консервирование крови при температурах выше 0°
Консервирование крови при температурах выше 0° проводится с целью: 1) стабилизировать кровь in vitro в жидком состоянии, т. е. предохранить от свертывания, связывания или разрушения любого ее компонента; 2) сохранить функц, активность и морфол. структуру клеток крови, позволяющие поддерживать на нормальном уровне или близком к нормальному обменные процессы в них и циркуляцию в кровеносной системе организма; 3) сохранить способность к приживаемости в организме реципиента после трансфузии; 4) сохранить кровь в стерильном состоянии .
Наибольшее распространение как стабилизаторы получили лимонная к-та и лимоннокислый цитрат натрия. Механизм их действия состоит в связывании ионов кальция, что предотвращает свертывание крови.
Динатриевая соль этилендиаминтетраацетата — ЭДТАNa2 — также связывает ионы кальция. Однако одновременно она вызывает связывание ионов калия и магния и ранний гемолиз консервированной крови, что ограничило ее применение. Гепарин (50—60 мг на 1 л крови) используется для стабилизации крови гл. обр. в аппаратах искусственного кровообращения. Недостатком его является ограничение сроков стабилизации (до 24 час.) и образование сгустков за счет инактивации гепарина, в связи с чем он применяется лишь для кратковременного (несколько часов) К. к.
Стабилизация крови может быть достигнута и без добавления хим. веществ — путем пропускания крови через колонку с катионообменными смолами. По этому принципу в Белорусском НИИ переливания крови Е. Д. Бугловым в 1969 г. разработан препарат M-1-фосфат целлюлозы.
Для К. к., кроме стабилизации, имеет значение сохранение морфол, целостности эритроцитов и их функц, полноценности. Для этого требуется постоянный приток основного субстрата питания этих клеток — глюкозы, а также средств, обеспечиващих ее утилизацию,— ферментов и коферментов.
Установлена прямая связь кислородно-транспортной функции эритроцитов с содержанием 2,3-дифосфоглицерата (2,3-ДФГ), его важная роль в регуляции сродства гемоглобина к кислороду и в процессе отдачи кислорода тканям: при низкой концентрации в эритроцитах 2,3-ДФГ сродство гемоглобина к кислороду повышено, при этом диссоциация оксигемоглобина и передача кислорода тканям затруднены; при высокой концентрации 2.3-ДФГ связи гемоглобина с кислородом ослаблены, оксигемоглобин диссоциирует быстрее и ткани легко извлекают кислород из его комплекса с гемоглобином. Известно, что АТФ, кроме участия в формировании 2,3-ДФГ, также может быть связана с гемоглобином и влиять на процесс отдачи кислорода тканям; поэтому предполагается корреляция кислородно-транспортной функции эритроцитов с содержанием 2.3-ДФГ и АТФ. Т. о., наряду со стабилизацией, основное требование к гемоконсервантам — пополнять недостаток АТФ и 2,3-ДФГ. Введение в цитратный р-р для К. к. глюкозы дало возможность продления синтеза АТФ и покрытия потребности эритроцитов в энергии. Кроме того, важным моментом явилось доведение pH консервирующих р-ров до 4,5—5,1 (при этом эритроциты медленнее потребляют глюкозу), что отдаляет наступление гемолиза и повышает посттрансфузионную выживаемость эритроцитов.
Кислые глюкозоцитратные р-ры начиная с 1947 г. получили признание во многих странах. Они позволяют сохранять консервированную кровь при t 4—8 до 21 дня с посттрансфузионной выживаемостью 70% перелитых эритроцитов, что является международным стандартом. В СССР применяется р-р ЦОЛИПК-76, ЛИПК-Л-6, в США и др. странах — р-р ACD.
Состав консервирующего р-р а ЦОЛИПК-76: лимоннокислый цитрат натрия — 2 г, глюкоза — 3 г, левомицетин — 0,015 г, бидистиллированная вода до 100 мл. Срок хранения — до 2 лет.
Состав гемоконсерванта ЛИПК-Л-6: лимоннокислый цитрат натрия — 2,5 г, глюкоза — 3 г, натрия сульфацил — 0,5 г, трипафлавин нейтральный — 0,025 г, бидистиллированная вода до 100 мл. Срок хранения — до 7 дней.
Кислые глюкозоцитратные р-ры стали основой для создания новых гемоконсервантов, напр, цитроглюкофосфата, содержащего 1 г лимонной к-ты, 0,75 г тринатрийфосфата, 3 г глюкозы, до 100 мл б о дистиллированной воды, нормального р-ра едкого натра до pH 5,7 (20 мл р-ра на 80 мл крови), позволяющего удлинить сохранность функ. полноценности эритроцитов. За рубежом применяется цитратно-фосфатный р-р с декстрозой — СРВ.
Включение в гемоконсерванты метаболитов углеводно-фосфорного обмена (аденин, инозин, пируват и др.) открыло новую перспективу в К. к.— возможность восстановления («омоложения») консервированных эритроцитов после предельно допустимых сроков (21 день) хранения. Инкубация длительно хранившихся консервированных эритроцитов с метаболитами углеводно-фосфорного обмена приводит к восстановлению утраченной в процессе хранения их функц, полноценности (содержания 2,3-ДФГ, АТФ, Р50 и других показателей). Последующее замораживание восстановленных эритроцитов в жидком азоте позволяет сохранять «омоложенные» клетки длительное время.
Разработаны методы получения и консервирования компонентов крови: эритроцитной, тромбоцитной, лейкоцитной массы и плазмы. Консервирование клеток крови имеет большое значение, особенно в связи с возрастающим использованием в леч. практике трансфузий отдельных компонентов вместо цельной крови.
Эритроцитная масса (см.) — наиболее распространенная Трансфузионная среда. Получают ее путем асептического удаления плазмы после отстаивания или центрифугирования консервированной крови; в последующем возможно хранение конц. эритроцитной массы (гематокрит до 70%)- В леч. практике применяется также отмытая эритроцитная масса (подвергнутая повторному асептическому отмыванию физиол. р-ром), особенно у реактивных больных (сенсибилизированных, аллергизированных и др.).
Для применения в клин, практике лейкоцитной и тромбоцитной масс разработаны методы их получения с использованием центрифугирования в пластикатной аппаратуре и коллоидных осадите лей. Лейкоцитная масса (см. Лейкоконцентрат) сохраняется до 24 час.
Тромбоцитная масса (см.) сохраняется в собственной плазме при t° 4° в течение 6—8 час., а при t° 22° в пластикатных мешках — 72 часа.
Выделение и хранение лейкоцитной и тромбоцитной масс, кроме пластикатной аппаратуры, осуществляют с помощью специальных фракционаторов для автоматического асептического разделения крови на компоненты и получения в больших количествах этих клеток от одного донора методом цитафереза. (см. Плазмаферез).
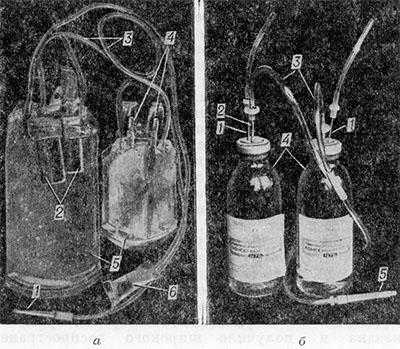
Рис. 1. Системы для взятия крови: а — пластикатные мешки (1 — инъекционная игла в колпачке; 2 — флаконы-спутники для анализа донорской крови; 3 — трубка между мешками; 4 — штуцеры для подсоединения систем для переливания крови или ее компонентов; 5 — мешки с консервирующим раствором; 6 — емкость для бактериологического исследования); б — стеклянные флаконы (1 — игла воздуховода; 2 — игла для подключения к флакону кровепроводящих трубок; 3 — пластикатные трубки для проведения крови во флаконы; 4 — флаконы с консервирующим раствором; 5 — игла инъекционная в колпачке).
Массовую заготовку консервированной крови и ее компонентов проводят учреждения службы крови (станции и отделения переливания крови) по единым методическим правилам. Кровь консервируется гл. обр. на стерильных гемоконсервантах 76 и цитроглюкофосфате, изготовляемых на заводах. Взятие крови от доноров в стеклянные флаконы или пластикатные мешки с гемоконсервантом производится в стационарных операционных станций и отделений переливания крови или по месту работы доноров, куда направляются специальные бригады, оснащенные всем необходимым для заготовки крови. Стерильность К. к. обеспечивается соблюдением строгих мер асептики при ее заготовке от доноров, использованием простерилизованных гемоконсервантов (в герметически укупоренных флаконах или пластикатных мешках) и замкнутых стерильных систем для взятия крови (рис. 1). Стерильность и качество консервированной крови строго контролируют путем выборочных бактериол, посевов, производимых на станциях и в отделениях переливания крови, а также макроскопической оценкой в леч. учреждениях перед выдачей для трансфузии.
Консервирование крови при температурах ниже 0°
Долгосрочное хранение клеток крови и плазмы возможно лишь при отрицательных температурах. При этом клетки сохраняются в анабиотическом состоянии — при подавлении метаболизма, но сохранении активности ферментных систем и жизнеспособности клеток.
Замораживание и хранение плазмы производят при t° —30°. Решению проблемы замораживания эритроцитов помогло установление факта, что ультрабыстрое охлаждение крови (100° в секунду) может происходить почти без кристаллического затвердевания (в тонком слое удавалось заморозить и сохранить малые объемы эритроцитов), и открытие криозащитного свойства глицерина, позволившего при смешении с эритроцитами сохранять их в замороженном состоянии. А. Д. Беляков с соавт. в 1956 г. и Ф. Р. Виноград-Финкель с соавт, в 1958 г. разработали метод сохранения клеточных элементов крови в переохлажденном состоянии при температурах ниже 0° (от —8 до —16°) без кристаллообразования.
В практике применяют два метода криоконсервирования эритроцитов: ультрабыстрое замораживание в жидком азоте (—196°) с малыми (15%) концентрациями глицерина или медленное замораживание с большой (30—50%) концентрацией глицерина при умеренных температурах (—40, —80°) в воздушной камере электрорефрижераторов. Эти методы позволяют длительно (годами) сохранять неповрежденными 85—95% эритроцитов.
Методика ультрабыстрого замораживания эритроцитной массы состоит в том, что из цельной донорской крови после центрифугирования эритроциты выделяют с соблюдением строгих условий асептики и смешивают их со стерильным ограждающим р-ром, содержащим глицерин. Смесь переводят в алюминиевый гофрированный контейнер или специальный пластикатный мешок и подвергают в течение 2 мин. замораживанию путем погружения в ванну с жидким азотом, после чего переносят в специальный бункер или камеру также с жидким азотом для последующего длительного хранения. Для использования замороженных эритроцитов контейнеры или мешки вынимают из жидкоазотного хранилища, подвергают оттаиванию путем помещения на 25 сек. в ванну с водой (t° 45°). После оттаивания производят отмывание эритроцитов от глицерина маннитно-солевыми, глюкозоманнитными, солевыми и другими р-рами с последовательно снижающейся гиперосмией до изоосмии. Для отмывания эритроцитов используют метод последовательного центрифугирования и сливания надстоя или автоматические фракционаторы различного типа для асептического отмывания размороженных эритроцитов в замкнутой системе. Отмытые эритроциты заливают равным объемом изотонических р-ров (сахарозоглюкозофосфатный, солевой и др.), после чего они пригодны для переливания в течение 24 час.
Методика медленного замораживания при умеренных температурах имеет свои преимущества — не требуется жидкоазотного оборудования, т. к. используются электрорефрижераторы. В качестве эндоцеллюлярного криофилактика широко применяют глицерин в большой концентрации (40%), хотя это и усложняет способы его отмывания после размораживания эритроцитов.
Для криоконсервирования лейкоцитов и тромбоцитов подобраны ограждающие р-ры, содержащие криофилактики эндоцеллюлярного (глицерин, диметилсульфоксид, диметилацетамид) или экзоцеллюлярного действия (поливинилпирролидон) в сочетании с углеводными р-рами (сахароза, глюкоза, аскорбиновая к-та). Замораживание клеток производят в специально сконструированных аппаратах, позволяющих охлаждать их по заданной программе. После программного замораживания и оттаивания лейкоцитов можно получать от 75 до 92% восстановленных клеток.
Существует метод разделения лейкоцитной массы на лимфоциты и гранулоциты. Размороженные лимфоциты предназначаются для типирования и переливания больным с угнетенной иммунол, активностью; гранулоциты можно использовать при лечении больных с септицемиями, агранулоцитозом и др.

Замораживание, хранение, оттаивание и отмывание эритроцитов и других клеток крови производятся в специально организованных отделениях (банках) долгосрочного хранения замороженной крови при учреждениях службы крови (рис. 2).
Клин, опыт подтверждает эффективность трансфузий взвеси размороженных эритроцитов при лечении острой кровопотери, анемий различной этиологии, при операциях на открытом сердце и при использовании аппарата «искусственная почка». Преимущества трансфузий размороженных отмытых эритроцитов заключаются в их лучшей переносимости (без посттрансфузионных реакций) больными, сенсибилизированными или аллергизированными предыдущими переливаниями крови или медикаментозными средствами. Они не содержат иммуноагрессивных клеточных (лейкоциты и тромбоциты) и белковых компонентов плазмы, являющихся основной причиной реакций при повторных трансфузиях (см. Переливание крови).
Метод криоконсервирования крови, помимо обеспечения многолетнего хранения, создания запасов крови редких групп, снижает риск заражения вирусным гепатитом В. Он также дает возможность широкого применения аутотрансфузий путем предварительного накопления крови от данного больного и длительного ее хранения в замороженном состоянии до момента операции или необходимости трансфузий (см. Аутогемотрансфузия).
Посмертная кровь
Идея заготовки и применения посмертной (трупной, постагональной, фибринолизной) крови была высказана и экспериментально обоснована B. Н. Шамовым в 1929 г., который доказал, что кровь трупов животных в первые 6—8 час. после смерти сохраняет свою полноценность, не имеет токсических свойств и оказывает леч. эффект при переливании обескровленным собакам. В 1930 г.
C. С. Юдин впервые с успехом произвел переливание посмертной крови больному с острой кровопотерей. Дальнейшие многолетние исследования ряда авторов послужили основанием для заключения о сохранности функц, полноценности посмертной крови, ее нетоксичности и выраженной леч. эффективности для человека.
Особым качеством посмертной крови является ее способность после заготовки свертываться, а затем «развертываться», т. е. сгусток вновь переходит в жидкое состояние. Это свойство, названное фибринолизом (см.), — сложный биол, процесс, происходящий в системе свертывания крови после смерти. Оно используется с диагностической целью: фибринолиз характерен только для крови скоропостижно скончавшихся людей и не наблюдается в случаях смерти после длительной агонии. Фибринолиз позволяет заготавливать и хранить кровь без добавления стабилизирующих средств. В СССР в Московском городском НИИ скорой помощи им. Н.Б. Склифосовского и Ленинградском городском НИИ скорой помощи им. проф. Ю. Ю. Джанелидзе накоплен большой опыт заготовки и применения посмертной крови. В ряде городов организованы специальные отделения для заготовки от трупов органов и тканей, в т. ч. крови. Существуют определенные правила взятия крови (в первые 6—8 час. после смерти) от внезапно умерших в результате острой сердечно-сосудистой недостаточности, спазма или склероза коронарных сосудов, инфаркта миокарда, гипертонической болезни, кровоизлияния в мозг, электротравмы, закрытой травмы черепа, спинного мозга, шейного отдела позвоночника, асфиксии от сдавления. Установлена возможность удлинения сроков хранения посмертной крови путем добавления специальных консервирующих р-ров (сахарозоглюкозофосфатного).
Использование посмертной крови, хранившейся при температуре 4—6°, разрешается после получения результатов лабораторного исследования крови и суд.-мед. вскрытия трупа. По данным К. С. Симоняна с соавт. (1975), ок. 24% заготовленной крови бракуется: 7% по бактериальному загрязнению, 13% по серол, показателям и примерно 4% на основании противопоказаний по данным патологоанатомического исследования.
Переливание посмертной крови не получило широкого распространения в леч. практике гл. обр. в связи с хорошей организацией донорства и службы крови, обеспечивающей леч. учреждения консервированной кровью.
Библиография: Аграненко В. А. и Обшиваловa H. Н. Метод восстановления (омоложения) консервированных эритроцитов предельных сроков хранения, Сов. мед., № 8, с. 66, 1976; Аграненко В. А. и др. Сравнительная характеристика эритроцитной массы и цельной крови, заготовленных на разных гемоконсервантах, Пробл, гематол, и перелив. крови, т. 21, № 8, с. 37, 1976; Виноград-Финкель Ф. Р. и др. Консервирование крови при температурах ниже 0°, там же, т. 3, № 1, с. 27, 1958; Гаврилов O.K. Научно-организационные основы службы крови, М., 1977; Голосова Т. В., Киселев А. Е. и Марголина А. Н. Асептика при заготовке консервированной крови, М., 1974, библиогр.; Руководство по применению крови и кровезаменителей, под ред. А. Н. Филатова, Л., 1973; Симонян К. С., Гутионтова К. П. и Цуринова Е. Г. Посмертная кровь в аспекте трансфузиологии, М., 1975, библиогр.; Шамов В.Н. Проблема переливания трупной крови, Нов. хир. арх., т. 36, кн. 3-4, с. 581, 1936; Юдин С. С. Избранные произведения, кн. 2, с. 309, М., 1960.
Заготовка, консервирование и хранение органов и тканей
Одна из самых бурно развивающихся дисциплин медицины в настоящее время ТРАНСПЛАНТОЛОГИЯ - наука о пересадке органов и тканей.
В широком понимании ТРАНСПЛАНТАЦИЯ (от латинского слова transplanto -пересаживать) есть перемещение органов или тканей от одного организма другому или из одной зоны в другую у одного индивида с целью замещения или восстановления утраченной функции или анатомического дефекта. Принцип всех трансплантаций - СВОБОДНАЯ пластика - пересадка тканей или органов с полным отделением их от материнского места во время операции, или пересадка заранее заготовленных донорских объектов. Когда с целью восстановления утраченной функции целый орган перемещают от одного организма другому (от донора реципиенту) с восстановлением его кровообращения в организме реципиента говорят об истинной ТРАНСПЛАНТАЦИИ или трансплантации органов. Именно органная трансплантация и является основным предметом трансплантологии. Помимо истинной трансплантации трансплантология занимается проблемами РЕПЛАНТАЦИИ, когда пораженный орган или ткань помещают обратно на прежнее место (оторванная конечность или ее части), а также ИМПЛАНТАЦИЕЙ, когда ткани или клетки во время операции переносят в близлежащую область для восстановления функции, утраченной в результате заболевания или травмы.
В зависимости от анатомической зоны, в которую помещают трансплантат выделяют ОРТОТОПИЧЕСКУЮ трансплантацию (орган помещают на свое анатомическое место) и ГЕТЕРОТОПИЧЕСКУЮ трансплантацию (орган перемещают в иное, не предназначенное ему природой место).
Помимо пересадки органов, в трансплантологии последних лет появилось новое перспективное направление клеточной трансплантации, когда с целью восстановления функции в организм реципиента пересаживаются культивированные клетки органа.
Источником тканей и органов для трансплантации являются практически здоровые люди погибшие от случайных причин (тяжелых травм не совместимых с жизнью) или скончавшиеся в результате остро развившихся тяжелых заболеваний (инфаркт миокарда, инсульт и т.п.). Наиболее оптимальным для трансплантологии источником являются близкие родственники пациента нуждающегося в пересадке органа или тканей. Это обусловлено тем, что при изогенной или сингенной трансплантации реакция тканевой несовместимости выражена мало и наступает достаточно быстрое выздоровление реципиента. Однако изогенная и сингенная трансплантация возможна только парных органов.
Другим, не менее важным источником для трансплантологии являются ткани трупа (кожа, сухожилия, кости, роговица и т.д.).
Несколько реже в качестве источника тканей для трансплантации используют животных.
Медицинским противопоказанием к изъятию тканей и органов для трансплантации являются все случаи смерти от инфекционных заболеваний, острых и хронических отравлений, злокачественных опухолей, туберкулеза, а также случаи смерти ВИЧ инфицированных пациентов и больных СПИД.
Важным моментом заготовки органов и тканей для аллотрансплантации являются не только медицинские, но и морально-этические и юридические аспекты. Забор органов и тканей должен производится с согласия родственников, после констатации врачебной комиссией смерти мозга потенциального донора. В состав этой комиссии входят: анестезиолог; хирург или нейрохирург; невропатолог; психиатр; лечащий врач. Критерием установления диагноза смерти мозга служат: 1.Глубокая безрефлекторная кома; 2.Отсутствие кашлевого рефлекса при эндотрахеальном отсасывании; 3.Полный центральный паралич дыхания; 4.Изоэлектрическая (нулевая линия) при электроэнцефалографии; 5.Интракраниальная остановка кровообращения (доказанная с помощью ангиографии). Констатация смерти мозга комиссией осуществляется в письменном виде с подписями всех ее членов.
Забор, консервирование и хранение органов и тканей для трансплантации производят при строгом соблюдении правил асептики и антисептики в специально оборудованных лабораториях-операционных центров трансплантологии, НИИ и их филиалов. Изъятие органов у донора выполняют сразу же после констатации комиссией смерти мозга, на фоне внутривенных вливаний донору растворов электролитов, диуретиков, ангиопротекторов, а также при проведении искусственной вентиляции легких. Эти мероприятия имеют цель сохранить функции донорских органов до конца операции их изьятия. не рекомендуется выполнять забор органов в период тепловой ишемии (период времени, когда циркуляция крови уже прекращена, а температура тканей еще близка к нормальной).
Ткани трупа изымают и консервируют в первые 6 часов после смерти. Консервирование тканей трупа возможно в течение первых суток при условии хранения их в специальных условиях при температуре 0 0 С.
После изъятия органы и ткани вначале тщательно отмывают от крови и тканевой жидкости в специальных растворах, а затем, в зависимости от предполагаемой длительности хранения, приступают к консервированию.
Существуют следующие методы консервирования тканей и органов:
1. Криоконсервирование - консервирование при низкой температуре с быстрым замораживанием (от -183 0 С до -273 0 С) и хранением при температуре от -25 0 С до -30 0 С;
2. Консервирование в специальных растворах, содержащих антибиотики или антисептики, с последующим хранением в плазме или крови реципиента или охлажденном растворе;
3. Лиофилизация - замораживание с последующей сушкой в условиях вакуума. Используется для консервирования костей и сухожилий. Метод достаточно широко распространен, вместе с тем его недостатком является не полное подавление антигенных свойств ткани;
4. Консервирование в парафине;
5. Консервирование в растворе альдегида (глютаральдегид, формальдегид).
После консервирования материал хранят в специальных условиях в центрах и НИИ трансплантологии, создавая таким образом банк органов и тканей. Доставка органов для трансплантации в хирургические клиники и отделения осуществляется в специальных контейнерах в растворе при температуре +4 0 С.
L ЗАГОТОВКА, КОНСЕРВИРОВАНИЕ И ХРАНЕНИЕ ОРГАНОВ И ТКАНЕЙ
Основным источником тканей и органов для трансплантации (аллот-рансплантации) являются практически здоровые люди, погибшие от случайных причин (тяжелых травм, не совместимых с жизнью) или скончавшиеся в результате остро развившихся тяжелых заболеваний (инфаркт ми-акарда, инсульт). Другим не менее важным источником для трансплантологии являются ткани трупа (кожа, сухожилия, кости, роговица и т.д.). Медицинским противопоказанием к изъятию тканей и органов для трансплантации являются все случаи смерти от инфекционных заболеваний, острых и хронических отравлений, злокачественных опухолей, туберкулеза, а также случаи смерти ВИЧ-инфицированных пациентов и больных СПИД. Несколько реже в качестве источника тканей для трансплантации (ксенотран-сплантации) используют животных. В биологическом отношении самыми близкими по физиологическим аспектам к человеку являюся ткани свиньи и обезьяны. К примеру, свиной инсулин отличается от человеческого толь-ко одной аминокислотой. Поэтому в последнее время достаточно широкое распространение получил метод ксенотрансплантации культуры клеток поджелудочной железы свиней для лечения сахарного диабета. Наиболее оптимальным источником для трансплантологии являются близкие родственники пациента, нуждающегося в пересадке органа или тканей. Как правило, при изогенной или сингенной трансплантации реакция тканевой несовместимости выражена мало и наступает достаточно быстрое выздоровление реципиента. Вместе с тем этот источник трансплантологии весьма скромен, поскольку как по медицинским, так и по морально-этическим каг нонам сложно подобрать необходимого донора. Кроме того, изогенная и
сингенная трансплантация возможна только парных органов (например почки).
ГЛАВА \\ III. BCX'CTAlfc .ВИТЕЛЫ1АЯ ХИРУРГИЯ
Очень важным моментом заготовки органов и тканей для аллотранс-пплнтациц являются не только медицинские и морально-этические, но и юридические аспекты. Следует отметить, что забор органов и тканей дол-жеи производиться с согласия родственников (если таковые имеются), после констагацип смерги мозга потенциального донора врачебной комиссией. В состав комиссии входят: анестезиолог; хирург или нейрохирург; невропатолог; психиатр; лечащий врач. Критериями установления диагноза смерти мозга служат : 1) глубокая безрефлекторная кома; 2) отсутствие кашлевого рефлекса при эндотрахеальном отсасывании; 3) полный центральный паралич дыхания; 4) изоэлектрическая (нулевая) линия при электроэнцефалографии; 5) интракраниальная остановка кровообращения (доказанная с помощью ангиографии). К дополнительным тестам для установления смерти мозга относят: 1) отсутствие изменений сердечного ритма на введение атропина; 2) отсутствие реакции на термическое раздражение лабиринта (тепловое раздражение внутреннего уха). Констатация смерги мозга осуществляется комиссией в письменном виде с подписями всех ее членов.
Забор, консервирование и хранение органов и тканей для трансплантации производят при строгом соблюдении правил асептики и антисептики в специально оборудованных лабораториях-операционных центров трансплантологии, НИИ и их филиалов. Изъятие органов (печени, почек, сердца) у донора выполняют сразу же после констатации комиссией смерти мозга, на фоне внутривенных вливаний растворов электролитов, диуретиков, ангиопротекторов, а также при проведении искусственной вентиляции легких. Эти мероприятия имеют цель сохранить функции донорских органов до конца операции их изъятия. Не рекомендуется выполнять забор органов в период тепловой ишемии (период времени, когда циркуляция крови уже прекращена, а температура тканей еще близка к нормальной). Ткани трупа изымают и консервируют в первые 6 ч после смерти. Консервирование тканей трупа возможно в течение первых суток при условии хранения их при температуре О °С в специальных условиях. Забор тканей для ксенотрансплантации производят ex tempore у гуманно умерщвленных животных (к примеру, воздушная эмболия) в строго асептических условиях.
После изъятия органы и ткани вначале тщательно отмывают от крови и тканевой жидкости в специальных растворах, а затем в зависимости от предполагаемой длительности хранения приступают к консервированию. Существуют следующие методы консервирования тканей и органов:
ГЛАВА XVIII. ВОССТАНОВИТЕЛЬНАЯ ХИРУРГИЯ
• крноконсервирование - консервирование при низкой температуре с быстрым замораживанием (от -183 до -273 °С) и хранением при температуре от -25 до -30 °С;
• консервирование в специальных растворах, содержащих антибиотики или антисептики, с последующим хранением в плазме или крови реципиента или охлажденном растворе;
• лиофилизация - замораживание с последующей сушкой в условиях вакуума. Используется для консервирования костей и сухожилий. Метод достаточно широко распространен, вместе с тем его недостатком является не полное подавление антигенных свойств ткани;
• консервирование в парафине;
• консервирование в растворе альдегида (глютаральдегид, формальдегид).
После консервирования материал хранят в специальных условиях в центрах и НИИ трансплантологии, создавая таким образом банк органов и тканей Доставка органов для трансплантации в хирургические клиники и отделения осуществляется в специальных контейнерах в растворе при температуре +4 °С.
Методы сохранения органов и техника приготовления музейных препаратов

Сохранение органов и тканей трупов животных преследует различные цели. Органы и ткани сохраняют для уточнения патологоанатомического диагноза и производства судебно-ветеринарной экспертизы (как вещественное доказательство). Из органов и тканей готовят патологоанатомические препараты для проведения ветеринарно-просветительной работы среди работников животноводства, для научных и учебных целей.
Комната, где хранятся препараты, называется патологоанатомическим музеем. Такие музеи есть при крупных кафедрах и научно-исследовательских лабораториях.
В настоящее время для сохранения органов и тканей предложено много методов. Применение того или иного из них зависит от целей предпринимаемого консервирования. По способу изготовления патологоанатомические препараты могут быть влажные и сухие. При любом способе изготовления препаратов стремятся сохранить естественную окраску органов и тканей.
Изготовление влажных препаратов
Наиболее распространен метод сохранения органов и отдельных тканей (частей) трупа животного во влажной среде (жидкости), как более надежный для сохранения естественной окраски.
Изготовление влажных патологоанатомических препаратов слагается из ряда этапов: отбор материала и подготовка его к фиксации; фиксация; восстановление цвета; консервирование (пропитывание глицериновой смесью); монтирование препарата.
Для фиксации, восстановления цвета и консервирования патологоанатомического материала предложено несколько прописей растворов. Из них наибольшее практическое значение имеют следующие.
Раствор I (фиксирующий):
Раствор III (консервирующий):
| вода | 900 мл |
| глицерин | 300 мл |
| уксуснокислый калий | 200 г |
| формалин | 100 мл |
| хлористый калий | 5 г |
| уксуснокислый калий (или натрий) | 30 г |
| вода | 1000 мл |
Раствор II (восстанавливающий цвет): спирт 85—90%-ный
| вода | 1000 мл |
| глицерин | 600 мл |
| уксуснокислый калий (или натрий) | 400 г |
| вода дистиллированная | 900 мл |
| глицерин | 540 мл |
| уксуснокислый калий (или натрий) (химически чистый) | 270 мл |
Формалин представляет собой 40%-ный водный раствор формальдегида (СН2О). Это бесцветная или слегка желтоватая жидкость с резким запахом. Хорошо растворима в воде. Обладает сильным бактерицидным действием. Впервые в патологоанатомической практике применен в 1893 г., с тех пор благодаря доступности, дешевизне и способности надежно предохранять органы и ткани от гниения стал одним из наиболее употребительных фиксаторов.
Растворы формалина легко испаряются, и его пары вызывают раздражение слизистых оболочек, что вызывает слезотечение, кашель, чихание (опасен для верхних дыхательных путей). При работе (с патматериалом, фиксированным в формалине) без перчаток происходит дубление и сморщивание кожи рук. Действие его на ткани вызывает необратимый процесс. Хранение формалина на свету, а также в холодном помещении приводит к полимеризации его, образуется параформальдегид (параформ), который выпадает на дно сосуда (бутыли) в виде плотного белого осадка или хлопьев, которые плавают в жидкости и придают ей цвет молока.
Для растворения осадка (или восстановления) формалин нагревают до 80—85 °C со щелочами. На 100 мл такого формалина (с осадком) берут 130 мл воды и 20 мл нормального раствора едкого кали (56 г КОН на 1л воды). В результате формалин становится прозрачным. Иногда для просветления формалина бывает достаточно лишь подогреть его. Подогревают формалин в вытяжном шкафу или на открытом воздухе.
Действие формалина на ткани зависит от концентрации его и продолжительности фиксации. Если растворы концентрированные, быстро образуется поверхностный слой коагулированного белка и фиксация замедляется, слабые растворы легче проникают в ткань, но действуют медленнее.
Лучшими фиксирующими свойствами обладает 10%-ный раствор нейтрального формалина.
Последовательность изготовления патологоанатомических препаратов. Отбор материала и подготовка его к фиксации. Для приготовления препарата берут такие участки органов и тканей, которые содержат не только пораженные, но и здоровые ткани (для сравнения). Материал для приготовления препаратов берут вскоре после гибели или убоя животного, так как чем дольше лежит труп, тем хуже сохраняется картина патологического процесса (особенно быстро изменяется цвет тканей), тем труднее восстановить естественный цвет тканей.
Вначале проводят предварительную обработку. Она заключается в том, чтобы удалить все ненужные для демонстрации того или иного процесса ткани. Различные загрязнения, обрывки тканей, сгустки крови удаляют до фиксации, поскольку после нее придать соответствующую форму препарату или снять загрязнение и кровь практически невозможно, не нарушая его внешнего вида. Иногда препарат на несколько часов (4—8) помещают в фиксирующую жидкость, а затем проводят его соответствующую обработку: снимают загрязнения, срезают обрывки тканей, удаляют жир и др.
Толщина препарата не должна превышать 3—4 см, так как фиксирующая жидкость медленно проникает в глубь тканей. Если препараты по какой-либо причине нельзя сделать требуемой толщины, то до погружения их в жидкость делают (острым ножом с противоположной для показа стороны) надрезы, в которые кладут гигроскопическую вату, смоченную фиксирующей жидкостью. Фиксирующую жидкость в толщу препарата можно вводить шприцем, прокалывая его во многих местах. Если фиксируют целиком орган или труп мелкого животного, фиксирующую жидкость вводят в крупные кровеносные сосуды или другие естественные каналы под давлением. Кроме того, удаляют внутренние органы через разрез брюшной стенки; последнюю аккуратно зашивают (или кишечник удаляют через тазовую полость и прямую кишку).
Ткани, обладающие способностью быстро сморщиваться, перед фиксацией растягивают на каком-либо твердом предмете (на пробковой пластинке, картоне, тонкой доске) и вместе с ним помещают в фиксирующую жидкость. Отрезки кишечника (слизистой оболочкой вверх) также фиксируют, укрепив на кусочке картона или пробковой пластинке. В тех случаях, когда нужно сохранить целостность и толщину полостного органа, фиксирующую жидкость наливают в его полость, а затем заполняют гигроскопической ватой или выворачивают (если есть показания) слизистой оболочкой наружу, а полость заполняют гигроскопической ватой или другим гигроскопическим материалом (хлопчато-бумажной материей), придав ему соответствующий внешний вид. Плотные трубчатые органы (трахея, бронхи, гортань) фиксируют в раскрытом состоянии. Для этого вставляют распорки (стеклянные трубочки или деревянные палочки) в местах их разреза или разъединения. Распорки вставляют так, чтобы они не заслоняли измененных участков. Под сердечные клапаны (митральный, трехстворчатый и полулунные в аорте и легочной артерии) кладут кусочки гигроскопической ваты, смоченной фиксирующей жидкостью.
Фиксирование. Подготовленный препарат фиксируют. Для этого на дно посуды (избегать металлической), в которой будет фиксироваться препарат, кладут слой гигроскопической ваты, смоченной фиксирующей жидкостью. На нее помещают препарат, придают ему соответствующую форму и заливают жидкостью. Лучшими считают жидкости Кайзерлинга и Мельникова-Разведенкова (раствор I). Если одновременно фиксируют несколько препаратов, то каждый из них аккуратно прокладывают ватой (также смоченной фиксирующей жидкостью). Это делают для того, чтобы препараты не деформировались.
Объем фиксирующей жидкости должен в несколько раз превышать объем фиксируемого материала. Продолжительность фиксации зависит от размеров органа или ткани и определяется опытным путем. Стенки полостных органов (желудок, кишечник, мочевой пузырь и др.) фиксируют 1—2 сут, паренхиматозные органы (сердце, селезенка, почки, легкие и др.) — 1—2 нед и дольше.
Критерием того, что материал профилировался, является его уплотнение, равномерное окрашивание с поверхности и на разрезе в грязно-серый или буроватый цвет. Передерживать препараты в фиксирующей жидкости не рекомендуется, так как формалин разрушает гемоглобин и способность органа восстанавливать естественную окраску утрачивается.
Восстановление цвета препарата. Профилированный материал переносят в этиловый спирт концентрацией не ниже 80—90 % (спирт-сырец непригоден). Небольшие органы или ткани (или кусочки крупных органов) полностью погружают в спирт, крупные органы, чтобы не расходовать много спирта, обкладывают ватой, обильно смоченной спиртом. Посуду, в которой восстанавливают препарат, плотно закрывают.
В 1895 г. Н. Ф. Мельников-Разведенков установил, что метгемоглобин, образующийся при фиксации препарата и придающий органу или ткани грязно-серый цвет, переводится спиртом в стойкий катгемоглобин (нейтральный гематин), имеющий цвет оксигемоглобина и восстанавливающий естественную окраску органа или ткани.
Иногда естественный цвет восстанавливается очень быстро, в течение нескольких минут. Однако, чтобы спирт проник глубже в ткани, препарат выдерживают в спирте в течение 12 ч. Можно вначале погрузить препарат в спирт, уже бывший в употреблении, а затем на 1—2 ч в свежий. Если препарат достаточно полно восстановил естественный цвет, процесс нужно приостановить. При передержке в спирте препарат обесцвечивается.
В литературе есть прописи, в которых спирт не является необходимой составной частью для восстановления цвета. Естественная окраска органа или ткани сохраняется, если к раствору I прибавить хлоралгидрат. Пример такой прописи:
Раствор I (фиксирующий и восстанавливающий цвет):
карловарская соль (искусственная)…………………………………….. 50 г
хлоралгидрат (концентрированный водный раствор)…………… 50 мл
Раствор II (консервирующий):
уксуснокислый калий (или натрий)……………………………………. 300 г
Однако эта смесь (пропись) менее эффективна по сравнению с прописями, содержащими спирт, и используется значительно реже.
Консервирование (пропитывание препаратов глицериновой смесью). После восстановления цвета органы или ткани переносят в раствор III для консервирования и длительного хранения. Препарат опускают в стеклянную банку со смесью и, чтобы он не всплывал, покрывают ватой или тканью. Через 2—3 нед препарат опускается на дно. Хранят препараты в этих же смесях. При длительном хранении препаратов глицериновая смесь мутнеет в результате перехода красящих веществ из ткани в глицерин и может выпадать осадок. Причинами этого могут быть плохая первичная фиксация, несоблюдение сроков фиксации, объемных пропорций, содержание в препарате повышенного количества пигмента, неправильное хранение (перепад температур) и др. В таких случаях препарат заделывают заново. Для удаления осадков и пигмента его промывают в воде и на 30—60 мин помещают в жидкость следующего состава: 1000 мл воды, 30 мл концентрированной химически чистой соляной кислоты и 10 мл азотной кислоты. Затем такое же время промывают в воде, выдерживают в 0,5%-ном растворе хлорамина, переносят в 2%-ный раствор хлорной извести, опять промывают водой (желательно проточной) и заливают свежей смесью глицерина.
Заключение препарата в стеклянную банку (подготовка посуды и монтаж влажных препаратов). Для хранения влажных патологоанатомических препаратов чаще используют прямоугольные стеклянные банки. Можно употреблять и цилиндрические сосуды, редко — банки домашнего обихода (консервная посуда). Посуда, в которой делают препараты для музея, должна быть прозрачной, не искажать цвет и форму препарата и герметически закрываться крышкой. Банки для хранения препаратов готовят заранее. Их тщательно моют при помощи щетки водой с мылом. Подбирают к ним и также тщательно моют стеклянные крышки (их вырезают из стекла чуть больше периметра отверстия банки). Перед приклеиванием крышки края банки обезжиривают спиртом или авиационным бензином и обмазывают менделеевской замазкой (лучше окунуть края банки в расплавленную замазку). Затем в банку наливают немного глицериновой смеси (раствор III) и опускают смонтированный (на стеклянной пластинке или без нее) препарат. Стеклянную пластинку обычно вырезают по ширине банки, а препарат к ней прикрепляют белыми нитками вплотную. Заливают препарат смесью, не доводя до краев на 3—4 см. Туда же опускают кусок ватмана или другой плотной белой бумаги, на которой тушью или графитным карандашом написан код препарата. В книге записей под этим номером-шифром обозначают все данные о препарате: откуда он поступил, когда, вид животного, чем болело и др. Затем нагревают на пламени горелки (спиртовой или газовой) крышку и кладут ее на ребра банки, на которой предварительно была нанесена менделеевская замазка. Последняя плавится, и крышка плотно прилегает к банке. Можно крышкуне нагревать, а поставить на нее горячий тяжелый предмет (например, утюг). Когда крышка остынет и замазка затвердеет, края крышки еще раз обмазывают менделеевской замазкой и покрывают черной эмалью или черным лаком. В верхнем углу банки обычно наклеивают этикетку с указанием органа и патологоанатомического процесса.
В состав менделеевской замазки входят:
мумия просушенная (или прокаленная охра)…………….200 г
льняное (подсолнечное) масло……………………………………… 5 мл
Готовят ее следующим обравом. Сначала в водяной бане расплавляют пчелиный воск, затем добавляют канифоль, массу перемешивают, добавляют мумию (охру), размешивают и добавляют масло. Смесь варят до прекращения пенообразования (примерно 2 ч).
Музейную посуду приобретают по линии Зооветснаба или в зоомагазинах. Если специальной посуды нет, ее можно приготовить из органического стекла. Техника изготовления описана в соответствующих руководствах.
Изготовление сухих препаратов
Тонкостенные органы (чаще полостные: кишечник, желудок, пищевод и др.) можно сохранять в сухом виде (метод Г. В. Шора). Вначале эти органы обрабатывают так же, как и при влажном способе хранения. Фиксируют, восстанавливают цвет, переносят в консервирующую жидкость (раствор III) и хранят не более двух недель. Затем подсушивают на воздухе во взвешенном состоянии (излишки влаги удаляют гигроскопической ватой или хлопчатобумажной материей). На поверхность сухого препарата наносят тонким слоем расплавленный агар и дают остыть. Из органического или обычного стекла делают камеру по размеру органа, края ее тщательно заделывают менделеевской замазкой. Чтобы не конденсировалась влага, помещают в уголок камеры на ватке жженую магнезию.
Патологоанатомические препараты из органов и тканей делают в виде пластинок (пластинчатый метод по Талалаеву) и заключают в желатину или агар-агар. Используя этот метод, особенно хорошие препараты получают из кожи, сальника, сосудов. Из консервирующей жидкости берут орган и вырезают пластинку толщиной 1— 1,5 см. Подсушивают на воздухе. Из стекла (органического или обычного) готовят коробочки высотой до 2 см с таким расчетом, чтобы в них помещалась вырезанная пластинка из органа. В эту коробочку (форму) наливают расплавленный желатин или агар-агар, сразу кладут пластинку из органа и плотно прижимают ее к стеклу дна коробочки. Остывая, агар-агар или желатин сжимаются, поэтому в камеру по мере их остывания доливают эти реактивы. Полное уплотнение среды происходит через 24—36 ч, что зависит от температуры и влажности окружающей среды. Для изготовления коробочек лучше всего пользоваться фотографическими пластинками (они имеют стандартные размеры различной величины и приготовлены из высококачественного стекла). Из них же вырезают и боковые пластинки. Края и крышки склеивают менделеевской замазкой или техническим клеем.
Приготовление желатина. В 500 мл дистиллированной воды помещают 180 г желатина, дают ему набухнуть в течение 2—3 дней, затем нагревают до расплавления. К раствору последовательно добавляют 800 мл глицерина, 350 мл насыщенного при нагревании раствора уксуснокислого калия или натрия и расплавленной химически чистой карболовой кислоты из расчета 1:500. Кипятят в водяной бане и фильтруют через марлю, прослоенную гигроскопической ватой.
Приготовление агар-агара. К 500 мл дистиллированной воды добавляют 15 г мелко нарезанного агар-агара, дают набухнуть 2—3 дня и нагревают до полного растворения. К раствору добавляют 90 г 50%-ного водного раствора уксуснокислого калия или натрия, 200 мл глицерина и расплавленной химически чистой карболовой кислоты из расчета 1: 500. Фильтруют так же, как и желатин.
В специальной литературе описаны и другие методы консервирования и хранения препаратов. Они имеют меньшее практическое применение.
Читайте также:
- Гонадотропин-рилизинг гормон (ГнРГ) в лечении рецидива рака эндометрия и его эффективность
- Дистихиаз: причины, диагностика, лечение
- Взаимодействие вируса с клеткой. Характер взаимодействия вирус-клетка. Продуктивное взаимодействие. Вирогения. Интерференция вирусов.
- Ошибки и осложнения лечения заболеваний стопы у танцоров
- Диагностика добавочной внутренней сонной артерии височной кости
