Строение и функции протеинтриозинкиназы Src
Добавил пользователь Евгений Кузнецов Обновлено: 01.02.2026
1. Введение. Общие принципы построения протеинкиназ. Биологическая роль.
Большая группа ферментов, объединенная под названием “протеинкиназы”, катализирует перенос концевого остатка фосфата с АТФ на различные группы в структуре белка. Протеинкиназы разделены на пять больших классов в зависимости от того, на какие группы в структуре белка переносится остаток фосфата. Протеинкиназы первого класса переносят фосфат на спиртовые группы серина и треонина. Протеинкиназы второго класса переносят фосфат на спиртовые группы тирозина. Протеинкиназы третьего класса образуют фосфоамидные связи, перенося остаток фосфата на атомы азота гистидина, лизина или аргинина. Протеинкиназы четвертого класса фосфорилируют остатки цистеина в структуре белка. Наконец, протеинкиназы пятого класса способны фосфорилировать остатки аспарагиновой и глутаминовой кислот.
Протеинкиназы, фосфорилирующие спиртовые группы серина, треонина и тирозина, наиболее подробно исследованы и имеют много общего в структуре и свойствах.
В ходе реакции, катализируемой протеинкиназами двух первых классов, нейтральная спиртовая группа белка превращается в сложный эфир, несущий большой отрицательный заряд. Введение отрицательного заряда в ранее нейтральную область может приводить к значительным изменениям в структуре белка, а значит, и к изменению его свойств.
Простая химическая модификация молекулы белка, происходящая под действием протеинкиназ, является эффективным и широко распространенным способом регуляции активности многих ферментов и других внутриклеточных белков. Остаток фосфорной кислоты, перенесенный протеинкиназой на спиртовую группу белка, может быть удален под действием другого фермента - фосфатазы. Таким образом, протеинкиназы и фосфатазы образуют две группы ферментов-антагонистов, способных осуществлять обратимую ковалентную модификацию белков-мишеней и тем самым регулировать их активность.
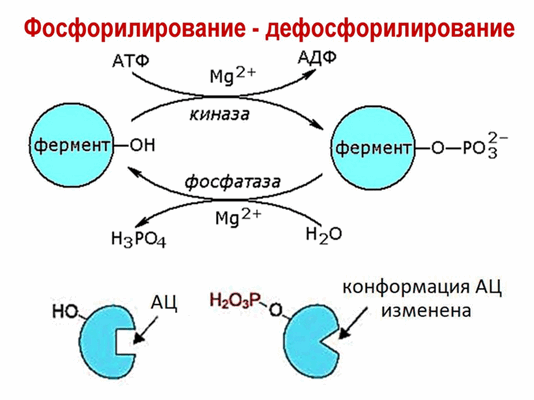
Рис. 1 Обратимая ковалентная модификация белков-мишеней,
Протеинкиназы относятся к группе сложно устроенных ферментов, так как они должны взаимодействовать , как минимум, с двумя субстратами. Протеинкиназы должны иметь специальный центр связывания АТФ или других нуклеозидтрифосфатов, которые используются в качестве доноров остатков фосфата, а также специальный центр связывания белка-субстрата, на который осуществляется перенос фосфатной группы.
Для того чтобы осуществить перенос фосфата с АТФ на белок, нужен специальный активный центр, содержащий определенные аминокислотные остатки, которые непосредственно участвуют в переносе фосфата от АТР на белок. Два субстрат связывающих участка (участок связывания АТФ и участок связывания белка-субстрата) должны располагаться поблизости и быть соответствующим образом ориентированы относительно друг друга. Только в этом случае становится возможным эффективный перенос остатка фосфата. Субстрат связывающие участки должны обладать достаточно высокой специфичностью.
Регуляторные участки протеинкиназ крайне разнообразны, поэтому активность этих ферментов может точно и тонко регулироваться. Вследствие всех перечисленных свойств протеинкиназы играют исключительно важную роль в передаче сигнала внутрь клетки.
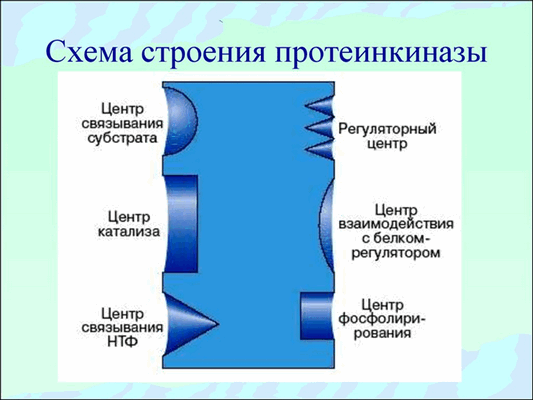
Рис.2 Общая схема строения протеинкиназ
Субстратами протеинкиназ являются белки ионных каналов, ферменты, регулирующие метаболические процессы, белки рибосом, ядерные белки, белки цитоскелета и т.д.
2. Протеинкиназа А, строение, участие в регуляции обмена гликогена и триацилглицеридов, CRE.
Протеинкиназа А - строение, участие в регуляции обмена гликогена и триацилглицеридов, CRE.
Протеинкиназа А, или цАМФ-зависимая протеинкиназа (КФ 2.7.11.1), относится к семейству ферментов, активность которых зависит от уровня циклического АМФ (цАМФ) в клетке. Протеинкиназа А является самой изученной из всех протеинкиназ, её функции разнообразны, она участвует в регуляции метаболизма гликогена и липидов, её субстратами могут быть другие протеинкиназы или другие ферменты.
В неактивном состоянии молекула протеинкиназы А является является тетрамером — состоит из двух регуляторных ( R ) и двух каталитических субъединиц. Если уровень цАМФ в клетке низкий, то фермент остается интактным, и каталитическая активность отсутствует. При возрастании концентрации цАМФ в клетке он связывается с двумя сайтами связывания на регуляторных субъединицах протеинкиназы А, в результате происходят конформационные изменения фермента, в результате которых тетрамер протеинкиназы А диссоциирует на два димера (2 R и 2С). Открытые активные центры каталитических субъединиц переносят концевой фосфат молекулы АТФ на остатки серина или треонина белков - субстратов протеинкиназы А.
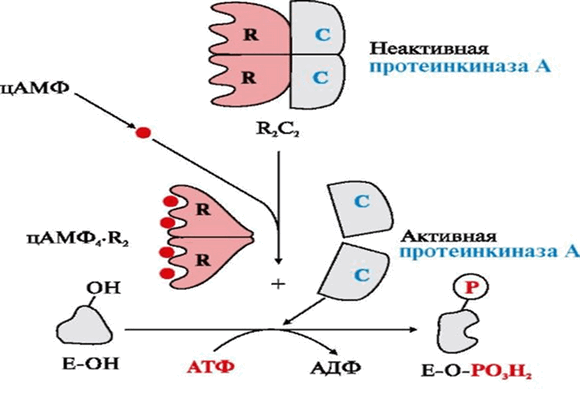
Рис. 1. Активация протеинкиназы А путем диссоциации тетрамера.
Протеинкиназы А представлены во многих типах клеток и проявляют каталитические активности в отношении разных субстратов.
Например, субстратами ПК А являются ферменты, участвующие в метаболизме гликогена. Действие гормонов на синтез и распад гликогена опосредовано изменением в противоположном направлении активности двух ключевых ферментов: гликогенсинтазы (гликогеногенез) и гликогенфосфорилазы (гликогенолиз) при помощи их фосфорилирования/дефосфорилирования. Так фосфорилирование гликогенфосфорилазы приводит к активации фермента, а фосфорилирование гликогенсинтазы, наоборот, к инактивации фермента.
Это переключение происходит при переходе из абсорбтивного состояния в постабсортивное, а также при смене состояния покоя на режим физической работы. В печени оно осуществляется при участии гормонов инсулина, глюкагона и адреналина, а в мышцах — инсулина и адреналина.
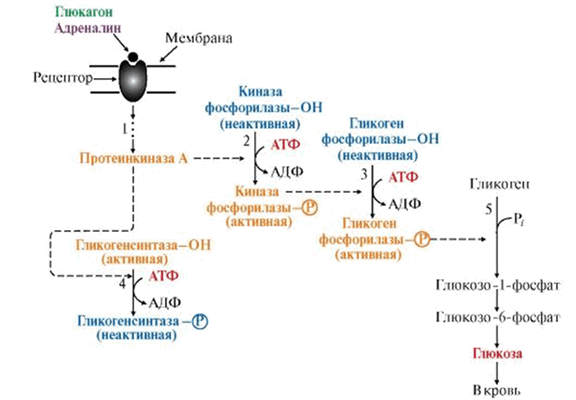
Рис. 2. Участие ПК А в регуляции синтеза и распада гликогена.
ПК А принимает участие и в мобилизации триглицеридов. Мобилизация депонированных жиров стимулируется глюкагоном и адреналином и, в меньшей степени, некоторыми другими гормонами (соматотропным, кортизолом). В постабсорбтивный период и при голодании глюкагон, действуя на адипоциты через аденилатциклазную систему, активирует протеинкиназу А, которая фосфорилирует и, таким образом, активирует диацилглицерол липазу или гормончувствительную липазу ( HSL ), что инициирует липолиз и выделение жирных кислот и глицерина в кровь. При физической активности увеличивается секреция адреналина, который действует через β-адренергические рецепторы адипоцитов, активирующие аденилатциклазную систему.
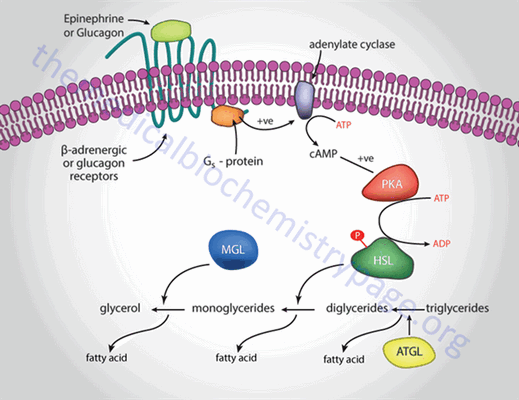
Рис. 3. Гормональная регуляция мобилизации жиров в постабсорбтивном периоде, при голодании и физической работе.
Следует отметить, что действие протеинкиназы А, вызванное фосфорилированием белков-субстратов, как правило, кратковременное, так как протеинфосфатазы, сопряженные с протеинкиназами, быстро дефосфорилируют белки-мишени, ранее фосфорилированные протеинкиназой А.
Протеинкиназа А участвует в цАМФ-стимулируемой транскрипции генов, которые имеют цАМФ-реактивный элемент в регуляторном участке. Повышение концентрации цАМФ ведет к активации протеинкиназы А, которая в ответ фосфорилирует транскрипционный фактор CREB по остатку серина 133; CREB своим фосфорилированным участком связывает коактиватор транскрипции и стимулирует транскрипцию.
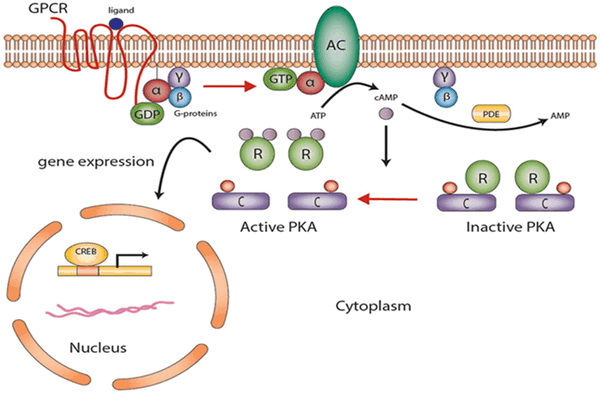
Рис. 4. Участие протеинкиназы А в цАМФ-стимулируемой транскрипции генов.
При прямом фосфорилировании белка ПK A напрямую увеличивает или снижает активность белка. При синтезе белка ПКА сначала непосредственно активирует CREB, который связывает элемент ответа cAMP (CRE), изменяя транскрипцию, и, следовательно, синтез белка. Как правило, этот механизм требует больше времени (от часов до дней).
Активность протеинкиназы А регулируется и по механизму отрицательной обратной связи. Одним из субстратов, активируемых протеинкиназой А, является фосфодиэстераза, которая быстро превращает цАМФ в АМФ, тем самым уменьшая количество цАМФ, которое может активировать протеинкиназу А.
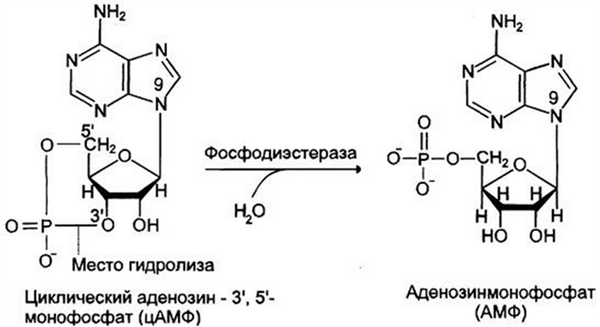
Рис. 5. Фосфодиэстераза гидролизует фосфодиэфирную связь и превращает цАМФ в АМФ.
Тирозинкиназа
Тирозинкиназа, тирозин-специфичная протеинкиназа (англ. tyrosine kinase ) — фермент подкласса протеинкиназ, группы киназ (фосфотрасфераз). Тирозинкиназы катализируют перенос фосфатного остатка от АТФ на тирозиновый остаток специфических клеточных белков-мишеней. Тирозинкиназы — одно из важнейших звеньев в системе передачи сигналов в клетке [1] [2] .
Содержание
Структура
В зависимости от структуры и локализации в клетке, выделяют 2 большие группы тирозинкиназ:
- рецепторные тирозинкиназы, к которым относятся тирозинкиназы, встроенные в клеточную мембрану ((КФ2.7.10.1). У таких тирозинкиназ есть внеклеточный домен, выполняющий функцию рецептора и специфически связывающийся с гормонами или другими сигнальными веществами; каталитический домен, находящийся с внутренней стороны клеточной мембраны, и трансмембранный домен, закрепляющий тирозинкиназу в клеточной мембране и передающий сигнал от рецепторного домена к каталитическому. При связывании лиганда тирозинкиназа активируется и переносит фосфатную группу от АТФ на гидроксильную группу тирозинового остатка в молекуле белка [1][2] . У человека обнаружено 20 подсемейств рецепторных тирозинкиназ, в которые входят 58 ферментов.
- цитоплазматические тирозинкиназы, находящиеся в цитоплазме, ядре, ЭПР и других частях клетки ((КФ2.7.10.2). В геноме человека обнаружено 32 различные тирозинкиназы этой группы, объединенные в 10 семейств.
Функции
К семейству тирозинкиназ относятся рецепторы инсулина, рецепторы факторов роста, включая тромбоцитарный фактор роста и фактор роста эпидермиса. При активации рецепторы с тирозинкиназной активностью могут фосфорилировать сами себя. Такое аутофосфорилирование, обычно сопряженное с формированием димеров рецептора, повышает активность фермента по типу положительной обратной связи [2] . Активированная тирозинкиназа фосфорилирует различные белки-мишени, что приводит к изменениям мембранного транспорта, транскрипции генов и других клеточных процессов.
Примечания
- ↑ 12Hanks SK, Quinn AM, Hunter T The protein kinase family: conserved features and deduced phylogeny of the catalytic domains (англ.) // Science. — 1988. — Т. 241. — № 4861. — С. 42-52.
- ↑ 123Dengjel J, Kratchmarova I, Blagoev B Receptor tyrosine kinase signaling: a view from quantitative proteomics (англ.) // Mol Biosyst. — 2009. — Т. 5. — № 10. — С. 1112-1121.
Ссылки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Тирозинкиназа" в других словарях:
Тирозинкиназа — фермент, играющий ключевую роль в деятельности клетки. В норме он присутствует в клетках, и его выработкой управляет нормальный ген ABL, который находится на хромосоме 9. У больных ХМЛ изменение ДНК приводит к образованию мутантного… … Медицинские термины
Тирозинкиназа Брутона — Структура каталитического домена тирозинкиназы Брутона Обозначения … Википедия
Blk — Структура SH2 домена киназы Blk, полученная методом ядерного магнитного резонанса Обозначения … Википедия
Гормоны — (др. греч. ὁρμάω возбуждаю, побуждаю) биологически активные вещества органической природы, вырабатывающиеся в специализированных клетках желёз внутренней секреции, поступающие в кровь и оказывающие регулирующее влияние на обмен… … Википедия
1-я хромосома человека — Идиограмма 1 й хромосомы человека 1 я хромосома человека самая большая из 23 человеческих хромосом, одна из 22 аутосом человека. Хромосома содержит около 248 млн пар оснований … Википедия
Тарцева — Действующее вещество ›› Эрлотиниб* (Erlotinib*) Латинское название Tarceva АТХ: ›› L01XX34 Эрлотиниб Фармакологическая группа: Противоопухолевые средства — ингибиторы протеинтирозинкиназы Нозологическая классификация (МКБ 10) ›› C25… … Словарь медицинских препаратов
Острые лимфобластные лейкозы — Острые лимфобластные лейкозы злокачественные заболевания системы кроветворения, характеризующиеся неконтролируемой пролиферацией незрелых лимфоидных клеток (лимфобластов). Острые лимфобластные лейкозы являются самыми распространёнными… … Википедия
Фишер, Эдмонд — В Википедии есть статьи о других людях с такой фамилией, см. Фишер. Эдмонд Фишер (англ. Edmond H. Fischer; 6 апреля 1920, Шанхай, Китай) швейцарский американский биохимик, лауреат Нобелевской премии по физиологии и медицине 1992 года «За… … Википедия
Молекулярная регуляция метаболизма и клеточного цикла
Интегрины - это семейство трансмембранных гликопротеинов - рецепторов, состоящих из альфа- и бета-субъединиц, способные нековалентно связываться между собой в разных сочетаниях, формируя около 20 типов интегринов. Интегриновые рецепторы экспрессированы на разных типах клеток: фибробластах, эпителиоцитах, эндотелиоцитах, лейкоцитах и тромбоцитах, опухолевых клетках . Один и тот же тип клеток может экспрессировать несколько разных интегринов, хотя есть интегрины, обладающие клеточной специфичностью.
Интегрины обладают целым рядом общих структурных и функциональных свойств. Интегрины являются главными медиаторами адгезии клеток к экстрацеллюлярному матриксу, а также играют роль в процессах "прилипания" клеток друг к другу и к эндотелию. Как следует из названия, они действуют "интегрируя" цитоскелет клеток с внеклеточным матриксом. Многочисленные биологические функции зависят от опосредованной интегринами клеточной адгезии: агрегация тромбоцитов, восстановление поврежденной ткани, механизмы иммунологической защиты, эмбриогенез, опухолевый рост и инвазию. Недавно было показано, что интегрины имеют существенное значение в передаче сигналов от клетки к клетке. См источник
Интегрины состоят из двух нековалентно связанных субъединиц - альфа- и бета-цепей - каждая из которых содержит экстрацсллюлярный и цитоплазматический домены. Они проникают в клеточную цитоплазму, делая возможным прохождение сигналов из клеток в окружающий их матрикс и наоборот.
Домен SH2 Характеристики, структура и функции
Домен SH2 (SRC Гомология 2) является белковым доменом, высоко консервативным в эволюции и присутствующим в более чем 100 различных белках, наиболее выдающимся из которых является онкопротеин src, участвующий в процессе передачи сигнала в клетке.
Функция домена заключается в связывании фосфорилированных последовательностей тирозина в белых белках; этот союз запускает серию сигналов, которые регулируют экспрессию генов. Этот домен также был обнаружен в ферменте тирозин фосфатазе.
Обычно домены SH2 обнаруживаются вместе с другими доменами, которые были связаны с путями передачи сигнала. Одним из наиболее распространенных взаимодействий является соединение с доменом SH2 и SH3, которое, по-видимому, участвует в регуляции взаимодействия с пролин-богатыми последовательностями..
Белки могут содержать один домен SH2 или более одного, как в случае с белком GAP и субъединицей p85 фосфоинозитол-3-киназ.
Домен SH2 широко изучался фармацевтической промышленностью с целью создания лекарственных средств для борьбы с такими заболеваниями, как рак, аллергия, аутоиммунные заболевания, астма, СПИД, остеопороз и другие..
- 1 Характеристики
- 2 Структура
- 3 функции
- 4 Эволюция
- 5 Клинические последствия
- 5.1 Лимфопролиферативная связь с Х
- 5.2 Агаммаглобулинемия, связанная с Х-хромосомой
- 5.3 Синдром Нунана
черты
Домен SH2 состоит из около 100 аминокислот, связанных с каталитическими доменами. Наиболее очевидным примером являются ферменты тирозинкиназы, которые ответственны за катализирование переноса фосфатной группы от АТФ к аминокислотным остаткам тирозина..
Домены SH2 присутствуют у высших эукариот, и было высказано предположение, что они также появляются у дрожжей. Что касается бактерий, в Кишечная палочка модуль, напоминающий о доменах SH2.
Белок src является первой открытой тирозинкиназой, которая при мутировании, вероятно, участвует в регуляции активности киназы, а также в стимулировании взаимодействия этих белков с другими компонентами в клетке..
После открытия доменов в белке scr домен SH2 был идентифицирован в большом количестве сильно варьирующих белков, включая протеинтирозинкиназы и факторы транскрипции..
структура
Структура домена SH2 была выявлена с использованием таких методов, как дифракция рентгеновских лучей, кристаллография и ЯМР (ядерный магнитный резонанс), для определения общих закономерностей во вторичной структуре исследуемых доменов SH2..
Домен SH2 имеет пять высоко консервативных мотивов. Общий домен состоит из центра β-листов с небольшими смежными участками антипараллельных β-листов, окруженных двумя α-спиралями.
Аминокислотные остатки на одной стороне листа и в N-концевой области αA участвуют в координации связывания пептидов. Однако остальные характеристики белков довольно разнообразны среди изучаемых доменов..
В концевой углеродной части изолейцин находится в третьем положении и образует гидрофобный карман на поверхности домена SH2..
Важной особенностью является наличие двух областей, каждая из которых имеет определенную функцию. Зона, расположенная между первой α-спиралью и β-листом, представляет собой сайт распознавания фосфотирозина..
Кроме того, область между β-листом и α-спиралью концевого углерода образует область, ответственную за взаимодействие с концевыми углеродными остатками фосфотирозина..
функции
Функция домена SH2 заключается в распознавании состояния фосфорилирования в аминокислотных остатках тирозина. Это явление имеет решающее значение в передаче сигналов, когда молекула, расположенная снаружи клетки, распознается рецептором в мембране и обрабатывается внутри клетки..
Сигнальная трансдукция является чрезвычайно важным событием в регуляции, когда клетка реагирует на изменения во внеклеточной среде. Этот процесс происходит благодаря передаче внешних сигналов, содержащихся в определенных молекулярных мессенджерах, через его мембрану.
Фосфорилирование тирозина приводит к последовательной активации межбелковых взаимодействий, что приводит к изменению экспрессии генов или изменению клеточного ответа.
Белки, которые содержат домены SH2, участвуют в регуляторных путях, связанных с важными клеточными процессами, такими как перестройка цитоскелета, гомеостаз, иммунные ответы и развитие.
эволюция
О присутствии домена SH2 сообщалось в примитивном одноклеточном организме. Monosiga brevicollis. Считается, что этот домен развивался как инвариантная сигнальная единица с появлением фосфорилирования тирозина..
Предполагается, что наследственное расположение домена служило для направления киназ к их субстратам. Таким образом, с увеличением сложности в организмах домены SH2 приобретали новые функции в процессе эволюции, такие как аллостерическая регуляция каталитического домена киназ..
Клинические последствия
Лимфопролиферативный, связанный с X
Некоторые мутированные домены SH2 были определены как вызывающие заболевания. Мутации в домене SH2 в SAP вызывают Х-сцепленное лимфопролиферативное заболевание, которое вызывает значительное повышение чувствительности к определенным вирусам и, таким образом, происходит неконтролируемая пролиферация В-клеток..
Пролиферация возникает потому, что мутация доменов SH2 вызывает нарушения в сигнальных путях между B и T-клетками, что приводит к вирусным инфекциям и неконтролируемому росту B-клеток. Это заболевание имеет высокий уровень смертности.
Агаммаглобулинемия, связанная с Х-хромосомой
Аналогичным образом, мутации в SH2-домене брутон-протеинкиназы ответственны за состояние, называемое агаммаглобулинемией..
Это состояние связано с Х-хромосомой, характеризуется отсутствием В-клеток и сильным снижением концентрации иммуноглобулина.
Синдром Нунана
Наконец, мутации в N-концевой области домена SH2 в протеин-тирозин-фосфатазе 2 являются причиной синдрома Нунана..
Эта патология в основном характеризуется сердечными заболеваниями, невысокого роста из-за снижения скорости роста и аномалий лица и скелета. Кроме того, состояние может представлять умственную и психомоторную отсталость в четверти исследованных случаев..
Рецепторная тирозинкиназа - Receptor tyrosine kinase
![]()
Рецепторные тирозинкиназы (RTK ) представляют собой рецепторы с высоким сродством на поверхности клетки для многих полипептидов факторов роста, цитокинов и гормонов. Из 90 уникальных генов тирозинкиназы , идентифицированных в геноме человека, 58 кодируют рецепторные тирозинкиназные белки. Было показано, что рецепторные тирозинкиназы не только являются ключевыми регуляторами нормальных клеточных процессов, но также играют решающую роль в развитии и прогрессировании многих типов рака. Мутации в рецепторных тирозинкиназах приводят к активации ряда сигнальных каскадов, которые оказывают многочисленные эффекты на экспрессию белка. Рецепторные тирозинкиназы являются частью более крупного семейства протеинтирозинкиназ, включающего белки рецепторных тирозинкиназ, которые содержат трансмембранный домен, а также нерецепторные тирозинкиназы, которые не содержат обладают трансмембранными доменами.
- 1 История
- 2 Классы
- 3 Структура
- 4 Активность киназы
- 5 Передача сигнала
- 6 Семейства
- 6.1 Семейство рецепторов эпидермального фактора роста
- 6.2 Семейство рецепторов фактора роста фибробластов (FGFR)
- 6.3 Семейство рецепторов фактора роста эндотелия сосудов (VEGFR)
- 6.4 Семейство рецепторов RET
- 6.5 Семейство рецепторов Eph
- 6.6 Семейство рецепторов дискоидинового домена (DDR)
- 7.1 Белковые тирозинфосфатазы
- 7.2 Герстатин
- 7.3 Эндоцитоз рецепторов
История
Первыми RTK, которые были обнаружены в 1960-х годах, были EGF и NGF, но классификация рецепторных тирозинкиназ не была разработана. скрывались до 1970-х годов.
Классы
Было идентифицировано около 20 различных классов RTK.
- RTK класс I (семейство рецепторов EGF ) (семейство ErbB)
- RTK класса II (семейство инсулиновых рецепторов ) (рецепторов PDGF семейство)
- RTK класса IV (Рецепторы VEGF семейство)
- RTK класс V (рецептор FGF семейство)
- RTK класс VI (CCK рецептор семейство)
- RTK класс VII (рецептор NGF семейство)
- RTK класс VIII (рецептор HGF семейство)
- RTK класс IX (Семейство рецепторов Eph )
- RTK класса X (рецепторов AXL семейство)
- RTK класса XI (TIE-рецепторов семейство)
- RTK класс XII (семейство рецепторов RYK )
- RTK класса XIII (семейство рецепторов DDR )
- RTK класса XIV (Семейство рецепторов RET )
- RTK класса XV (семейство рецепторов ROS )
- RTK класса XVI (семейство рецепторов LTK )
- RTK класса XVII (семейство рецепторов ROR )
- RTK класс XVIII (MuSK рецептор семейство)
- RTK класс XIX (LMR рецептор)
- RTK класс XX (не определено)
Большинство RTK представляют собой рецепторы с одной субъединицей, но некоторые существуют в виде мультимерных комплексов, например, рецептор инсулина, который образует димеры с дисульфидной связью в присутствии гормона (инсулина); кроме того, связывание лиганда с внеклеточным доменом индуцирует образование димеров рецептора. Каждый мономер имеет один гидрофобный трансмембранный -протяженный домен, состоящий из 25-38 аминокислот, внеклеточный N-концевая область и внутриклеточная C-концевая область. Внеклеточная N-концевая область демонстрирует множество консервативных элементов, включая иммуноглобулин (Ig) -подобные или эпидермальный фактор роста (EGF) -подобные домены, повторы фибронектина типа III или богатые цистеином области, которые характерны для каждого подсемейства RTK; эти домены содержат в первую очередь сайт связывания лиганда, который связывает внеклеточные лиганды, например, конкретный фактор роста или гормон. Внутриклеточная С-концевая область демонстрирует наивысший уровень консервативности и включает каталитические домены, ответственные за киназную активность этих рецепторов, которая катализирует аутофосфорилирование рецептора и фосфорилирование тирозина субстратов RTK.
Киназная активность
В биохимии киназа представляет собой тип фермента, который переносит фосфатные группы (см. Ниже) из высокоэнергетических молекулы-доноры, такие как АТФ (см. ниже), для конкретных молекул-мишеней (субстратов ); этот процесс называется фосфорилированием. Напротив, фермент, который удаляет фосфатные группы с мишеней, известен как фосфатаза. Ферменты киназ, которые специфически фосфорилируют тирозиновые аминокислоты, называются тирозинкиназами.
Когда фактор роста связывается с внеклеточным доменом RTK, его димеризация запускается с другими соседними RTK. Димеризация приводит к быстрой активации цитоплазматических киназных доменов белка, причем первым субстратом для этих доменов является сам рецептор. В результате активированный рецептор затем становится аутофосфорилированным по множеству специфических внутриклеточных тирозиновых остатков.
Передача сигнала
Посредством различных способов связывание внеклеточного лиганда обычно вызывает или стабилизирует димеризацию рецептора. Это позволяет тирозину в цитоплазматической части каждого мономера рецептора трансфосфорилироваться его партнерским рецептором, распространяя сигнал через плазматическую мембрану. Фосфорилирование специфических остатков тирозина в активированном рецепторе создает сайты связывания для белков, содержащих домен гомологии Src 2 (SH2) и домен связывания фосфотирозина (PTB). Конкретные белки, содержащие эти домены, включают Src и фосфолипазу C γ. Фосфорилирование и активация этих двух белков при связывании с рецептором приводит к инициированию путей передачи сигнала. Другие белки, которые взаимодействуют с активированным рецептором, действуют как адаптерные белки и не обладают собственной ферментативной активностью. Эти адаптерные белки связывают активацию RTK с нижележащими путями передачи сигнала, такими как сигнальный каскад киназы MAP. Пример пути передачи жизненного сигнала включает рецептор тирозинкиназы c-met, который необходим для выживания и пролиферации мигрирующих миобластов во время миогенеза. Недостаток c-met нарушает вторичный миогенез и - как в LBX1 - предотвращает формирование мускулатуры конечностей. Это местное действие FGF (факторов роста фибробластов) с их рецепторами RTK классифицируется как паракринная передача сигналов. Поскольку рецепторы RTK фосфорилируют несколько остатков тирозина, они могут активировать несколько путей передачи сигнала.
Семейства
Семейство рецепторов эпидермального фактора роста
Семейство белков ErbB или семейство рецепторов эпидермального фактора роста (EGFR) представляет собой семейство четырех структурно связанных рецепторных тирозинкиназ. Недостаточная передача сигналов ErbB у людей связана с развитием нейродегенеративных заболеваний, таких как рассеянный склероз и болезнь Альцгеймера. У мышей потеря передачи сигналов любым членом семейства ErbB приводит к эмбриональной летальности с дефектами в органах, включая легкие, кожу, сердце и мозг. Избыточная передача сигналов ErbB связана с развитием большого разнообразия типов солидных опухолей. ErbB-1 и ErbB-2 обнаружены во многих раковых заболеваниях человека, и их избыточная передача сигналов может быть критическим фактором в развитии и злокачественности этих опухолей.
Фактор роста фибробластов Семейство рецепторов (FGFR)
Факторы роста фибробластов составляют самое большое семейство лигандов факторов роста, состоящее из 23 членов. Природный альтернативный сплайсинг четырех генов рецептора фактора роста фибробластов (FGFR) приводит к продукции более 48 различных изоформ FGFR. Эти изоформы различаются по своим свойствам связывания лиганда и киназным доменам; однако все они имеют общую внеклеточную область, состоящую из трех иммуноглобулиновых (Ig) -подобных доменов (D1-D3), и, таким образом, принадлежат к суперсемейству иммуноглобулинов. Взаимодействия с FGFs происходят через домены FGFR D2 и D3. Каждый рецептор может быть активирован несколькими FGF. Во многих случаях сами FGF также могут активировать более одного рецептора. Однако это не относится к FGF-7, который может активировать только FGFR2b. Также был идентифицирован ген пятого белка FGFR, FGFR5. В отличие от FGFR 1-4, в нем отсутствует цитоплазматический домен тирозинкиназы, а одна изоформа, FGFR5γ, содержит только внеклеточные домены D1 и D2.
Семейство рецепторов фактора роста эндотелия сосудов (VEGFR)
Сосудистые фактор роста эндотелия (VEGF) является одним из основных индукторов пролиферации эндотелиальных клеток и проницаемости кровеносных сосудов. Два RTK связываются с VEGF на поверхности клетки, VEGFR-1 (Flt-1 ) и VEGFR-2 (KDR / Flk-1 ).
Рецепторы VEGF имеют внеклеточную часть, состоящую из семи Ig -подобные домены, так что, как и FGFR, принадлежат к суперсемейству иммуноглобулинов. Они также обладают одной трансмембранной охватывающей областью и внутриклеточной частью, содержащей расщепленный домен тирозинкиназы. VEGF-A связывается с VEGFR-1 (Flt-1 ) и VEGFR-2 (KDR / Flk-1 ). VEGFR-2, по-видимому, опосредует почти все известные клеточные ответы на VEGF. Функция VEGFR-1 менее четко определена, хотя считается, что он модулирует передачу сигналов VEGFR-2. Другая функция VEGFR-1 может заключаться в том, чтобы действовать как фиктивный / ложный рецептор, изолируя VEGF от связывания VEGFR-2 (это, по-видимому, быть особенно важным во время васкулогенеза у эмбриона). Был обнаружен третий рецептор (VEGFR-3); однако VEGF-A не является лигандом для этого рецептора. VEGFR-3 опосредует лимфангиогенез в ответ на VEGF -C и VEGF-D.
Семейство рецепторов RET
Естественный альтернативный сплайсинг гена RET приводит к образованию 3 различных изоформ белок RET. RET51, RET43 и RET9 содержат 51, 43 и 9 аминокислот в их С-концевом хвосте, соответственно. Биологические роли изоформ RET51 и RET9 являются наиболее хорошо изученными in-vivo, поскольку это наиболее распространенные изоформы, в которых встречается RET.
RET представляет собой рецептор для членов семейства нейротрофического фактора (GDNF), происходящего из линии глиальных клеток, внеклеточных сигнальных молекул или лигандов (
Чтобы активировать RET, первые GFL должны образовывать комплекс с гликозилфосфатидилинозитолом (GPI) -защищенным корецептором. Сами корецепторы классифицируются как члены семейства белков рецептора GDNF-α (GFRα). Различные члены семейства GFRα (GFRα1-GFRα4) проявляют специфическую связывающую активность в отношении определенных GFL. После образования комплекса GFL-GFRα, комплекс затем объединяет две молекулы RET, запуская транс-аутофосфорилирование конкретных остатков тирозина в домене тирозинкиназы каждого Молекула RET. Фосфорилирование этих тирозинов затем инициирует процессы внутриклеточной передачи сигнала.
Семейство рецепторов Eph
Ephrin и Eph рецепторы являются самым большим подсемейством RTK.
Семейство рецепторов дискоидинового домена (DDR)
DDR являются уникальными RTK в том смысле, что они связываются с коллагенами, а не с растворимыми факторами роста.
Регулирование
Путь рецепторной тирозинкиназы (RTK) тщательно регулируется множеством петель положительной и отрицательной обратной связи. Поскольку RTK координируют широкий спектр клеточных функций, таких как пролиферация и дифференцировка клеток, их необходимо регулировать, чтобы предотвратить серьезные нарушения клеточного функционирования, такие как рак и фиброз.
Белковые тирозинфосфатазы
Белок тирозин Фосфатаза (PTP) - это группа ферментов, которые обладают каталитическим доменом с фосфотирозин-специфической фосфогидролазной активностью. ПТР способны изменять активность рецепторных тирозинкиназ как в положительную, так и в отрицательную сторону. PTP могут дефосфорилировать активированные фосфорилированные остатки тирозина на RTK, что фактически приводит к прекращению сигнала. Исследования с участием PTP1B, широко известного PTP, участвующего в регуляции клеточного цикла и передачи сигналов рецептора цитокинов, показали, что он дефосфорилирует рецептор эпидермального фактора роста и рецептор инсулина. С другой стороны, некоторые PTP представляют собой рецепторы клеточной поверхности, которые играют положительную роль в пролиферации клеточных сигналов. Cd45, гликопротеин клеточной поверхности, играет важную роль в антиген-стимулированном дефосфорилировании специфических фосфотирозинов, которые ингибируют путь Src.
Герстатин
Герстатин является аутоингибитором семейства ErbB, который связывается с RTK блокирует димеризацию рецепторов и фосфорилирование тирозина. Клетки СНО, трансфицированные герстатином, привели к снижению олигомеризации рецептора, клональному росту и фосфорилированию тирозина рецептора в ответ на EGF.
Эндоцитоз рецептора
Активированные RTK могут подвергаться эндоцитозу, что приводит к подавлению регуляции рецептора и, в конечном итоге, сигнальный каскад. Молекулярный механизм включает поглощение RTK за счет клатрин-опосредованного эндоцитоза, что приводит к внутриклеточной деградации.
Медикаментозная терапия
RTK стали привлекательной мишенью для лекарственной терапии из-за их участия в различные клеточные аномалии, такие как рак, дегенеративные заболевания и сердечно-сосудистые заболевания. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило несколько противораковых препаратов, вызываемых активированными RTK. Лекарства были разработаны для нацеливания на внеклеточный домен или каталитический домен, тем самым ингибируя связывание лиганда и олигомеризацию рецептора. Герцептин, моноклональное антитело, способное связываться с внеклеточным доменом RTK, использовалось для лечения сверхэкспрессии HER2 при раке груди.
Низкомолекулярные ингибиторы и моноклональные антитела (одобренные Управлением по контролю за продуктами и лекарствами США) против RTK для терапия рака
малая молекула Цель Заболевание Год утверждения Иматиниб (Gleevec) PDGFR, KIT, Abl, Arg ХМЛ, GIST 2001 Гефитиниб (Иресса) EGFR Рак пищевода, Глиома 2003 Эрлотиниб (Tarceva) EGFR Рак пищевода, Глиома 2004 Сорафениб (Нексавар) Raf, VEGFR, PDGFR, Flt3, KIT Почечно-клеточная карцинома 2005 Сунитиниб (Сутент) KIT, VEGFR, PDGFR, Flt3 Почечно-клеточная карцинома, GIST, эндокринный рак поджелудочной железы 2006 Дазатиниб (Sprycel) Abl, Arg, KIT, PDGFR, Src ХМЛ, устойчивый к иматинибу 2007 Нилотиниб (Tasigna) Abl, Arg, KIT, PDGFR Има устойчивый к тинибу ХМЛ 2007 Лапатиниб (Tykerb) EGFR, ErbB2 Карцинома молочной железы 2007 Трастузумаб (Герцептин) ErbB2 Карцинома молочной железы 1998 Цетуксимаб (Эрбитукс) EGFR Колоректальный рак, рак головы и шеи 2004 Бевацизумаб (Авастин) VEGF Рак легких, Колоректальный рак 2004 Панитумумаб (Вектибикс) EGFR Колоректальный рак 2006 + Таблица адаптирована из «Передача сигналов клетками рецептор-тирозинкиназами», Lemmon and Schlessinger's, 2010. Cell, 141, p. 1117-1134.
Читайте также:

