Техника операции при свище поджелудочной железы. Методика операции при свище панкреаз.
Добавил пользователь Morpheus Обновлено: 01.02.2026
На протяжении последних трех десятилетий отмечается увеличение заболеваемости острым панкреатитом, растет и число травм поджелудочной железы, что закономерно сопровождается увеличением риска развития панкреатических свищей [5, 10, 16]. По данным различных авторов частота формирования наружного панкреатического свища (НПС) после перенесенного деструктивного панкреатита составляет 30-55%, после травмы поджелудочной железы - 12-40%. [1, 2, 8, 14]. Внутреннее свищевое отверстие формируется в результате разгерметизации протоковой системы поджелудочной железы. На формирование свищевого хода непосредственное влияние оказывает также характер хирургического вмешательства на поджелудочной железе (оментобурсостома, абдоминизация, внутренние и наружные дренирования кист поджелудочной железы) [4].
Длительно существующие панкреатические свищи способствуют прогрессированию фиброза паренхимы поджелудочной железы, формированию стойкой гипертензии в протоковой системе органа. Наличие функционирующего свища приводит к тяжелым нарушениям гомеостаза, истощению больных, сопровождается снижением качества жизни [3, 4, 9]. В 75-80% случаев внутреннее отверстие свища локализуется в теле и хвосте поджелудочной железы [1, 3, 6, 7, 8] .
Взгляды на тактику лечения наружных панкреатических свищей и кист неоднозначны. Показания к хирургическому и консервативному лечению остаются предметом дискуссий. Консервативное лечение пациентов с панкреатическими свищами предполагает длительную госпитализацию и продолжительный период долечивания в амбулаторных условиях. Хирургическая тактика в зависимости от клинической ситуации может быть реализована как с помощью малоинвазивных, так и с применением традиционных открытых хирургических вмешательств [1, 7, 11]. Предлагались различные варианты лечения панкреатических свищей: от резекции части железы, несущей свищ, до всевозможных способов пломбировки свища [11]. Несмотря на существующие разногласия по вопросам хирургического лечения, большинство исследователей единодушны в отношении необходимости секретолитической терапии при панкреатических свищах [3, 10, 12, 13].
Цель исследования - оценка эффективности применения препаратов соматостатина короткого и продленного действия для лечения наружных панкреатических свищей.
Материал и методы
В исследование вошли 24 пациента с наружными панкреатическими свищами, находившихся на лечении в КГБУЗ «Краевая клиническая больница» Красноярска, в период с 2011 по 2013 г. Мужчин было 16 (66,7%), женщин - 8 (33,3%), средний возраст больных составил 48,3±6,4 года. Этиологическими факторами фистулообразования в большинстве случаев явились последствия перенесенного панкреонекроза (85,7%), открытые травмы живота с повреждением поджелудочной железы (14,3%).
В работе использована классификация свищей ПЖ, предложенная А.П. Радзиховским (1985), где определяющим признаком является связь свища с системой панкреатических протоков [2]. Острыми считали свищи, развившиеся в раннем послеоперационном периоде, хроническими - имеющие сформированный свищевой ход (существующие более 3 мес). Истинными наружными панкреатическими свищами обозначали свищи, связанные с главным панкреатическим протоком, а также его крупными ветвями. В зависимости от локализации, последние подразделяли на боковые и терминальные. Наружные гнойно-панкреатические свищи исходили из инфицированной панкреатической или парапанкреатической полости или кисты, связанной с протоками 1-го и 2-го порядка.
Диагноз наружного панкреатического свища устанавливался на основании осмотра, клинических, биохимических, инструментальных методов исследования (УЗИ, ЭРХПГ, фистулоскопия, КТ). Обязательно исследовали активность амилазы и липазы в крови и отделяемом свища. При гнойно-панкреатических свищах отделяемое свищевого хода направляли на бактериологическое исследование.
Статистический анализ данных производился с помощью пакета прикладных программ Microsoft Office Excel-2010. Данные обработаны методом вариационной статистики с определением средней величины (М) и средней ошибки (m) для каждой группы с оценкой критерия достоверности (р) по Стьюденту при парных сравнениях (ДИ=95%). Проверку соответствия анализируемых параметров нормальному распределению проводили с помощью критерия Шапиро-Уилса. В случае отклонения от нормального распределения для сравнения данных использовали непараметрические критерии Вилкоксона. Достоверными считали различия при р
Результаты и обсуждение
Характер отделяемого зависел от типа свища. При истинных наружных панкреатических свищах отделяемое в большинстве случаев было прозрачным, дебет в 85% превышал 500 мл в сутки. При гнойно-панкреатических свищах отделяемое было мутным, содержало мелкие секвестры, мутный осадок, а суточный дебет составлял в среднем около 350 мл.
В зависимости от задач исследования больные были разделены на две группы. Группы были сопоставимы по полу, возрасту, характеру свища поджелудочной железы (см. таблицу). В исследование включались пациенты с острыми наружными свищами ПЖ.
Лечение острых панкреатических свищей было направлено на угнетение экзокринной панкреатической секреции, формирование свищевого хода, санацию свищевого хода, устранение повреждения кожи вокруг свищевого хода; коррекцию имеющихся нарушений белкового, углеводного, жирового, водно-электролитного, липидного обмена. По показаниям проводилась антибиотикотерапия.
Формирование наружного свищевого хода выполнялось путем своевременной установки дренажей, соответствующих диаметру свищевого хода, с обязательным этапным рентгенологическим и УЗИ- контролем. Гнойно-некротические свищи подвергались постоянной или фракционной санации с активной аспирацией отделяемого.
У больных 1-й группы (14 пациентов) для секретолитической терапии применялся препарат октреотид - синтетический аналог соматостатина короткого действия в стандартной дозировке 0,1 мг подкожно 3 раза в сутки. Пациентам 2-й группы (10 человек) лечение наружного панкреатического свища осуществлялась с помощью аналога соматостатина продленного действия (октреотид-депо) в дозе 20 мг внутримышечно 1 раз за весь период пребывания больного в хирургическом отделении.
Терапию препаратами синтетического аналога соматостатина короткого и продленного действия у больных 1-й и 2-й групп начинали с момента диагностики наружного панкреатического свища по описанной выше схеме.
Длительность курса секретолитической терапии у пациентов 1-й группы варьировала от 18 до 34 сут и составила, в среднем, 24±1,2 суток. Обычно перед инъекцией октреотида-депо пациентам необходимо вводить аналоги саматостатина короткого действия в стандартной дозировке на протяжении 3-5 сут. Однако у всех пациентов, вошедших в исследование, этиологическим фактором формирования наружных панкреатических свищей был острый панкреатит, базовая схема лечения которого включает секретолитическую терапию октреотидом. Поэтому необходимости подготовительного курса инъекций аналога соматостатина короткого действия у пациентов 2-й группы не было. Препарат октреотид-депо вводили внутримышечно однократно после подтверждения наличия наружного панкреатического свища. Повторные инъекции препарата аналога соматостатина продленного действия через 26 сут потребовались в одном случае у пациентки с истинным панкреатическим свищом, располагавшимся терминально. В последующем ей было выполнено оперативное вмешательство, с наложением панкреатикоеюноанастомоза.
Анализ эффективности терапии осуществляли с учетом объема и активности амилазы свищевого отделяемого, сроков заживления свища, наличия рецидива.
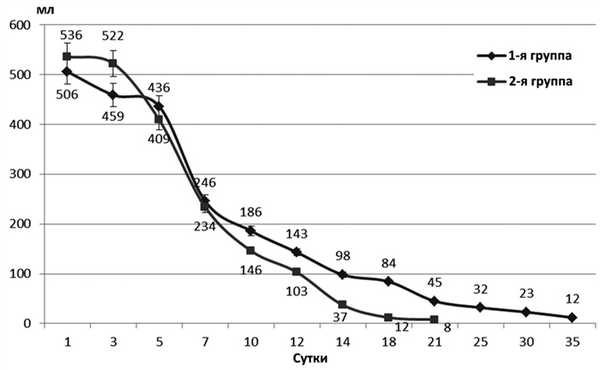
У пациентов первой группы с истинными панкреатическими свищами на фоне секретолитической терапии октреотидом короткого действия статистически значимое снижение дебета по свищу зафиксировано на 7-е сутки наблюдения (рис. 1). Рисунок 1. Динамика дебета истинного панкреатического свища у больных 1-й и 2-й групп (ДИ 95%).
Динамика изменений объема отделяемого из истинного панкреатического свища у больных второй группы на фоне применения аналога соматостатина продленного действия несколько отличалась от показателей, полученных у больных первой группы. Существенное снижение дебета по свищу происходило в среднем на 5-е сутки наблюдения (рис. 1).
Рецидивов образования свища у пациентов с истинными панкреатическими свищами в обеих группах зафиксировано не было.
У пациентов с гнойно-панкреатическими свищами количество отделяемого исходно было меньше, по сравнению с истинными свищами. В первые 12-14 сут после формирования свищевого хода в отделяемом преобладал воспалительный компонент (лейкоциты, мелкие секвестры, фибрин), активность амилазы была относительно невысокой. Вероятно, с этим связаны иные закономерности в динамике изменения дебета свищей у этих больных, в сравнении с пациентами с истинными панкреатическими свищами.
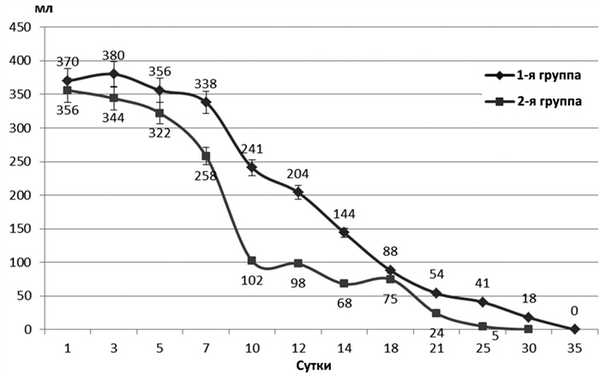
У пациентов 1-й группы, несмотря на секретолитическую терапию, на протяжении 7 суток объем отделяемого из свища оставался на относительно стабильном уровне. Начиная с 10-х суток наблюдения отмечено снижение суточного дебета, в эти же сроки менялся и характер отделяемого, которое становилось более прозрачным, а содержание амилазы в нем увеличивалось и достигало 8330±135 Ед/л (p<0,05). В дальнейшем, на протяжении 7-9 суток суточный дебет по свищу существенно не менялся, оставаясь на уровне 86,4±8,5 мл (p>0,05)(рис.2). Рисунок 2. Динамика дебета гнойно-панкреатических свищей у больных 1-й и 2-й групп (ДИ 95%).
Статистически значимое снижение объема свищевого отделяемого у 83,3% больных 1-й группы происходило на 21±2,3 сутки наблюдения. У одного больного интенсивное выделение секрета из свищевого хода наблюдалось на протяжении всего периода наблюдения. На контрольной фистулографии у этого больного сохранялась промежуточная полость до 2,5 см в диаметре, четкой взаимосвязи с протоковой системой ПЖ визуализировано не было. После закрытия свищевого хода больной был выписан. Через 7 мес у больного сформировалась псевдокиста ПЖ, что потребовало повторной госпитализации.
Выводы
На фоне применения соматостатина короткого действия в стандартной дозировке у больных с истинными панкреатическими свищами заживление свищевого хода происходит, в среднем, на 28±2,6 сут, у больных с гнойно-некротическими свищами - на 21±2,3 сут лечения. Неэффективность применяемой терапии отмечена у 25% больных с истинными свищами. Формирование псевдокисты произошло у одного больного с гнойно-панкреатической формой свища.
На фоне применения аналога соматостатина продленного действия заживление истинных панкреатических наружных свищей происходит в среднем на 19±1,8 сут, при гнойно-некротических свищах выделение секрета прекращается, в среднем, на 16,2±1,2 сут наблюдения. Эпизодов неэффективности консервативной терапии не выявлено. Формирование псевдокисты произошло также, как и в 1-й группе - у одного больного с гнойно-некротическим свищом.
Таким образом, применение аналога соматостатина продленного действия позволяет в более ранние сроки снизить дебет свищевого отделяемого, способствует уменьшению сроков заживления свища, в сравнении с соматостатином короткого действия в стандартной дозировке и достигнуть консервативного закрытия свища.
Хирургическое лечение наружных панкреатических свищей
Наружные свищи наиболее часто возникают после открытой травмы живота, после операций на поджелудочной железе, вследствие деструктивных изменений в железе (острый панкреатит, панкреонекроз)
Панкреатический свищ представляет собой неравномерно суженный канал, сообщающийся с протоком поджелудочной железы, стенки которого образованы фиброзной тканью. В ткани поджелудочной железы в месте формирования свища обнаруживают различного рода морфологические изменения, которые привели к его образованию (некроз, воспаление, киста).
Для наружных свищей поджелудочной железы характерно выделение панкреатического сока через их наружное отверстие. Количество отделяемого зависит от вида свища. При полном свище за сутки выделяется до 1-1,5 л панкреатического сока, при неполном - нередко всего несколько миллилитров. В зависимости от выраженности деструктивных и воспалительных изменений в поджелудочной железе и в стенках из свища выделяется либо чистый панкреатический сок, либо сок с примесью крови или гноя. Выделяющийся в большом количестве панкреатический сок с кожей очень быстро вызывает мацерацию кожи вокруг наружного отверстия свища. Значительная потеря сока приводит к резкому ухудшению состояния больного, выраженным нарушениям белкового, жирового и углеводного обмена, существенным потерям воды, электролитов и расстройствам кислотно-основного состояния.
Окончательный диагноз подтверждается обнаружением в отделяемом свища высокой концентрации панкреатических ферментов. Для уточнения диагноза применяют фистулографию.
Неполные свищи нередко закрываются под влиянием консервативного лечения. Однако при безуспешности консервативной терапии и при наличии полного свища показано хирургическое лечение. Основным методом лечения свищей тела и хвоста поджелудочной железы является выделение свищевого хода и дистальная резекция органа. При локализации внутреннего отверстия свища в области головки, перешейка и проксимальной части тела поджелудочной железы оперативное лечение заключается в формировании соустья между внутренними отверстием свища (панкреатический проток), либо между самим свищом и тонкой кишкой.
Гастропанкреатодуоденальная резекция (Kausch-Wipple procedure)
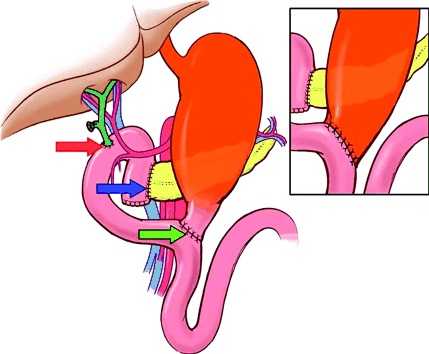
Гастропанкреатодуоденальная резекция (ГПДР), синоним - операция Уиппла (Whipple’s procedure) включает одномоментное удаление головки поджелудочной железы, дистальной части желудка, двенадцатиперстной кишки, начального отдела тощей кишки, части желчных протоков, желчного пузыря и регионарных лимфатических узлов.
Показанием к проведению ГПДР являются: верифицированное опухолевое поражение головки поджелудочной железы, терминального отдела холедоха, большого дуоденального сосочка и двенадцатиперстной кишки, а также невозможность исключения злокачественного процесса указанной локализации. Кроме этого ГПДР в ряде случаев показана пациентам, страдающим хроническим панкреатитом.
Операция ГПДР, являясь единственным средством избавления пациента от опухоли панкреатодуоденальной зоны, является, тем не менее, весьма травматичным вмешательством. Необходимость формирования нескольких анастомозов обусловливает вероятность развития в послеоперационном периоде их несостоятельности с формированием свищей и развитием других достаточно тяжелых осложнений. Впервые ГПДР была проведена в Европе немецким хирургом Walter Kausch в 1909 году, в США - хирургом Allen Whipple в 1932 году. Результаты гастропанкреатодуоденальной резекции на протяжении десятилетий были весьма неутешительны: ГПДР сопровождалась большим количеством осложнений и достаточно высокой летальностью. Однако в настоящее время, благодоря отработанной технике этой операции, современной оснащенности операционной, профессиональной подготовке врачей анестезиологов-реаниматологов, ГПДР сопровождается минимальным количеством осложнений и послеоперационной летальности, хорошими отдаленными результатами выживаемости и качества жизни.

M.Evseev, A.Vladykin, I.Klyshin. Multivisceral resection for locally advanced colorectal cancer. Case report. Одним из направлений научных исследований.

В историческом обзоре приводятся в хронологической последовательности этапы рождения и эволюции панкреатодуоденальной резекции. Описаны первые опыты проведения.
Техника операции при свище поджелудочной железы. Методика операции при свище панкреаз.
Институт хирургии им. А.В. Вишневского Министерства здравоохранения и социального развития РФ, Москва
Институт хирургии им. А.В. Вишневского, Москва
Причины возникновения и профилактика панкреатических свищей после резекционных операций на поджелудочной железе
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2014;(5): 79‑83
Ахтанин Е.А., Кригер А.Г. Причины возникновения и профилактика панкреатических свищей после резекционных операций на поджелудочной железе. Хирургия. Журнал им. Н.И. Пирогова. 2014;(5):79‑83.
Akhtanin EA, Kriger AG. Causes and prevention of pancreatic fistulas after pancreas resection. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2014;(5):79‑83. (In Russ.).
Заболеваемость раком поджелудочной железы (ПЖ) и хроническим панкреатитом увеличивается с каждым годом, что приводит к увеличению количества операций, выполняемых по поводу этих заболеваний [4]. Характерной особенностью хирургической панкреатологии является большое количество послеоперационных осложнений, причем на протяжении длительного времени этот показатель не имеет тенденции к снижению.
V. Hunt [24], проанализировав мировой опыт хирургических вмешательств на ПЖ с момента первой панкреатодуоденальной резекции (ПДР), выполненной A. Cadevilla в 1898 г., до 1940 г. выявил 124 операции на ПЖ. Летальность в то время составила 60%, 5-летняя выживаемость - лишь 3%. В последующие 30 лет летальность после ПДР снизилась до 5-11%, а показатель осложнений достиг 36% [16]. За последние годы в специализированных хирургических центрах летальность составляет не более 3-5%, однако показатель послеоперационных осложнений по-прежнему остается на уровне 30-60% [9] (уровень доказательности А).
Основным специфическим осложнением после резекционных операций на ПЖ является панкреатический свищ - ПС; уровень доказательности А [53]. Частота наружных ПС после ПДР колеблется от 0 до 30% [48]. При возникновении ПС возрастает риск развития септических осложнений и аррозионного кровотечения, значительно увеличивается длительность пребывания больного в стационаре и стоимость его лечения, неизбежно возрастает летальность [32, 59].
Причиной образования послеоперационного наружного ПС является несостоятельность швов панкреатодигестивного анастомоза или культи ПЖ после дистальной резекции. В результате панкреатический секрет поступает в брюшную полость и при наличии дренажной трубки выделяется наружу [40] (уровень доказательности А). Основной причиной возникновения несостоятельности швов является послеоперационный панкреатит, приводящий к некрозу паренхимы ПЖ в области анастомоза [3] (уровень доказательности С).
Под термином «панкреатический свищ» подразумевается поступление из брюшной полости отделяемого с повышенным содержанием амилазы [8]. M. Buchler и соавт. [11] считали подтверждением ПС наличие панкреатогенного отделяемого по дренажу в объеме 50 мл в сутки с большим содержанием амилазы крови через 1 и более дней после операции. По мнению других хирургов [46], о ПС можно говорить при наличии отделяемого в объеме более 10 мл в сутки с уровнем амилазы, в 3 раза превышающим норму на 5-е и более поздние сутки послеоперационного периода. A. Lowy и соавт. [36] предложили использовать термин «клинически значимый ПС», подразумевая под ПС наличие гипертермии более 38 °С, лейкоцитоза более 10·10 9 /л и признаков тяжелого сепсиса. Этот термин был введен с целью разделения бессимптомных, так называемых, «биохимических» ПС и ПС, протекающих с клиническими проявлениями.
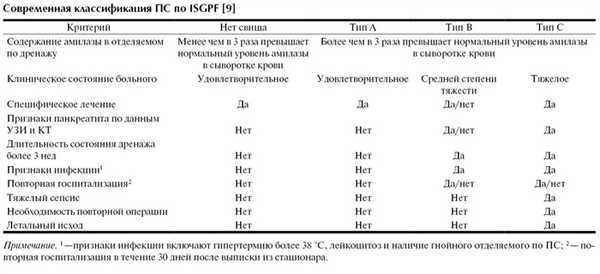
Согласно рекомендациям международной группы по изучению панкреатических свищей (ISGPF, 2005 г.), доказательством ПС считается наличие панкреатогенного отделяемого по дренажу с уровнем амилазы, в 3 раза превышающим ее нормальное содержание в сыворотке крови на 3-и и более поздние сутки послеоперационного периода [9] (уровень доказательности А). Согласно этому определению, ПС делятся на 3 типа (см. таблицу).
В настоящее время проводится множество исследований, направленных на идентификацию факторов риска возникновения ПС. Результаты этих исследований часто противоречат друг другу, что требует их критической оценки [13, 31, 35].
Предполагаемые факторы риска разделяют на 3 группы:
1) гистоморфологические особенности ПЖ (консистенция, липоматоз паренхимы, диаметр протока ПЖ);
2) индивидуальные особенности больного (возраст, пол, сопутствующие заболевания);
3) операционные факторы (длительность операции, кровопотеря, интраоперационное переливание крови, травматичность операции).
Консистенция ПЖ - один из наиболее изученных факторов риска развития ПС. При описании консистенции паренхимы ПЖ принято употреблять термин «мягкая» железа. Под ним подразумевается нормальное состояние ткани железы без ее фиброзного перерождения [17]. За счет сохраненной функциональной активности ПЖ в ответ на операционную травму неизбежно развивается острый панкреатит, а при краевом панкреонекрозе (в области панкреатодигестивного анастомоза или культи ПЖ при дистальной резекции) возникает несостоятельность швов анастомоза или культи ПЖ, ведущая к ПС [3, 50].
J. Denbo и соавт. [17] в мультицентровом исследовании, включавшем 2706 больных, которым была выполнена ПДР, отметили, что ПС чаще возникает при наличии «мягкой» культи ПЖ (уровень доказательности А).
Ожирение (высокий индекс массы тела - ИМТ) сопровождается липоматозом ПЖ, что усугубляет эффект «мягкой» железы. Жировая инфильтрация культи ПЖ делает ее склонной к разрывам во время формирования шва и завязывания узлов [21]. A. Mathur и соавт. [38] выяснили, что 40 больных с ПС после ПДР имели значительно большее количество интралобулярных, межлобулярных и диффузных отложений жира в ПЖ, чем больные без послеоперационного свища (уровень доказательности В).
E. Rosso и соавт. [51] установили, что риск развития послеоперационного ПС существенно возрастает при двух факторах: ИМТ более 25, а также степень жировой инфильтрации ПЖ больше 10%, даже при нормальном ИМТ. Выявлена зависимость между увеличением риска возникновения ПС и толщиной висцерального жира, превышающей 2 см [23] (уровень доказательности А). КТ или МРТ органов брюшной полости позволяет обнаружить патологическое отложение жира в ПЖ в виде жировой инфильтрации паренхимы либо отдельные участки отложения жира, схожие с липомой [47]. Предоперационное измерение содержания жира в ПЖ предлагается в качестве неинвазивного метода прогнозирования послеоперационных осложнений, в том числе ПС [33].
В отличие от «мягкой», «плотная» ПЖ характеризуется фиброзным перерождением паренхимы и низкой функциональной активностью, что существенно снижает вероятность возникновения послеоперационного панкреатита и облегчает формирование панкреатодигестивного анастомоза. В результате вероятность возникновения ПС снижается [10, 20, 26, 28, 41, 44, 54] (уровень доказательности А).
Диаметр просвета протока ПЖ считается существенным прогностическим фактором развития ПС после операций, сопровождающихся наложением панкреатодигестивных анастомозов. Многомерный анализ результатов лечения 300 больных показал, что ПС чаще формируются при «узком» (диаметр не более 3 мм) протоке ПЖ [41] (уровень доказательности В). Аналогичные результаты были отмечены и другими авторами [27, 48, 49]. В ходе одноцентрового, нерандомизированного исследования результатов 696 ПДР O. Belyaev и соавт. [10] установили, что в группе больных, у которых развился ПС, диаметр протока ПЖ в среднем был меньше, чем в группе больных без ПС (уровень доказательности С).
Для оценки вероятности возникновения ПС с помощью методов лучевой диагностики предложено определять индекс диаметра протока ПЖ - отношение диаметра протока ПЖ к поперечному размеру тела ПЖ. При индексе меньше 0,2 вероятность образования ПС достигает 45% [6] (уровень доказательности А).
Существует предположение, что развитие осложнений после резекционных операций на ПЖ может зависеть от пола больного. Н. Pitt [47] указывает, что у женщин послеоперационный свищ формируется реже. Есть сведения о том, что мужчины более подвержены появлению ПС [35, 61]. Изучение результатов 1239 ПДР показало, что мужской пол является значимым фактором, предрасполагающим к развитию ПС [28] (уровень доказательности А).
По мнению многих авторов, возраст не оказывает значимого влияния на частоту возникновения ПС [22]. Корреляция возраста с частотой возникновения ПС у больных старше 80 лет не была установлена [56]. Сопутствующие заболевания также не оказывают явного воздействия на частоту возникновения ПС [12].
Отмечена прямая связь между объемом операции и возникновением ПС - увеличение травматичности, длительности вмешательства, расширенная лимфаденэктомия увеличивают вероятность возникновения ПС [12, 62]. Для сокращения длительности операции при лапароскопических и робот-ассистированных дистальных резекциях ПЖ хирурги пересекают ПЖ с помощью степлеров. Этот метод пересечения железы обеспечивает надежный гемостаз, но не позволяет избежать появления ПС [18]. Трехрядные сшивающие аппараты более надежны в отношении как обеспечения гемостаза по линии шва, так и предотвращения образования ПС [58]. Основной причиной возникновения свищей при использовании степлеров является грубое раздавливание тканей ПЖ браншами сшивающего аппарата, что приводит к краевому некрозу паренхимы [29].
Формирование панкреатодигестивного анастомоза - ответственный этап операции, влияющий на вероятность возникновения ПС. Существует три варианта анастомозирования культи ПЖ: панкреатикоеюноанастомоз (ПЕА), панкреатикогастроанастомоз (ПГА), инвагинационные методики.
Каждый из указанных способов анастомозирования имеет сторонников и противников. Первые считают ПГА более надежным за счет хорошего кровоснабжения стенки желудка, близкого расположения задней стенки желудка и культи ПЖ, что уменьшает натяжение швов анастомоза [19, 55]. К преимуществу ПГА по сравнению с ПЕА относят факт отсутствия активации панкреатического сока в кислой среде желудка, что предотвращает аутолиз ткани в зоне анастомоза [37]. Мультицентровое исследование A. McKay и соавт. [39] показало меньшее количество ПС и других осложнений после формирования ПГА по сравнению с ПЕА (уровень доказательности А).
В то же время сторонники ПЕА приводят аргументированные данные, свидетельствующие об отсутствии значимых различий в частоте несостоятельности ПГА и ПЕА [7, 42, 62].
Инвагинационный метод используют при «мягкой» консистенции ПЖ либо при узком протоке ПЖ [5].
F. Chou и соавт. [15] провели сравнение стандартного и инвагинационного методов формирования ПЕА. Результаты их работы показали, что частота развития осложнений, в том числе ПС, а также послеоперационная летальность выше при использовании инвагинационной техники (уровень доказательности А).
Таким образом, единое мнение о преимуществе какого-либо вида анастомозирования отсутствует. Очевидно, что вопрос о способе формирования анастомоза должен решаться в индивидуальном порядке в зависимости от состояния ПЖ и предпочтения хирурга.
Способы профилактики возникновения ПС в хирургической панкреатологии всегда были и остаются актуальной проблемой. Идея ингибирования экзокринной секреции для предотвращения осложнений после операций на ПЖ впервые была озвучена в 1979 г. I. Klempa и соавт. [30]. В настоящее время применяют не соматостатин, а его аналоги, оказывающие пролонгированное действие. Наиболее востребованным стал синтетический пептид октреотид, являющийся производным соматостатина [2]. В сравнительном плане было изучено влияние на образование послеоперационных ПС другого мощного аналога соматостатина пролонгированного действия - вапреотид. Различий в частоте послеоперационных осложнений между 135 больными, получавшими вапреотид, и контрольной группой из 140 больных обнаружено не было [52]. Был сделан вывод о неэффективности данного препарата (уровень доказательности В).
Таким образом, до сих пор однозначного мнения об эффективности использования аналогов соматостатина при резекционных вмешательствах на ПЖ нет.
Биологические клеи были использованы даже для облитерации протока ПЖ как при ПДР, так и при дистальных резекциях ПЖ [57], однако желаемого эффекта не получено. В ряде исследований сообщается об увеличении количества осложнений [60] (уровень доказательности А).
Противоречивы результаты использования для профилактики ПС большого сальника. Ряд авторов сообщили о сокращении числа ПС при окутывании ПЕА или культи ПЖ лоскутом большого сальника [14]. В то же время анализ результатов 2597 ПДР, проведенный М. Tani и соавт. [58], показал, что обертывание анастомоза сальником увеличивает частоту образования у пациентов ПС (уровень доказательности А).
Стентирование протока ПЖ при формировании панкреатодигестивного анастомоза является довольно распространенным способом профилактики несостоятельности швов и возникновения ПС. Одно из первых исследований показало, что стентирование протока в области анастомоза снижает вероятность образования панкреатического свища, что послужило предпосылкой для изучения этого метода [63]. Его используют для наружного стентирования с выведением стента через стенку кишки, а также в качестве «потерянного» стента. Полученные результаты свидетельствует об отсутствии однозначного мнения. R. Poon и соавт. [48], G. Ramacciato и соавт. [50] сообщили об уменьшении количества ПС при стентировании протока ПЖ. Эффективность стентирования не подтверждена в исследовании, проведенном Т. Imaizumi и соавт. [25] (уровень доказательности В). К аналогичному выводу пришли J. Winter и соавт. [61] (уровень доказательности А).
Таким образом, панкреатические свищи остаются истинным «бичом» хирургии поджелудочной железы. Основными предрасполагающими факторами развития этого осложнения является «мягкая» консистенция паренхимы железы, узкий проток поджелудочной железы, травматичность операции, возрастающая при лимфаденэктомии. Фактором служит прорезывание швов, обусловленное, как правило, краевым панкреонекрозом. Способ формирования панкреатодигестивного анастомоза не имеет определяющего значения в профилактике возникновения панкреатического свища. Медикаментозное подавление секреции поджелудочной железы, использование медицинских клеев, стентирование области анастомоза не позволяют добиться убедительных положительных результатов.
Для улучшения результатов резекционных операций на поджелудочной железе требуется дальнейший поиск методов прогнозирования возникновения панкреатического свища и методов надежной профилактики этого осложнения.
© К.Г. Холоденин, В.А. Соловьев, Н.В. Парахоняк,
А.А. Малов, 2004 г.
УДК 616.37—007.253
Поступила 26.12.2003 г.
К.Г. Холоденин, В.А. Соловьев, Н.В. Парахоняк, А.А. Малов
Нижегородская государственная медицинская академия;
Областная больница им. Н.А.Семашко, Нижний Новгород
Случай успешного лечения посттравматического наружного панкреатического свища
Наружные панкреатические свищи являются исходом острого деструктивного панкреатита, травм поджелудочной железы, панкреатодуоденальных резекций и наружных дренирований кист поджелудочной железы. Особую сложность представляют свищи, исходящие из головки и перешейка поджелудочной железы, поскольку они чаще всего функционируют по типу полных. При полных наружных панкреатических свищах значительно страдает пищеварение и нарушаются все виды обмена, что приводит к прогрессивному истощению больных. Это диктует тактику раннего закрытия свища. Однако выбор оперативного вмешательства и сроки его выполнения зависят от состояния свищевого хода, кожного покрова вокруг свища, а также функционального состояния поджелудочной железы. Для оценки последнего в клинике разработана методика исследования отделяемого из свищевого хода. Определяются количество панкреатического сока, его рН, число лейкоцитов в мазке, содержание белка в секрете, уровень веществ с низкой и средней молекулярной массой, активность амилазы и внутрипротоковое давление в поджелудочной железе. На основании полученных данных устанавливается фаза воспалительного процесса, протекающего в поджелудочной железе. Как показали исследования, после завершения воспаления количество выделяющегося панкреатического сока уменьшается до 180—200 мл/сут, рН остается в пределах 8,21±0,2, внутрипротоковое давление снижается до 253±13 мм вод.ст., активность амилазы составляет 139±33 г/ч·л, определяются единичные лейкоциты в мазке, содержание белка доходит до 0,5 г/л, уровень средних молекул убывает до 0,25.
Приводим наблюдение успешного лечения посттравматического наружного панкреатического свища, где были использованы эти исследования.
Больной М., 35 лет, поступил в хирургическую клинику им. А.И.Кожевникова 4.11.2000 г. 2,5 мес назад был оперирован в ЦРБ по поводу тупой травмы живота с повреждением поджелудочной железы. В послеоперационном периоде сформировался наружный панкреатический свищ. При поступлении обращало на себя внимание значительное количество истекающего сока из поджелудочной железы, которое достигало 2—3 л в сутки; рН отделяемого составляла 8,5, амилаза — 55 г/ч·л. Количество лейкоцитов в мазке было до 100 в поле зрения, содержание белка — 6,2 г/л, давление в панкреатическом протоке — 330 мм вод. ст., уровень средних молекул — 0,8. При росте 164 см масса тела больного составляла 40 кг. Отмечались гипопротеинемия (содержание белка в крови 31 г/л), резкая диспротеинемия и электролитные нарушения. Состояние больного прогрессивно ухудшалось, нарастало истощение.
16.11.2000 г. была предпринята операция, в ходе которой установлено, что свищ исходит из головки поджелудочной железы и располагается у медиального контура вертикальной части 12-перстной кишки. Стенка 12-перстной кишки — в состоянии стекловидного отека, ткань поджелудочной железы в области головки — без фиброзных изменений, рыхлая и «сочная», тело и хвост не изменены. В сложившейся ситуации выполнение панкреатодуоденальной резекции или формирование фистулоэнтеростомии на петле по Ру признано нецелесообразным ввиду высокого риска несостоятельности анастомоза. Было осуществлено наложение панкреатикофистулогастроанастомоза на «скрытом дренаже». В свищ на глубину 2 см введен хлорвиниловый катетер, который фиксирован, а затем через серо-серозный туннель погружен в просвет желудка на глубину 6 см. Минимальный объем операции позволил избежать массивной потери панкреатического сока.
Послеоперационный период протекал без осложнений, состояние больного быстро улучшалось. На 14-й день произведена фиброгастроскопия, на которой виден дренаж, находящийся в просвете желудка. Больной был выписан.
Спустя 3,5 мес после выписки, 13.03.2001 г., больной в экстренном порядке был повторно оперирован с признаками ферментативного перитонита. При ревизии брюшной полости выявлено, что оставленный «скрытый дренаж» в зоне анастомоза отсутствует, отверстие в желудке зарубцевалось, панкреатический сок поступает в брюшную полость. Последняя была осушена и дренирована. К головке поджелудочной железы подведена дренажно-поролоновая система, на которой вновь в последующем сформировался наружный панкреатический свищ.
Исследованы показатели истекающего панкреатического сока в течение 14 дней: внутрипротоковое давление — 260 мм вод.ст., активность амилазы — 140 г/ч·л, рН=8,4, число лейкоцитов в мазке — единичное, содержание белка — 0,1 г/л, уровень средних молекул — 0,25. Учитывая стабильность этих показателей, что свидетельствовало о стихании процессов воспаления в поджелудочной железе и формировании плотной стенки свища, решено было выполнить операцию по закрытию наружного свищевого хода. Операцией выбора в данном случае являлась органосохраняющая операция.
Во время операции выделен свищевой ход, который проходил через брыжейку поперечноободочной кишки и исходил из головки поджелудочной железы. Выкроена петля тонкой кишки по Ру длиной 35 см. Петля проведена через окно брыжейки толстой кишки. Наложен панкреатофистулоеюноанастомоз с петлей по Ру узловыми швами в 2 ряда.
Послеоперационный период прошел без осложнений. Рана зажила вторичным натяжением. Больной выписан по выздоровлении.
Пациент был осмотрен через 1,5 года, чувствует себя хорошо, состояние удовлетворительное, дефицита массы тела нет. Трудоспособность восстановлена.
Читайте также:
