Тиреоидная офтальмопатия: признаки, гистология, лечение, прогноз
Добавил пользователь Евгений Кузнецов Обновлено: 08.01.2026
Эндокринная офтальмопатия - это органоспецифическое прогрессирующее поражение мягких тканей орбиты и глаза, развивающееся на фоне аутоиммунной патологии щитовидной железы. Течение эндокринной офтальмопатии характеризуется экзофтальмом, диплопией, отечностью и воспалением тканей глаза, ограничением подвижности глазных яблок, изменениями роговицы, ДЗН, внутриглазной гипертензией. Диагностика эндокринной офтальмопатии требует проведения офтальмологического обследования (экзофтальмометрии, биомикроскопии, КТ орбиты); исследования состояния иммунной системы (определение уровня Ig, Ат к ТГ, Ат к ТПО, антиядерных антител и др.), эндокринологического обследования (Т4 св., Т3 св., УЗИ щитовидной железы, пункционной биопсии). Лечение эндокринной офтальмопатии направлено на достижение эутиреоидного состояния; может включать медикаментозную терапию или удаление щитовидной железы.
МКБ-10
Общие сведения
Эндокринная офтальмопатия (тиреоидная офтальмопатия, офтальмопатия Грейвса, аутоиммунная офтальмопатия) - аутоиммунный процесс, протекающий со специфическим поражением ретробульбарных тканей и сопровождающийся экзофтальмом и офтальмоплегией различной степени выраженности. Впервые заболевание было подробно описано К. Грейвсом в 1776 г.
Эндокринная офтальмопатия - проблема, представляющая клинический интерес для эндокринологии и офтальмологии. Эндокринной офтальмопатией страдает примерно 2 % всего населения, при этом среди женщин заболевание развивается в 5-8 раз чаще, чем среди мужчин. Возрастная динамика характеризуется двумя пиками манифестации офтальмопатии Грейвса - в 40-45 лет и 60-65 лет. Эндокринная офтальмопатия также может развиваться в детском возрасте, чаще у девочек первого и второго десятилетия жизни.
Причины
Факторы, инициирующие эндокринную офтальмопатию, до сих пор окончательно не выяснены. В роли пусковых механизмов могут выступать:
- респираторные инфекции,
- малые дозы радиации,
- инсоляция,
- курение,
- соли тяжелых металлов,
- стресс,
- аутоиммунные заболевания (сахарный диабет и пр.), вызывающие специфический иммунный ответ.
Отмечена ассоциация эндокринной офтальмопатии с некоторыми антигенами HLA-системы: HLA-DR3, HLA-DR4, HLA-B8. Мягкие формы эндокринной офтальмопатии чаще встречаются среди лиц молодого возраста, тяжелые формы заболевания характерны для пожилых людей.
Патогенез
Предполагается, что вследствие спонтанной мутации Т-лимфоциты начинают взаимодействовать с рецепторами мембран клеток глазных мышц и вызывают в них специфические изменения. Аутоиммунная реакция Т-лимфоцитов и клеток-мишеней сопровождается высвобождением цитокинов (интерлейкина, фактора некроза опухолей, γ-интерферона, трансформирующего фактора роста b, фактора роста тромбоцитов, инсулиноподобного фактора роста 1), которые индуцируют пролиферацию фибробластов, образование коллагена и выработку гликозаминогликанов. Последние, в свою очередь, способствуют связыванию воды, развитию отека и увеличению объема ретробульбарной клетчатки. Отек и инфильтрация тканей орбиты со временем сменяются фиброзированием, в результате чего экзофтальм становится необратимым.
Классификация
В развитии эндокринной офтальмопатии выделяют фазу воспалительной экссудации, фазу инфильтрации, которая сменяется фазой пролиферации и фиброза. С учетом выраженности глазной симптоматики выделяют три формы эндокринной офтальмопатии:
- Тиреотоксический зкзофтальм. Характеризуется незначительной истинной или ложной протрузией глазных яблок, ретракцией верхнего века, отставанием века при опускании глаз, тремором закрытых век, блеском глаз, недостаточностью конвергенции.
- Отечный экзофтальм. Об отечном экзофтальме говорят при выстоянии глазных яблок на 25-30 мм, выраженном двустороннем отеке периорбитальных тканей, диплопии, резкой ограниченности подвижности глазных яблок. Дальнейшее прогрессирование эндокринной офтальмопатии сопровождается полной офтальмоплегией, несмыканием глазных щелей, хемозом конъюнктивы, язвами роговицы, застойными явлениями на глазном дне, болями в орбите, венозным стазом. В клиническом течении отечного экзофтальма выделяют фазы компенсации, субкомпенсации и декомпенсации.
- Эндокринную миопатию. При эндокринной миопатии имеет место слабость чаще прямых глазодвигательных мышц, приводящая к диплопии, невозможности отведения глаз кнаружи и кверху, косоглазию, отклонению глазного яблока книзу. Вследствие гипертрофии глазодвигательных мышц прогрессирующе нарастает их коллагеновая дегенерация.
Для обозначения выраженности эндокринной офтальмопатии в России обычно используются классификация В. Г. Баранова, согласно которой выделяют 3 степени эндокринной офтальмопатии.
- Критериями эндокринной офтальмопатии 1 степени служат: невыраженный экзофтальм (15,9 мм), умеренная отечность век. Ткани конъюнктивы при этом интактны, функция глазодвигательных мышц не нарушена.
- Эндокринная офтальмопатия 2 степени характеризуется умеренно выраженным экзофтальмом (17,9 мм), значительным отеком век, выраженным отеком конъюнктивы, периодическим двоением.
- При эндокринной офтальмопатии 3 степени выявляются выраженные признаки экзофтальма (20,8 мм и более), диплопия стойкого характера, невозможность полного смыкания век, изъязвление роговицы, явления атрофии зрительного нерва.
Симптомы эндокринной офтальмопатии
К ранним клиническим проявлениям эндокринной офтальмопатии относятся преходящие ощущения «песка» и давления в глазах, слезотечение либо сухость глаз, светобоязнь, отечность периорбитальной области. В дальнейшем развивается экзофтальм, который вначале носит асимметричный или односторонний характер.
На стадии развернутых клинических проявлений названные симптомы эндокринной офтальмопатии становятся постоянными; к ним добавляется заметное увеличение выстояния глазных яблок, инъекция конъюнктивы и склеры, припухлость век, диплопия, головные боли. Невозможность полного смыкания век приводит к образованию язв роговицы, развитию конъюнктивита и иридоциклита. Воспалительная инфильтрация слезной железы усугубляется синдромом сухого глаза.
Осложнения
При выраженном экзофтальме может возникать компрессия зрительного нерва, приводящая к его последующей атрофии. Механическое ограничение подвижности глазных яблок приводит к увеличению внутриглазного давления и развитию, так называемой, псевдоглаукомы; в некоторых случаях развивается окклюзия вен сетчатки. Вовлечение глазных мышц нередко сопровождается развитием косоглазия.
Диагностика
Диагностический алгоритм при эндокринной офтальмопатии предполагает обследование пациента эндокринологом и офтальмологом с выполнением комплекса инструментальных и лабораторных процедур.
1. Эндокринологическое обследование направлено на уточнение функции щитовидной железы и включает исследование тиреоидных гормонов (свободных Т4 и Т3), антител к ткани щитовидной железы (Ат к тиреоглобулину и Ат к тиреопероксидазе), проведение УЗИ щитовидной железы. В случае выявления узлов щитовидной железы диаметром более 1 см, показано выполнение пункционной биопсии.
2. Функциональное офтальмологическое обследование при эндокринной офтальмопатии преследует цель уточнения зрительной функции. Функциональный блок включает:
- визометрию
- периметрию
- исследование конвергенции
- электрофизиологические исследования
- биометрические исследования глаза (экзофтальмометрия, измерение угла косоглазия) - позволяют определить высоту выстояния и степень отклонения глазных яблок
3. Методы визуализации направлены на морфлогическую оценку структур глаза. Включают следующие исследования:
- осмотр глазного дна (офтальмоскопия) производится для исключения развития нейропатии зрительного нерва
- биомикроскопия - с целью оценки состояния структур глаза
- тонометрия - выполняется для выявления внутриглазной гипертензии
- УЗИ, МРТ, КТ орбит) позволяют дифференцировать эндокринную офтальмопатию от опухолей ретробульбарной клетчатки.
4. Иммунологическое обследование. При эндокринной офтальмопатии чрезвычайно важным представляется обследование иммунной системы больного. Изменения клеточного и гуморального иммунитета при эндокринной офтальмопатии характеризуется снижением числа CD3+ T-лимфоцитов, изменением соотношения CD3+ и лимфоцитов, уменьшением количества CD8+T-cynpeccopoв; возрастанием уровня IgG, антиядерных антител; повышением титра Ат к ТГ, ТПО, АМАb (глазным мышцам), второму коллоидному антигену. По показаниям выполняется биопсия пораженных глазодвигательных мышц.
Экзофтальм при эндокринной офтальмопатии следует дифференцировать с псевдоэкзофтальмом, наблюдаемым при высокой степени близорукости, орбитальном целлюлите (флегмоне глазницы), опухолях (гемангиомах и саркомах орбиты, менингиомах и др.).
Лечение эндокринной офтальмопатии
Патогенетическая терапия
Лечебная тактика определяется стадией эндокринной офтальмопатии, степенью нарушения функции щитовидной железы и обратимостью патологических изменений. Все варианты лечения направлены на достижение эутиреоидного состояния.
- Иммуносупрессивная терапия. Включает назначение глюкокортикоидов (преднизолон), оказывающих противоотечное, противовоспалительное и иммуносупрессивное действие. Кортикостероиды применяются внутрь и в виде ретробульбарных инъекций. При угрозе потери зрения проводится пульс-терапия метилпреднизолоном, рентгенотерапия орбит. Использование глюкокортикоидов противопоказано при язвенной болезни желудка или двенадцатиперстной кишки, панкреатите, тромбофлебитах, артериальной гипертензии, нарушении свертываемости крови, психических и онкологических заболеваниях.
- Экстракорпоральная гемокоррекция. Методами, дополняющими иммуносупрессивную терапию, служат плазмаферез, гемосорбция, иммуносорбция, криоаферез.
- Коррекция функции ЩЖ. При наличии нарушений функции щитовидной железы проводится ее коррекция тиростатиками (при тиреотоксикозе) или тиреоидными гормонами (при гипотиреозе).
- Хирургическая тактика. При невозможности стабилизации функции щитовидной железы может потребоваться выполнение тиреоидэктомии с последующей ЗГТ.
Офтальмологическое лечение
Симптоматическая терапия при эндокринной офтальмопатии направлена на нормализацию метаболических процессов в тканях и нервно-мышечной передачи. В этих целях назначаются инъекции актовегина, прозерина, инстилляции капель, закладывание мазей и гелей, прием витаминов А и Е. Из методов физиотерапии при эндокринной офтальмопатии используется электрофорез с лидазой или алоэ, магнитотерапия на область орбит.
Возможное хирургическое лечение эндокринной офтальмопатии включает три типа офтальмологических операций:
- Декомпрессия орбиты. Направлена на увеличение объема глазницы и показана при прогрессирующей нейропатии зрительного нерва, выраженном экзофтальме, изъязвлениях роговицы, подвывихе глазного яблока и др. ситуациях. Декомпрессия орбиты (орбитотомия) достигается путем резекции одной или нескольких ее стенок, удаления ретробульбарной клетчатки.
- Операции на глазодвигательных мышцах. Показаны при развитии стойкой болезненной диплопии, паралитического косоглазия, если его не удается скорригировать призматическими очками.
- Операции на веках. Представляют большую группу разнообразных пластических и функциональных вмешательств, выбор которых диктуется развившимся нарушением (ретракцией, спастическим заворотом, лагофтальмом, пролапсом слезной железы, грыжей с выпадением орбитальной клетчатки и пр.).
Прогноз
В 1-2 % случаев наблюдается особо тяжелое течение эндокринной офтальмопатии, приводящее к тяжелым зрительным осложнениям или остаточным явлениям. Своевременное медицинское вмешательство позволяет добиться индуцированной ремиссии и избежать тяжелых последствий заболевания. Результатом терапии у 30% больных служит клиническое улучшение, у 60% - стабилизация течения эндокринной офтальмопатии, у 10% - дальнейшее прогрессирование заболевания.
Тиреотоксикоз (гипертиреоз) - симптомы и лечение
Что такое тиреотоксикоз (гипертиреоз)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Курашова О. Н., эндокринолога со стажем в 28 лет.
Над статьей доктора Курашова О. Н. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
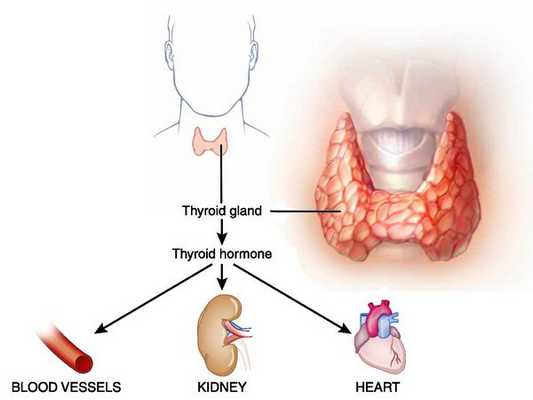
Тиреотоксикоз (гипертиреоз) — гиперметаболический процесс, вызванный избытком тиреоидных гормонов в организме и их токсическим воздействием на различные органы и ткани. Клинически характеризуется увеличением щитовидной железы и поражением других систем и органов. [3] [5] [11]
Первые описания этой патологии были найдены в работах персидского врача Джурджани, созданных в 1100 году. [5] [11]
Данный синдром встречается как у женщин (до 2%), так и у мужчин (до 0,2%). Чаще он возникает у людей в возрасте 20-45 лет.
Причины тиреотоксикоза
Причин возникновения тиреотоксикоза множество. К основным относятся:
- повышение продукции гормонов щитовидной железой вследствие различных заболеваний (диффузно-токсический, узловой зоб и другие);
- избыточный приём препаратов, содержащих гормоны щитовидной железы (нарушение назначенной схемы лечения гипертиреоза).
Факторы риска
Провоцирующим фактором синдрома является дополнительное количество йода, поступающее в организм при самостоятельном использовании йодных добавок.
Состояние тиреотоксикоза при диффузно-токсическом зобе является аутоиммунным заболеванием. Обычно оно развивается в результате избыточной выработки антител к рецептору тиреотропного гормона (ТТГ), производимого гипофизом.
Возникновение тиреотоксического состояния возможно при возникновении функциональной автономии уже существующего узла щитовидной железы — одно- и многоузлового зоба. Это заболевание развивается достаточно долго, в основном у людей, старше 45 лет. Так, в отсутствие воздействия ТТГ — основного физиологического стимулятора [7] [8] — узлы синтезируют количество тиреогормонов, превышающее потребность организма. [5] [6] [11]
Тиреотоксикоз при беременности
Во время беременности потребность организма женщины в тиреоидных гормонах возрастает на 30-50 %, поэтому изменение работы щитовидной железы происходит уже с первых недель беременности. Вследствие этого у 2 % беременных развивается гестационный гипертиреоз. Беременным рекомендуется вовремя обратиться к лечащему врачу, провести диагностику и подобрать необходимое индивидуальное лечение.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы тиреотоксикоза (гипертиреоза)
При опросе пациентов с подозрением на повышенную функцию щитовидной железы выявляются:
- непредсказуемая возбудимость, эмоциональная неустойчивость, беспричинная плаксивость;
- беспокойство и нарушение концентрации внимания, возникающее при нахождении в обществе;
- ежедневное нарушение сна;
- суетливость при выполнении любой работы;
- слабость во время ходьбы;
- повышенная потливость диффузного характера, не зависящая от физического или эмоционального напряжения, ощущение «жара»;
- периодические сердцебиения;
- дрожь в теле и нарастающая потеря веса (наблюдаются редко).
Эмоциональные расстройства сочетаются с двигательно-волевыми: появляется необходимость в постоянном движении и хореоподобные подёргивания. Причём тремор конечностей и тела - типичный симптом тиреотоксикоза. [2] [3] [5] [11]
Папиллярный рак щитовидной железы
Папиллярный рак щитовидной железы - самая распространенная разновидность карциномы щитовидной железы. Характеризуется относительно благоприятным течением. Первым проявлением обычно становится безболезненный узел в области поражения. При прогрессировании процесса возможны затруднения глотания и дыхания, першение и боли в горле, увеличение шейных лимфоузлов. При постановке диагноза используют данные радиоизотопного сканирования, УЗИ щитовидной железы, биопсии и других исследований. Лечение - полная или частичная тиреоидэктомия, послеоперационная терапия с использованием радиоактивного йода, заместительная гормонотерапия.

Папиллярный рак щитовидной железы - самый распространенный и наиболее благоприятно протекающий тип онкологического поражения щитовидной железы. Отличается медленным ростом и низкой склонностью к метастазированию (за исключением метастазов в регионарные лимфоузлы, которые, по различным данным, обнаруживаются у 30-60% больных). Составляет около 75% от общего количества карцином щитовидной железы. Может возникать в любом возрасте, в том числе, в раннем детском. Чаще всего диагностируется у пациентов 30-50 лет. Мужчины страдают в 2,5 раза реже женщин.
Папиллярный рак щитовидной железы считается прогностически относительно благоприятным онкологическим заболеванием, средняя продолжительность жизни после проведения хирургического вмешательства составляет 10-15 и более лет. У детей отмечается более агрессивное течение по сравнению с взрослыми, нередко выявляются метастазы не только в лимфоузлы, но и в отдаленные органы. Лечение проводят специалисты в области онкологии и эндокринологии.
Причины возникновения папиллярного рака щитовидной железы точно не выяснены. Установлено, что в подавляющем большинстве случаев развитие опухоли вызывается соматическими мутациями. В отдельных случаях выявляются врожденные генетические аномалии. Наиболее распространенными генными модификациями при папиллярном раке щитовидной железы являются мутации генов BRAF и RET/PTC. Мутация RET/PTC обнаруживается у 20%, мутация BRAF - у 40-70% пациентов. В настоящее время проводятся исследования по выявлению и изучению других измененных генов, провоцирующих образование папиллярной аденокарциномы щитовидки.
В числе факторов, повышающих риск развития рака, специалисты указывают доброкачественные опухоли щитовидной железы (пролиферирующую цистаденому, аденому, зоб), дефицит йода в организме, проживание в районах с неблагоприятной экологической обстановкой, предшествующую лучевую терапию по поводу других онкологических заболеваний, гормональные нарушения, женский пол и наследственную предрасположенность.
Патологическая анатомия
Злокачественное новообразование обычно одиночное, в отдельных случаях выявляются множественные узлы. Опухоль имеет смешанное папиллярно-фолликулярное строение, ее диаметр колеблется от нескольких миллиметров до 5 и более сантиметров. Капсула обычно отсутствует. При гистологическом исследовании папиллярного рака щитовидной железы выявляется структура, напоминающая ветвящиеся стебли. Основа стеблей представлена васкуляризированной соединительной тканью. Стебли выстланы цилиндрическим и кубическим эпителием с крупными ядрами. Отмечается незначительное количество митозов.
В некоторых стеблях сосуды отсутствуют, эпителиальные клетки имеют признаки атрофии. В центральной части папиллярного рака щитовидной железы могут обнаруживаться рубцы и участки кальцификации. Метастазирование осуществляется преимущественно лимфогенным путем. Клетки неоплазии могут распространяться по лимфатическим сосудам как внутри щитовидной железы, так и за ее пределами, поражая регионарные лимфоузлы. Отдаленные метастазы при папиллярном раке щитовидной железы выявляются редко, их основой обычно становится фолликулярная часть опухоли. Паппиллярные элементы новообразования не выделяют гормонов, фолликулярные могут проявлять гормональную активность.
В клинической практике используют традиционную четырехстадийную классификацию:
- I стадия - определяется локальная опухоль, не вызывающая внешней деформации органа и не распространяющаяся на капсулу щитовидной железы. Метастазы отсутствуют.
- IIа стадия - папиллярный рак щитовидной железы вызывает внешнюю деформацию органа, но не распространяется за его пределы. Метастазы отсутствуют.
- IIб стадия - выявляется одиночный узел в сочетании с лимфогенными метастазами на стороне поражения.
- III стадия - папиллярный рак щитовидной железы прорастает капсулу либо сдавливает близлежащие органы (гортань, пищевод), определяются двухсторонние метастазы в регионарных лимфоузлах.
- IV стадия - новообразование прорастает соседние органы, обнаруживаются лимфогенные и гематогенные метастазы.
Симптомы папиллярного рака щитовидной железы
Новообразование достаточно долго может протекать бессимптомно. Поводом для первого обращения к врачу нередко становится случайно обнаруженный узел в области щитовидной железы. Папиллярный рак достаточно часто образуется на фоне доброкачественных неоплазий, поэтому начальные стадии заболевания могут пройти для больного незамеченными. Иногда подозрение на развитие злокачественной неоплазии возникает при проведении очередного осмотра, когда эндокринолог обнаруживает быстрое изменение размера и структуры доброкачественной опухоли.
Обычно папиллярный рак щитовидной железы выявляется в нижней части одной из долей, реже пальпируется в области перешейка с распространением на обе доли. Неоплазии размером менее 1 см могут не прощупываться. На начальных стадиях опухоль подвижная, плотная, с гладкой или немного неровной поверхностью. При прогрессировании процесса узел увеличивается в размере, становится бугристым, распространяется на значительную часть щитовидки и теряет подвижность. При сдавлении органов, расположенных за щитовидной железой, возникают затруднения глотания, одышка, першение в горле и изменения голоса.
При дальнейшем распространении папиллярного рака щитовидной железы возникает увеличение лимфоузлов на стороне поражения. Иногда увеличенные лимфоузлы становятся первым симптомом болезни. Как правило, регионарные метастазы долгое время остаются покрытыми капсулой, поэтому сохраняют подвижность. В результате местного агрессивного роста в процесс вовлекаются мягкие ткани шеи. Возникает внешняя деформация, отмечается расширение подкожных вен. На поздних стадиях у некоторых пациентов выявляется отдаленное метастазирование в кости и легкие.
Диагноз устанавливают с учетом жалоб, данных осмотра, лабораторных и инструментальных исследований. Поводом для направления больных на обследование служит появление бугристого узла в области щитовидной железы или быстрое увеличение уже существующей доброкачественной опухоли. Пациентам с подозрением на папиллярный рак назначают УЗИ щитовидной железы и радиоизотопное сканирование с использованием радиоактивного йода. Обе методики дают возможность подтвердить наличие опухолевидного образования и оценить его распространенность, но не позволяют определить степень злокачественности.
Окончательный диагноз папиллярный рак щитовидной железы выставляется на основании тонкоигольной биопсии с последующим определением морфологической структуры полученного образца ткани. Биопсию проводят под контролем УЗИ. В отдельных случаях при отсутствии выраженной клинической симптоматики и отрицательном результате цитологического исследования забор материала выполняют во время хирургического вмешательства. Ткань отправляют на срочное гистологическое исследование, по результатам исследования определяют объем операции.
Анализ крови на гормоны в подавляющем большинстве случаев неинформативен, поскольку гормональную активность проявляют всего около 1% папиллярных раков щитовидной железы. Для оценки распространенности первичной опухоли выполняют ларингоскопию. Паралич голосовой связки на стороне поражения является признаком прорастания возвратного нерва. При проведении бронхоскопии оценивают выраженность сужения трахеи. По показаниям проводят контрастную рентгенографию пищевода. При подозрении на отдаленное метастазирование больных направляют на сцинтиграфию костей скелета, рентгенографию и КТ органов грудной клетки.
Лечение и прогноз при папиллярном раке щитовидной железы
Лечение хирургическое. В зависимости от распространенности онкологического процесса выполняют полную или частичную тиреоидэктомию в сочетании с одно- или двухсторонней лимфаденэктомией. В послеоперационном периоде пациентам с папиллярным раком щитовидной железы назначают терапию с использованием радиоактивного йода. Данная методика позволяет уменьшать вероятность развития местных рецидивов, в ряде случаев устранять метастазы в легких и существенно замедлять рост вторичных очагов в костной ткани. На поздних стадиях папиллярного рака щитовидной железы иногда применяют лучевую терапию. При выраженном сдавлении трахеи осуществляют трахеостомию. Больным, перенесшим тотальную тиреоидэктомию, до конца жизни требуется заместительная гормонотерапия тироксином.
Прогноз при папиллярном раке щитовидной железы достаточно благоприятный. При отсутствии отдаленных метастазов до 5 лет с момента постановки диагноза удается дожить 97% больных, до 10-88% больных, до 15-75% больных. При метастазировании в кости и легкие прогноз ухудшается, однако у многих пациентов удается добиться продолжительной ремиссии. Летальный исход в возрасте до 50 лет наблюдается редко. Смерть обычно наступает при рецидивировании первичной опухоли. Больным, перенесшим папиллярный рак щитовидной железы, необходимо проходить регулярные осмотры эндокринолога, УЗИ и анализы крови на гормоны (для определения адекватности заместительной терапии и выявления гормонально активных отдаленных метастазов).
Цитокин-индуцированные тиреопатии
Цитокин-индуцированные тиреопатии - это группа заболеваний щитовидной железы, вызванных применением цитокинов интерфероновой группы для лечения вирусных инфекций и онкопатологий. Проявляются симптомами гипер- и гипотиреоза. При тиреотоксикозе развивается тахикардия, артериальная гипертензия, повышается температура тела, возникает чувство жара, одышка. Гипотиреоз характеризуется замедлением пульса, артериальной гипотензией, возникновением медлительности, вялости, апатии. Диагностика включает определение Т4, Т3, ТТГ и анти-ТПО в крови, УЗИ и сцинтиграфию щитовидной железы. Лечение медикаментозное, нацелено на устранение симптомов гипертиреоза и компенсацию гипотиреоза.
В практической эндокринологии роль цитокинов в патогенезе тиреопатий исследуется с 90-х годов прошлого столетия. Исследователи из Великобритании Ажан Р.А. и Уитман А.П. экспериментально доказали, что эндогенные и экзогенные цитокины усиливают аутоиммунные процессы и активируют воспалительные реакции в щитовидной железе.
Было выявлено, что при терапии интерферонами (вид цитокинов) развиваются деструктивные тиреопатии. Их распространенность в группе пациентов, принимающих альфа-интерферон, составляет 5-10%. Среди аутоиммунных цитокин-инициированных дисфункций ЩЖ в 3,8% случаев возникает стойкий гипотиреоз, в 2,8% - тиреотоксикоз. У женщин цитокин-индуцированные тиреопатии развиваются в 4 раза чаще, чем у мужчин.
Основным этиофактором развития тиреопатии является терапия препаратами α-интерферона. Фармакологический эффект заключается в активации и усилении аутоиммунных процессов, поражающих ткани ЩЖ. Аналогичные изменения наблюдаются при повышении уровня эндогенного интерферона, например, у больных вирусными инфекциями. К дополнительным факторам, увеличивающим риск развития цитокин-индуцированной тиреопатии, относятся:
- Женский пол. Вероятность развития аутоиммунного поражения ЩЖ на фоне лечения интерфероном среди женщин составляет от 3,5 до 5,9%. Среди мужчин данный показатель - 1,0-1,5%.
- Антитела к ЩЖ. Наличие в плазме аутоантител к тканям ЩЖ, особенно к тиреопероксидазе, является провоцирующим фактором тиреопатии. В среднем риск заболевания у лиц с АТ-ТПО - 50%, а если антитела отсутствуют - 5,4%.
- Гепатит С. Вирус гепатита C и интерферон-альфа оказывают синергическое воздействие, стимулируя аутоиммунные патологии ЩЖ. Частицы вируса провоцируют индукцию интерферонов в тканях железы.
Цитокины стимулируют аутоиммунные реакции в ЩЖ у пациентов с базедовой болезнью и тиреоидитом Хашимото, а у людей с интактной железой, провоцируют транзиторное аутоиммунное поражение. Естественным образом они производятся в гранулоцитах, макрофагах и лимфоцитах, а также в фолликулярных клетках железы. Извне поступают во время терапевтического применения интерферона. Поступая к тиреоцитам, цитокины активируют воспалительную реакцию, стимулируя активность Т- и В-лимфоцитов. Это приводит к образованию аутоантител и повреждению тканей.
Установлено, что экзогенное введение цитокинов формирует дисфункцию ЩЖ до начала активной аутоиммунной реакции. Их влияние обнаружено не только при цитокин-индуцированных тиреопатиях, но и при подостром тиреоидите, амиодарон-индуцированных тиреопатиях. При развитии тиреоидной офтальмопатии цитокины запускают пролиферацию фибробластов и усиливают продукцию глюкозаминогликанов.
Симптомы
До 70% тиреопатий, спровоцированных использованием цитокинов, клинически проявляются как деструктивный тиреоидит. Для него характерно двухфазное течение. Сначала развивается фаза транзиторного тиреотоксикоза, которая обусловлена разрушением фолликулярных клеток и выходом тиреоидных гормонов в кровь. Затем наступает фаза гипотиреоза, когда запас гормонов истощен, а достаточное производство новых невозможно.
Тиреотоксикоз проявляется слабостью, усилением потливости, чувством жара в теле, повышением общей температуры, артериальной гипертензией, тахикардией, одышкой, тремором, диареей, снижением веса, быстрой сменой настроения. Пациенты становятся раздражительными, плаксивыми, часто просыпаются по ночам, плохо переносят привычные физические и умственные нагрузки, нахождение на солнце или в душном помещении.
При гипотиреоидной фазе замедляются все виды обмена веществ, угнетается высшая нервная деятельность. Возникает артериальная гипотензия, снижается частота сердечных сокращений. Больные вялы, медлительны, сонливы, часто испытывают зябкость, быстро замерзают. Пониженное артериальное давление сопровождается головокружениями, головными болями, апатией. Кожа сухая и бледная, волосы и ногти - ломкие.
Отеки наиболее выражены на лице и конечностях, характерна одутловатость, прибавка веса, охриплость голоса, медленная и невнятная речь, заторможенность психических процессов (снижение активного внимания и памяти, сообразительности). Иногда клиническая картина тиреопатий не имеет четкого разделения на фазы: тиреотоксикоз протекает практически бессимптомно, а гипотиреоз слабо выражен, либо наоборот.
При тиреопатиях с острым течением тиреотоксической фазы существует риск кризового состояния, сопровождающегося кардиологическими нарушениями. Он проявляется через повышение возбуждения, интенсивную дрожь рук и ног, понос, рвоту, лихорадку, тяжелую артериальную гипертонию, ускорение сердечного ритма. Без медицинской помощи тиреотоксический криз завершается потерей сознания, комой и смертью. Осложнение гипотиреоидного этапа - перманентный гипотиреоз. Иногда транзиторные изменения работы ЩЖ становятся постоянными: после отмены интерфероновых цитокинов не происходит восстановления функций, аутоиммунные нарушения становятся стойкими.
Обследование пациентов проводит врач-эндокринолог по направлению лечащего врача, назначившего интерферон (инфекциониста, гепатолога, онколога). На диагностической консультации специалист выясняет анамнез: дозировку и продолжительность приема цитокинов, наличие аутоиммунного тиреоидита или болезни Базедова. При опросе определяет наличие жалоб, характерных для гипер- или гипотиреоза.
С помощью пальпации оценивает размеры и плотность щитовидной железы (возможно некоторое ее увеличение), состояние кожных покровов, положение глазных яблок, отечность. С целью подтверждения диагноза ЦИТ, его различения с диффузным токсическим зобом проводятся инструментальные и лабораторные диагностические процедуры:
- Исследование уровня гормонов. По уровню йодированных гормонов и изменению их динамики подтверждается диагноз транизиторного заболевания ЩЗ. В гипертиреоидной фазе ЦИТ регистрируется легкое или умеренное повышение Т4 и свободного Т3, в гипотиреоидной - понижение обоих показателей. При тиреоидите Хашимото определяется выраженное и стабильное снижение концентрации гормонов, а при базедовой болезни - стойкое значительное повышение.
- Анализы крови на антитела. Определение уровня антител необходимо для подтверждения наличия аутоиммунного процесса. Наиболее часто диагностируется значительное повышение титра анти-ТПО. Реже выявляется повышенный титр антител к рецептору ТТГ (при диффузном токсическом зобе анти-рТТГ повышены почти всегда).
- Радиосцинтиграфия. При тиреотоксической фазе в ходе сцинтиграфии щитовидной железы выявляется снижение или полное отсутствие накопления радиофармпрепарата. Это отличает ЦИТ от болезни Грейвса, при которой захват йода увеличивается.
- Сонография. По данным УЗИ щитовидной железы характерны нормальные либо незначительно увеличенные размеры железы, пониженная эхогенность. Иногда определяются диффузные изменения. Ультразвуковое исследование позволяет исключить наличие опухолей и иных новообразований, но не информативно при дифференциации аутоиммунных тиреопатий.
Лечение цитокин-индуцированных тиреопатий
Тактика терапии определяется лечащим врачом и эндокринологом совместно. Для устранения транзиторной тиреопатии достаточно поддерживающего лечения и отмены препарата, спровоцировавшего аутоиммунную реакцию. Но прекращение приема интерферона не всегда целесообразно. Так, стойкий гипотиреоз является менее опасным состоянием, чем тяжелое течение вирусного гепатита и его последствия. Стандартная схема лечения включает три этапа, согласно фазам тиреопатии:
- Тиреотоксикоз. На стадии деструкции фолликулов применение тиреостатических препаратов противопоказано, так как отсутствует усиление продукции гормонов. Для улучшения самочувствия больных используются бета-адреноблокаторы, НПВС, кортикостероиды. Тиреотоксические явления носят временный характер, купируются самостоятельно спустя 1-2 месяца.
- Транзиторный гипотиреоз. Для восстановления нормального уровня йодсодержащих гормонов используются препараты тироксина (например, L-тироксин). При условии отмены интерферона функции ЩЖ восстанавливаются примерно через год после начала гипотиреоидной стадии. К этому времени производятся попытки отмены тироксина при периодическом измерении количества гормонов.
- Аутоиммунный гипотиреоз/болезнь Грейвса. В случаях, когда прекращение лечения препаратами интерферона невозможно, развиваются стойкие аутоиммунные заболевания. При аутоиммунном тиреоидите назначается пожизненная гормонозаместительная терапия. Пациентам с болезнью Грейвса показан прием тиреостатиков.
Прогноз и профилактика
Цитокин-индуцированные тиреопатии поддаются медикаментозной коррекции, при правильном подходе к лечению не приводят к ухудшению качества жизни. Единственно возможный путь профилактики данной группы заболеваний - отказ от лечения интерферонами. Но при тяжелых вирусных инфекциях, например, при гепатите C, эффект от терапии выше, чем риски и последствия тиреопатии. Больным с нарушениями в работе щитовидной железы рекомендовано начинать курс противовирусной терапии после достижения компенсации тиреоидной патологии. В процессе приема интерферонов необходимо периодически контролировать уровень ТТГ, Т4, АТ к ТПО.
1. Цитокин-индуцированные тиреопатии/ Моргунова Т.Б., Решетник Н.А., Фадеев В.В.// Клиническая и экспериментальная тиреоидология. - 2010 - Т.7, №1.
Эндокринная офтальмопатия

Следствием этого является ряд офтальмологических симптомов, среди которых сильнее всего выделяется пучеглазие — яркий симптом Базедовой болезни (болезнь Грейвса, диффузный токсический зоб).
Эндокринная офтальмопатия считается осложнением Базедовой болезни. По статистике, это состояние диагностируется у 25% пациентов с диффузным токсическим зобом. В 6% случаев наблюдается её тяжелая форма. У 0,3% пациентов эндокринная офтальмопатия сопровождается серьёзным риском потери зрения из-за поражения зрительного нерва.
У 20% пациентов пучеглазие и другие признаки офтальмопатии являются первыми симптомами Базедовой болезни. В 85% случаев между началом диффузного токсического зоба и возникновением офтальмопатии проходит не более 18 месяцев. Поражение ретробульбарной клетчатки и глазодвигательных мышц носит двухсторонний характер, с небольшим различием в выраженности симптомов. Только в 15% случаев офтальмопатия затрагивает один глаз. Чаще всего это осложнение диагностируется у женщин. Однако у мужчин симптомы офтальмопатии, как правило, более выражены и чаще приводят к тяжёлым последствиям.
Классификация эндокринной офтальмопатии
В зависимости от степени вовлечения мягких тканей глазницы в процесс различают следующие классы патологии:
- 0 класс — симптомы офтальмопатии отсутствуют;
- 1 класс — начальные признаки офтальмопатии: ретракция верхнего века, его отставание при закрытии глаза. Эти изменения делают взгляд больного удивлённым, пристальным или злобным;
- 2 класс — изменения мягких тканей глаза: отёк конъюнктивы, век, инъекция слизистой конъюнктивальной полости, склеры;
- 3 класс — визуально определяется проптоз глаза (пучеглазие);
- 4 класс — признаки вовлечения глазодвигательных мышц: двоение в глазах;
- 5 класс — патологические изменения роговицы (кератопатия, язва роговицы) глаза из-за лагофтальма (невозможность сомкнуть веки полностью из-за выпячивания глазного яблока);
- 6 класс — резкое снижение остроты зрения из-за вовлечения в патологический процесс зрительного нерва.
Клиническая классификация использует шкалу Европейской группы по изучению офтальмопатии Грейвса, позволяющую оценить степень активности патологии:
- спонтанная ретробульбарная боль;
- боль при взгляде верх или вниз;
- покраснение век;
- инъекция конъюнктивы;
- отек век;
- хемоз;
- воспаление карункулы.
Каждый пункт равен 1 баллу. При наличии 3 и более баллов ЭОП считается достаточно активной. Потеря зрения — самое тяжёлое осложнение, к которому может приводить эндокринная офтальмопатия, симптомы, возникающие при этом (прогрессирующее снижение зрения и/или повреждение роговицы глаза) является признаком тяжёлого течения патологии и требуют экстренного лечения. В противном случае возможны необратимые изменения в зрительном нерве и сетчатке, приводящие к слепоте.
Эндокринная офтальмопатия поддаётся лечению у большинства пациентов. Реальная угроза потери зрения при адекватной терапии возникает только у 0,3% больных. При своевременной диагностике и грамотном лечении прогноз благоприятный. Проблемы возникают у пациентов, обратившихся поздно, или лечившихся у офтальмологов (проявления ЭОП часто принимают за различные офтальмологические заболевания — конъюнктивиты, блефариты, инородные тела и т.п.). По этой причине требуется специализированная терапия в профильном лечебно-профилактическом учреждении всем больным с диагнозом эндокринная офтальмопатия.
Узнайте, в каких клиниках проводят лечение эндокринной офтальмопатии в Москве, на нашем сайте.
Причины эндокринной офтальмопатии
Причина эндокринной офтальмопатии связанна с основным заболеванием — диффузным токсическим зобом или болезнью Грейвса-Базедова-Флаяни. Это аутоиммунное воспаление щитовидной железы, протекающее с диффузным увеличением её объема и массы (зоб), возникающее в результате действия аутоантител к рецептору тиреотропного гормона.
Тиреотропный гормон или ТТГ — гормон гипофиза, стимулирующий секрецию трийодтиронина (Т3) и тироксина (Т4) щитовидной железой. В норме увеличение его уровней способствует росту концентрации тиреоидных гормонов в периферической крови и тканях. Снижение уровня ТТГ приводит к понижению секреции гормонов щитовидки. Таким образом осуществляет регуляция эндокринной функции железы.
Особенность диффузного токсического зоба в нарушении этого механизма из-за аутоиммунного процесса. По непонятным до конца причинам иммунная система начинает интенсивно продуцировать антитела к тканям щитовидной железы. Группа таких аутоантител специфична против рецепторов к тиреотропному гормону, имеющихся на поверхности мембраны фолликулярных клеток щитовидки (анти-рТТГ). Эти антитела присоединяются к рецептору, и из-за похожей структуры начинают оказывать стимулирующее воздействие на ткани щитовидной железы. В результате резко увеличивается секреция тиреоидных гормонов, что приводит к вторичному гипертиреозу (тиреотоксикозу).
Клетки соединительной и жировой ткани глазницы также имеют рецепторы к тиреоидному гормону, из-за чего они могут быть целью повреждающего действия аутоантител при Базедовой болезни. В результате возникает отёк глазодвигательных мышц и ретробульбарной клетчатки, давление в глазнице возрастает, из-за чего глаз фактически выдавливается наружу, подобно пробке в бутылке шампанского. Отёк также нарушает венозный отток, из-за чего страдает и сам глаз. По такому механизму возникает эндокринная офтальмопатия, лечение этой патологии может представлять трудности и требует обязательной терапии основного заболевания.
Симптомы эндокринной офтальмопатии
Разными учёными описано более 30 признаков и симптомов ЭОП. В основном причиной их возникновения считают отёк и воспаление мягких тканей орбиты. Клинически наиболее значимые симптомы:
- выпячивание глазного яблока (пучеглазие) — проптоз;
- появление полоски склеры между краем радужки и веком сверху — признак Кохера;
- расширение глазной щели из-за спазма век, придающее взгляду удивлённый вид — признак Дальримпля;
- дрожание закрытых век — признак Розенбаха;
- редкое или моргание — признак Штельвага;
- отставание или неподвижность верхнего века при взгляде вниз — признак Грефе;
- невозможность полностью сомкнуть веки — лагофтальм;
- отёк век — признак Энрота.
Неспецифические симптомы ЭОП включают в себя:
- распирающие боли за глазами, усиливающиеся при движении глазного яблока;
- чувство «песка» или инородного тела в глазах;
- слезотечение;
- фотофобия;
- пелена перед глазами, двоение;
- покраснение склеры глаза, конъюнктивы, сосудистая инъекция.
Неспецифические симптомы могут возникать из-за лагофтальма — неполное смыкание век приводит к раздражению роговицы, лишённой защиты от пересыхания и попадания инородных тел. В тяжёлых случаях следствием этого является кератопатия, кератит или язва роговицы. Лагофтальм увеличивает риск инфицирования конъюнктивы и склеры.
Нарушение венозного оттока может приводить к увеличению внутриглазного давления, из-за чего больные жалуются на боли в глазах, головные боли. По этой же причине возникают застойные явления в сетчатке, отёк зрительного нерва, ретинопатия. Ущемление или сдавливание зрительного нерва приводит к снижению зрения, сужению полей зрения, исчезновению роговичного рефлекса и потере цветового зрения. Эти признаки свидетельствуют о тяжёлой ЭОП. Степень проптоза варьирует. Его выраженность можно измерить в миллиметрах с помощью специального прибора — экзофтальмометра. При значительном экзофтальме возможен подвывих глазного яблока, приводящем к повреждению зрительного нерва.
Двоение в глазах является признаком миопатии глазодвигательных мышц. Из-за их воспаления могут быть ограничены движения глазного яблока. В начале заболевания эти симптомы могут возникать периодически, однако с течением времени приобретают хронический характер.
Особенность ЭОП — связь с табакокурением. У курящих пациентов симптомы и тяжесть патологии намного более выражены, по сравнению с некурящими. Риск возникновения глазных осложнений тиреотоксикоза у таких больных выше в 5 раз. Отказ от курения является обязательным требованием перед началом лечения, так как облегчает терапию и улучшает прогноз.
Диагностика эндокринной офтальмопатии
Диагностика ЭОП основывается на характерных признаках заболевания, которыми сопровождается эндокринная офтальмопатия. Симптомы, характерные для неё, хорошо известны любому врачу-эндокринологу. Но в некоторых случаях проптоз является признаком других патологий глазницы — опухолей, воспаления ретробульбарной клетчатки из-за инфекции, кровоизлияния, переломов глазницы, объёмных образований и т.д. По этой причине диагностика обязательно дополняется лабораторными и инструментальными исследованиями.
Лабораторная диагностика ЭОП
Лабораторная диагностика ЭОП проводится для оценки тиреоидного статуса пациента (гипертиреоз, гипотиреоз, эутиреоз), определения уровней тиреотропного гормона. Высокий уровень тиреоидных гормонов или тиреотоксикоз, низкий уровень ТТГ подтверждает эндокринную природу патологии. Затем проводится анализ крови на аутоантитела к рецепторам ТТГ, тиреоглобулину и тиреопероксидазе. При положительном результате диагноз диффузного токсического зоба, а также эндокринной офтальмопатии, более чем вероятен.
Инструментальная диагностика ЭОП
Инструментальные исследования — УЗИ, МСКТ и МРТ проводят для исключения объёмных образований глазницы. При этом выявляются признаки диффузного отёка ретробульбарной клетчатки, изолированный или диффузный отёк глазодвигательных мышц, диагностируется компрессия зрительного нерва. Такие изменения могут определяться и у пациентов без явных признаков патологии.
Лечение эндокринной офтальмопатии
Тактика лечения ЭОП зависит от тяжести состояния. При наличии угрозы потери зрения, ведётся агрессивная терапии, вплоть до хирургического вмешательства.
Лечение тяжёлой эндокринной офтальмопатии
Основой консервативной терапии тяжёлых форм ЭОП является системное назначение высоких доз глюкокортикостероидов (пульс-терапия) — преднизолона, метилпреднизолона. Предпочтительный метод введения препаратов — внутривенный (меньше осложнений, по сравнению с таблетированными средствами). Ретробульбарное введение ГКС не рекомендуется. Улучшение состояния наблюдается через 1-2 недели. При назначении глюкокортикостероидов необходимо учитывать вероятность рецидива после отмены препаратов (синдром отмены).
Существует много схем назначения глюкокортикостероидов при ЭОП. Доза препаратов варьирует от 60-80 мг в день, на протяжении нескольких месяцев, до 500 мг в неделю, на протяжении 6 недель, с последующим переходом на поддерживающую дозу или постепенную отмену. При отсутствии эффекта от системной гормональной терапии проводится хирургическая декомпрессия орбиты (удаляется часть костей глазницы).
Применение лучевой терапии на область орбиты имеет противоречивые сведения об эффективности у пациентов с диагнозом эндокринная офтальмопатия, лечение таким образом может привести к плохим результатам в долгосрочной перспективе. Суммарная доза облучения не должна превышать 20 грей. В целом, метод не считается приемлемой альтернативой глюкокортикостероидам.
Кератопатия или язва роговицы, возникающие как следствие неполного смыкания век, часто являются осложнением тяжёлой ЭОП. В таких случаях назначается местное лечение с помощью ежечасного нанесения антибактериальных, увлажняющих и заживляющих средств. Цель лечения — добиться полного закрытия глазной щели. В таких случаях декомпрессия орбиты является альтернативным способом предотвратить дальнейшее повреждение роговицы (с возможной перфорацией и потерей зрения).
При отсутствии эффекта от назначения ГКС возможно начало иммуносупрессивной терапии, подавляющей аутоиммунный процесс. Для лечения применяются циклоспорин, азатиоприн. Эффективность иммуносупрессивной терапии не доказана и многими учёнными считается терапией отчаяния — когда все возможные методы не дали эффекта.
Удаление щитовидной железы в сочетании с гормональной терапией или без у некоторых пациентов по эффективности сравнимо с назначением кортикостероидов. Однако однозначных рекомендаций и показаний к этому виду лечения нет.
Похожая тактика применяется и при ЭОП средней степени тяжести. В целом, даже такие экстремальные методы, как хирургическая декомпрессия, считаются достаточно безопасными. Лечение даёт положительный эффект у более чем 80% пациентов с тяжёлой офтальмопатией.
Лечение лёгкой ЭОП
У части больных офтальмопатия протекает в лёгкой форме. В таких случаях показанием к лечению с помощью глюкокортикостероидов является желание пациента улучшить свое качество жизни. В целом, для этой группы больных приём кортикостероидов не показан, так как риск их назначения превышает возможный положительный эффект. Вместо этого назначаются местные противовоспалительные препараты и средства, увлажняющие слизистую глаза.
Данная статья размещена исключительно с целью ознакомления в познавательных целях и не является научным материалом или профессиональным медицинским советом. За диагностикой и лечением обратитесь к врачу.
Введите ваши данные, и наши специалисты свяжутся с Вами, и бесплатно проконсультируют по волнующим вас вопросам.
Читайте также:
- Диагностика кисты кармана Ратке по КТ, МРТ
- Исход туберкулом легкого. Обострение туберкулом легких.
- Трансплантация печени у детей: показания, прогноз
- Волосковые клетки лабиринта. Перепончатые полукружные каналы лабиринта
- Показания для медиального оперативного доступа к локтевому суставу (хирургический доступ)
