Тканевые ответы на действие лекарств. Лекарства агонисты рецепторов
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Все лекарственные средства по механизму действия можно разделить на 3 группы:
1. Лекарства, в основе действия которых лежат физические взаимодействия вне клеток;
2. Лекарства, механизм действия которых обусловлен химическими взаимодействиями вне клеток;
3. Лекарства, действующие на клеточные структуры.
К препаратам первой группы относятся многие лекарственные средства для местного применения, оказывающие обволакивающее, вяжущее, адсорбирующее действие, некоторые слабительные (сульфат магния).
Лекарственные средства второй группы вступают в химическое взаимодействие вне клеток с различными медиаторами, ферментами, гормонами, вызывая их инактивацию или повышение активности (например, цитрат натрия, связывающий кальций, протаминсульфат, инактивирующий действие гепарина). Препаратов такого типа действия сравнительно немного, большая же часть лекарств по механизму действия относится к третьей группе.
Некоторые лекарственные средства третьей группы проявляют свое действие на уровне клеточной мембраны; они взаимодействуя с соответствующими рецепторами, приводят к изменению функционального состояния клеток. Другая часть лекарств третьей группы взаимодействует с мишенями, локализованными во внутриклеточном пространстве.
Мишени для действия лекарств - это биологические субстраты с которыми они взаимодействуют, вызывая при этом фармакологический эффект. В качестве мишеней для лекарственных средств выступают рецепторы, ионные каналы, ферменты, транспортные системы, гены.
Рецепторы - это активные группировки макромолекул субстратов, с которыми взаимодействуют различные эндогенные вещества (медиаторы, гормоны) и экзогенные вещества (например, лекарства). Специфические рецепторы - это активные группировки макромолекул с идентифицированным эндогенным лигандом, которые обеспечивают проявление действия лекарственных веществ.
Существуют 4 типа рецепторов:
Рецепторы, ассоциированные с G-белками.
Рецепторы, связанные с ионными каналами.
Рецепторы, связанные с ферментами.
4. Рецепторы, связанные с ДНК (регуляторы транскипции).
Кроме указанных выше, существуют и так называемые неспецифические рецепторы (белки плазмы крови, мукополисахариды соединительной ткани, жировая ткань), связывание с которыми лекарственных веществ не вызывает каких-либо эффектов. Эти биологические субстраты правильнее называть местами неспецифического связывания.
Способность вещества связываться со специфическим рецептором называется аффинитетом (сродством). Способность вещества, связываясь с рецептором, стимулировать его и вызывать тот или иной эффект называется внутренней активностью.
Взаимодействие лекарств и специфических рецепторов называется первичной фармакологической реакцией. Это взаимодействие зависит от степени их пространственного взаимоотношения (комплементарности). Обычно лекарства устанавливают с рецепторами обратимые связи (ионные, ван-дер-ваальсовы, водородные, дипольные), значительно реже - необратимые (ковалентные). Вещества, образующие с рецепторами необратимые связи (цитостатики, необратимые ингибиторы холинэстеразы и др.) обладают высокой токсичностью.
Первичная фармакологическая реакция необходима для развития вторичной фармакологической реакции в виде изменений метаболизма и функции клеток и органов.
В целом фармакологическая реакция - это трансформация молекулярного сигнала в биохимическую, а затем в физиологическую реакцию. Этапами фармакологической реакции являются: выход сигнала→ передача, усиление, изменение сигнала→получение сигнала→развитие физиологического ответа.
Механизм фармакологической реакции, опосредованной через рецепторы, связанные с G-белками: связывание внеклеточного специфического лиганда с рецептором ведет к активации рецептором G-белка, расположенного на внутренней поверхности цитоплазматической мембраны→передача G-белком информации с регуляторного домена для связывания лигандов на эффекторную систему с использованием энергии ГТФ (G-белки связывают и гидролизуют ГТФ до ГДФ, что позволяет усилить передаваемый сигнал). Эффекторная система представлена аденилатциклазой, фосфолипазами, белками ионных каналов и транспортными белками. Эффекторный элемент, в свою очередь, изменяет концентрацию внутриклеточного вторичного мессенджера (посредника). В частности, аденилатциклаза превращает АТФ во вторичный посредник цАМФ (причем рецепторы могут как активировать, так и угнетать аденилатциклазу и синтез внутриклеточного цАМФ). Циклическая АМФ реализует большинство своих эффектов путем активации протеинкиназ, которые осуществляют фосфорилирование белковых субстратов. Изменение активности белковых субстратов сопровождается физиологическим ответом. Прекращение сигнала, обусловленное гидролизом ГТФ до ГДФ в составе активного комплекса с G-белком, ведет к завершению внутриклеточных эффектов цАМФ путем выработки серии ферментов.
Другая система вторичных переносчиков связана со стимуляцией гидролиза фосфоинозитидов мембранным ферментом фофолипазой С. После стимуляции рецептора, связанного с G-белком, изменяется конформация G-белка, с использованием энергии ГТФ информация передается на фосфолипазу С, что сопровождается ее активацией. Стимулированная фосфолипаза С катализирует гидролиз фосфоинозитидов с образованием инозитол-1,4,5-трифосфата и диацилглицерола. Инозитол-1,4,5-трифосфат стимулирует выход кальция из эндоплазматического ретикулума, который образует активный комплекс с кальмодулином, изменяющий активность белковых субстратов. Диацилглицерол активирует мембранную протеинкиназу С, усиливающую фосфорилирование белковых субстратов. Итогом изменения активности белковых субстратов является физиологический эффект.
Рецепторы, связанные с ионными каналами передают сигнал через цитоплазматическую мембрану путем увеличения трансмембранной проводимости токов ионов натрия, кальция, калия и хлора, что ведет к изменению электрического потенциала мембраны. В фармакологической реакции, опосредованной через указанные рецепторы, отсутствует этап трансдукции сигнала, а эффектором являются ионные каналы. Естественными лигандами рецепторов этого типа являются ацетилхолин, γ-аминомасляная кислота, возбуждающие аминокислоты и др.
Рецепторы, связанные с ферментами опосредуют передачу сигналов инсулина, предсердного натрийуретического фактора, эпидермального и тромбоцитарного факторов роста и др. Они состоят из внеклеточного домена, связывающего лиганды и внутриклеточного домена с ферментативной активностью - протеинкиназы или гуанилатциклазы. Оба домена соединены гидрофобным сегментом, пересекающим липидный бислой плазматической мембраны. После связывания лиганда с внеклеточным доменом рецептора происходит переход рецептора из неактивного мономерного состояния в активное димерное состояние. Внутриклеточные домены фосфорилируются, что повышает их ферментативную активность, в дальнейшем происходит фосфорилирование субстратных белков, изменение их активности и развитие физиологического ответа. В данной фармакологической реакции отсутствует трансдуктор, роль эффектора выполняют протеинкиназы и гуанилатциклаза.
Рецепторы, связанные с ДНК взаимодействуют со стероидными, тиреоидными гормонами, витамином Д, ретиноидами. Указанные лиганды, являясь жирорастворимыми, проникают через цитоплазматическую мембрану, затем поступают в ядро, где взаимодействуют с рецепторами, регулирующими транкрипцию генов. Трансдуктором сигнала является ДНК, эффектором - рибосомально-матричный комплекс.
Вещества, связывающиеся с рецепторами и вызывающие биологический эффект, называются агонистами (миметиками). Полный агонист, взаимодействуя с рецептором, приводит к развитию максимального эффекта, частичный (неполный, парциальный) агонист - к возникновению менее значительной клеточной реакции.
Неспособность неполных агонистов вызывать максимальный эффект не связана со снижением их аффинитета к рецепторам. Напротив, парциальные агонисты способны занять весь пул соответствующих рецепторов и по конкурентному механизму угнетать реакции, вызванные полными агонистами (рис 1). Точный молекулярный механизм, объясняющий неполный максимальный ответ на неполные агонисты, в настоящее время неизвестен. Можно сказать, что неполные агонисты - это вещества с низкой эффективностью, которые даже при полной оккупации всех соответствующих рецепторов не вызывают максимального эффекта, который характерен для полных агонистов.
Рис. 1 Кривые зависимости эффекта агониста от концентрации
А - эффект полного агониста;
В - эффект парциального агониста;
С - эффект комбинации полного и парциального агонистов
Вещества, связывающиеся с рецепторами, но не стимулирующие их, называются антагонистами (блокаторами). Антагонисты предупреждают связывание агонистов (других лекарственных средств или эндогенных регуляторных молекул) с рецепторами и их активацию. Наиболее изучены антагонисты, взаимодействующие с рецепторами вегетативной нервной системы.
Агонисты-антагонисты возбуждают одни рецепторы и угнетают другие.
Конкурентные антагонисты занимают те же участки рецепторов, с которыми взаимодействуют агонисты. Конкурентные антагонисты блокируют рецепторы обратимо. Блокада рецептора конкурентным антагонистом может быть устранена большими дозами агониста.
Неконкурентные антагонисты и агонисты занимают различные участки одних и тех же рецепторов, которые, однако, взаимосвязаны друг с другом. Неконкурентные антагонисты блокируют рецепторы необратимо или почти необратимо. При оккупации ими значительного числа рецепторов даже высокие дозы агониста не смогут вызвать максимального фармакологического эффекта (рис 2).
Рис. 2 Кривые зависимости эффекта агониста от концентрации в присутствии антагонистов.
А - эффект агониста;
В - эффект агониста в присутствии конкурентного антагониста;
С - эффект агониста в присутствии неконкурентного антагониста.
Выраженность и длительность фармакологического эффекта обратимых антагонистов зависит от их концентрации, а необратимых антагонистов - от концентрации и времени жизни модифицированных рецепторов.
В зависимости от прочности связи между веществом и рецептором различают обратимое действие (характерно для большинства лекарственных средств) и необратимое (характерно для немногих, как правило, высокотоксичных препаратов, например, противоопухолевых).
Вещества, взаимодействующие только с определенными рецепторами, оказывают избирательное действие. Вещества с низкой избирательностью действия оказывают влияние на многие ткани, органы и системы, они вызывают много побочных эффектов (например, противоопухолевые средства действуют на все быстро делящиеся клетки, поэтому повреждают не только ткань опухоли, но и костный мозг, кишечный эпителий и др.)
Действие, возникающее на месте применения лекарственного средства, называется местным (например, утрата болевой и температурной чувствительности на фоне местных анестетиков).
Действие, развивающееся после всасывания лекарственного средства, его поступления в кровоток, а затем в ткани, называется резорбтивным (например, анальгетический эффект при приеме наркотических и ненаркотических анальгетиков).
Местное и резорбтивное действие может быть прямым и косвенным.
Прямое действие - изменение функции органов и тканей, на которых направлено действие препарата (например, подавление аритмий антиаритмическими средствами путем блокады ионных каналов кардиомиоцитов). Косвенное действие - изменение функции тех органов и тканей, на которые лекарство не оказывает прямого действия (например, увеличение диуреза, связанное с улучшением кровоснабжения почек на фоне действия сердечных гликозидов). Косвенно действие может быть рефлекторным, когда изменение функции органов и тканей является следствием воздействия лекарственного вещества на чувствительные нервные окончания. Так действуют раздражающие средства, например, эфирное горчичное масло, раздражая энтерорецепторы кожи, приводит к улучшению трофики органов дыхания.
Совокупность изменений в организме, для достижения которых применяется лекарственное средство в каждом конкретном случае, называется основным (главным) действием (в других случаях оно может быть побочным).
Дополнительные эффекты лекарственных средств, не имеющие лечебного эффекта в каждом конкретном случае, называются побочным действием. Как правило, побочное действие нежелательно для больного.
Вся совокупность изменений в организме, вызываемая лекарственным средством в терапевтической концентрации, называется спектром терапевтического действия.
Боль: от патогенеза к выбору лекарственного препарата
Боль является наиболее частой и сложной по субъективному восприятию жалобой пациентов. В 40% всех первичных обращений к врачу боль является ведущей жалобой. Большая распространенность болевых синдромов оборачивается значительными материальными, социальными и духовными потерями.
Как уже говорилось выше, комитет по классификации Международной ассоциации по изучению боли определяет боль как «неприятное сенсорное и эмоциональное переживание, связанное с существующим или возможным повреждением ткани или описываемое в терминах такого повреждения» [37]. В этом определении подчеркивается, что ощущение боли может возникать не только при повреждении ткани, но даже при отсутствии какого-либо повреждения, что указывает на важную роль психических факторов в формировании и поддержании боли.
Классификация боли
Боль - понятие клинически и патогенетически сложное и неоднородное. Она различается по интенсивности, локализации и по своим субъективным проявлениям. Боль может быть стреляющей, давящей, пульсирующей, режущей, а также постоянной или периодической. Все существующее многообразие характеристик боли во многом связано с самой причиной, вызвавшей ее, анатомической областью, в которой возникает ноцицептивный импульс, и очень важно для определения причины боли и последующего лечения [3].
Одним из наиболее существенных факторов в понимании этого феномена является разделение боли на острую и хроническую (рис. 8).
Рис. 8. Боль: острая и хроническая. Главным отличием хронической боли от острой является не временной фактор, а качественно иные нейрофизиологические, психофизиологические и клинические соотношения.
Острая боль всегда указывает на конкретную проблему или угрозу для человека. В этом ее биологический смысл и «польза». Хроническая боль является во всех случаях патологическим состоянием, приводящим к дезадаптации и снижению качества жизни пациента. А для общества хроническая боль оборачивается огромными экономическими потерями.
Острая боль - это сенсорная реакция с последующим включением эмоционально-мотивационных вегетативных и других факторов при нарушении целостности организма. Развитие острой боли связано, как правило, с вполне определенными болевыми раздражениями поверхностных или глубоких тканей и внутренних органов, нарушением функций гладкой мускулатуры. Острый болевой синдром развивается в 80% случаев, имеет защитное, предупредительное значение, так как свидетельствует о «повреждении» и вынуждает человека предпринять меры для выяснения причины боли и ее устранения. Длительность острой боли определяется временем восстановления поврежденных тканей и/или нарушенной функции гладких мышц и обычно не превышает 3 месяцев. Острая боль обычно хорошо купируется анальгетиками.
В 10-20% случаев острая боль переходит в хроническую, которая длится более 3-6 месяцев. Однако главным отличием хронической боли от острой является не временной фактор, а качественно иные нейрофизиологические, психофизиологические и клинические соотношения. Хроническая боль не носит защитного характера. Хроническая боль в последние годы стала рассматриваться не только как синдром, но и как отдельная нозология. Ее формирование и поддержание зависит в большей степени от комплекса психологических факторов, нежели от характера и интенсивности периферического ноцицептивного воздействия. Хроническая боль может сохраняться после завершения процессов заживления, т.е. существовать вне зависимости от повреждения (наличия ноцицептивного воздействия). Хроническая боль не купируется анальгетиками и часто приводит к психологической и социальной дезадаптации пациентов.
Одной из возможных причин, способствующих хронификации боли, является лечение, неадекватное причине и патогенезу болевого синдрома. Устранение причины острой боли и/или максимально эффективное ее лечение - залог профилактики трансформации острой боли в хроническую.
Важное значение для успешного лечения боли имеет определение ее патогенеза. Наиболее часто встречается ноцицептивная боль, возникающая при раздражении периферических болевых рецепторов - «ноцицепторов», локализованных практически во всех органах и системах (коронарный синдром, плеврит, панкреатит, язва желудка, почечная колика, суставной синдром, повреждения кожи, связок, мышц и т.д). Нейропатическая боль возникает вследствие повреждения различных отделов (периферической и центральной) соматосенсорной нервной системы [9].
Ноцицептивные болевые синдромы чаще всего являются острыми (ожог, порез, ушиб, ссадина, перелом, растяжение), но могут носить и хронический характер (остеоартроз). При этом виде боли фактор, вызвавший ее, как правило, очевиден, боль обычно четко локализована (обычно в зоне повреждения). Описывая ноцицептивную боль, пациенты чаще всего пользуются определениями «сжимающая», «ноющая», «пульсирующая», «режущая». В лечении ноцицептивной боли хороший терапевтический эффект можно получить при назначении простых анальгетиков и НПВП. При ликвидации причины (прекращении раздражения «ноцицепторов») ноцицептивная боль проходит [9].
Причинами нейропатической боли могут быть повреждения афферентной соматосенсорной системы на любом уровне, начиная от периферических чувствительных нервов и заканчивая корой больших полушарий, а также нарушения в нисходящих антиноцицептивных системах. При поражении периферической нервной системы боли называют периферическими, при поражении центральной нервной системы - центральными (рис. 9).
Нейропатическая боль, возникающая при повреждении различных участков нервной системы, характеризуется пациентами как жгучая, стреляющая, холодящая и сопровождается объективными симптомами раздражения нервов (гиперестезия, парестезия, гипералгезия) и/или нарушения их функции (гипестезия, анестезия). Характерным симптомом нейропатической боли является аллодиния - феномен, характеризующийся возникновением боли в ответ на действие безболевого стимула (поглаживание кисточкой, ватой, температурного фактора).
Рис. 9. Периферическая и центральная нейропатическая боль.
Нейропатическая боль характерна для хронических болевых синдромов разной этиологии. При этом их объединяют общие патофизиологические механизмы формирования и поддержания боли.
Нейропатическая боль плохо поддается лечению стандартными анальгетиками и НПВП и часто приводит к выраженной дезадаптации пациентов.
В практике невролога, травматолога, онколога встречаются болевые синдромы, в клинической картине которых наблюдаются симптомы как ноцицептивной, так и нейропатической боли - «смешанная боль» (рис. 10). Такая ситуация может возникать, например, при компрессии опухолью нервного ствола, раздражении межпозвонковой грыжей спинномозгового нерва (радикулопатии) или при компрессии нерва в костном или мышечном канале (туннельные синдромы). В лечении смешанных болевых синдромов необходимо воздействие на оба, ноцицептивный и нейропатический, компоненты боли.
Рис. 10. Представленность различных типов боли.
Ноцицептивная и антиноцицептивная системы
Сегодняшние представления о формировании боли основаны на представлениях о существовании двух систем: ноцицептивной (НС) и антиноцицептивной (АНС) (рис. 11).
Ноцицептивная система (является восходящей) обеспечивает проведение боли от периферических (ноцицептивных) рецепторов до коры головного мозга. Антиноцицептивная система (является нисходящей) предназначена для контроля над болью [17, 18].
На первом этапе формирования боли происходит активация болевых (ноцицептивных) рецепторов. К активации болевых рецепторов может привести, например, воспалительный процесс. Это вызывает проведение болевых импульсов к задним рогам спинного мозга.
На сегментарном спинальном уровне происходит модуляция ноцицептивной афферентации, которая осуществляется влиянием нисходящих антиноцицептивных систем на различные опиатные, адренергические, глютаматные, пуриновые и другие рецепторы, расположенные на нейронах заднего рога. Этот болевой импульс затем передается в вышележащие отделы центральной нервной системы (таламус, кора головного мозга), где происходит обработка и интерпретация информации о характере и локализации боли.
Рис. 11. Современные представления о боли: ноцицептивная (НС) и антиноцицептивная системы (АНС).
Однако итоговое восприятие боли в значительной степени зависит от активности АНС. АНС головного мозга играют ключевую роль в формировании боли и изменении реакции на боль. Очевидна их широкая представленность в головном мозге и включение в различные нейротрансмиттерные механизмы (норадреналин, серотонин, опиоиды, дофамин). АНС работают не изолированно, а, взаимодействуя между собой и с другими системами, они регулируют не только болевую чувствительность, но и сопряженные с болью вегетативные, моторные, нейроэндокринные, эмоциональные и поведенческие проявления боли. Это обстоятельство позволяет рассматривать их как важнейшую систему, определяющую не только характеристики болевого ощущения, но и его многообразные психофизиологические и поведенческие корреляты [3]. В зависимости от активности АНС боль может усиливаться или уменьшаться.
Препараты для лечения боли
Препараты для лечения боли назначают с учетом предполагаемых механизмов боли. Понимание механизмов формирования болевого синдрома позволяет проводить индивидуальный подбор лечения. При ноцицептивной боли с наилучшей стороны зарекомендовали себя нестероидные противовоспалительные препараты (НПВП) и опиоидные анальгетики. При нейропатической боли обоснованным является применение антидепрессантов, антиконвульсантов, местных анестетиков, а также блокаторов калиевых каналов.
Нестероидные противовоспалительные препараты
Если в патогенезе болевого синдрома ведущую роль играют механизмы воспаления, то наиболее целесообразно в этом случае применение НПВП. Их использование позволяет подавить синтез альгогенов в поврежденных тканях, что предотвращает развитие периферической и центральной сенситизации [26]. Помимо болеутоляющего эффекта препараты из группы НПВП оказывают противовоспалительное и жаропонижающее действие.
Современная классификация НПВП предполагает разделение этих средств на несколько групп, отличающихся селективностью в отношении ферментов циклооксигеназы 1 и 2 типа, которые участвуют в ряде физиологических и патологических процессов (рис. 12).
Рис. 12. Селективные и неселективные НПВП.
Считается, что противоболевой эффект препаратов из группы НПВП связан в основном с их влиянием на ЦОГ2, а желудочно-кишечные осложнения обусловлены их влиянием на ЦОГ1. Однако исследования последних лет обнаруживают и другие механизмы анальгетического действия некоторых препаратов из группы НПВП. Так, было показано, что диклофенак (Вольтарен) может оказывать противоболевое действие не только через ЦОГ-зависимые, но и другие периферические, а также центральные механизмы [15].
Местные анестетики
Ограничения поступления ноцицептивной информации в ЦНС можно достичь при применении различных местных анестетиков, которые могут не только предотвратить сенситизацию ноцицептивных нейронов, но и способствовать нормализации микроциркуляции в зоне повреждения, уменьшению воспаления и улучшению обмена веществ. Наряду с этим местные анестетики расслабляют поперечно-полосатую мускулатуру, устраняют патологическое напряжение мышц, которое является дополнительным источником боли [26].
К местным анестетикам относят вещества, вызывающие временную потерю чувствительности тканей в результате блокады проведения импульсов в нервных волокнах. Наибольшее распространение среди них получили лидокаин, новокаин, артикаин и бупивакаин. Механизм действия местных анестетиков связан с блокированием Na + -каналов на мембране нервных волокон и торможением генерации потенциалов действия.
Антиконвульсанты
Длительно существующее раздражение ноцицепторов или периферических нервов приводит к развитию периферической и центральной сенситизации (гипервозбудимости).
Существующие сегодня антиконвульсанты, применяемые для лечения боли, имеют различные точки приложения. Дифенин, карбамазепин, окскарбазепин, ламотриджин, вальпроаты, топиромат действуют главным образом, подавляя активность потенциал-зависимых натриевых каналов, предотвращая спонтанную генерацию эктопических разрядов в поврежденном нерве. Эффективность этих препаратов доказана у пациентов с тригеминальной невралгией, диабетической невропатией, фантомно-болевым синдромом.
Габапентин и прегабалин тормозят вход ионов кальция в пресинаптическую терминаль ноцицепторов, тем самым уменьшая выброс глутамата, что приводит к уменьшению возбудимости ноцицептивных нейронов спинного мозга (уменьшает центральную сенситизацию). Эти препараты также модулируют активность NMDA-рецепторов и снижают активность Na + -каналов.
Антидепрессанты
Антидепрессанты и препараты из группы опиоидов назначают с целью усиления антиноцицептивных влияний. При лечении болевых синдромов в основном используют препараты, механизм действия которых связан с блокадой обратного захвата моноаминов (серотонина и норадреналина) в ЦНС. Обезболивающий эффект антидепрессантов может быть частично обусловлен и непрямым анальгетическим действием, так как улучшение настроения благоприятно сказывается на оценке боли и уменьшает болевое восприятие. Кроме того, антидепрессанты потенцируют действие наркотических анальгетиков, повышая их сродство к опиоидным рецепторам [26].
Мышечные релаксанты
Мышечные релаксанты применяют в случаях, когда вклад в формирование боли вносит мышечный спазм. Следует отметить, что мышечные релаксанты оказывают воздействие на уровне спинного мозга, а не на уровне мышц.
В нашей стране для лечения болезненных мышечных спазмов используются тизанидин, баклофен, мидокалм, а также препараты из группы бензодиазепинов (диазепам). В последнее время с целью расслабления мышц в лечении миофасциальных болевых синдромов применяются инъекции ботулинотоксина типа А [22]. У представленных препаратов - разные точки приложения. Баклофен является агонистом ГАМК-рецепторов, ингибирует активность вставочных нейронов на спинальном уровне.
Толперизон блокирует Na + -и Ca 2+ -каналы интернейронов спинного мозга и уменьшает выброс болевых медиаторов в нейронах спинного мозга. Тизанидин относится к мышечным релаксантам центрального действия. Основная точка приложения его действия находится в спинном мозге. Стимулируя пресинаптические a2-рецепторы, он подавляет высвобождение возбуждающих аминокислот, которые стимулируют рецепторы к N-метил-D-аспартату (NMDA-рецепторы). Вследствие этого на уровне промежуточных нейронов спинного мозга происходит подавление полисинаптической передачи возбуждения. Поскольку именно этот механизм отвечает за избыточный мышечный тонус, то при его подавлении мышечный тонус снижается. В дополнение к миорелаксирующим свойствам, тизанидин оказывает также центральный умеренно выраженный анальгезирующий эффект.
Исходно тизанидин был разработан для лечения мышечного спазма при различных неврологических заболеваниях (при травматических повреждениях головного и спинного мозга, рассеянном склерозе, инсульте). Однако в скором времени после начала его применения были выявлены анальгетические свойства тизанидина. В настоящее время применение тизанидина в монотерапии и в комплексном лечении болевых синдромов получило широкое распространение [11].
Селективные активаторы нейрональных калиевых каналов (SNEPCO)
Принципиально новым классом препаратов для лечения болевых синдромов являются селективные активаторы нейрональных калиевых каналов - SNEPCO (Selective Neuronal Potassium Channel Opener), оказывающие воздействие на процессы сенситизации нейронов заднего рога за счет стабилизации мембранного потенциала покоя.
Первый представитель этого класса лекарственных средств - флупиртин (Катадолон), обладающий широким спектром ценных фармакологических свойств, выгодно отличающих его от других обезболивающих препаратов.
В последующих главах подробно изложены сведения о фармакологических свойствах и механизме действия Катадолона, представлены результаты исследований его эффективности и безопасности, рассказывается об опыте применения препарата в разных странах мира, даны рекомендации по применению Катадолона при различных болевых синдромах.
Взаимодействия лекарственного вещества с рецептором
Рецепторы - это макромолекулы, участвующие в передаче химических сигналов как между клетками, так и внутри одной клетки; они могут находится на поверхности клеточной мембраны или в цитоплазме (см. таблицу Некоторые типы физиологических рецепторов и рецепторов лекарственных препаратов Влияние возраста на особенности клинических эффектов некоторых лекарственных препаратов ). Активированные рецепторы прямо или косвенно регулируют клеточные биохимические процессы (например, проводимость ионных каналов, фосфорилирование белков, транскрипцию ДНК, ферментативную активность).
Молекулы (к примеру, лекарственные препараты, гормоны, нейротрансмиттеры), которые связываются с рецептором, называются лигандами. Связывание может быть специфическим и обратимым. Связывание с лигандом может приводить к активации либо инактивации рецептора; активация может стимулировать либо ингибировать ту или иную клеточную функцию. Каждый лиганд способен взаимодействовать с различными подтипами рецепторов. Почти не существует препаратов, абсолютно специфичных к одному рецептору или его подтипу, но большинство из них имеет относительную селективность. Селективность - это степень, с которой лекарственное средство действует на определенный участок относительно других участков; селективность относится в основном к физико-химическому связыванию препарата с клеточными рецепторами. (См. также Обзор фармакодинамики Обзор фармакодинамики (Overview of Pharmacodynamics) Фармакодинамика (под которой понимают то, как препарат действует на организм) - это изучение биохимических, физиологических и молекулярных эффектов лекарственных средств на организм, в том числе. Прочитайте дополнительные сведения ).
Способность лекарственного препарата воздействовать на конкретный тип рецептора зависит от его аффинности (вероятности того, что ЛС займет рецептор в определенный момент времени) и внутренней активности (степени активации рецептора после связывания с лигандом и развития клеточной реакции). Аффинность и внутренняя активность лекарственного вещества в свою очередь определяются его химической структурой.
Фармакологический эффект определяется также длительностью сохранения комплекса "препарат-рецептор" (время удержания). На продолжительность существования комплекса "препарат-рецептор" влияют динамические процессы (изменения конформации), которые контролируют скорость ассоциации и диссоциации лекарственных веществ от своей мишени. Большее время удержания служит объяснением продолжительному фармакологическому действию. К препаратам с длительным временем удержания относятся финастерид и дарунавир. Длительное время удержания может быть потенциальным недостатком, если за этот счет продлевается и токсический эффект препарата. Для некоторых рецепторов транзиторное связывание производит нужный фармакологический эффект, в то время как длительное связывание провоцирует токсичность.
Физиологические функции (такие как сокращение, секреция), как правило, регулируются множественными рецептор-опосредованными механизмами и включают несколько этапов (связывание с рецептором, активация внутриклеточных вторичных мессенджеров и т. д.) между первоначальным взаимодействием лекарственного вещества с рецептором и конечным ответом ткани или органа. По этой причине один и тот же желаемый фармакологический эффект может быть достигнут применением ЛС с разной химической структурой.
На способность препарата связываться с рецептором оказывают влияние внешние факторы, а также внутриклеточные регуляторные механизмы. Исходная плотность рецепторов и эффективность механизмов ответа на стимул варьируют от ткани к ткани. Лекарственные средства, старение, мутации и заболевания могут повышать (активировать) или снижать (подавлять) число и аффинность рецепторов. Например, клонидин снижает активность альфа-2-адренорецепторов; по этой причине быстрая отмена клонидина может спровоцировать гипертонический криз Неотложные состояния К неотложным состояниям относят поражения органов-мишеней (головной мозг, сердечно-сосудистая система и почки) на фоне выраженного повышения АД. Диагностика производится посредством измерения. Прочитайте дополнительные сведения . Длительная терапия бета-блокаторами повышает плотность бета-рецепторов, в связи с чем резкое прекращение приема данного класса препаратов может вызвать развитие тяжелой гипертензии или тахикардии. Стимуляция и ингибирование рецепторов влияют на механизмы приспособления организма к лекарственному средству (например, в виде гипосенсибилизации, тахифилаксии, толерантности, приобретенной резистентности и гиперчувствительности после отмены).
Лиганды связываются с определенными участками на макромолекуле рецептора, называемыми сайтами узнавания. Места связывания лекарственного вещества и эндогенного агониста (гормона или нейротрансмиттера) могут быть идентичными либо различаться. Агонисты, связывающиеся со смежным или другим сайтом, иногда называются аллостерическими агонистами. Также происходит неспецифическое связывание препаратов, т.е. с молекулярными участками, не являющимися рецепторами (например, белками плазмы крови). Связывание лекарственного вещества с подобными неспецифическими участками, например, связывание с белками сыворотки крови, препятствует его связыванию с рецептором, тем самым делая препарат неактивным. Несвязанные препараты способны взаимодействовать с рецепторами и, следовательно, вызывать эффект.
Агонисты и антагонисты
Агонисты активируют рецепторы для реализации желаемого фармакологического эффекта. Традиционные агонисты повышают долю активированных рецепторов. Обратные агонисты стабилизируют рецепторы в их неактивной конформации и действуют аналогично конкурентным агонистам. Многие гормоны, нейротрансмиттеры (например, ацетилхолин, гистамин, норадреналин ) и лекарственные средства (например, морфин, фенилэфрин, изопреналин, бензодиазепины, барбитураты) действуют как агонисты рецепторов.
Антагонисты препятствуют активации рецептора. Предотвращение активации оказывает множество эффектов. Антагонисты усиливают клеточную функцию в том случае, если они блокируют действие вещества, обычно подавляющего данную функцию. Справедлива и обратная закомерность: антагонисты снижают клеточную функцию, если блокируют действие вещества, усиливающего ее.
Антагонисты рецепторов могут быть классифицированы на обратимые и необратимые. Обратимые антагонисты легко диссоциируют от соответствующих рецепторов, необратимые - образуют стабильную, постоянную или почти постоянную химическую связь со своим рецептором (например, при алкилировании). Псевдообратимые антагонисты медленно разрывают связь со своим рецептором.
При конкурентном антагонизме связывание антагониста с рецептором препятствует связыванию с ним агониста.
При неконкурентном антагонизме агонист и антагонист могут связываться одновременно, но связывание антагониста снижает эффект агониста либо препятствует его развитию.
При обратимом конкурентном антагонизме агонист и антагонист образуют кратковременные связи с рецептором, в результате чего достигается равновесное состояние этой трехкомпонентной системы. Такой антагонизм можно преодолеть путем увеличения концентрации агониста. Например, налоксон (антагонист опиоидных рецепторов, структурно схожий с морфином) при введении незадолго до или сразу после введения морфина блокирует действие последнего. Тем не менее конкурентный антагонизм налоксона может быть преодолен с помощью введения морфина в большей дозе.
Такие лекарственные вещества называются частичными агонистами или агонистами-антагонистами. Структурные аналоги молекул агониста часто обладают одновременно свойствами агониста и антагониста. Например, пентазоцин активирует опиоидные рецепторы, но блокирует их активацию другими опиоидами. Таким образом, пентазоцин обеспечивает опиоидное действие, но ослабляет эффект другого опиоида, если последний вводится в период сохранения связи пентазоцина с рецептором. Лекарственное средство, действующее как частичный агонист в одной ткани, может действовать как полный агонист в другой.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Взаимодействие лекарственных веществ с рецепторами.
Способность вещества связываться с рецепторами клетки называется аффинностью 4 . Аффинность обусловлена тем, что пространственная конфигурация лекарства может напоминать конфигурацию эндогенного лиганда этого рецептора. Внутренней активностью называют способность лекарственного вещества вызывать активацию рецептора. В зависимости от величины внутренней активности все лекарственные вещества можно разделить на несколько групп:
Агонисты или миметики (от греч. agonistes- соперник;mimeomai- подражать) - вещества, которые связываясь с рецепторами способны их активировать, что вызывает развитие ответа, характерного для данного типа рецепторов. Считают, что внутренняя активность у агонистов равна 1,0 (т.е. они вызывают полный ответ ткани).
Антагонисты или блокаторы (от греч. antagonisma- соперничество, противоборство) - это лекарственные вещества, которые связываются с рецепторами, но не вызывают их активации (т.е. их внутренняя активность равна нулю). Антагонисты экранируют циторецепторы и препятствуют развитию ответа при действии эндогенных агонистов.
Парциальные агонисты - это вещества, которые связываются с рецепторами и вызывают их активацию, однако, даже если они займут все рецепторы, эти вещества не способны вызвать максимальный ответ для данного типа рецепторов. Т.е. внутренняя активность таких агонистов меньше 1,0 и составляет обычно 0,3-0,6.
Действие парциального агониста будет зависеть от того, с какими рецепторами они взаимодействуют - с покоящимися или с рецепторами, которые уже активированы полными агонистами. Если парциальный агонист взаимодействует с покоящимися рецепторами, то он вызывает их активацию и ответ ткани возрастает с нуля до некоторой величины (»30-60%), т.е. это типичное агонистическое воздействие. Если парциальный агонист действует на ткань, рецепторы которой уже активированы полным агонистом, то он начинает вытеснять агонист из связи с рецептором и занимать его место. Поскольку эффект парциального агониста уступает полному - ответ ткани снижается со 100% до более низкой величины (»30-60%), т.е. это типичное блокирующее действие (см. схему 2).
Иногда выделяют также понятие агонистов-антагонистов. Агонисты-антагонисты - это вещества с низкой аффинностью, которые могут взаимодействовать не с одним, а с несколькими типами рецепторов, при этом они одни рецепторы активируют, а другие блокируют.
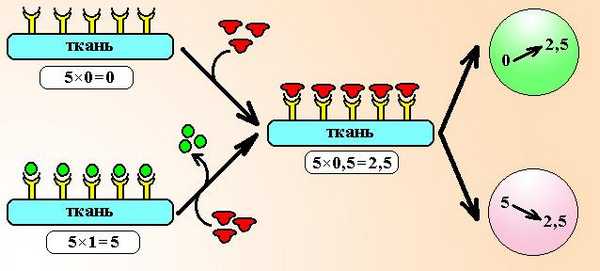
Схема 2. Действие парциальных агонистов. Предположим, что имеется тест-ткань, несущая всего 5 рецепторов. Если рецепторы свободны, ответ ткани равен нулю. После добавления парциального агониста с внутренней активностью 0,5 он будет активировать рецепторы и общий ответ ткани составит 5´0,5=2,5 ЕД. Если рецепторы уже заняты полным агонистом, ответ ткани максимальный (5´1,0=5 ЕД), при добавлении к системе парциального агониста он начинает вытеснять лиганд из связи с рецептором и будет активировать их слабее полного агониста. Общий ответ ткани при этом уменьшится и составит 5´0,5=2,5 ЕД, т.е. возникнет эффект блокады.
Можно показать, что чем больше изначальное число активированных рецепторов в ткани, тем будет более выражен блокирующий эффект парциального агониста.
Инверсные агонисты - это вещества, которые связываются с рецепторами и вызывают эффект обратный тому, который возникает при действии обычного агониста. Т.е. внутренняя активность реверсных агонистов меньше нуля (-1,0). Инверсные агонисты не следует путать с антагонистами. Антагонист предупреждает эффект агониста, блокируя рецептор, инверсный агонист - вызывает при взаимодействии с рецептором зеркально противоположный эффект. Примером реверсных агонистов могут служить b-карболины. Диазепам является агонистом бензодиазепин-ГАМК рецепторного комплекса и вызывает при активации рецептора развитие седативного и снотворного эффектов. Флумазенил - антагонист этих рецепторов, если его ввести в организм пациента, то воспроизвести снотворное действие диазепама не удается.b-карболины при взаимодействии с бензодиазепиновым рецептором будут вызывать судороги (качественно противоположный снотворному действию диазепама эффект).
Читайте также:
- Синдром Криста-Сименса-Турена (Christ-Siemens-Touraine)
- Уход после артроскопической операции по поводу кальцифицирующего тендинита плечевого сустава
- Причины сердечной недостаточности у ребенка. Клиника
- КТ при врожденных заболеваниях семенных пузырьков
- Примеры семейной эксудативной витриоретинопатии симулирующей ретинобластому
