УЗИ, МРТ при папилломе сосудистого сплетения головного мозга у плода
Добавил пользователь Валентин П. Обновлено: 21.01.2026
Звоните нам по телефону 8 (812) 241-10-46 с 7:00 до 00:00 или оставьте заявку на сайте в любое удобное время
Ваша заявка принята!
Благодарим за обращение.
В ближайшее время с вами свяжется наш специалист.
Киста сосудистого сплетения у плода и взрослого: причины, симптомы
Киста сосудистого сплетения (КСС) у плода и новорожденного - это УЗИ термин, образующийся из-за избыточных скоплений спинномозговой жидкости вдоль сосудов. В большинстве случаев по мере роста младенца образования проходят самостоятельно. Если структуры сохраняются, не представляют опасности для здоровья ребенка. Если структуры сохраняются, не представляют опасности для здоровья ребенка. Только в редких случаях требуется оперативное вмешательство по удаления разросшейся кистозной полости.
Киста сосудистого сплетения у плода - что это такое
Опасность представляют КСС у детей с хромосомными аномалиями типа болезни Эдвардса (трисомия 18 хромосомы). Нозология характеризуется множественными пороками развития, поэтому внутримозговые полости с ликвором - минимальная проблема при лечении.
Болезнь Дауна не характеризуется формированием КСС головного мозга.
Интересные факты о кистах сосудистых сплетений детей:
- Самопроизвольное исчезновение у 90% плодов к 28 неделе развития;
- Частота распространенности нозологии среди беременных - 2%;
- Варьирует форма, размер, количество полостей;
- Обнаруживаются у взрослых и здоровых людей;
- Частота кист ворсинчатого, хориоидного сплетения - около 3%.
Нельзя определить первоначальный тип образований у плода из-за физиологической деградации. Отсутствие выраженной симптоматики не позволяет врачам накопить достаточно информации о патологии.
Морфологическая структура хориоидных кистозных полостей у ребенка
Скопление цереброспинальной жидкости внутри хориоидных образований не представляет опасности здоровью младенца. Морфологически полость представлена тонкой стенкой, способна изменять размеры, форму.
Сплетения сосудов - это ранние структуры формирования центральной нервной системы плода. Двусторонняя локализация обусловлена наличием двух полушарий, требующих содержания ликвора. Объяснить необходимость формирования ограниченных полостей вокруг сплетений ученые не смогли. Предположительно, структуры являются частью формирования ЦНС, поэтому проходят к 28 неделе. Если замедляется развития, КСС прослеживаются у новорожденных, младенцев 3 месяца и несколько старше.
Кистозные полости головного мозга иногда прослеживаются у взрослых. Клинических симптомов патология не формирует, поэтому выявляются случайно на МРТ, проводимой по причине верификации другой этиологии.
Практика показывает отсутствие опасности для здоровья сохранение кист хориоидных сплетений после 30 недель, за исключением болезни Эдвардса.
Причины возникновения КСС
Этиология не установлена. Считается вероятным длительное сохранение кистозных полостей на фоне вирусных инфекций, герпеса, осложненного течения беременности. Отсутствие клинических проявлений до конца жизни человека свидетельствует об отсутствии вреда патологии. За образованиями требуется динамическое наблюдение. Незаращение родничков у ребенка позволяет выполнить УЗИ черепа, а взрослым людям рекомендуют периодическое МРТ.
Вирусные кисты способны видоизменяться: растут, перерождаются. Динамическое наблюдение определяет прогноз последствий для человека с КСС.
Следует отличать два разных диагноза - «киста сосудистого сплетения плода», «сосудистая киста головного мозга». Первая нозология безвредна, проходит самостоятельно или сохраняется без динамики много лет. Вторая разновидность опасна, так как иногда провоцирует симптоматику.
Существует определение «псевдокиста». На экране УЗИ-монитора врачи могут обнаружить полость, которая образованная физиологическими структурами.
Исключение патологических состояний после установки диагноза «киста сосудистого сплетения» у новорожденного и плода обеспечивается дополнительным комплексным обследованием. Генетическое консультирование исключает болезнь Эдвардса. Магнитно-резонансная томография показывает структуру мягких тканей головного мозга с высоким разрешением, трехмерным моделированием исследуемой области.
Обнаружение у ребенка кисты сосудистого сплетения требует верификации провоцирующих факторов: вирусных и бактериальных инфекций, изменения состава ликвора, повышения внутричерепного давления. Если отсутствуют дополнительные изменения, можно утверждать об отсутствии условий для негативного развития сосудистой кисты.
Кисты сосудистого сплетения новорожденного ребенка
Обнаружение КСС после рождения не является опасным состоянием, но требует обследования новорожденного малыша. Герпетическая инфекция активируется при ослабленном иммунитете, способна обусловить изменения сосудистых сплетений. С ростом младенца укрепляется иммунитет, поэтому после 3 месяцев наблюдается активное развитие иммунитета. Снижение вирусной активности стабилизирует состояние. Кистозные полости могут наблюдаться у грудничка при отсутствии клинической патологии. По стандартной схеме детей обследует три раза:
- 3 месяца;
- 6 месяцев;
- 12 месяцев.
Отсутствие прогрессирования свидетельствует об отсутствии изменений, которые будут способствовать развитию опасных состояний.
Киста левого сосудистого сплетения у ребенка
Сосудистое сплетение закладывается в организме плода достаточно рано. Образование принимает участие в образовании спинномозговой жидкости, которая обеспечивает питание головного мозга.
Диагноз кисты левого сплетения распространен у новорожденных, хотя чаще встречается двухсторонняя локализация. Формируется патология в возрасте до 1 года, когда присутствуют перенесенные внутриутробные инфекции. Кистозные полости образуются в любом участке головного мозга с одинаковой вероятностью.
Киста сосудистого сплетения правого бокового желудочка
Нозология считается самой доброкачественной, так как большинство вариантов самостоятельно исчезает. Обнаруживается после 22 недель. Ультразвуковое сканирование после 28 недель показывает отсутствие патологии. Кистозная полость правого желудочка способна рассасываться. Если отсутствует сочетанная патология (с повреждением других вентрикулярных пространств) данное расположение кисты не будет формировать осложнений на протяжении всей жизни, даже если нозология сохранится у ребенка после 1 года. У взрослого человека нозология встречается редко.
Двусторонние сосудистые кисты сплетений
Патология способна сохраняться во взрослом периоде. Некоторые полости исчезают, часть сохраняется. Несмотря на двустороннее расположение клинических симптомов не возникает. Динамическое наблюдение способно может выявить увеличение размеров, изменение формы. Только тогда проводится консервативное лечение. Предварительно исключаются хромосомные мутации. Врачи-генетики способны выявить генетическую предрасположенность к болезни Эдвардса. Правда, определить патологию можно без консультирования по внешним симптомам нозологии, характеризующимся множественными пороками развития.
Ультразвуковое исследование через каждые 3 месяца позволяет отследить состояние паренхимы мозга у младенцев. Процедуры достаточно для получения информации о деградации или прогрессировании кистозных полостей.
Мелкие кистозные полости в мозге ребенка
Природа КСС достоверно не установлена. Патология является случайной находкой. Мелкие очаги не влияют на психику человека, метаболические реакции. Нарушение обмена веществ отсутствует, поэтому опасность исключена.
Следует дифференцировать мелкие кисты сплетений и сосудов. Последний вариант провоцирует некоторую симптоматику. Угроза жизни, здоровью отсутствуют. У взрослых людей возможно возникновение мелкой геморрагии, пропитывания окружающих тканей.
Внутриутробное инфицирование провоцирует воспалительное повреждение стенок полости. Выявление инфекции требует назначения антибактериальных препаратов.
Обнаружение кисты сплетения на 19 или 20 неделе - это не повод для переживаний со стороны родителей. Повторное обследование на 29 неделе покажет отсутствие полостей.
Большинство ученых считает нормой кистозное сплетение внутримозговых сосудов. Отсутствие клиники позволяет предположить нозологии вариантом нормы. Совершенствование способов диагностики позволило выявлять болезнь у плода и младенцев чаще.
Следует обращать внимание на позднее кистообразование, являющееся результатом инфицирование герпеса, рядом других вирусов.
Симптомы кист сосудистых сплетений
Киста головного мозга у взрослых людей может быть последствием гематомы. Ограниченное скопление крови (субдуральное, эпидуральное) с проникновением внутрь желудочков мозга способствует вентрикулярному кистообразованию.
Патология способствует появлению клинических симптомов:
- Головокружение, головная боль;
- Расстройство координации движений;
- Мышечные судороги, эпилепсия;
- Гипертонус у новорожденных.
Локализация проявлений вблизи важных нервных центров способствует возникновению специфической симптоматики.
Присутствие цитомегаловирусной или герпетической инфекции осложняет течение заболевания. Обнаружение возбудителя и КСС у взрослого человека с высокой долей вероятности свидетельствует о вирусной этиологии кистозных полостей.
Микрокиста сосудистого сплетения правого бокового желудочка редко вызывает неврологические расстройства.
У детей сосудистые микрокисты и более крупные образования не сопровождаются патологической симптоматикой. Международная классификация болезней (МКБ 10) не относит нозологию к ряду патологических состояний.
Последствия кист сосудистых сплетений
Осложненные кистозные образования обуславливают специфические проявления:
- Гипертонус новорожденных;
- Неврологическая симптоматика при компрессии мозговых структур;
- Эпилепсия (мышечные судороги);
- Незначительное падение зрения и слуха.
При магнитно-резонансной томографии нужно будет отличать истинную сосудистую кисту от псевдокисты. Последняя разновидность является вариантом физиологического развития мозга, но анатомически структура при обследовании УЗИ напоминает полость. Магнитно-резонансная томография - точное исследование (информативность около 96%). Режим трехмерного моделирования позволит правильно верифицировать нозологию.
Синдром Эдвардса может обнаружить УЗИ по определению аномалий конечностей, изменению внутренних органов. Дополнительные диагностические тесты:
- Определение концентрации хорионического гонадотропина;
- Биохимический анализ крови;
- Анализ околоплодных вод.
Особую группу риска составляют женщины в возрасте от 32 лет и старше с гормональными нарушениями.
Диагностика сосудистых кист головного мозга
Большинство детей с наличием кисты сосудистого сплетения обладают доброкачественным течением. Никаких внешних и внутренних проявлений не формируется. Отсутствие изменений после динамического обследование через трехмесячный срок и 1 год позволяет с высокой степенью достоверности доказать отсутствие последующего прогрессирования изменений.
У взрослых определяются кистозные полости на КТ сосудов головы с контрастом, МР-ангиографии.
Современная диагностика позволяет обнаружить мелкие, двусторонние, односторонние полости любых размеров.
Новорожденным, младенцам магнитно-резонансную томографию проводят без наркоза во время сна. Обследование проводится во время сохранения полной неподвижности. Обеспечение качества при сканировании младенцев и дошкольников предполагает исследование под наркозом.
У грудничков верификация патологии возможна с помощью нейросонографии. Некоторые государственные клиники проводят обследование всем детям после рождения с профилактической целью. Частные диагностические центры предлагают обследование платно.
УЗИ, МРТ при папилломе сосудистого сплетения головного мозга у плода
ГБУ НИИ нейрохирургии им. Н.Н. Бурденко
ФГБУ "НИИ нейрохирургии им. акад. Н.Н. Бурденко" РАМН, Москва
ФГАУ «Научно-исследовательский институт нейрохирургии им. акад. Н.Н. Бурденко», Минздрава России, Москва, Россия
Мигрирующая папиллома сосудистого сплетения бокового желудочка у ребенка грудного возраста - современные подходы к хирургическому лечению
Журнал: Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2013;77(6): 45‑50
Горелышев С.К., Матуев К.Б., Медведева О.А. Мигрирующая папиллома сосудистого сплетения бокового желудочка у ребенка грудного возраста - современные подходы к хирургическому лечению. Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2013;77(6):45‑50.
Gorelyshev SK, Matuev KB, Medvedeva OA. Migrating choroid plexus papilloma of the lateral ventricle in infant - modern approaches to surgical treatment. Zhurnal Voprosy Neirokhirurgii Imeni N.N. Burdenko. 2013;77(6):45‑50. (In Russ., In Engl.).
Папилломы сосудистого сплетения (ПСС) редки у взрослых и составляют всего 0,4-1% от всех интракраниальных опухолей, и хотя встречаются во всех возрастных группах, это опухоли прежде всего детского возраста - у детей первого года жизни их доля составляет 12-14% от числа всех новообразований головного мозга. Преимущественная локализация ПСС - до 50%, по данным разных серий исследований - боковые желудочки головного мозга. Описан редкий клинический случай ребенка грудного возраста с "мигрирующей" папилломой сосудистого сплетения бокового желудочка и рассмотрены современные подходы к хирургическому лечению.
Папилломы сосудистого сплетения (ПСС) редки у взрослых и составляют всего 0,4—1% от всех интракраниальных опухолей. Хотя они встречаются во всех возрастных группах, прежде всего это опухоли детского возраста — у детей первого года жизни их доля составляет 12—14% от числа всех новообразований головного мозга [2, 8, 11]. Локализуются ПСС преимущественно в боковых желудочках головного мозга — до 50%, по данным разных серий исследований [7, 12, 19].
Лучшей стратегией в хирургии ПСС является выделение питающей опухоль сосудистой ножки, пересечение ее и удаление опухоли единым блоком [2, 18]. Эта стратегия «оправдывает» широкую кортикотомию при больших размерах опухоли и связанную с этим сложность выделения сосудистой ножки. Между тем дефект коры на большом протяжении, высокая гидрофильность детского мозга, небольшие кровоизлияния в ложе удаленной опухоли повышают риск развития субдуральных скоплений либо прогрессирующей внутренней гидроцефалии (от 27 до 75%, по данным литературы [2, 14]), требующих в последующем ликвородренирующих операций.
Планирование оптимального доступа к опухоли и хирургическая стратегия осуществляются традиционно на основании результатов дооперационных компьютерных и магнитно-резонансных томографий (КТ и МРТ).
Цель настоящей публикации — описание редкого клинического случая с «мигрирующей» ПСС бокового желудочка у ребенка грудного возраста и современных подходов к хирургическому лечению.
Клиническое наблюдение
Девочка, 4 мес жизни. Ребенок от 2-й беременности, протекавшей без осложнений, роды в срок, родоразрешение посредством кесарева сечения. Первый ребенок из двойни. С рождения девочка была более сонлива, чем второй ребенок, что настораживало мать. Это явилось причиной проведения ультразвукового исследования (УЗИ) головного мозга в возрасте ребенка 3 нед. Обнаружено объемное образование в полости черепа, при МРТ подтвержден диагноз опухоли правого бокового желудочка (рис. 1, а).
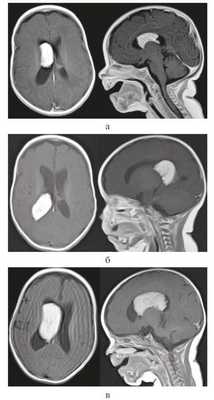
Рисунок 1. МРТ с контрастным усилением в аксиальной (слева) и сагиттальной (справа) проекции: ПСС тела и переднего рога правого бокового желудочка. а — возраст ребенка 1 мес; б — возраст ребенка 2 мес: миграция ПСС в задний рог правого бокового желудочка; в — возраст ребенка 3 мес: миграция ПСС в тело и передний рог правого бокового желудочка.
Отсутствие клинической симптоматики, малый возраст ребенка послужили поводом для динамического наблюдения.
Контрольная МРТ головного мозга через 1 мес выявила миграцию опухоли в задний рог правого бокового желудочка, размер опухоли немного увеличился (см. рис. 1, б).
При совместном обсуждении с детскими анестезиологами, учитывая стабильное состояние ребенка, отсутствие клинических проявлений образования, малый возраст ребенка, высокий риск анестезиологического пособия, было принято решение от нейрохирургической операции воздержаться, рекомендовано динамическое наблюдение.
В возрасте 3 мес девочка стала хуже есть, наблюдалось отставание в моторном развитии: голову в вертикальном положении устойчиво не держала, в положении на животе голову поднимала с трудом и не удерживала. Окружность головы 43 см, большой родничок умеренно напряжен, чуть выбухает, усиления рисунка подкожной венозной сети головы нет. Таким образом, клиническая симптоматика была представлена гидроцефальным синдромом (окружность головы 43 см, напряжение большого родничка), задержкой моторного развития (не держит голову). Принято решение об оперативном лечении.
На контрольной МР-томограмме головного мозга выявлено значительное увеличение размеров опухоли и ее миграция в передний рог и тело бокового желудочка (см. рис. 1, в).
По результатам последних МРТ-исследований головного мозга решено было произвести удаление опухоли с применением транскаллезного доступа с эндоскопической ассистенцией. Учитывая мигрирующий характер опухоли и для уточнения локализации питающего опухоль сосуда непосредственно перед оперативным вмешательством проведена нейросонография в режиме допплерографии. Выявлен крупный питающий сосуд — проходящая в толще опухоли хориоидальная артерия, а также миграция опухоли в задний и нижний рог правого бокового желудочка (рис. 2).
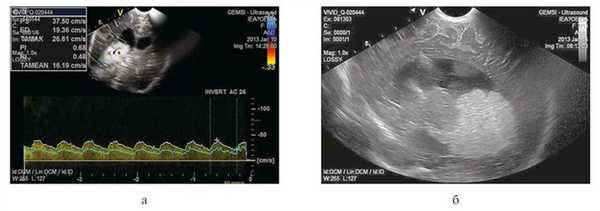
Рисунок 2. Нейросонография в день операции. а — фронтальный срез в режиме допплерографии, видна ветвь хориоидальной артерии, ветвящейся в толще опухоли; б — сагиттальный срез: миграция ПСС в задний и нижний рог правого бокового желудочка (возраст ребенка 4 мес).
Данные нейросонографии изменили хирургическую тактику — доступ к опухоли был осуществлен транскортикально через теменную долю к области желудочкового треугольника с кортикотомией до 1 см. На глубине 2 см вскрылся правый боковой желудочек, в рану под давлением стал поступать ликвор, в правом боковом желудочке обнаружилось новообразование розового цвета, по виду типичная хориоидпапиллома (рис. 3).
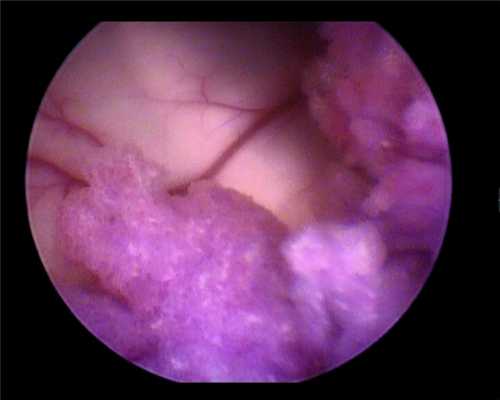
Рисунок 3. ПСС — момент осмотра патологического образования и анатомических структур, прилежащих к нему. Эндоскоп 30°. Удаление образования начато с помощью биполярной коагуляции, отсоса и микроножниц.
Новообразование занимало большую часть тела правого бокового желудочка, исходным местом роста являлось сосудистое сплетение. Проведена инспекция тела правого бокового желудочка при помощи эндоскопа 30°, выявившая длинную сосудистую ножку, исходящую из задней хориоидальной артерии (рис. 4),
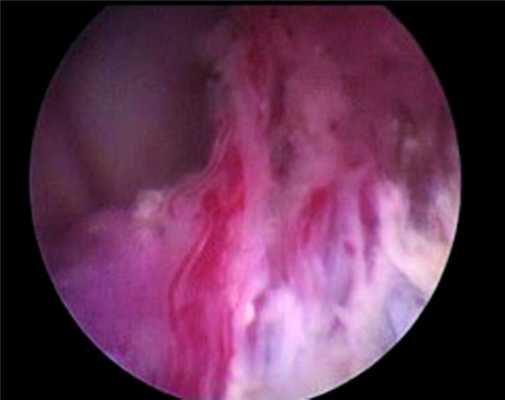
Рисунок 4. Питающая опухоль сосудистая ножка — вид через оптику эндоскопа 30°. которая прокоагулирована и отсечена при помощи микроножниц.
При эндоскопической инспекции височного рога обнаружены дополнительные артерии, подходящие к опухоли, которые также были прокоагулированы и отсечены при помощи микроножниц. После этого остаточные части опухоли, располагавшиеся в задней части правого бокового желудочка, были легко удалены. Опухоль не инфильтрировала окружающую мозговую ткань, и при эндоскопической инспекции желудочковой системы остатков опухоли обнаружено не было. Контроль гемостаза и наличия остатков опухоли произведен с помощью эндоскопической оптики 0, 30° (рис. 5).
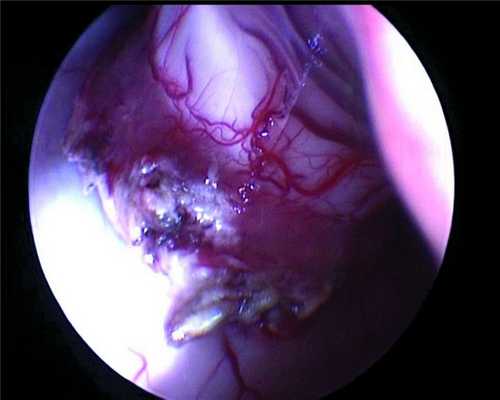
Рисунок 5. Ложе удаленной опухоли — контроль гемостаза и радикальности удаления (область сосудистого треугольника). Эндоскоп 0°.
МРТ головного мозга с контрастным усилением показала радикальное удаление опухоли и отсутствие осложнений (рис. 6).
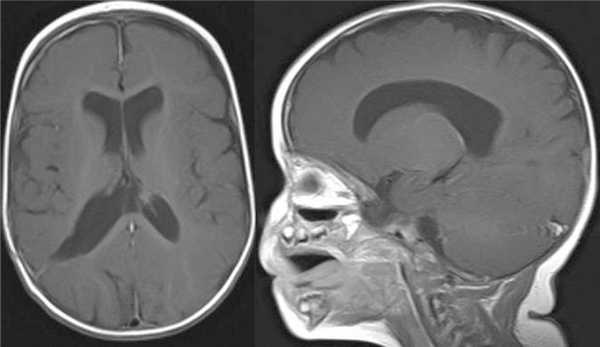
Рисунок 6. МРТ с контрастным усилением (аксиальный и сагиттальный срезы) — радикальное удаление опухоли. На аксиальном срезе виден узкий, фактически закрывшийся раневой ход. Признаков гидроцефалии и напряженных субдуральных скоплений нет.
В удовлетворительном состоянии ребенок был выписан домой. Катамнез 8 мес — признаков внутричерепной гипертензии нет.
За последние десятилетия в связи с распространением методов нейровизуализации (нейросонография, КТ и МРТ) диагностика опухолей головного мозга у детей стала возможна на ранних этапах развития заболевания. За рубежом и в России нейросонография широко применяется как метод первичной диагностики прежде всего опухолей желудочковой системы головного мозга у детей грудного возраста [1, 13]. Публикаций, касающихся «мигрирующих» ПСС, в доступной нам литературе не найдено. Ранняя диагностика, внедрение микрохирургических методик, совершенствование нейроанестезиологической техники позволили нейрохирургам оперировать младенцев с опухолями головного мозга на первом году жизни. Техника эндоскопической ассистенции, минимально инвазивные методики в хирургии опухолей головного мозга у взрослых и детей старшего возраста подробно описаны в зарубежных публикациях [4, 15], однако показания и особенности применения этих методик у детей грудного возраста освещены в литературе крайне скудно.
В современных публикациях выделены две особенности опухолей сосудистого сплетения у детей грудного возраста, которые затрудняют удаление образования. Первая особенность — обильное кровоснабжение: питающий артериальный сосуд может ветвиться в опухоли, в связи с чем высок риск операционной кровопотери при удалении. Некоторые авторы [6, 20] рекомендуют суперселективную катетеризацию и эмболизацию афферентов хориоидпапиллом, однако технические сложности — малый калибр ветвей хориоидальной артерии у грудных детей — ограничивают широкое применение этой методики. К тому же удаление ПСС не сопровождается обильным кровотечением (до повреждения питающей опухоль сосудистой ножки), в отличие от карцином сосудистого сплетения.
Вторая особенность — большие размеры опухоли, в связи с чем хирургу приходится делать обширную кортикотомию, чтобы затем выделить и пересечь питающую опухоль сосудистую ножку с последующим удалением опухоли единым блоком [10]. Большая кортикотомия, высокая гидрофильность детского мозга повышают риск западения мозговой ткани и развития напряженных субдуральных скоплений [2]. Во избежание этого некоторые авторы [2] рекомендуют использование фибринового клея для закрытия дефекта коры, однако эффективность этой методики, на наш взгляд, неубедительна.
В настоящем наблюдении для уточнения кровоснабжения опухоли непосредственно перед операцией проведена нейросонография в режиме допплерографии, которая позволила не только оценить кровоток в опухоли, но и выявить ее миграцию в задний и нижний рог бокового желудочка, что дало возможность хирургу своевременно изменить доступ к опухоли. Эндоскопическая ассистенция позволила удалить опухоль из минимально инвазивного доступа и избежать осложнений, связанных с кровопотерей и тракцией детского мозга.
Заключение
При наличии длинной питающей «ножки» возможна миграция хориоидпапиллом в пределах желудочковой системы, даже несмотря на большие размеры опухоли, что подчеркивает необходимость проведения нейровизуализации (УЗИ, МРТ) непосредственно перед оперативным вмешательством для уточнения топографии, кровоснабжения опухоли и планирования хирургического доступа.
Эндоскопическая ассистенция в хирургии опухолей желудочковой системы у грудных детей дает возможность обнаружить питающие сосуды на раннем этапе хирургического вмешательства, что позволяет снизить риск интраоперационного кровотечения и время операции, а также удалить опухоль из минимально возможного доступа (без широкой кортикотомии и значительной тракции мозга), осуществить надежный гемостаз и таким образом снизить риск образования напряженных субдуральных скоплений и прогрессирующей гидроцефалии.
Комментарий
Статья проф. С.К. Горелышева и соавт. «Мигрирующая папиллома сосудистого сплетения бокового желудочка у ребенка грудного возраста — современные подходы к хирургическому лечению» показывает интересный клинический случай с опухолью головного мозга у 3-месячного ребенка.
Использование интраоперационной ультразвуковой нейровизуализации и эндоскопии позволило хирургу изменить хирургический подход к опухоли, тем самым уменьшить неизбежную хирургическую агрессию первичного запланированного доступа по данным предоперационного МРТ-обследования. Очень полезным является использование ультразвукового метода в режиме допплерографии.
Симультанное использование эндоскопического и микрохирургического методов значительно увеличивает степень радикальности операции, уменьшает ее травматичность. Авторы показали преимущества эндоскопической ассистенции при удалении папилломы сосудистого сплетения бокового желудочка (эндоскопическая инспекция остатков опухоли, микрохирургическая работа вне поля видимости микроскопа с сохранением малотравматичного микрохирургического доступа).
Опыт нашей работы также подчеркивает преимущества использования эндоскопической технологии в лечении и диагностики опухолей внутрижелудочковой локализации. Варианты использования могут быть самые разнообразные: монопортальной эндоскопической ассистенции в комбинации с микрохирургией как показано в представленной работе, так и в самых разных моно и/или мультипортального доступа путем чисто трансэндоскопической хирургии.
В период с 1996 г. нами были проперированы больше 35 пациентов с использованием эндоскопического доступа для удаления внутрижелудочковых опухолей головного мозга. При этом из 5 случаев с папилломой сосудистого сплетения в 4 использовался мультипортальный доступ, который позволил тотально трансэндоскопически без трепанации черепа удалить объемное образование с помощью нескольких эндоскопических портов.
Наш опыт позволяет высказаться о преимуществах мультипортального подхода в эндохирургии, особенно в тяжелых случаях. В такой ситуации мультипортальность позволяет использовать необходимое количество инструментов, визуально контролировать ситуацию практически во всех отделах желудочка головного мозга и под разными углами зрения (например, в противоположном желудочке), а также панорамно визуализировать кончик микроинструмента относительно структур головного мозга с любым увеличением и максимальной освещенностью. Например, это особенно важно при проведении эндоскопа через узкое отверстие Монро. Использование портов одинакового диаметра важно для обеспечения возможности проведения любого инструмента через любой порт. Все это значительно снижает риск и резко повышает возможности оперативного вмешательства. При отдельных благоприятных условиях (например, небольшие внутрижелудочковые опухоли) на некоторых этапах возможно даже бимануальное манипулирование. Эти наши данные согласуются с данными других авторов [1—3].
Заключение. Клинический случай приведенный авторами показывает, что рутинное использование ультразвуковой интраоперационной нейровизуализации, эндоскопической техники является необходимым условием проведения нейрохирургических операций при опухолях головного мозга, особенно в детском возрасте. Очень надеемся, что данное успешное наблюдение будет стимулировать дальнейший интерес современных российских нейрохирургов к использованию малоинвазивных и, в частности, эндоскопических методов лечения, у данной тяжелой категории пациентов.
Цель работы - анализ литературы, посвященной применению эндоскопического метода при хирургическом лечении ПСС, а также представление собственного опыта применения данной методики на конкретном клиническом примере с катамнезом наблюдения за пациентом 22 мес.
Клинический пример
Ребенок З., 8 мес жизни, находился на стационарном лечении в отделении нейрохирургии детского возраста ФГБУ «ФЦН» (Тюмень) с 01.08.11 по 15.08.11. За 4,5 мес до поступления в клинику в возрасте 3,5 мес при проведении ультразвукового исследования головного мозга заподозрено наличие в правом боковом желудочке объемного образования размером до 3 мм. 12.04.11 выполнена компьютерная томография (КТ) головного мозга, заключение: сосудистая мальформация хориоидального сплетения справа, объемное образование? Внутренняя открытая гидроцефалия. При неврологическом осмотре от 20.04.11 отмечено существенное увеличение окружности головы - до 47,5 см (+12,5 см). В этот период возникли жалобы на регресс ранее приобретенных навыков. 22.04.11 из-за прогрессирующей внутренней гидроцефалии выполнено вентрикулоперитонеальное шунтирование (ВПШ) слева с положительной динамикой в виде уменьшения явлений гипертензионно-гидроцефального синдрома. 27.07.11 осуществлена ревизия ВПШ. После операции состояние с положительной динамикой.
Для определения дальнейшей тактики ребенок направлен в ФГБУ «ФЦН» Тюмени. При поступлении в клинику жалобы (со слов мамы ребенка), что ребенок не удерживает голову, не сидит, не поворачивается, плохо глотает, высокий мышечный тонус в конечностях. Соматически ребенок компенсирован. Окружность головы 51 см, большой родничок напряжен. В ясном сознании, зрение снижено до различения свет-тень, рефлексы фиксации взора и слежения отсутствуют. Спонтанные содружественные движения глазных яблок. Псевдобульбарные нарушения в виде рефлексов орального автоматизма, дисфагии, дисфонии, мышечный гипертонус флексоров верхних конечностей, экстензоров и аддукторов нижних конечностей, пассивные и активные движения конечностей ограничены из-за высокого мышечного тонуса, сухожильные рефлексы с верхних и нижних конечностей спастичные D=S. Болевая защитная реакция в виде генерализованного возбуждения с непостоянным защитным сгибанием конечностей без локализации раздражителя. Менингеальных знаков нет.
На офтальмоскопии выявлены застойные явления на глазном дне справа и слева. По данным магнитно-резонансной томографии (МРТ) головного и спинного мозга с внутривенным контрастированием в последовательности MPRAGE, толщиной среза 1 мм на фоне выраженной внутренней гидроцефалии в заднем роге правого бокового желудочка выявлен опухолевый узел в виде «цветной капусты» на сосудистой ножке, размером 33×20×24 мм, гипоплазия червя мозжечка, mega cisterna magna, которая широко сообщается с IV желудочком (вариант мальформации Денди-Уокера) (рис. 1).
Рисунок 1. Данные МРТ головного мозга с внутривенным контрастированием до проведения операции. а - сагиттальный срез: 1 - mega cisterna magna, сообщающаяся с IV желудочком (вариант мальформации Денди-Уокера). Отмечается гипоплазия червя мозжечка; б - аксиальный срез: 2 - опухолевый узел в виде «цветной капусты» на сосудистой ножке, расположенный в заднем роге правого бокового желудочка, на фоне выраженной внутренней гидроцефалии; в - сагиттальный срез: 3 - сосудистая ножка опухоли. В анализе ликвора (пункция помпы ВПШ) цитоз 13 клеток (лимфоцитов 8, нейтрофилов 5), белок 0,62 г/л, хлор 116 ммоль/л, глюкоза 3,25 ммоль/л. Для дополнительной визуализации сосудистой ножки опухоли выполнена КТ с ангиографией и 3D-реконструкцией (рис. 2). Рисунок 2. Данные КТ ангиографии с 3D-реконструкцией. а - вид спереди: 1 - опухоль; б - вид сверху: 2 - сосудистая ножка опухоли (венозный компонент которой формируется из таламостриарной вены), 3 - таламостриарная вена; в - вид сбоку: 1 - опухоль расположенная в заднем роге бокового желудочка, 2 - сосудистая ножка опухоли. 05.08.11 проведена операция: эндоскопическое тотальное удаление хориоидпапилломы правого бокового желудочка. Клипирование сосудистой ножки опухоли. Проба Арендта. Удаление ВПШ (хирург - д.м.н., проф. А.А. Суфианов). Операция выполнена в положении ребенка на спине с мягкой фиксацией головы в раме DORO (PMI, Германия). Использовался комплект для эндоскопических операций на головном мозге (Gaab KARL STORZ, Германия), оптика HOPKINS II Karl Storz (0°, 30°, 45°). Выполнен операционный доступ парасагиттально справа в теменной области через фрезевое отверстие. Через нейроэндоскоп визуализирована опухоль, расположенная в заднем роге бокового желудочка, и ее сосудистая ножка. Сформирован второй операционный доступ в теменной области справа, введен дополнительный эндоскопический порт 6 мм («Johnson&Johnson», XCEL ENDOPATH) (рис. 3). Рисунок 3. Начальный этап операции - установка эндоскопических портов. 1 - дополнительный эндоскопический порт для микроинструментов; 2 - основной эндоскопический порт нейроэндоскопа. С помощью биполярной коагуляции проведено выделение сосудистой ножки для клипирования. Эндоскопическим клипатором сосудистая ножка клипирована титановыми клипсами и пересечена. Опухоль удалена кускованием через дополнительный эндоскопический порт (рис. 4). Рисунок 4. Основные этапы эндоскопического бипортального удаления хориоидпапилломы. а - основные анатомические интравентрикулярные ориентиры в теле желудочка: 1 - отверстие Монро, 2 - таламостриарная вена, 3 - таламус; б - основные анатомические интравентрикулярные ориентиры в заднем роге бокового желудочка: 4 - сосудистая ножка опухоли, 5 - область треугольника заднего рога бокового желудочка, 6 - височный рог; в - общий вид опухоли (7). Стрелками обозначены визуализированные при вентрикулоскопии микрокальцинаты в опухоли; г - сосудистая ножка опухоли: 8 - венозный компонент, 9 - артериальный компонент; д - этап введения дополнительного эндоскопического порта и его расположение по отношению к опухоли: 10 - эндоскопический порт, 11 - опухоль; е - коагуляция мелких сосудов в структуре сосудистой ножки опухоли: 12 - эндоскопический коагулятор, 13 - след от коагуляции сосудов; ж - частичная диссекция сосудистой ножки опухоли: 14 - микродиссектор; з - после микродиссекции введен эндоскопический клипатор с несъемными клипсами (15); и - этап наложения клипсы (16) на сосудистую ножку; к - клипированная сосудистая ножка; л - пересечение клипированной сосудистой ножки микроножницами (17); м - клипса на культе сосудистой ножки. Кровопотеря составила 10 мл, большая часть которой приходилась на кожные разрезы. После проведения пробы Арендта (положительная) ВПШ удален. Послеоперационный период протекал удовлетворительно. После операции проведена КТ головы, данных о кровоизлиянии нет. На контрольной МРТ и КТ с 3D-реконструкцией черепа с внутривенным контрастированием состояние после тотального удаления опухоли сосудистого сплетения правого бокового желудочка, сосудистая ножка клипирована. Открытая внутренняя гидроцефалия прежних размеров (рис. 5). Рисунок 5. Данные МРТ головного мозга и КТ-ангиографии с 3D-реконструкцией после операции. а - аксиальный срез МРТ, опухоль тотально удалена: 1 - артефакт от сосудистой клипсы; б - сагиттальный срез МРТ. Обозначение то же, что и на рис. а; в - вид спереди, опухоль тотально удалена: 2 - место расположения опухоли до ее удаления.
На момент выписки из отделения на 10-е сутки после операции ребенок в сознании, двигательная активность минимальная: выполняет сгибание-разгибание конечностей, мышечный тонус в конечностях повышен, сухожильные рефлексы с верхних и нижних конечностей спастичные, с мелким клонусом. Аппетит улучшился, окружность головы уменьшилась на 2 см. Существенно уменьшились явления пирамидной недостаточности, сохранились глазодвигательные и зрительные нарушения. Послеоперационные раны зажили первичным натяжением (рис. 6).
Рисунок 6. Данные КТ с 3D-реконструкцией черепа и фотография черепа ребенка. а - 3D-реконструкция черепа: 1 - трефинационные отверстия. Обозначен их диаметр; б - фотография черепа ребенка: 2 - послеоперационные раны. Срок наблюдения за ребенком составил 22 мес. За весь период наблюдения гидроцефалия не прогрессировала. Данных о продолженном росте опухоли не было (рис. 7). Рисунок 7. Данные нейровизуализации при динамическом наблюдении. а-в - МРТ головного мозга через 10 мес после удаления опухоли; г - КТ головы через 22 мес после удаления опухоли. В заднем роге правого бокового желудочка визуализируется сосудистая клипса. Гидроцефалия без нарастания.
Результаты и обсуждение
На первый год жизни приходится от 14 [20] до 12,8% опухолей сосудистого сплетения [23]. По данным K. Laurence [30], 75% всех опухолей сосудистого сплетения возникают в первые 10 лет жизни ребенка, а 70-90% этих опухолей приходится на детей в возрасте до 2 лет [8, 32, 38].
Наиболее частой локализацией опухоли у взрослых и детей является боковой желудочек (50%). Также в 40% случаев она может располагаться в IV желудочке, в 5% находится в III желудочке [3]. Оставшиеся 5% опухолей могут локализоваться в самых различных областях, включая мостомозжечковый угол, супраселлярную область, лобную долю, заднюю спайку, пинельную область, мозжечок [29]. Супратенториальное расположение в основном превалирует у детей раннего возраста [47]. Инфратенториальная локализация чаще встречается у взрослых [16, 39, 45]. ПCC в очень редких случаях имеют агрессивное течение и склонность к инфильтративному росту, распространению в паренхиму головного мозга, появлению атипии строения ворсинок сплетения в месте инвазии [32, 42].
Наиболее частым и характерным симптомом при хориоидпапилломе является гидроцефалия и повышение внутричерепного давления [16, 29]. По данным R. Humphreys и соавт. [25], гидроцефалия встречается в 78% случаев, по R. Ellenbogen и соавт. [15] - в 95% случаев. В 80% случаев вентрикуломегалия развивается без явлений обструкции путей ликвороциркуляции. Развитие гидроцефалии в данном случае является следствием гиперпродукции ликвора гипертрофированным сосудистым сплетением или сопутствующим нарушением резорбции ликвора [11, 14]. Иногда удаление образования сопровождается регрессом гидроцефалии, но она может сохраняться даже после успешного удаления опухоли [21]. Установка шунта требуется до 50% пациентов [12, 38].
Поскольку хориоидпапиллома всегда имеет интенсивное кровоснабжение, то при введении контраста отмечается ее выраженное контрастирование. Кальцификация опухоли происходит в 25% поражений, но редко встречается у детей [1, 33]. Хотя, по данным K. Koeller и G. Sandberg [29], кальцификация присутствует в 14% случаев по результатам КТ-исследований.
J. Wolff и соавт. [47] отмечают, что показатели 1, 5 и 10-летней выживаемости при ПСС составляют соответственно 90, 81 и 77%.
Следует подчеркнуть, что до настоящего времени бипортальные доступы не являются общепринятыми в нейрохирургии. На сегодняшний день существует немного работ, где упоминается об использовании двух эндоскопических портов при интравентрикулярной нейрохирургии. В качестве примера можно привести работу F. Veto и соавт. [46]. Авторы применили данный способ при хирургическом лечении 3 больных с опухолями III желудочка с окклюзией водопровода, развитием гидроцефалии и пришли к выводу об эффективности данного подхода. Мультипортальный подход (более двух портов) подробно разработан и широко внедрен в клиническую практику российским автором в 2000 г. [2]. Мультипортальный принцип подразумевает создание большего, а именно необходимого количества портов при эндоскопической операции с целью достижения наиболее безопасного, минимально инвазивного и максимально радикального вмешательства. Наш опыт позволяет высказаться о преимуществах мультипортального подхода в эндоскопической нейрохирургии, особенно в тяжелых случаях. В такой ситуации мультипортальность позволяет использовать необходимое количество инструментов, визуально контролировать ситуацию практически во всех отделах желудочка головного мозга и под разными углами зрения (например, в противоположном желудочке), а также панорамно визуализировать кончик микроинструмента относительно структур головного мозга с любым увеличением и максимальной освещенностью. Например, это особенно важно при проведении эндоскопа через узкое отверстие Монро. Использование портов одинакового диаметра важно для обеспечения возможности проведения любого инструмента через любой порт. Все это значительно снижает риск и резко повышает возможности оперативного вмешательства. При отдельных благоприятных условиях (например, небольшие внутрижелудочковые опухоли) на некоторых этапах возможно даже бимануальное манипулирование. Наши суждения согласуются с данными других авторов [18, 35, 46].
Заключение
Несмотря на то что хориоидпапиллома встречается относительно редко в общей структуре интракраниальных опухолей центральной нервной системы, следует признать актуальность и необходимость изучения данной патологии, что особенно важно для нейрохирургии детского возраста. На сегодняшний день очень мало работ, посвященных данной проблеме, в которых освещены вопросы, касающиеся особенностей хирургической тактики в отношении ППС. Данная опухоль наиболее часто встречается в детской практике, где выбор и использование наиболее малоинвазивных способов лечения являются жизненно необходимыми и актуальными.
Приведенный клинический случай наглядно демонстрирует использование малоинвазивной методики (на примере бипортального эндоскопического тотального удаления ПСС) при удалении внутрижелудочковой опухоли у ребенка.
Комментарий
Статья профессора А.А. Суфианова и соавт. «Эндоскопическое бипортальное удаление хориоидпапилломы бокового желудочка у ребенка»: примечательна прежде всего тем, что авторы демонстрируют успешное применение минимально инвазивных методик - бипортального эндоскопического удаления - в детской нейроонкологии. В публикации справедливо отмечено, что в зарубежной литературе описаны методики микрохирургического удаления опухоли с эндоскопической ассистенцией, есть публикации эндоскопического удаления коллоидных кист, небольших доброкачественных опухолей желудочковой системы, однако публикаций бипортального или мультипортального нейроэндоскопического удаления крайне мало. Как следствие, показания и противопоказания к применению данной методики являются предметом оживленной дискуссии.
Наш опыт применения эндоскопии (более 80 наблюдений) в детской нейроонкологии позволяет высказать предположение, что ограничением применения данной методики являются размеры опухоли и степень ее кровоснабженности/злокачественности. В приведенном наблюдении продемонстрирован случай папилломы сосудистого сплетения с хорошо визуализируемой питающей опухоль длинной сосудистой ножкой. Известно, что ПСС является доброкачественной опухолью и ее удаление не сопровождается кровотечением, до повреждения питающих артерий. Поэтому первостепенной задачей хирурга, планирующего операцию, является идентификация питающего опухоль сосуда с помощью современных методов нейровизуализации (НСГ, КТ, МРТ), что в наблюдении и было успешно сделано. Бимануальный эндоскопический доступ, безусловно, создает хирургу более комфортные условия для манипуляций и контроля в операционной ране. Авторы наглядно продемонстрировали возможности и технику применения данной методики.
Еще одной проблемой в хирургии ПСС у грудных детей являются ликвородинамические нарушения в послеоперационном периоде - прогрессирующая гидроцефалия, напряженные субдуральные скопления (от 28 до 75%). В современной литературе для профилактики данных осложнений некоторые авторы рекомендуют предоперационную эмболизацию питающих опухоль афферентов. Однако учитывая малый калибр афферентов у грудных детей не всегда возможно провести их суперселлективную катетеризацию. Еще одним минусом является риск эмболизации конечных ветвей передней хориоидальной артерии, а также сомнительный экономический эффект. По нашим данным, так же как и по данным авторов статьи, маленькая кортикотомия и отсутствие кровотечения в ложе удаленной опухоли минимизируют риск развития ликвородинамических нарушений в послеоперационном периоде.
В заключение можно поздравить авторов с успешным применением бипортальной нейроэндоскопической техники в детской нейроонкологии. Данное наблюдение, несомненно, вызовет интерес как российских, так и зарубежных нейрохирургов.
Аномальная форма сосудистых сплетений боковых желудочков - новый ультразвуковой маркер открытых дефектов позвоночника плода в I триместре
1 Дагестанский государственный медицинский университет, Махачкала.
2 Кабинет частной ультразвуковой практики «СОНО», Махачкала.
УЗИ сканер RS80
Эталон новых стандартов! Беспрецедентная четкость, разрешение, сверхбыстрая обработка данных, а также исчерпывающий набор современных ультразвуковых технологий для решения самых сложных задач диагностики.
Введение
Сосудистые сплетения (СС) боковых желудочков занимают наибольший объем головного мозга плода и являются элементами обязательной оценки при ультразвуковом скрининге в 11-14 нед беременности [1, 2]. В то же время количество работ, посвященных исследованию СС, относительно небольшое. М.В. Медведев и Н.А. Алтынник [2] в 2002 г. для описания нормальной картины СС боковых желудочков на аксиальном срезе в сроки 11-14 нед применили термин «бабочка». В дальнейшем W. Sepulveda и соавт. [3] дали описательную характеристику этой картине, подчеркнув, что картину, аналогичную крыльям бабочки, создает сужение в средних отделах СС. T. Loureiro и соавт. [4] отметили, что в I триместре эта форма СС всегда отмечается на аксиальном срезе головного мозга плода на уровне крыши III желудочка. R.S. Abu-Rustum и соавт. [5] разработали значения длины, окружности и площади СС в 11-13 нед беременности и показали некоторую степень асимметричности.
Также немногочисленными являются публикации, посвященные нарушениям СС боковых желудочков при различных аномалиях. Так, отсутствие признака «бабочки» СС было отмечено авторами как признак голопрозэнцефалии, акрании [3, 6]. В другом исследовании было выявлено, что соотношение площади СС и площади бокового желудочка было ниже 5-й процентили у 32% плодов с трисомией 18 и у 86% с трисомией 13 [7].
R. Chaoui и соавт. [8] в 2020 г. предложили оценку размеров СС боковых желудочков мозга относительно размеров головы плода в качестве нового маркера ультразвукового скрининга открытого дефекта позвоночника (ОДП) плода в 11-14 нед беременности. В англоязычной литературе эта работа является первым обращением к оценке СС как к маркеру ОДП плода в I триместре, и других работ, посвященных оценке формы СС как маркера ОДП, мы не нашли.
На нарушение формы «бабочки» СС боковых желудочков в случае менингоцеле в поясничном отделе позвоночника плода при ультразвуковой диагностике в 14 нед беременности нами было обращено внимание еще в 2007 г. [9]. В публикации было показано, что СС боковых желудочков, в отличие от нормальной картины «бабочки», были вытянутой формы c уплощением их латерального контура. Кроме того, в этом исследовании было подчеркнуто, что «именно нарушение формы сосудистых сплетений - уплощенность их контуров - и явилось пусковым моментом диагностического алгоритма в нашем наблюдении», в результате которого был обнаружен ОДП.
Как показывает опыт последних 20 лет, что было нами подробно отражено в обзоре литературы, основным подходом для выявления плодов с ОДП в сроки первого ультразвукового скрининга является оценка церебральных маркеров этой патологии [10]. В то же время неоднозначность результатов использования практически всех рекомендованных маркеров ОДП показывает, что эта тема еще требует продолжения исследований.
В 2020 г. мы опубликовали 17 случаев ретроспективной ультразвуковой пренатальной диагностики ОДП плода в ранние сроки, где показали нарушение картины СС при этой патологии [11]. В последние два года доказательством такой картины явились 5 наблюдений, выявленных нами в результате проспективного исследования, что и хотим представить в данной публикации.
Целью данного исследования явилось представление нарушения картины СС у плодов с ОДП в сроки первого эхографического скрининга.
Материал и методы
В течение 2011-2020 гг. нами проведено около 13 000 УЗИ в сроки 11-13,6 нед беременности с оценкой маркеров хромосомных аномалий, согласно рекомендациям Фонда медицины плода (Великобритания), и расширенной оценкой анатомии плода [1, 12]. Все исследования проведены М.А. Эсетовым, который является обладателем сертификата Фонда медицины плода с 2007 г.
Всего нами было диагностировано в указанный период 27 случаев spina bifida в сроки первого ультразвукового скрининга. После исключения случаев с закрытой формой, с гидроцефалией, порэнцефалией и одного случая с некачественной эхографической картиной у 17 плодов была проведена ретроспективная и еще у 5 проспективная оценка картины СС боковых желудочков головного мозга.
Возраст пациенток был в среднем 27 лет с пределом колебаний от 19 лет до 41 года. Анамнез у 2 пациенток был отягощен рождением детей с пороками развития нервной трубки (по одному случаю - черепно-мозговая и спинномозговая грыжи).
Сроки беременности в нашем исследовании составили 11-12 нед в 3 случаях, 12-13 нед в 13 и 13-14 нед в 6 случаях.
Контрольную группу составили беременные, проходившие ультразвуковой скрининг I триместра в 11 - 13 нед + 6 дней и родившие здорового доношенного ребенка.
УЗИ проводилось как в качестве первичного скринингового, так и для уточнения диагноза при направлении пациенток с различными проблемами. Использовались современные приборы с конвексным (2-5 МГц) и трансвагинальным (6-9 МГц) датчиками. Основным методом исследования было трансабдоминальное УЗИ. При затрудненном исследовании, при неясности картины или при получении аномальной картины выполнялось трансвагинальное УЗИ. Во всех случаях проводилось архивирование объемных изображений аксиального среза головного мозга плода на уровне таламуса и мезэнцефалона. Применялись методики трехмерного реконструирования изображения, объемного контрастного изображения (VCI) и мультиплоскостного анализа (TUI).
Согласно рекомендациям СС, T. Loureiro и соавт. [4] для стандартизации аксиальных срезов головного мозга проводилась коррекция изображения в трехмерном режиме для получения вертикального среднесагиттального среза (рис. 1). Ориентиром вертикальности при этом является нахождение на одной оси крыши III желудочка и I позвонка на плоскости С (см. рис. 1, плоскость С). При такой ориентации на аксиальном срезе на уровне крыши III желудочка СС боковых желудочков отражаются в виде «бабочки» (см. рис. 1, плоскость А). По аналогии с крыльями бабочки эта картина в норме предполагает превалирование расстояния между затылочными порциями СС над расстоянием между лобными порциями и характерное сужение (талия) по середине латерального контура СС.
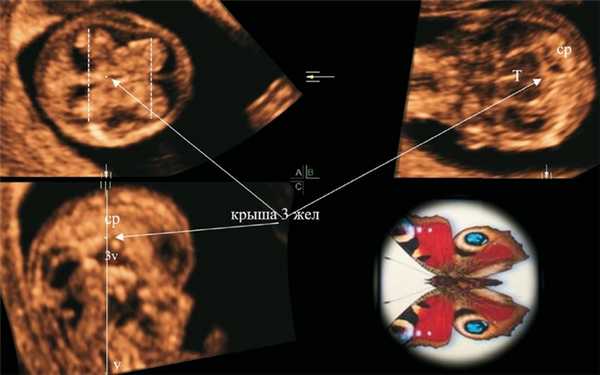
Рис. 1. Ультразвуковая трехмерная реконструкция головного мозга плода в 12 нед + 2 дня. Референсная точка на уровне крыши III желудочка.
На плоскости С отображен вертикальный сагиттальный срез (крыша III желудочка и шейный отдел позвоночника на одной вертикальной оси), на плоскости А - аксиальный срез на уровне крыши III желудочка и признак «бабочки» сосудистых сплетений; ср - сосудистые сплетения боковых желудочков, v - позвоночник, 3v - III желудочек, Т - таламус.
На рис. 2 отображена нормальная картина головного мозга на трех стандартных уровнях аксиального среза у плода в 12 нед + 2 дня (копчико-теменной размер (КТР) 57,4 мм; бипариетальный размер (БПР) 19,5 мм), полученная в мультиплоскостном режиме.
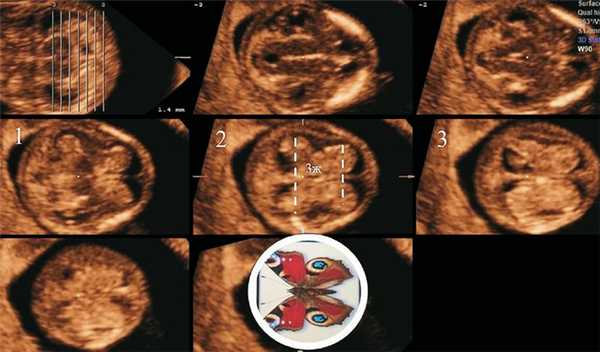
Рис. 2. В режиме TUI отображена ультразвуковая картина трех стандартных аксиальных срезов головного мозга плода в 12 нед + 2 дня.
1 - трансталамический; 2 - на уровне крыши III желудочка; 3 - трансвентрикулярный. Эти срезы показывают, что картину «бабочки» можно получить только на уровне крыши III желудочка (3ж).
На этом рисунке видно, что СС имеют картину «бабочки» только на уровне крыши III желудочка. При подъеме уровня исследования выше на трансвентрикулярном срезе контур СС выравнивается, и они занимают практически все внутричерепное пространство.
Оценку СС в нашей работе мы проводили визуально (есть или нет правильная картина «бабочки») без проведения измерений параметров. На рис. 3 показан ряд нормальных картин «бабочки» СС боковых желудочков головного мозга плода, полученных при двухмерном ультразвуковом сканировании, в 12-13 нед беременности.
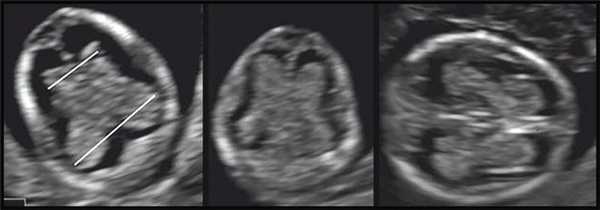
Рис. 3. Отображен ряд нормальных картин «бабочки» СС боковых желудочков головного мозга плода, полученных при двухмерном ультразвуковом сканировании, в 12-13 нед беременности.
Исследование позвоночника плода проводилось в трех стандартных срезах. Диагноз ОДП плода во всех случаях подтверждался прямой трансвагинальной визуализацией нарушения позвоночника.
В 26 выявленных нами случаях патологий позвоночника беременности были прерваны по решению родителей. Еще в одном случае семья приняла решение прервать беременность после повторной постановки диагноза в 19 нед.
Патоморфологическое и цитогенетическое исследования не проводились в связи с отсутствием технических возможностей.
Результаты
В группу исследования было включено 22 плода с ОДП, диагностированным в I триместре беременности. При этом в 13 случаях это было первичное выявление, а в остальных 9 случаях пациентки с подозрением на патологию позвоночника плода были направлены в наш кабинет для уточнения диагноза.
На момент исследования КТР составил в среднем 61,4 мм (в пределах 46,3-80,6 мм). На рис. 4 представлены полученные картины СС на стандартном аксиальном срезе на уровне крыши III желудочка во всех исследованных случаях. Отдельно показаны 5 случаев проспективной оценки картины СС боковых желудочков при ОДП плода. Данные КТР и БПР головы плода приведены соответственно для каждого случая на этом же рисунке.
У всех плодов с ОДП при эхографии структур головного мозга было отмечено отсутствие типичной картины «бабочки» СС независимо от уровня их исследования.
Объединяющими характеристиками картины СС при этом были
- Уплощенный (или с некоторой выпуклостью) латеральный контур сплетений с отсутствием характерной для «бабочки» талии посередине.
- Практически одинаковое расстояние между затылочными и лобными порциями.
- Отсутствие картины крыши III желудочка.
По аналогии сравнения нормальной картины СС с «бабочкой» полученные нами характеристики картины СС у плодов с ОДП вызвали у нас ассоциацию с различной формой хитиновых оболочек «тараканов» (см. рис. 4).
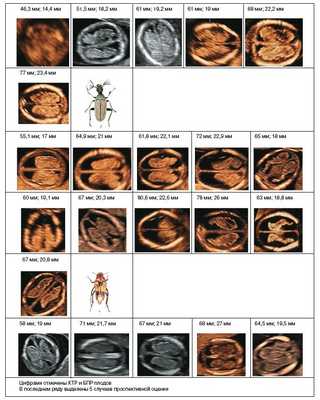
Рис. 4. Отображена эхографическая картина аксиального среза СС на уровне крыши III желудочка у всех плодов с ОДП, диагностированными нами в 11-14 нед беременности.
Приведена аналогия с хитиновыми оболочками «тараканов». В последнем ряду показаны случаи проспективной оценки СС при ОДП. В каждом случае приведены копчико-теменной и бипариетальный размеры плода соответственно.
Как видно на обзорном рис. 4, результаты нашей работы показали, что площадь СС боковых желудочков относительно общей площади головного мозга является различной - у 16 плодов они практически заполняют весь объем черепа, у остальных являются уменьшенными.
В исследовании R. Chaoui и соавт. [8] показано увеличение соотношения размеров СС относительно размеров головы в большинстве случаев ОДП плода при УЗИ в 11-13 нед. В результате этого, по мнению авторов, на трансвентрикулярном аксиальном срезе СС практически полностью заполняют полость черепа, давая картину «dry brain» («сухой мозг». - Пер. М.А. Эсетова).
Наиболее вероятной причиной этого явления предполагается уменьшение БПР и площади боковых желудочков вследствие транзиторного уменьшения количества спинномозговой жидкости (СМЖ) из-за утечки при ОДП плода [13]. В других исследованиях при этой патологии описано уменьшение практически всей желудочковой системы (площади боковых желудочков, диаметра крыши III желудочка, сильвиева водопровода и VI желудочка) головного мозга плода [7, 14, 15]. Кроме того, считается, что такое уменьшение СМЖ может приводить к компрессии боковых желудочков костями черепа.
Эти рассуждения могут служить теоретической основой для объяснения полученной нами аномальной эхографической картины СС у плодов с ОДП. Утечка СМЖ при ОДП с уменьшением БПР и площади боковых желудочков, следовательно, и приводит к уплощению контура и вытянутости СС, что и было показано в нашем исследовании практически у всех плодов с ОДП.
В своей работе R. Chaoui и соавт. [8] представили, что у 88% плодов с ОДП СС боковых желудочков занимают практически площадь всей полости черепа, создавая картину «сухого мозга». По результатам нашего исследования подобная картина была отмечена у 16 (73%) плодов. В остальных случаях площадь СС при ОДП визуально была меньше относительно площади полости черепа.
Одним из возможных объяснений б ольшего числа случаев с уменьшенной площадью СС при ОДП в нашем исследовании может быть попадание большего процента плодов с аномалиями кариотипа (у нас не было возможности оценить это, так как цитогенетическое исследование в анализируемой группе не проводилось). T. Loureiro и соавт. [7] в 2012 г. выявили уменьшение соотношения площади СС и площади боковых желудочков в результате увеличения количества СМЖ при трисомиях 18 и 13 у 86 и 32% плодов соответственно.
Другой причиной различия результатов оценки площади СС может быть получение аксиальных срезов головного мозга на различных уровнях (рис. 5). Так, мы оценивали СС на уровне крыши III желудочка с коррекцией вертикальности среднесагиттального среза, так как только при таком подходе возможно получение признака «бабочки», тогда как в работе R. Chaoui и соавт. [8] для оценки СС использован трансвентрикулярный срез. Как видно на рис. 5, на трансвентрикулярном срезе можно получить различную картину СС в зависимости от проведения исследования на строго аксиальном срезе или с выведением максимального продольного размера боковых желудочков. Эта ситуация может быть связана с тем, что в I триместре нет описанных четких ориентиров для стандартизации аксиального трансвентрикулярного среза [1].
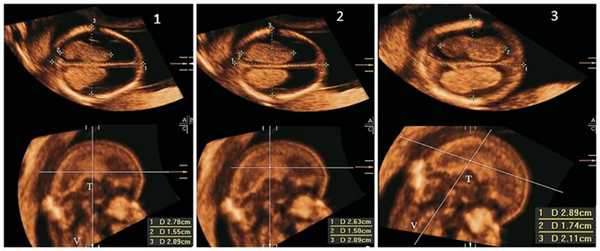
Рис. 5. Отображена различная картина СС боковых желудочков у плода с ОДП в зависимости от уровня и ориентации исследования.
1 - аксиальный срез на уровне крыши III желудочка при вертикальной ориентации; 2 - аксиальный трансвентрикулярный срез при вертикальной ориентации; 3 - косой трансвентрикулярный срез (наклон головы кпереди примерно до 30°) по максимально продольному размеру СС.
Изучение аксиального сечения головы плода с изображением «бабочки» СС является обязательной частью ультразвукового скрининга в 11-14 нед беременности. В связи с этим является логичной необходимость оценки корректности получаемого признака «бабочки». Ранее приводились данные о нарушении картины «бабочки» при голопрозэнцефалии и акрании [3, 6], но это патологии с нарушением анатомической целостности СС, тогда как у плодов с ОДП целостность СС сохранена, и при этом наше исследование во всех случаях показало их аномальную картину. Показанное нами уплощение формы СС с отсутствием характерного сужения по латеральному контуру больше напоминает форму хитиновых оболочек «тараканов» в противовес типичной картине «бабочки» в норме. Является ли правильным проводить аналогию с представителями таких насекомых, которые могут вызывать неприятные ассоциации, - это вопрос этики. И в некоторое оправдание можно привести факт, что эта аналогия применена по отношению к патологии.
Сильными сторонами нашего исследования является то, что, во-первых, описанный нами признак выявлен у всех плодов с ОДП в нашем исследовании и отсутствует в норме, включая 5 случаев проспективной оценки; во-вторых, представлен маркер ОДП, оцениваемый на стандартном обязательном эхографическом аксиальном срезе головного мозга плода на этапе первого скрининга, и, в-третьих, оценка проводится только визуально без проведения дополнительных измерений и не зависит от гестационного срока.
Слабыми сторонами данного исследования можно считать относительно небольшое количество исследованных плодов и отсутствие цитогенетического исследования. Возможность влияния различных генетических нарушений на форму СС требует дополнительной оценки.
Наше исследование показало в 100% случаев аномальную форму СС боковых желудочков у плодов с ОДП при УЗИ в сроки беременности от 11 нед + 4 дня до 14 нед. Мы считаем, что полученные нами результаты позволяют предложить нарушение формы «бабочки» СС боковых желудочков головного мозга как скрининговый эхографический маркер ОДП плода в I триместре, так как оценка их проводится на стандартном скрининговом срезе, не требует дополнительных измерений и дополнительных затрат времени.
В то же время до проведения широких проспективных исследований для оценки эффективности представленной картины СС для скрининга ОДП плода в сроки первого ультразвукового скрининга это следует рассматривать как маркер, требующий более углубленного исследования позвоночника.
Литература
Читайте также:
- Клиническое обследование пациента в гематологии: сбор анамнеза, объективный осмотр
- Оксигенотерапия. Техника оксигенотерапии.
- Добавочный центр оссификации лодыжки голеностопного сустава на рентгенограмме
- Причины неправильного прикуса, лечение и диагностика
- Социальные факторы инфаркта миокарда. Стресс и депрессия как причина инфаркта миокарда
