УЗИ, МРТ при туберозном склерозе у плода
Добавил пользователь Skiper Обновлено: 28.01.2026
1) ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России, Москва, Россия;
2) ФГБУ «Национальный медицинский исследовательский центр сердечно-сосудистой хирургии им. А.Н. Бакулева» Минздрава России, Москва, Россия
Цель. Совершенствование эффективности антенатальной эхографической и молекулярно-генетической диагностики туберозного склероза.
Материалы и методы. Проанализированы 13 случаев антенатального выявления рабдомиомы сердца в сроки от 20 до 36 недель у беременных, проходивших перинатальный консилиум в ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» в период с октября 2017 по март 2020 гг. Всем плодам проводилась нейросонография с целью обнаружения патологии головного мозга, ассоциированной с туберозным склерозом. В 9 случаях получены клинические данные о состоянии рожденных детей и результаты молекулярно-генетического исследования на обнаружение мутации в генах TSC1 и TSC2.
Результаты. В 69% случаев первичная эхографическая визуализация рабдомиомы приходилась на период III триместра. У половины плодов с множественными рабдомиомами сердца (5/10) при эхографии были обнаружены множественные подкорковые туберы головного мозга. При катамнестическом анализе у 6 детей с множественными рабдомиомами сердца выявлены субкортикальные и субэпендимальные туберы и мутации в генах TSC1 и TSC2.
Заключение. Эхографическое выявление туберов в головном мозге у плодов с множественными рабдомиомами сердца значительно повышает риск наличия туберозного склероза. Для ранней диагностики туберозного склероза необходим поиск новых эхографических маркеров, в том числе патологии головного мозга до начала процессов сулькации.
Туберозный склероз (ТС), или болезнь Бурневилля, - полисистемное, генетически детерминированное заболевание, при котором доброкачественные опухоли (гамартомы) выявляются в различных органах, включая головной мозг, глаза, кожу, сердце, почки и печень. Данное заболевание впервые описано von Recklinghausen в 1862 г. [1]. Частота ТС в популяции составляет 1:10 000, у новорожденных - 1:6000 [2, 3]. Болезнь наследуется по аутосомно-доминантному типу. Примерно две трети случаев вызваны новыми мутациями в генах TSC1 и TSC2, в остальных случаях болезнь связана с отягощенной наследственностью. Неврологические проявления заболевания включают в себя эпилепсию, аутизм, когнитивные и поведенческие дисфункции.
Так как ТС является врожденным заболеванием, именно антенатальная ультразвуковая диагностика является первичным звеном, определяющим дальнейшую тактику ведения пациентки с подозрением на данное заболевание у плода. В неврологической практике широко используемые первичные (большие: гипопигментированные пятна, ангиофибромы или бляшки на голове, ногтевые фибромы и проч.) и вторичные (малые: пятна типа конфетти на коже, дефекты эмали зубов, фибромы полости рта и проч.) клинические критерии для постановки диагноза ТС (Международная Согласительная (Консенсусная) конференция, 2012) не могут быть в полной мере применимы для исключения данного заболевания антенатально. Ввиду специфичности признаков и поздней их манифестации ТС может быть заподозрен в случае обнаружения у плода опухоли сердца - рабдомиомы, визуализация которой при ультразвуковом исследовании в большинстве случаев возможна после 24 недель беременности [4]. Рабдомиомы, располагаясь в различных полостях сердца, могут быть как единичными (10% случаев), так и множественными (90% случаев) [4]. По данным литературных источников, при наличии единичной рабдомиомы ТС выявляется в 50% случаев, в то время как выявление множественных рабдомиом увеличивает риск заболевания практически до 100% 6.
В большинстве случаев изолированная рабдомиома, подвергаясь спонтанному регрессу после рождения, сама по себе имеет благоприятный исход [6, 7]. В связи с этим ключевым прогностическим критерием при обнаружении опухоли сердца может служить выявление признаков вовлечения в патологический процесс других органов плода, а обнаружение специфических очагов в головном мозге может определять тяжесть неврологического статуса после рождения.
Поражение головного мозга при ТС характеризуется аномальной пролиферацией нейронов и глии с последующим формированием в паренхиме туберов, субэпендимальных узлов, гигантоклеточной астроцитомы в сочетании с нарушением процессов миграции и дифференциации. Имеются данные, свидетельствующие о том, что количество кортикальных туберов, их размер и объем связаны с тяжестью церебральной дисфункции 11. Более того, с возрастом у пациентов на фоне регресса рабдомиом может отмечаться прогрессирование количества и размеров туберов. Большинство работ посвящено диагностике поражения головного мозга при ТС с помощью магнитно-резонансной томографии (МРТ) в антенатальном и постнатальном периодах. В то же время возможности нейросонографии (НСГ) плода для идентификации очагов ТС представлены в единичных зарубежных публикациях [12].
Таким образом, в связи с вышесказанным целью нашего исследования явилось совершенствование эффективности антенатальной эхографической и молекулярно-генетической диагностики ТС.
Материалы и методы
Проанализированы 13 случаев рабдомиом сердца в сроки первичного их выявления (от 20 до 36 недель) у беременных, проходивших перинатальный консилиум в ФГБУ «НМИЦ АГиП им. В.И. Кулакова» в период с октября 2017 по март 2020 гг. Гестационный срок устанавливался по данным копчико-теменного размера во время ультразвукового скрининга I триместра беременности. Всем плодам проводились расширенная двухмерная эхокардиография, детальная оценка анатомии центральной нервной системы - НСГ плода (рекомендации ISUOG, 2007) и допплерометрия с интервалом 4 недели. Ультразвуковое исследование (УЗИ) проводилось с помощью двухмерного конвексного датчика 3,5 МГц на аппарата.
Туберозный склероз
Туберозный склероз — генное заболевание, характеризующееся поражением нервной системы в виде эпилепсии и олигофрении, полиморфными кожными симптомами, опухолевыми и неопухолевыми процессами в соматических органах. Диагностический алгоритм состоит из обследования нервной системы (МРТ, КТ головного мозга, ЭЭГ), офтальмологического исследования, обследования внутренних органов (УЗИ, МРТ сердца, КТ почек, рентгенография легких, ректороманоскопия). Главными направлениями лечения являются: противоэпилептическая терапия, нейропсихологическая коррекция, наблюдение и своевременное хирургическое лечение новообразований.
МКБ-10
Общие сведения
Туберозный склероз (ТС) — наследственная нейроэктодермальная патология, проявляющаяся изменениями кожи, эпилептическими приступами, олигофренией (умственной отсталостью) и возникновением новообразований различной локализации. Наряду с нейрофиброматозом, болезнью Гиппеля-Линдау, синдромом Луи-Бар, болезнью Стерджа-Вебера и др., ТС относится к факоматозам. Заболеваемость составляет 1 случай на 30 тыс. населения, среди новорожденных — 1 случай на 6-10 тыс. Известны не только семейные, но и спорадические случаи. Причем последние составляют до 70%.
Впервые туберозный склероз был описан Реклингхаузеном в 1862 г. Француз Бурневилль в 1880 г. подробно исследовал морфологические изменения, происходящие в головном мозге при этом заболевании, и впервые употребил термин «туберозный склероз». В 1890 г. дерматолог Прингл сделал описание ангиофибром лица у пациентов с ТС. Поэтому в литературе по неврологии можно встретить синонимичное название ТС — болезнь Бурневилля-Прингла.
Причины туберозного склероза
Заболевание имеет генетическую природу. Большинство случаев обусловлено возникновением новых мутаций и лишь 30% аутосомно-доминантным наследованием генных аберраций, имеющихся у родителей. Выделяют туберозный склероз тип 1, развитие которого обусловлено мутациями в гене 34 локуса 9-й хромосомы, ответственном за кодирование гамартина, и туберозный склероз тип 2, связанный с нарушениями в 13-ом участке 16-й хромосомы, отвечающем за кодирование туберина.
Биохимические аспекты патогенеза до конца не изучены. Известно только, что в норме гамартин и туберин являются факторами подавления опухолевого роста. Морфологическим субстратом выступают разросшиеся глиальные элементы церебральной ткани, гистологически представленные гигантскими клетками с атипично увеличенными ядрами и большим числом отростков. Глиальные разрастания формируют субэпендимальные узлы, корковые туберы и специфические островки в белом веществе. Все эти образования имеют тенденцию к обызвествлению. Субэпендимальные узлы зачастую дают начало образованию гигантоклеточной астроцитомы. В 10% случаев отмечается поражение тканей мозжечка. Глиальные разрастания наблюдаются также на диске зрительного нерва и в периферических отделах сетчатки.
Симптомы туберозного склероза
Клиника, которую имеет туберозный склероз, очень вариабельна. Она включает поражение центральной нервной системы (ЦНС), дерматологические и офтальмологические проявления, новообразования внутренних органов. Дебют приходится на различные возрастные периоды, но чаще туберозный склероз манифестирует в течение первых 5-ти лет жизни. Возможны различные по тяжести варианты течения. В легких случаях пациенты имеют ряд факультативных неспецифических симптомов и зачастую не проходят диагностику на наличие ТС. Туберозный склероз в стертой форме протекает без эпиприступов, олигофрении и расстройств поведения.
Поражение ЦНС
Изменения в ЦНС выступают доминирующими проявлениями ТС. Среди них наиболее часто (в 80-90% случаев) встречается судорожный синдром, с которого обычно манифестирует заболевание. Для эписиндрома, дебютирующего на первом году жизни, характерны инфантильные спазмы (синдром Веста), затем трансформирующиеся в синдром Леннокса-Гасто. Возможны атипичные абсансы, сомато- и сенсомоторные пароксизмы, вторично-генерализованные приступы. Возникновение в возрасте до года, высокая частота и гетерогенность приступов сопровождаются их резистентностью к антиконвульсантной (противоэпилептической) терапии. Эпилептические пароксизмы являются причиной задержки психического развития и нарушений поведения (агрессивности, аутизма, СДВГ) у детей.
В половине случаев туберозный склероз сопровождается выраженной в различной степени олигофренией. Наряду с эпилепсией, причиной ее развития считается наличие корковых туберов. Уже в младшем возрасте у детей отмечается анормальное поведение: общее беспокойство, капризность и недовольство наряду с медлительностью, затруднениями переключаемости внимания. Степень этих нарушений тем выше, чем раньше возник туберозный склероз. У большинства пациентов также наблюдаются нарушения сна. Они характеризуются ночными пробуждениями, инсомнией, сомнамбулизмом, ранним утренним переходом от сна к бодрствованию.
Дерматологические симптомы
Изменения со стороны кожи сопровождают туберозный склероз практически в 100% случаев. Они характеризуются большим полиморфизмом элементов и их сочетаний. Чаще всего (в 90% случаев) наблюдаются пятна гипопигментации, которые возникают обычно в первые 3 года жизни и в дальнейшем увеличивают свое количество. Они асимметрично разбросаны по ягодицам, туловищу и на передне-латеральных поверхностях конечностей. Возможна депигментация ресниц, бровей и волос. В 14% случаев выявляются участки гиперпигментации в виде пятен, более характерных для нейрофиброматоза. Как правило, их насчитывается не более 5 штук.
Ангиофибромы лица по различным данным отмечаются у 50-90% пациентов и образуются в основном после 4-летнего возраста. Это множественные или одиночные плотные узелки в виде зерен проса, красноватого или желтоватого цвета. «Шагреневая кожа» имеет место в 21-68 % случаев. Обычно возникает в период от 10 до 20 лет. Представляет собой асимметричные участки жесткой огрубевшей кожи, локализующиеся на спине и пояснице, имеющие размер от 2-3 мм до 10 см. При дерматоскопии видно, что шагреневые участки состоят из множества фиброзных гамартом.
В 25% случаев туберозный склероз сопровождается образованием фиброзных бляшек, в 30% случаев — мягких дерматофибром. До 50% больных после пубертата имеют склонные к прогредиентному росту околоногтевые фибромы. Последние более часто располагаются на ступнях. Имеют вид тусклых красных узелков или папул, окружающих ногтевую пластинку.
Офтальмологические симптомы
Отмечаются редко, хотя почти у половины больных ТС выявляется наличие гамартом зрительного нерва и/или гамартом сетчатки. Гамартомы могут иметь плоскую гладкую, незначительно возвышающуюся поверхность или представляют собой узловатое образование, иногда встречаются гамартомы смешанного типа — узловатые в центре. Основным проявлением гамартом является прогрессирующее падение зрения, но зачастую наблюдается их субклиническое течение. Возможны и другие офтальмологические расстройства: депигментация радужки, отек диска зрительного нерва, колобома, косоглазие, ангиофибромы век, катаракта.
Поражение внутренних органов
Новообразования соматических органов, сопровождающие туберозный склероз, отличаются множественностью и частым двусторонним поражением парных органов, длительно протекают субклинически. Период их манифестации колеблется от 5 до 40 лет. К наиболее патогномоничным для ТС новообразованиям относятся: рабдомиома сердца, кисты легких, поликистоз почек, гамартомы печени, ректальные полипы. В 4,5% случаев при ТС наблюдаются злокачественные опухоли, чаще почечно-клеточный рак.
Со стороны сердечно-сосудистой системы выявляются опухоли сердца. В 30-60% случаев это рабдомиомы. При их внутриутробном развитии может наблюдаться антенатальная гибель плода. У половины новорожденных с ТС рабдомиомы выявляются случайно при выполнении ЭхоКГ. У маленьких детей они проявляются аритмией, синдромом WPW, тахикардией, фибрилляцией желудочков. Интрамуральное положение рабдомиомы влечет за собой расстройство сократимости; обтурация опухолевой массой сердечных камер приводит к сердечной недостаточности. У старших детей рабдомиомы преимущественно бессимптомны; возможна блокада ножки пучка Гиса, псевдоишемические отклонения на ЭКГ. Зачастую наблюдается регресс и даже полное исчезновение рабдомиомы к 6-летнему возрасту.
Поражение легких отмечается у пациентов, имеющих туберозный склероз, после 30 лет. На рентгенограмме определяется характерная для множественных легочных кист картина «сотового легкого». Поражение ЖКТ включает опухоли полости рта, дефекты зубной эмали, множественные или одиночные гамартомы в печени, не склонные к малигнизации полипы прямой кишки. Поражение почек сопровождают туберозный склероз в 50-85%. Могут отмечаться ангиомиолипомы, кисты, гломерулосклероз, нефрокальциноз, интерстициальный нефрит, гломерулонефрит. Патология почек выступает второй после поражения ЦНС причиной летального исхода при ТС.
Диагностика
Диагностировать туберозный склероз возможно лишь совместными усилиями нескольких специалистов (невролога, офтальмолога, дерматолога, кардиолога, нефролога) с проведением широкого аппаратного обследования пациента. Церебральная эпилептическая активность регистрируется при помощи ЭЭГ и ЭЭГ с пробами. У детей до года возможно проведение нейросонографии. Наибольшую значимость в диагностике поражений ЦНС имеют КТ и МРТ. КТ головного мозга более информативно в отношении кальцифицированных туберов и субэпендимальных узлов, а МРТ головного мозга — в выявлении некальцифицированных туберов. С целью своевременной диагностики астроцитомы детям, имеющим туберозный склероз, рекомендовано прохождение МРТ или КТ-исследования не реже чем раз в 2 года.
Проводится комплексное обследование соматических органов: ЭКГ, УЗИ и МРТ сердца, УЗИ брюшной полости, УЗИ и КТ почек, урография, обзорная рентгенография грудной клетки, ректороманоскопия, колоноскопия. Диагностика офтальмологических поражений осуществляется путем прямой и непрямой офтальмоскопии, сканирующей томографии сетчатки.
В связи с большой полиморфностью сопровождающих туберозный склероз проявлений, для установления диагноза используют диагностические критерии, разработанные в 1998 г. в Швеции. Они включают первичные, вторичные и третичные признаки. Туберозный склероз достоверен, когда имеет место 1 первичный признак в сочетании с 2 вторичными или третичными. Туберозный склероз вероятен при наличии 1 вторичного и 1 третичного или 3 третичных признаков. Окончательную точку в вопросе диагностики туберозного склероза помогает поставить генетический анализ.
Лечение туберозного склероза
Основополагающим направлением в лечении ТС является антиконвульсантная терапия, поскольку степень олигофрении и ЗПР напрямую коррелирует с частотой эпиприступов, а эпилептический статус может стать причиной смертельного исхода. Выбор препарата зависит от вида пароксизмов, при недостаточной эффективности монотерапии, назначается комбинированное лечение. При синдроме Веста применяют вигабатрин и тетракозактид. Препаратами второй очереди выступают вальпроаты. Если туберозный склероз протекает с парциальными эпиприступами, то базовой терапией считается сочетание вальпроатов с карбамазепином. При отсутствии эффекта в эту схему лечения включают ламотриджин. При генерализованных эпиприступах и парциальных пароксизмах в качестве монопрепарата и в комбинации с другими противоэпилептическими средствами могут применяться современные антиконвульсанты топирамат и леветирацетам.
Терапия олигофрении проводится преимущественно путем нейропсихологической коррекции и комплексного психологического сопровождения ребенка. Назначение ноотропов и прочих стимулирующих нейропрепаратов противопоказано из-за наличия эписиндрома. При выявлении астроцитомы проводится динамическое наблюдение. Хирургическое удаление внутримозговой опухоли показано только при резком увеличении ее размеров с подъемом внутричерепного давления. Операцию проводят нейрохирурги.
В отношении новообразований соматических органов применяется преимущественно выжидательная тактика. Хирургическое лечение проводится по показаниям, в основном в случаях, когда опухоль вызывает существенную дисфункцию органа или имеется угроза ее злокачественного течения.
Фокальная корковая дисплазия
Фокальная корковая дисплазия — аномалия структуры коры головного мозга, затрагивающая её ограниченный участок. Клинически проявляется фокальными двигательными эпиприступами с потерей сознания, но небольшой продолжительностью. Диагностируется неврологом или эпилептологом по данным ЭЭГ, специально проведённого МР-сканирования, субдуральной электрокортикографии, ПЭТ головного мозга. Как правило, эпилепсия при корковой дисплазии устойчива к проводимой противоэпилептической терапии. Альтернативным методом лечения выступает нейрохирургическая резекция участка дисплазии.
Фокальная корковая дисплазия (ФКД) — возникшее в период внутриутробного развития локальное нарушение в строении мозговой коры. Является самым частым этиофактором развития эпилепсии у детей. По данным международного исследования ILAE (2005 г.) ФКД была диагностирована у 31% детей с эпилепсией. Отличительными особенностями эпилептических пароксизмов при ФКД являются: устойчивость к проводимой противоэпилептической терапии, агрессивное течение с развитием у детей задержки психического развития и эпилептической энцефалопатии, эффективность нейрохирургических способов лечения.
Локальные диспластические изменения коры располагаются преимущественно в височных и лобных долях. Они слабо заметны на макроскопическом уровне, что затрудняет диагностику ФКД даже при помощи таких современных методов нейровизуализации как МРТ. Проблемы диагностики ФКД особо актуальны в практической неврологии и педиатрии, поскольку её выявление как причины эпилептических пароксизмов имеет решающее значение для выбора эффективной лечебной тактики в отношении резистентных форм эпилепсии.
Причины фокальной корковой дисплазии
ФКД обусловлена нарушением окончательных этапов развития церебральной коры (кортикогенеза) во внутриутробном периоде. В результате нарушений миграции и дифференцировки клеток коры образуется участок с аномальными нейронами, патологической утолщенностью, уплощенностью извилин или изменённой архитектоникой (появлением клеток, типичных для одного слоя, в другом слое коры). Формирование фокальной корковой дисплазии происходит незадолго до родов — за 4-6 недель до окончания периода внутриутробного развития. Более тяжёлые формы пороков мозговой коры (например, полимикрогирия, гемимегалэнцефалия) связаны с нарушениями конца 2-го начала 3-его триместра беременности.
Нельзя исключить генетическую природу ведущего к ФКД сбоя в кортикогенезе. Так, у многих пациентов обнаружены изменения в гене TSC1, которые также наблюдаются при туберозном склерозе. В настоящее время проводятся международные исследования по поиску генетического субстрата корковых дисплазий.
Классификация фокальной корковой дисплазии
До недавнего времени выделяли 2 основных типа ФКД. В 2011 г. была разработана новая классификация, в которую включён 3-й тип, ассоциированный с другим основным поражением церебральных структур. Согласно этой классификации выделяют:
ФКД I типа — локальное нарушение архитектоники коры: радиальное (IA), тангенциальное (IB) или смешанное (IC). Выявляется у 1,7% обследованных практически здоровых людей.
ФКД II типа — очаговое нарушение цитоархитектоники с наличием аномальных нейронов (IIA) и так называемых баллонных клеток (IIB). Как правило, дисплазия затрагивает лобные доли.
ФКД III типа — вторичное нарушение корковой архитектоники, обусловленное другой патологией: мезиальным темпоральным склерозом (IIIA), глиальной опухолью (IIIB), мальформацией сосудов головного мозга (IIIC) или другими нарушениями (IIID) — энцефалитом Расмуссена, нейроинфекцией, посттравматическими или постишемическими изменениями и пр.
Симптомы фокальной корковой дисплазии
Ведущим клиническим проявлением ФКД выступает фокальная эпилепсия. Как правило, она манифестирует в детском возрасте. Эпилептические пароксизмы отличаются своей кратковременностью — длятся не более минуты. Среди них преобладают сложные (с расстройством сознания) фокальные моторные приступы, зачастую с автоматизмами в начальном периоде пароксизма. Спутанность сознания в постприступный период выражена незначительно. Характерны двигательные феномены и внезапные падения. Вторичная генерализация эпиприступов происходит заметно быстрее, чем при височной эпилепсии.
Возраст дебюта эпилепсии и сопутствующая клиническая симптоматика зависят от типа, выраженности и расположения очага корковой дисплазии. Ранняя манифестация аномалии обычно сопровождается задержкой психического развития ребёнка и когнитивными нарушениями.
ФКД I типа имеет менее тяжёлое течение и не всегда проявляется эпиприступами. У ряда пациентов она приводит к затруднению в познавательной деятельности и проблемам в обучении. ФКД II типа сопровождается тяжёлыми парциальными и вторично генерализованными эпиприступами. У многих пациентов наблюдается эпилептический статус. Клиника и течение ФКД III типа зависит от характера основной патологии.
Диагностика фокальной корковой дисплазии
Основной метод диагностики ФКД — магнитно-резонансная томография. Она должна выполняться по специальному протоколу с толщиной срезов 1-2 мм. Только такое тщательное сканирование способно выявить минимальные структурные изменения мозговой коры. В МРТ диагностике корковой дисплазии имеет значение опыт и квалификация рентгенолога. Поэтому при необходимости результаты исследования следует показать более опытному в этом вопросе специалисту.
К МРТ признакам ФКД относятся: локальная гипоплазия или утолщение коры, «смазывание» перехода между белым и серым веществом, изменённый ход извилин, повышенный МР-сигнал на ограниченном участке коры при исследовании в режимах Т2 и FLAIR. Каждый тип ФКД имеет свои особенности МРТ-картины.
В обязательно порядке пациентам с ФКД проводится электроэнцефалография. В большинстве случаев она выявляет очаговую эпилептическую активность мозга не только в момент приступа, но и в межприступный период. Во время приступа отмечается повышенная возбудимость и активация зон коры, прилежащих в визуализируемому на МРТ очагу дисплазии. Это связано с наличием аномальных клеток и за пределами основного участка корковой дисплазии, который является лишь «верхушкой айсберга».
Выявление зоны начала эпилептического приступа возможно при помощи ПЭТ, совмещённой с МРТ-изображением. При этом радиофармпрепарат должен быть введён пациенту после первого же пароксизмального разряда. Такое исследование особенно ценно при МРТ-негативных случаях ФКД и при несовпадении очага, визуализируемого на МРТ, с данными ЭЭГ. Для более точного определения расположения эпилептогенного очага проводится инвазивная электрокортикография с установкой субдуральных электродов, требующая краниотомии.
Лечение фокальной корковой дисплазии
Терапию начинают с подбора эффективного противосудорожного препарата и его дозы. Пациента совместно курируют эпилептолог и невролог. Возможно применение карбамазепина, препаратов вальпроевой к-ты, диазепама, леветирацетама, топирамата и др. антиконвульсантов. Однако зачастую эпилепсия при ФКД оказывается резистентной к противосудорожной терапии. В таких случаях ставится вопрос о хирургическом лечении и проводится консультация нейрохирурга.
Поскольку диспластические изменения носят фокальный характер, то хирургическое удаление патологического очага является эффективным способом лечения ФКД. В начале нейрохирургического вмешательства проводится электростимуляция и индивидуальная интраоперационная кортикография с составлением карты функционально важных участков коры, что позволяет избежать их травмирования в ходе операции. Многие нейрохирурги настаивают на целесообразности как можно более радикального удаления диспластического очага для достижения наилучших результатов лечения. Сложность заключается в широком распространении зоны точечно расположенных патологически изменённых клеток вокруг основного очага и невозможности их полного удаления. Распространённые и билатеральные эпилептогенные поражения являются противопоказанием к хирургическому лечению.
В зависимости от локализации и распространённости очага применяется один из 3 видов оперативных вмешательств: селективная резекция эпилептогенной зоны, стандартизированная резекция головного мозга (лобэктомия), тэйлорированная резекция — «выкраивание» зоны дисплазии, определённой в ходе кортикографии. При ФКД III типа зачастую требуется удаление и дисплазии, и основного очага поражения (опухоли, участка склероза, сосудистой мальформации и т. п.).
Прогноз при фокальной корковой дисплазии
Прогноз зависит от типа ФКД, своевременности проведённого лечения, радикальности удаления участка корковой дисплазии. Консервативная терапия, как правило, не даёт желаемого результата. Длительное течение эпилепсии в детском возрасте чревато нарушением нервно-психического развития с исходом в олигофрению.
Хирургическое лечение наиболее эффективно при единичном хорошо локализуемом очаге. По некоторым данным полное отсутствие пароксизмов или их значительное урежение наблюдается у 60% прооперированных пациентов. Однако спустя 10 лет приступы отсутствуют только у 32%. По всей видимости, рецидив эпилепсии в таких случаях связан с неполным удалением эпилептогенных элементов.
Стойкие послеоперационные неврологические расстройства отмечаются в 2% случаев, при распространённых поражениях — в 6%. Риск их развития повышен при проведении лобэктомии и вмешательствах вблизи функционально значимых участков коры.
Вариант ультразвуковой картины почек и печени у ребенка с туберозным склерозом
Профессиональные диагностические инструменты. Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
Введение
Туберозный склероз, или синдром Бурневиля-Прингля, впервые описанный в 1862 году, представляет собой генетическое заболевание, наследуемое по аутосомно-доминантному типу с двумя вариантами поражения генов. Первый вариант туберозного склероза развивается при мутации гена, расположенного на хромосоме 9q34, второй - в связи с мутацией другого гена на хромосоме 16q13. Частота заболевания в популяции - 1:10000.
В настоящее время известно, что мутация перечисленных генов является основой для развития гиперпластических процессов в связи со снижением синтеза белка туберина.
Основными клиническими симптомами являются полиморфные судорожные приступы, психические расстройства в виде снижения интеллекта вплоть до идиотии, узелковые высыпания на лице в виде бабочки (аденома Прингля), локальное поседение, кожные фибромы, гемангиоэктазии, участки по типу шагреневой кожи, доброкачественные опухоли в сердце (рабдомиомы), адипозогенитальный синдром, деформации грудной клетки, позвоночника и конечностей [1].
У взрослых пациентов при туберозном склерозе наиболее часто диагностируются ренальные ангиомиолипомы. Так Steiner и соавт. у 17 % с ангиомиолипомами почек обнаружили туберозный склероз, причем нередко отмечалось двустороннее поражение. В этом возрастном контингенте к другой по частоте патологии почек при туберозном склерозе относятся гамартомы, которые могут сочетаться с саркомой [6]. В детском возрасте патогномоничным для туберозного склероза являются кистозные поражения почек, и, как правило, поражение носит двусторонний характер [2, 4].
Скрининговые исследования печени у детей с туберозным склерозом, проведенные Jozwiak и соавт., обнаружили гамартому у 23,5 % пациентов детского возраста.
В представленном наблюдении приводим нетипичное поражение почек и печени у ребенка с туберозным склерозом.
Описание случая
Девочка, 9 лет, поступила в хирургическое отделение с жалобами на острые боли в животе. Из анамнеза было выяснено, что пациентка состоит на диспансерном учете в течение шести лет у невропатолога по поводу туберозного склероза. Страдала эпилептиформными припадками, последние три года отмечалась ремиссия. Неоднократно проходила обследование головного мозга: при ЯМР - томографии в затылочных, теменных и лобных долях определялись зоны диаметром до 10 мм, с нечеткими неровными контурами, распространяющимися как на белое, так и на серое вещество (гамартомы?) и субэпиндимальные узлы в боковых желудочках.
При поступлении состояние удовлетворительное, девочка правильного телосложения, повышенного питания. На лице ярко-красные плотные бугорки в виде бабочки (рис. 1) (характерно, что на лице у матери пациентки аналогичные аденоматозные высыпания), кожа на туловище и конечностях покрыта обильными уртикарными элементами, на большом пальце левой кисти - изменения кожи по типу "шагреневой". Область головки лучевой кости деформирована, здесь же определяется опухолевидное образование плотноэластической консистенции (рис. 2). При допплерографии сосудов левого предплечья, выполненной год назад, были выявлены признаки дисциркуляции и сосудистой мальформации.
Рабдомиома сердца
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Первичные опухоли сердца в большой референсной детской клинике встречаются с частотой 0,001-0,003% от всех госпитализированных и не более чем в 0,01% всех случаев аутопсий с равным распределением по полу [1, 2], из них 40-60% у детей раннего и младшего возраста приходится на рабдомиому [3]. Рабдомиома сердца - самая частая опухоль сердца у детей дошкольного возраста, является гамартомой из кардиомиоцитов, не метастазирует. В более старшем возрасте на первое место выдвигаются фибромы, миксомы, тератомы, рабдомиосаркомы и др. [4].
Рабдомиомы сердца часто являются проявлением туберозного склероза, одной из форм факоматозов, наследуются аутосомно-доминантно, могут появляться спорадически. Рабдомиомы сердца выявляются более чем у половины пациентов с туберозным склерозом. У 51-86% детей с рабдомиомой сердца имеются признаки туберозного склероза либо в семейном анамнезе, либо его клинико-радиологические признаки [5].
Известны 2 гена, определяющие туберозный склероз: TSC1 на хромосоме 9q34 (определяет синтез гамартина) и TSC2 на хромосоме 16p13 (определяет синтез туберина). Гамартин и туберин ответственны за рост и развитие кардиомиоцитов, подавляя неконтролируемый рост и предупреждая развитие опухолей. Нарушение их синтеза ведет к развитию туберозного склероза и рабдомиомы сердца. Фенотип заболевания не зависит от того, какой из генов, TSC1 или TSC2, подвергся экспрессии. TSC1 или TSC2 обнаруживаются только у 80% больных туберозным склерозом. Причина каждого пятого случая остается неизвестной. Истинная частота туберозного склероза, факоматозов вообще и рабдомиомы сердца не определена. Гены туберозного склероза обнаруживаются с частотой 1:6000-1:9000 населения, а манифестные случаи заболевания регистрируются редко: с частотой 1:150 000 населения [6].
Клиническая картина рабдомиомы сердца очень неспецифична и определяется временем манифестации новообразования (плод, новорожденный, ребенок, подросток, взрослый), скоростью роста новообразования, числом опухолей сердца, их расположением. Рабдомиома сердца, вытесняя функционирующий миокард или располагаясь в области выносящих и входящих потоков, способна привести к перегрузке предсердий, полых вен, отекам, сердечной недостаточности. Возможны нарушения ритма, особенно при расположении опухоли в кавоатриальных и атровентрикулярных областях. Опухолевые клетки могут выступать как дополнительный путь проведения импульса. Сдавление опухолью коронарных сосудов приводит к инфарктоподобной картине на ЭКГ. Рабдомиомы сердца, формирующиеся уже у плода, могут привести к его гибели, при небольших размерах опухоли они выявляются при плановых скрининговых обследованиях в акушерских центрах [7]. Но рабдомиомы сердца могут формироваться на протяжении жизни.
Широкое внедрение в практику ультразвуковой диагностики позволило перейти от аутопсийной статистики к прижизненному выявлению. Эхокардиография - первый метод выявления рабдомиомы сердца и контроля состояния пациента в динамике. Учитывая очень большое число семейных случаев, необходимо обследование всех ближайших родственников, особенно при наличии у них пятен цвета кофе с молоком, депигментированных по типу шагреневой кожи, параунгвальных и параореолярных фибром, ранних миом матки, инфантильных спазмов, судорожных припадков и других признаков факоматозов. При семейных обследованиях рабдомиомы сердца могут выявляться у совершенно бессимптомных носителей (рис. 1, 2).
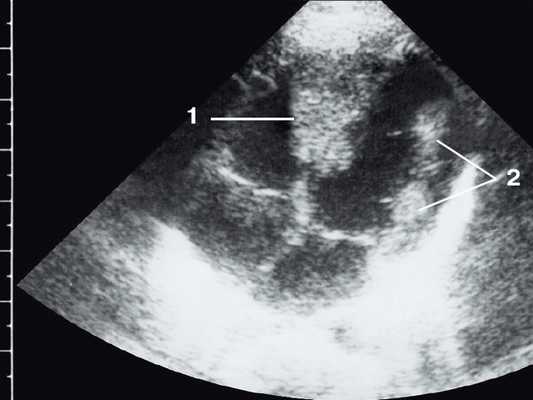
Рис. 1. Эхокардиограмма ребенка (девочки) с рабдомиомой. Крупный узел рабдомиомы в межжелудочковой перегородке (1) и менее крупные узлы в задней стенке левого желудочка (2). Эхоплотность образований выше, чем миокарда.
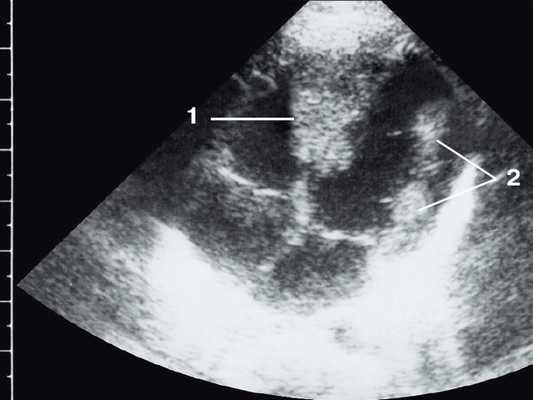
Рис. 2. Эхокардиограмма матери этого же ребенка. В межжелудочковой перегородке несколько эхоплотных образований (стрелки).
Рабдомиома сердца эхографически выглядят как достаточно четко очерченные образования. Чаще всего располагаются в миокарде левого желудочка, реже - в правом, еще реже - в предсердиях, кавоатриальных и атриовентрикулярных соединениях, эпикарде. Метастазирование не типично [8]. Наличие двух и более рабдомиом четко коррелирует с туберозным склерозом, одиночные рабдомиомы сердца такой связи, как правило, не имеют. По нашему опыту (18 пациентов), чем меньше объем новообразования, тем выше акустическая плотность, приближающаяся к эталонной эхоплотности (эндо-, эпи- и перикард). Эхоплотность больших рабдомиом практически не отличается от эхоплотности миокарда. В толще новообразования выявляются мелкие эхонегативные очажки (области некрозов) и эхопозитивные очажки (отложения кальция) (рис. 3).
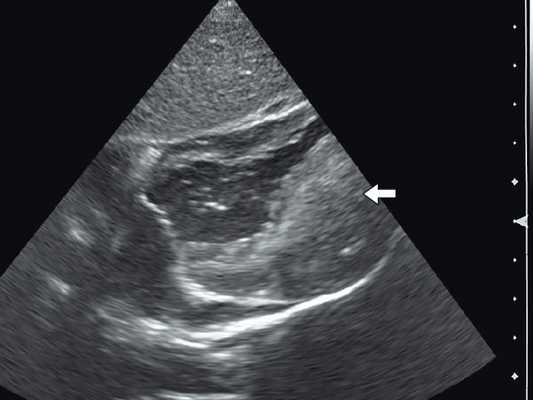
Рис. 3. Эхокардиограмма гигантской рабдомиомы (стрелка) у девочки марфаноидного статуса без признаков туберозного склероза (субксифоидальный доступ).
Рост рабдомиомы сердца медленный. Описаны случаи обратного развития одиночных рабдомиом сердца [9]. Рабдомиомы сердца, сопровождающиеся нарушениями ритма, гемодинамики, подвергаются оперативному лечению. При невозможности резекции опухоли, ее прогрессировании, угрозе фатальных нарушений ритма и некурабельной сердечной недостаточности не исключена трансплантация сердца [3, 9]. Приводятся сведения об эффективности такого мощного противоопухолевого препарата, как эверолимус, подавляющего пролиферацию, дифференциацию, рост и миграцию клеток [10].
Заключение
Рабдомиома сердца - относительно нередкое новообразование у детей и подростков, во многих случаях семейное, что требует обязательного обследования родственников. Первый метод диагностики - эхокардиография. Этот же метод незаменим для динамического контроля. Прогноз при множественных рабдомиом сердца, при расположении опухолевого узла в области привносящих или выносящих трактов, нарушающих функцию клапанов, с упорными и тяжелыми нарушениями ритма - плохой. Прогноз во многом определяется и неврологическими поражениями при туберозном склерозе. Хирургическое лечение сводится к иссечению участка опухоли, выступающего в полость камеры сердца. Удалить опухоль радикально невозможно. При больших рабдомиомах сердца не исключена трансплантация донорского органа. Химиотерапия применяется ограниченно.
Литература
УЗИ сканер HS50
Читайте также:
- Формы рака предстательной железы. Неэпителиальные формы рака предстательной железы.
- Наружная большеберцовая кость (os tibiale externum): атлас фотографий
- Неотложная помощь при гиперкалиемии у пациента с отравлением
- Инструментальные исследования пациентов в психиатрии
- Преимплантационная генетическая диагностика (ПГД). Показания и возможности
