УЗИ при врожденной гиперплазии коры надпочечников у плода
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
В последние годы значительно возрос интерес к изучению воздействия андрогенов у женщин. Во многом это связано с ростом числа заболеваний, сопровождающихся гиперандрогенией (ГА), способствующей нарушению овуляции, привычному невынашиванию беременности или бесплодию. Таким образом, появились принципиально новые подходы к диагностике надпочечниковой ГА и решению вопроса о целесообразности использования кортикостероидных препаратов в различных клинических ситуациях.
- КЛЮЧЕВЫЕ СЛОВА: гиперплазия, беременность, овуляция, бесплодие, андростендион, кортизол, Метипред
Таблица. Молекулярно-генетические исследования, применяемые для диагностики недостаточности 21-гидроксилазы
Андрогены играют важную роль в жизнедеятельности женского организма. Термин «андроген» в целом применим к классу C19 стероидов, которые образуются в гонадах и надпочечниках у лиц обоего пола и включают тестостерон (T), дегидроэпиандростерон (ДГЭА), дегидроэпиандростерон сульфат (ДГЭА-С), андростендион (A) и 5 a-дигидротестостерон (ДГТ) (см. рисунок) (1).
У женщин репродуктивного возраста приблизительно равное количество Т (25%) и А (50%) образуется в яичниках и надпочечниках, а остальная часть - на периферии, в основном в жировой ткани. Что касается так называемых D-андрогенов (дельта-андрогенов), - ДГЭА и ДГЭА-С, то около 70-80% от их общего количества продуцируется в надпочечниках, затем основная часть на периферии путем конверсии превращается в А, Т, ДГТ и эстрогены. Секреция андрогенов яичниками и надпочечниками, в дополнение к локальным внутрижелезистым механизмам, стимулируется ЛГ и АКТГ. По сравнению с другими андрогенными стероидами T и ДГТ обладают самой мощной биологической активностью. У молодых здоровых женщин ежедневная продукция Т в организме составляет примерно 300 mг (примерно 5% от таковой у мужчин), при этом около 98% этого гормона находится в связанном с белками состоянии, в основном с глобулином, связывающим половые стероиды (ГСПС), и только 2% - в свободном состоянии.
Продукция андрогенов яичниками и надпочечниками варьирует в течение менструального цикла, максимальный пик отмечается в середине цикла (2).
Известно, что первичными половыми гормонами, которые синтезируются в женском организме, являются андрогены, из которых в процессе ароматизации в гранулезных клетках яичников образуются эстрогены. Ароматазная активность, ответственная за превращение андрогенов в эстрогены, активизируется уже к 20-й неделе беременности, и с этого времени концентрация эстрогенов у плодов женского пола и далее в постнатальный период у девочек выше, чем у мальчиков. В возрасте 6-7 лет у девочек происходит увеличение секреции ДГЭА, ДГЭ-С и А в надпочечниках. Эта фаза полового развития называется адренархе, затем в течение пубертатного периода уровень этих гормонов продолжает нарастать. Полагают, что андрогены надпочечникового происхождения принимают участие в активации пубертатного роста и созревания скелета, играют определенную роль в развитии полового оволосения, участвуют в половой дифференцировке мозга, контролируют циклическую регуляцию секреции гонадолиберина и половое поведение. Максимальная концентрация адреналовых андрогенов достигается в 3-м 10-летии жизни женщины.
После диссоциации андрогенов и белка-носителя свободные гормоны проникают в клетку и связываются со специфическим белком - андрогенным рецептором, производя геномный эффект. Биологическое воздействие андрогенов осуществляется практически на все ткани, при этом основными органами-мишенями являются все гормонально-зависимые структуры репродуктивной системы (4). Помимо внутригонадного действия (участие в выборе доминантного фолликула), в норме андрогены оказывают влияние на центральную регуляцию репродуктивной системы, подавляя пульсирующую секрецию гонадолиберинов и гонадотропинов (ГТ) по принципу обратной отрицательной связи. В противоположность этому ГА оказывает множественное негативное влияние, проявляющееся в подавлении роста, созревания фолликулов и образования желтого тела; угнетении пролиферации эндометрия и развитии в нем атрофических процессов; в спазме капиллярных сосудов миометрия, нарушении кровообращения с последующей гипоплазией матки; в задержке ороговения влагалищного эпителия; атрофии железистой ткани молочных желез и подавлении лактации.
Этиопатогенез и клиника
Ключевую роль в регуляции гонадной дифференцировки, развитии надпочечников и в процессах стероидогенеза играет стероидный фактор 1 (SF-1). В постнатальный период SF-1 продолжает экспрессироваться в тестикулах и в яичниках, регулируя в них процессы стероидогенеза. Генез врожденной надпочечниковой недостаточности может быть связан с мутацией в этом гене.
Врожденная гиперплазия коры надпочечников (ВГКН) - наследственное нарушение, вызванное ферментативными дефектами (чаще 21-гидроксилазы, реже - 11b-гидроксилазы), характеризуется снижением синтеза кортизола. За развитие недостаточности 21-гидроксилазы отвечает только один ген - CYP 21А2. Как следствие дефицита кортизола, повышается секреция АКТГ, накапливаются его предшественники, образующиеся непосредственно перед ферментативным «блоком», которые, в свою очередь, превращаются в ДГЭА и андростендион, а затем путем периферической конверсии - в тестостерон, что вызывает появление симптомов гиперандрогении.
В случае классической тяжелой формы ВГКН (полный «блок» - менее 1% активности 21-гидроксилазы) отмечается выраженная маскулиницация женских гениталий, и диагноз легко ставится при рождении девочки. Частота классической формы ВГКН в мире составляет 1 случай на 14 500 живорождений. В случае неклассической формы (НФ) ВГКН отмечается неполный «блок» - 20-50% ферментативной активности 21-гидроксилазы.
Симптомами НФ ВГКН являются: позднее менархе, гирсутизм и другие признаки ГА, появляющиеся обычно после окончания пубертатного периода или даже в возрасте 20-30 лет, например, нерегулярный менструальный цикл. В 60% случаев эта форма заболевания проявляется у взрослых женщин только с гирсутизмом, в 10% - сочетанием гирсутизма с нарушением менструального цикла и в 10% - только нарушением менструального цикла. Частота бесплодия без лечения достигает 50%. НФ ВГКН выявляется у 1-3% женщин с признаками ГА (5).
Недостаточность 21-гидроксилазы наследуется по аутосомно-рецессивному типу. Ген CYP 21А2 расположен на расстоянии примерно 30000 пар нуклеотидов от функционально неактивного псевдогена CYP 21А2Р, на коротком плече 6-й хромосомы (6 р 21.3), рядом с генами, кодирующими HLA (6). Благодаря высокой гомологии последовательностей генов CYP 21А2 и CYP 21А2Р при рекомбинации возникают 2 типа мутаций: первый неравномерный кроссинговер во время мейоза, приводящий к делеции или удвоению гена CYP 21А2; замена (конверсия) между CYP 21А2 и CYP 21А2Р с переносом инактивирующей мутации с CYP 21А2Р на CYP 21А. Большинство больных с недостаточностью 21-гидроксилазы являются сложными гетерозиготными носителями. Распределение типичных мутаций при тяжелых классических формах ВГКН и при умеренных (неклассических) формах во взаимосвязи с уровнем ферментативной активности 21-гидроксилазы представлены в таблице.
В настоящее время доказано, что при тяжелых классических формах ВГКН при потере менее 1% ферментативной активности 21-гидроксилазы наиболее часто встречается мутация А/С659G; при потере 2-11% - мутация I172N; при умеренных (неклассических) формах ВГКН и потере » 20-50% активности 21-гидроксилазы - мутации Р30L, V281L, Р453S.
У гомозиготных носителей мутации CYP 21А2 развивается сольтеряющая форма врожденной гиперплазии коры надпочечников. На долю полной делеции гена CYP 21А2 и делеции 8 пар нуклеотидов в 3-м экзоне приходится еще 20% больных с сольтеряющей формой. Для выявления этих мутаций используется метод блоттинга по Саузерну (метод гибридизации ДНК на твердой подложке) (7).
Большинство родителей - гетерозиготы и «несут» один нормальный и один мутантный аллель. Приблизительно в 1% случаев мутации возникают de novo, в этом случае гетерозиготным носителем может быть только один из родителей.
Иногда у одного из родителей, который считал себя здоровым, диагностируют НФ ВГКН. Гетерозиготные носители мутации здоровы, у них только несколько повышен уровень 17-гидроксипрогестерона при проведении пробы с АКТГ.
Если оба родителя являются гетерозиготными носителями какого-либо варианта мутации в гене CYP 21А2, то в 25% у них рождается гомозиготный ребенок по дефекту этого гена, в 50% - гетерозиготный носитель и в 25% - здоровый ребенок.
Если у брата или сестры больного ребенка нет признаков заболевания, то в 2/3 случаев он является носителем. Если один из родителей болен, а второй является носителем, то с вероятностью 50% ребенок несет 2 мутантных аллеля и будет болен, а в 50% - будет только носителем.
Если у половой пары, являющейся носителями мутации гена CYP 21, рождается девочка с ВГКН, то вероятность рождения второго больного ребенка составляет 1:8. В случае если один из партнеров страдает классической формой ВГКН, а генетический статус второго партнера в отношении CYP 21 не известен, то риск рождения девочки с врожденной формой АГС составляет 0,4% или 1:250. У матери с НФ ВГКН риск рождения девочки с классической формой ВГКН составляет 0,1% (1:1000) (8).
Диагностика
Имеющиеся к настоящему времени молекулярно-генетические технологии в 95% случаев позволяют выявить наиболее часто встречающиеся мутации гена CYP 21А2, и эти исследования необходимо обязательно включать в обследование больных с ГА. Для пациенток со стертой НФ ВГКН характерен нормальный базальный уровень 17-гидроксипрогестерона, слабо выраженные признаки гирсутизма и относительно невысокое повышение уровня 17-гидроксипрогестерона на фоне пробы с аналогами АКТГ. При уровне 17-гидроксипрогестерона, измеренном в утренние часы и равном 8 нг/мл, диагноз НФ ВГКН не вызывает сомнений.
Уже в течение нескольких десятков лет при высоком риске рождения ребенка с недостаточностью 21-гидроксилазы проводят пренатальную диагностику, а с 1984 г. и лечение этого заболевания. Если у плода подозревают неклассическую форму заболевания, то пренатальное лечение не показано. На смену определению уровня 17-гидроксипрогестерона в околоплодных водах и типированию HLA с последующим анализом сцепления пришло молекулярно-генетическое исследование гена CYP 21А2. Разработан механизм пренатальной диагностики и лечения классической формы ВГКН. Цель пренатального лечения - уменьшить вирилизацию у плодов женского пола и тем самым избежать или уменьшить необходимость проведения феминизирующей пластики наружных половых органов (9).
Дифференциальная диагностика НФ ВГКН с СПКЯ
НФ ВГКН часто характеризуется нарушением менструального цикла и ановуляциией, механизм которой сходен с таковым при СПКЯ. Повышенный уровень андрогенов способствует снижению ГСПС и, таким образом, некоторому повышению уровня биологически активных эстрогенов. Повышение эстрогенов стимулирует тоническое образование ЛГ, выработку андрогенов яичниками и локально подавляет рост фолликулов и овуляцию. Поэтому клиническая картина у женщин с НФ ВГКН может напоминать таковую при СПКЯ и включает постпубертатное появление гирсутизма, олигоменорею или аменорею и др. Но в отличие от СПКЯ у женщин с НФ ВГКН в анамнезе отмечается препубертатное акцелератное повышение роста (между 6 и 8 годами) с последующим замедлением роста, и в конечном счете рост оказывается невысоким. Такая характеристика динамики роста, семейный анамнез постпубертатного проявления гирсутизма, выявление умеренных признаков вирилизации являются индикаторами надпочечниковой ГА.
Дифференциальный диагноз между НФ ВГКН и СПКЯ включает измерение базального уровня (в утренние часы) 17-гидроксипрогестерона в сыворотке. Как уже отмечалось, если его показатели выше 8 нг/мл, можно ставить диагноз НФ ВГКН. Если его уровень выше нормы (от 2,5 до 3,3 нг/мл), но ниже 8 нг/мл, необходимо провести тест с АКТГ. Для этого измеряется базальный уровень 17-гидроксипрогестерона и вводится 0,25 мг синтетического аналога АКТГ в единой дозе. Через 1 час еще раз определяют уровень 17-гидроксипрогестерона, если он выше 10 нг/мл - устанавливается диагноз НФ ВГКН. Однако наиболее объективным тестом является обнаружение мутации в гене CYP 21А2 (7).
Лечение ВГНК глюкокортикостероидами впервые было предложено Wikins в начале 50-х годов прошлого века. Наряду с заместительным гормональным эффектом глюкокортикостероиды - мощные противовоспалительные средства, широко используемые при острых и хронических ВЗОМТ. Обладая иммуносупрессивным действием, глюкокортикостероиды нашли широкое применение при привычном невынашивании беременности. Молекулярные механизмы действия глюкокортикостероидов реализуются путем регуляции супрессии ряда генов на транскрипционном и посттранскрипционном уровнях, а также в негеномных эффектах, которые возникают при использовании высоких доз препаратов. В низких концентрациях (> 10-12 ммоль/л) глюкокортикостероиды реализуют свое действие только за счет так называемых геномных эффектов, для развития которых требуется 30 мин. и более. Глюкокортикостероиды подавляют синтез и секрецию АКТГ гипофизом и вторично - глюкокортикостероидов надпочечниками. Оказывают противовоспалительное, противоаллергическое, десенсибилизирующее, противошоковое, иммунодепрессивное действие. Основной целью назначения заместительной терапии глюкокортикоидами (Метипред® таблетки 4 мг) у пациенток с классической формой ВГКН является восполнение недостатка кортизола и альдостерона, избегая передозировки, направленное на снижение уровня надпочечниковых андрогенов, уменьшение вирилизации, обеспечение нормального роста и репродуктивной функции. Метипред® таблетки используются в дозе 5-10 мг в 2 приема. Эффективность лечения контролируют по уровню 17-гидроксипрогестерона, андростендиона и тестостерона в ранние утренние часы, один раз в 3-6 месяцев. Терапия пациенток с классической формой ВГКН заключается в постоянном назначении кортикостероидов для купирования признаков гиперандрогении и восстановления регулярного менструального цикла. Однако больные с неклассической формой недостаточности 21-гидроксилазы не всегда нуждаются в медикаментозном лечении или им требуются меньшие дозы (Метипред® по 4 мг в 2 приема). Показанием для начала терапии является ускорение костного возраста, гирсутизм, нарушение менструального цикла, увеличение яичников и др. (10).
Ведение беременности
В случае наступления беременности у женщин с ГА любого генеза существенно увеличивается риск нарушения имплантации плодного яйца, нарушения кровообращения в матке, склерозирования сосудов миометрия и хориона, разрыва сосудов, образования ретрохориальных гематом, отслойки хориона, развития истмико-цервикальной недостаточности, кроме того, создаются предпосылки для внутриутробной вирилизации плода женского пола. С другой стороны, гестационный период может явиться провоцирующим стрессорным фактором, способствующим проявлению скрытой неполноценности ферментных систем стероидогенеза, в результате чего может развиться НФ ВГКН. В связи с этим нередко возникает необходимость обследования беременных женщин на наличии ГА с целью последующей коррекции имеющихся гормональных и метаболических нарушений и профилактики нарушений со стороны плода.
Следует учитывать, что выбор лабораторных маркеров ГА у беременных должен проводиться с учетом особенностей гормональной секреции в период гестации. В организме беременной метаболизм ДГЭА-С имеет ряд особенностей в связи с наличием фетоплацентарного комплекса, синтезирующего эстрогены. Помимо материнских андрогенов, фетальная зона коры надпочечников плода секретирует ДГЭА-С в количестве, на порядок превышающем его секрецию во взрослом организме, использующийся плацентой для образования эстриола.
Отсутствие корреляционной связи между повышением уровней ДГЭА-С и 17-гидроксипрогестерона не позволяет использовать уровень ДГЭА-С в качестве единственного диагностического критерия ВГКН у беременных, так как он превышает лабораторные показатели для беременных во всех триместрах беременности. При скрининговом обследовании беременных женщин отмечается повышение уровня ДГЭА-С относительно лабораторной нормы, установленной для беременных женщин: уровень ДГЭА обратно коррелирует со сроком гестации, составляя в среднем в I триместре 4,3 мкг/мл, во II - 3,2 мкг/мл, а к III триместру отмечается его снижение примерно в 2 раза от исходного уровня до 2,5 при средней норме 1,3 мкг/мл. Содержание общего Т в сыворотке крови беременных женщин в несколько раз превышает его показатели вне периода гестации: в I триместре - 3,7 нмоль/л, во II - 4,6 нмоль/л и в III - 6,35 нмоль/л.
Во время беременности глюкокортикостероиды показаны при вирилизирующей и сольтеряющей классической форме ВГКН и для профилактики вирилизации у плодов от гетерозиготных матерей с неклассической формой дисфункции.
В случае подтверждения НФ ВГКН при проведении генотипирования и выявления мутации в гене CYP 21 и женском поле плода средняя доза препарата Метипред® составляет 1 мг в сутки до конца беременности. При подтверждении мужского пола плода с помощью УЗИ или биопсии ворсин хориона в 9-11 недель или с помощью амниоцентеза в 15-18 недель прием Метипреда должен быть немедленно прекращен с целью минимизации потенциальных рисков со стороны матери и плода. Подобная тактика ведения беременности, по данным литературы, оправдана в 7 из 8 случаев у беременных с подозрением на НФ ВГКН. В настоящее время рассматриваются возможные риски неоправданного назначения кортикостероидов как по отношению к плоду, так и к матери. Риски по отношению к плоду: ряд врожденных уродств - гипертрофия межсердечной перегородки, гидроцефалия, синдром задержки развития плода, необъяснимая гибель плода (до 2%). В последствии у этих детей наблюдается задержка умственного развития, низкорослость, выраженная лабильность АД. Со стороны матери: развитие синдрома Иценко-Кушинга, гипертензия, гипогликемия, появление отечного синдрома и признаков ятрогенной ГА. Частота развития этих осложнений может достигать 10%.
Массовые обследования новорожденных на недостаточность 21-гидроксилазы позволяют выявить больных с классическими формами заболевания, угрожаемых по развитию синдрома потери соли, и уточнить диагноз у девочек с неправильным строением наружных гениталий. Это обследование в большинстве случаев позволяет выявить НФ ВГКН. В ряде штатов США проводятся обязательные массовые обследования новорожденных на недостаточность 21-гидроксилазы путем определения уровня 17-гидроксипрогестерона. К сожалению, в первые сутки жизни возможны ложноположительные результаты, особенно у маловесных и недоношенных детей, что необходимо учитывать.
Во время беременности для профилактики дистресс-синдрома из числа глюкокортикостероидных препаратов наиболее предпочтителен Метипред®. Этот препарат, быстро проходя через плаценту в биологически активных формах, обладает слабой иммуносупрессивной активностью, лишен минералокортикоидной активности и обладает более продолжительным периодом действия, чем кортизол. Биодоступность несинтетических глюкокортикостероидов плоду вторично снижается вследствие метаболизма в плаценте.
Врожденная гиперплазия надпочечников
Врожденная гиперплазия надпочечников - увеличение объема надпочечников вследствие дефекта ферментов стероидогенеза в корковой зоне, приводящего к компенсаторному росту органа для устранения гормональной недостаточности. Проявляется признаками гиперандрогении у детей обоих полов, вследствие чего наружные половые органы развиваются неправильно. Также характерно нарушение водно-солевого обмена и регуляции артериального давления со склонностью к его снижению. Врожденная гиперплазия надпочечников диагностируется на основании данных лабораторного обследования. Проводится заместительная гормональная терапия и хирургическая коррекция наружных половых органов.
Общие сведения
Врожденная гиперплазия надпочечников представляет собой целую группу заболеваний со схожей клиникой, однако лежащие в основе генетические мутации могут быть разными. Раньше нозология носила название адреногенитальный синдром. Частота встречаемости клинически выраженных форм составляет примерно 1 случай на 12 тысяч новорожденных. Около 0,01% в структуре заболеваемости приходится на стертые формы, проявляющиеся в подростковом возрасте, часто клинически незначимые. Врожденная гиперплазия надпочечников является актуальной проблемой в педиатрии, поскольку продуцируемые надпочечниками гормоны имеют множество органов-мишеней, а значит, последствия их недостатка в организме проявляются масштабно. Дефицит гормонов оказывает влияние на рост и развитие ребенка, приводя к серьезным последствиям.
Причины врожденной гиперплазии надпочечников
Заболевание развивается вследствие генетического дефекта в каком-либо звене стероидогенеза в надпочечниках. Повреждение может коснуться одного или нескольких ферментов, которые участвуют в синтезе гормонов, продуцируемых в коре надпочечников. Мозговой слой, как правило, не затрагивается. Причины мутаций в генах, отвечающих за синтез участников стероидогенеза и их правильную работу, остаются неизвестными. В настоящее время доказан аутосомно-рецессивный механизм наследования, то есть для манифестации врожденной гиперплазии надпочечников необходимо, чтобы оба родителя имели дефектный ген.
Патогенез заболевания сводится к нарушению синтеза глюкокортикоидов, минералкортикоидов и других гормонов, продуцируемых надпочечниками. Как следствие, возрастает концентрация адренокортикотропного гормона (АКТГ), поскольку именно он является предшественником вышеперечисленных гормонов и стимулирует их усиленное образование. Результатом влияния АКТГ на орган-мишень становится увеличение корковой зоны надпочечников, то есть гиперплазия. Несмотря на увеличение размеров, концентрация продуцируемых надпочечниками гормонов не возрастает, поскольку имеет место нарушение цепочки их синтеза. Таким образом, врожденная гиперплазия надпочечников в клинике проявляется симптомами дефицита гормонов на фоне избытка их гормона-предшественника - АКТГ.
Классификация врожденной гиперплазии надпочечников
Клиническая классификация имеет менее сложную структуру. Выделяют три формы врожденной гиперплазии надпочечников: простую (вирильную), сольтеряющую, неклассическую (стертую, позднюю). Простая форма заболевания сопровождается нарушением развития первичных половых признаков у детей обоих полов - гиперандрогенией у девочек, и макрогенитосомией у мальчиков. Для сольтеряющей формы характерны те же симптомы, уже в период новорожденности возможны приступы острой надпочечниковой недостаточности (адреналовые кризы). Неклассическая врожденная гиперплазия надпочечников проявляется отсрочено, чаще всего - в период полового созревания. Ввиду позднего начала раньше эта форма считалась приобретенной, однако в настоящее время доказано, что в ее основе лежит генетический дефект.
Симптомы врожденной гиперплазии надпочечников
Заболевание (за исключением поздней формы) проявляется с рождения, хотя первые признаки можно заметить еще антенатально, во время проведения УЗИ-скрининга. После родов педиатр сразу может диагностировать неправильное развитие наружных половых органов у девочек. Как правило, речь идет об увеличенном клиторе, но иногда может встречаться и полностью сформированный половой член, а также недоразвитие или полное отсутствие влагалища и матки. Что касается мальчиков, то у них отмечается усиленное развитие наружных половых органов и увеличенные их размеры. Иногда при врожденной гиперплазии надпочечников у детей обоих полов наблюдается гиперпигментация кожи. Это связано с избыточным синтезом меланина, предшественником которого также является АКТГ.
Помимо нарушения полового развития, отмечаются симптомы недостаточности глюкокортикоидов или минералкортикоидов либо обеих групп гормонов (в зависимости от уровня генетического дефекта). Характерно пониженное давление при учащенном сердцебиении, бледность или мраморный оттенок кожи. В то же время, такие дети кажутся физически более развитыми в сравнении со здоровыми новорожденными, отличаются крупными размерами, усиленным развитием мышц и скелета, небольшим размером родничков. Врожденная гиперплазия надпочечников впоследствии может проявляться преждевременным половым созреванием с ранним оволосением, которое у пациентов всегда предшествует развитию вторичных половых признаков.
Острая надпочечниковая недостаточность может возникать при любой форме заболевания, однако при сольтеряющей форме она отмечается достаточно рано, примерно на второй неделе жизни. Осложнение сопровождается критическим падением артериального давления, тахикардией, срыгиваниями или рвотой. Наблюдается диарея и прогрессирующая потеря массы тела. Адреналовый криз требует немедленного лечения в отделении интенсивной терапии, поскольку данное осложнение врожденной гиперплазии надпочечников часто приводит к летальному исходу. Симптомы заболевания также могут усиливаться после стрессовых ситуаций, например, в подростковом возрасте.
Диагностика врожденной гиперплазии надпочечников
Первичная диагностика проводится во время УЗИ-обследования беременных. Иногда во время первого или (чаще) второго акушерского УЗИ можно заметить неправильное развитие половых органов. При подозрении на врожденную гиперплазию надпочечников возможно проведение дополнительных лабораторных исследований, позволяющих определить уровень гормонов и концентрацию различных ферментов адреналового стероидогенеза. Ранняя диагностика позволяет специалистам определиться с дальнейшей тактикой ведения беременности, а также начать терапевтические мероприятия еще до родов.
В настоящее время осуществляется массовое обследование новорожденных на некоторые наследственные патологии, в число которых входит врожденная гиперплазия надпочечников. После рождения ребенка заболевание диагностируется на основании неправильного развития наружных половых органов, но подтвердить диагноз и установить конкретную форму этого состояния можно только на основании результатов лабораторной диагностики. Золотым стандартом является проба с АКТГ, позволяющая достоверно определить его высокую концентрацию. Кроме того, данная проба необходима для того, чтобы исключить вторичный дефицит гормонов надпочечников.
Дополнительные анализы выявляют гиперкалиемию и гипонатриемию, метаболический ацидоз и снижение концентрации глюкозы в крови. Уровень продуктов метаболизма надпочечников определяется также в моче. Проводится определение костного возраста, который у пациентов значительно ускорен. Установить его позволяет серия рентгенограмм области запястья. Кроме того, возможна генетическая диагностика заболевания, однако данный метод является дорогостоящим, и его использование обосновано только в случае установленного семейного анамнеза, то есть случаев врожденной гиперплазии надпочечников в семьях родителей больного.
Лечение и прогноз
Проводится заместительная гормональная терапия. Корректируется уровень глюкокортикоидов, минералкортикоидов. Назначение гормонов возможно также при установлении врожденной гиперплазии надпочечников до родов. В этом случае устраняется гиперандрогения у девочек, поэтому наружные половые органы формируются правильно. Однако антенатальная гормональная терапия в настоящее время является предметом дискуссии. Основные ее осложнения для матери - отеки, артериальная гипертензия и значительная прибавка массы. Отдаленное влияние на плод в настоящее время изучается. Кроме гормональной терапии, осуществляется хирургическая коррекция половых органов. Операцию лучше провести как можно раньше, однако ее срок обязательно оговаривается с родителями.
Прогноз заболевания сомнительный. Своевременная диагностика и терапия позволяют в значительной мере скорректировать гормональные нарушения и предотвратить их дальнейшее развитие. Однако необходим постоянный контроль концентрации гормонов, поскольку любой внешний или внутренний стрессовый фактор становится причиной изменения усвояемости препаратов. Результатом может быть развитие острой надпочечниковой недостаточности, часто приводящей к летальному исходу ввиду стремительного течения осложнения. В целом можно сказать, что врожденная гиперплазия надпочечников поддается контролю, но заболевание представляет серьезную опасность на протяжении всей жизни. Профилактика заключается в медико-генетическом консультировании родителей, имеющих данную патологию в анамнезе.
Адреногенитальный синдром ( ВДКН , Врожденная дисфункция коры надпочечников )
Адреногенитальный синдром — наследственное заболевание надпочечников, при котором вследствие функциональной несостоятельности ферментов нарушается стероидогенез. Проявляется вирилизацией гениталий, маскулиноподобным телосложением, недоразвитием груди, гирсутизмом, акне, аменореей или олигоменореей, бесплодием. В ходе диагностики определяют уровни 17-гидроксипрогестерона, 17-кетостероидов, андростендиона, АКТГ, проводят УЗИ яичников. Пациенткам назначают заместительную гормонотерапию глюкокортикоидами и минералокортикоидами, эстрогены в комбинации с андрогенами или прогестинами нового поколения. При необходимости выполняют пластику половых органов.
МКБ-10
Адреногенитальный синдром, или врожденная дисфункция (гиперплазия) коры надпочечников, — наиболее частое из наследуемых заболеваний. Распространенность патологии отличается у представителей разных национальностей. Классические варианты АГС у лиц европеоидной расы встречаются с частотой 1:14 000 младенцев, в то время как у эскимосов Аляски этот показатель составляет 1:282.
Существенно выше заболеваемость у евреев. Так, неклассическую форму адреногенитального расстройства выявляют у 19% лиц еврейской национальности группы ашкенази. Патология передается по аутосомно-рецессивному типу. Вероятность рождения ребенка с таким синдромом при носительстве патологического гена у обоих родителей достигает 25%, в браке носителя и больного — 75%. Если один из родителей имеет полноценные ДНК, клинические проявления синдрома у детей не развиваются. При наличии АДС у отца и матери ребенок также будет болен.
Причины
У больных с наследуемой гиперплазией надпочечников генетический дефект проявляется несостоятельностью ферментных систем, участвующих в секреции стероидных гормонов. В 90-95% случаев патология возникает при повреждении гена, который отвечает за синтез 21-гидроксилазы — фермента, влияющего на образование кортизола. В остальных клинических случаях вследствие дефекта ДНК нарушается производство других ферментов, обеспечивающих стероидогенез, — StAR/20,22-десмолазы, 3-β-гидрокси-стероиддегидрогеназы, 17-α-гидроксилазы/17,20-лиазы, 11-β-гидроксилазы, P450-оксидоредуктазы и синтетазы альдостерона.
У пациентов с признаками вирилизирующего синдрома вместо активного гена CYP21-B в коротком плече 6-й аутосомы расположен функционально несостоятельный псевдоген CYP21-A. Структура этих участков ДНК-цепи во многом гомологична, что повышает вероятность конверсии генов в мейозе с перемещением участка нормального гена на псевдоген или делецию CYP21-B.
По-видимому, именно этими механизмами объясняется существование скрытых форм болезни, дебютирующих в пубертате или постпубертатном периоде. В таких случаях клинические признаки патологии становятся заметными после нагрузок, истощающих кору надпочечников: тяжелых болезней, травм, отравлений, радиационных воздействий, длительного периода интенсивной работы, психологически напряженных ситуаций и т. д.
Патогенез
В основе механизма развития наиболее распространенного варианта адреногенитального синдрома с дефектом CYP21-B-гена лежит принцип обратной связи. Ее начальным звеном становится дефицит стероидов — кортизола и альдостерона. Несостоятельность процессов гидроксилирования сопровождается неполным переходом 17-гидроксипрогестерона и прогестерона в 11-дезоксикортизол и дезоксикортикостерон. В результате снижается секреция кортизола, а для компенсации этого процесса в гипофизе усиливается синтез АКТГ — гормона, вызывающего компенсаторную гиперплазию коры надпочечников для стимуляции выработки кортикостероидов.
Параллельно возрастает синтез андрогенов и появляются видимые признаки их влияния на чувствительные ткани и органы. При умеренном снижении активности фермента минералокортикоидная недостаточность не развивается, поскольку потребность организма в альдостероне почти в 200 раз ниже по сравнению с кортизолом. Только глубокий дефект гена вызывает тяжелую клиническую симптоматику, которая проявляется с раннего возраста. Патогенез развития заболевания при нарушении структуры других участков ДНК аналогичен, однако пусковым моментом являются нарушения в других звеньях стероидогенеза.
Классификация
Систематизация различных форм вирилизирующей гиперплазии надпочечников основана на особенностях клинической картины заболевания, выраженности генетического дефекта и времени проявления первых патологических признаков. Тяжесть расстройства напрямую связана со степенью повреждения ДНК. Специалисты в сфере эндокринологии различают следующие виды адреногенитального синдрома:
- Сольтеряющий. Самый тяжелый вариант патологии, проявляющийся в первый год жизни ребенка грубыми нарушениями строения наружных половых органов у девочек и их увеличением у мальчиков. Активность 21-гидроксилазы составляет не более 1%. Значительное нарушение стероидогенеза приводит к выраженным соматическим нарушениям — рвоте, поносу, судорогам, чрезмерной пигментации кожи. Без лечения такие дети умирают в раннем возрасте.
- Простой вирильный. Течение заболевания менее тяжелое, чем при сольтеряющем варианте. Преобладают проявления неправильного развития гениталий у младенцев женского пола, увеличение их размеров у мальчиков. Признаки надпочечниковой недостаточности отсутствуют. Уровень активности 21-гидроксилазы снижен до 1-5%. С возрастом у пациентов нарастают признаки вирилизации вследствие стимулирующего действия андрогенов.
- Неклассический (постпубертатный). Наиболее благоприятная форма АГС, явные признаки которой возникают в период полового созревания и в репродуктивном возрасте. Наружные половые органы имеют нормальное строение, может быть увеличен клитор у женщин и половой член у мужчин. Функциональность 21-гидроксилазы снижена до 20-30%. Заболевание выявляется случайно при обследовании в связи с бесплодием или нарушениями менструальной функции.
Сольтеряющий и простой вирильный виды адреногенитальных расстройств относят к категории антенатальной патологии, формирующейся внутриутробно и проявляющейся с момента рождения. При дефекте строения других генов наблюдаются более редкие варианты заболевания: гипертензивные — классический (врожденный) и неклассический (поздний), гипертермический, липидный, с ведущими проявлениями гирсутизма.
Симптомы
Сольтеряющий и простой вирильный
При антенатальных формах заболевания основным клиническим симптомом является видимая вирилизация гениталий. У новорожденных девочек обнаруживаются признаки женского псевдогермафродитизма. Клитор большой по размерам или имеет пенисообразную форму, преддверие влагалища углублено, сформирован урогенитальный синус, большие и малые половые губы увеличены, промежность высокая. Внутренние половые органы развиты нормально.
У младенцев-мальчиков увеличен половой член и гиперпигментирована мошонка. Кроме того, при сольтеряющем адреногенитальном расстройстве выражена симптоматика надпочечниковой недостаточности с тяжелыми, зачастую несовместимыми с жизнью соматическими нарушениями (понос, рвота, судороги, обезвоживание и др.), которые проявляются с 2-3-недельного возраста. У девочек с простым вирильным АГС по мере взросления признаки вирилизации усиливаются, формируется диспластическое телосложение.
Из-за ускорения процессов окостенения пациентки отличаются невысоким ростом, широкими плечами, узким тазом, короткими конечностями. Трубчатые кости массивные. Половое созревание начинается рано (до 7 лет) и протекает с развитием вторичных мужских половых признаков. Отмечается увеличение клитора, снижение тембра голоса, нарастание мышечной силы, формирование типичной для мужчин формы перстневидного хряща щитовидной железы. Грудь не растет, менархе отсутствует.
Неклассический
Менее специфичны клинические симптомы при неклассических формах вирилизирующего синдрома, возникшие в пубертате и после стрессовых нагрузок (выкидыша на ранних сроках беременности, медицинского аборта, операции и др.). Обычно пациентки вспоминают, что у них еще в младшем школьном возрасте появилось небольшое оволосение в подмышечных впадинах и на лобке. В последующем развились признаки гирсутизма с ростом стержневых волос над верхней губой, по белой линии живота, в области грудины, в сосково-ареолярной зоне.
Женщины с АГС предъявляют жалобы на стойкую угревую сыпь, пористость и повышенную жирность кожи. Менархе наступает поздно — к 15-16 годам. Менструальный цикл неустойчив, интервалы между менструациями достигают 35-45 дней и более. Кровянистые выделения во время месячных скудные. Молочные железы небольшие. Клитор несколько увеличен. Такие девушки и женщины могут иметь высокий рост, узкий таз, широкие плечи.
По наблюдениям специалистов в сфере акушерства и гинекологии, чем позже развиваются адреногенитальные расстройства, тем менее заметны внешние признаки, характерные для мужчин, и тем чаще ведущим симптомом становится нарушение месячного цикла. При более редких генетических дефектах пациентки могут жаловаться на повышение артериального давления или, наоборот, гипотонию с низкой работоспособностью и частыми головными болями, гиперпигментацию кожи с минимальными симптомами вирилизации.
Осложнения
Основным осложнением адреногенитального синдрома, по поводу которого пациентки обращаются к акушерам-гинекологам, является стойкое бесплодие. Чем раньше проявилось заболевание, тем меньше вероятность забеременеть. При значительной ферментной недостаточности и клинических проявлениях простого вирилизирующего синдрома беременность вообще не наступает.
У забеременевших пациенток с пубертатными и постпубертатными формами заболевания возникают самопроизвольные выкидыши на раннем сроке. В родах возможна функциональная истмико-цервикальная недостаточность. Такие женщины более склонны к возникновению психоэмоциональных расстройств — склонности к депрессии, суицидальному поведению, проявлениям агрессии.
Диагностика
Постановка диагноза при антенатальных типах АГС с характерными изменениями половых органов не представляет сложности и проводится сразу после родов. В сомнительных случаях применяют кариотипирование для подтверждения женского кариотипа (46ХХ), молекулярно-генетические тесты. Большее значение диагностический поиск приобретает при позднем клиническом дебюте или скрытом течении с минимальными внешними проявлениями вирилизации. В подобных ситуациях для выявления адреногенитального синдрома используют следующие лабораторные и инструментальные методы:
- Уровень 17-ОН-прогестерона. Высокая концентрация 17-гидроксипрогестерона, который является предшественником кортизола — ключевой признак недостаточности 21-гидроксилазы. Его содержание увеличено в 3-9 раз (от 15 нмоль/л и выше).
- Стероидный профиль (17-КС). Повышение уровня 17-кетостероидов в моче у женщин в 6-8 раз свидетельствует о высоком содержании андрогенов, производимых корой надпочечников. При выполнении преднизолоновой пробы концентрация 17-КС уменьшается на 50-75%.
- Содержание андростендиона в сыворотке крови. Повышенные показатели этого высокоспецифичного метода лабораторной диагностики подтверждают усиленную секрецию предшественников мужских половых гормонов.
- Уровень АКТГ в крови. Для классических форм заболевания характерна компенсаторная гиперсекреция адренокортикотропного гормона передней долей гипофиза. Поэтому при синдроме вирилизирующей дисфункции показатель повышен.
- УЗИ яичников. В корковом веществе определяются фолликулы на разных стадиях созревания, не достигающие преовуляторных размеров. Яичники могут быть несколько увеличены, однако разрастания стромы не наблюдается.
- Измерение базальной температуры. Температурная кривая типична для ановуляторного цикла: первая фаза растянута, вторая укорочена, что обусловлено недостаточностью желтого тела, которое не образуется из-за отсутствия овуляции.
Для сольтеряющего варианта АГС также характерна повышенная концентрация ренина в плазме крови. Дифференциальная диагностика адреногенитальных расстройств, возникших в пубертатном и детородном возрасте, проводится с синдромом поликистозных яичников, овариальными андробластомами, андростеромами надпочечников, вирильным синдромом гипоталамического происхождения и конституциональным гирсутизмом. В сложных случаях к диагностике привлекают эндокринологов, урологов, врачей-генетиков.
Лечение адреногенитального синдрома
Основным способом коррекции вирильной дисфункции надпочечников является заместительная гормональная терапия, восполняющая дефицит глюкокортикоидов. Если у женщины со скрытым АГС нет репродуктивных планов, кожные проявления гиперандрогении незначительны и месячные ритмичны, гормоны не применяют. В остальных случаях выбор схемы лечения зависит от формы эндокринной патологии, ведущей симптоматики и степени ее выраженности. Зачастую назначение глюкокортикоидных препаратов дополняют другими медикаментозными и хирургическими методами, подобранными в соответствии с конкретной терапевтической целью:
- Лечение бесплодия. При наличии планов по деторождению женщина под контролем андрогенов крови принимает глюкокортикоиды до полного восстановления овуляторного месячного цикла и наступления беременности. В резистентных случаях дополнительно назначают стимуляторы овуляции. Во избежание выкидыша гормонотерапию продолжают до 13-й недели гестационного срока. В I триместре также рекомендованы эстрогены, во II-III — аналоги прогестерона, не обладающие андрогенным эффектом.
- Коррекция нерегулярных месячных и вирилизации. Если пациентка не планирует беременность, но жалуется на расстройство менструального цикла, гирсутизм, угри, предпочтительны средства с эстрогенным и антиандрогенным эффектом, оральные контрацептивы, содержащие гестагены последнего поколения. Терапевтический эффект достигается за 3-6 месяцев, однако по окончании лечения при отсутствии заместительной гормонотерапии признаки гиперандрогении восстанавливаются.
- Лечение врожденных форм АГС. Девочкам с признаками ложного гермафродитизма проводят адекватную гормонотерапию и выполняют хирургическую коррекцию формы половых органов — клитеротомию, интроитопластику (вскрытие урогенитального синуса). При сольтеряющих адреногенитальных расстройствах кроме глюкокортикоидов под контролем рениновой активности назначают минералокортикоиды с увеличением терапевтических доз при возникновении интеркуррентных заболеваний.
Определенные сложности в ведении пациентки возникают в тех случаях, когда заболевание не диагностировано в акушерском стационаре, и девочка с выраженной вирилизацией гениталий регистрируется и воспитывается как мальчик. При решении о восстановлении женской половой идентичности хирургическую пластику и гормонотерапию дополняют психотерапевтической поддержкой. Решение о сохранении гражданского мужского пола и удалении матки с придатками принимается в исключительных случаях по настоянию больных, однако такой подход считается ошибочным.
Прогноз и профилактика
Прогноз при своевременном обнаружении адреногенитального синдрома и адекватно подобранной терапии благоприятный. Даже у пациенток со значительной вирилизацией гениталий после пластической операции возможна нормальная половая жизнь и естественные роды. Заместительная гормонотерапия при любой форме АГС способствует быстрой феминизации — развитию грудных желез, появлению месячных, нормализации овариального цикла, восстановлению генеративной функции. Профилактика заболевания осуществляется на этапе планирования беременности.
Если в роду наблюдались случаи подобной патологии, показана консультация генетика. Проведение пробы с АКТГ обоим супругам позволяет диагностировать гетерозиготное носительство или скрытые формы адреногенитального расстройства. При беременности синдром может быть обнаружен по результатам генетического анализа клеток хорионических ворсин или содержимого околоплодных вод, полученных методом амниоцентеза. Неонатальный скрининг, проводимый на 5-е сутки после родов, направлен на выявление повышенной концентрации 17-гидропрогестерона для быстрого выбора терапевтической тактики.
Врожденная дисфункция коры надпочечников
Адреногенитальный синдром Hадпочечники секретируют кортикостероиды, которые по биологическим свойствам можно разделить на 4 группы: глюкокортикоиды, минералокортикоиды, андрогены и эстрогены. Синтез кортизола в надпочечниках плода под вли
 |
| Адреногенитальный синдром |
Hадпочечники секретируют кортикостероиды, которые по биологическим свойствам можно разделить на 4 группы: глюкокортикоиды, минералокортикоиды, андрогены и эстрогены.
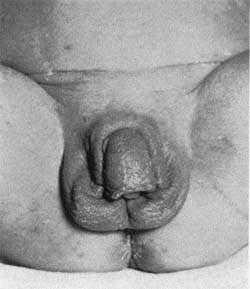
Синтез кортизола в надпочечниках плода под влиянием адренокортикотропного гормона (АКТГ) начинается рано, в связи с этим дефект ферментных систем приводит к вирилизации до рождения ребенка. Так как к этому сроку формирование внутренних половых органов заканчивается, вирилизация затрагивает наружные половые органы.
Из различных ферментных дефектов недостаточность 21-гидроксилазы встречается наиболее часто и протекает в виде двух клинических форм: вирильного и сольтеряющего синдромов.
Вирильная форма связана с частичной недостаточностью 21-гидроксилазы. Как правило, при этом наблюдается компенсация функции коры надпочечников в результате повышенной секреции АКТГ, то есть уровень кортизола определяется на нижней границе нормы. Компенсаторное выделение АКТГ приводит к образованию значительного количества андрогенов, прогестерона, 17-гидроксипрогестерона, которые угнетают сользадерживающую активность на уровне канальцев почек, что ведет к значительному увеличению продукции альдостерона. У девочек с вирильной формой с рождения имеются признаки ложного гермафродитизма. Клитор гипертрофирован, напоминает по строению половой член, имеющий единое мочеполовое отверстие — урогенитальный синус, открывающийся у корня клитора, мошонкообразные большие половые губы.
| Врожденная дисфункция коры надпочечников является наследственным заболеванием, характеризующимся нарушением синтеза кортикостероидов, в основном кортизола, в результате дефицита ферментных систем коры надпочечников с одновременной избыточной продукцией андрогенов в надпочечниках |
У мальчиков с рождения отмечается увеличение полового члена, кожа мошонки морщинистая, выражена пигментация шва полового члена, кожи мошонки, передней линии живота, ареолы сосков.
В постнатальном периоде продолжается избыточная секреция андрогенов, усиливаются явления вирилизации. Дети быстрее растут, имеют развитую мускулатуру. Вначале больные обгоняют в росте сверстников, в дальнейшем же, после 9-10 лет, в связи с закрытием зон роста остаются низкорослыми. В возрасте 2-4 лет появляется преждевременное оволосение на лобке, подмышках, туловище, лице. У некоторых мальчиков значительно увеличивается половой член и появляются эрекции. Телосложение девочек мускулинного типа. В пубертатный период менструации не наступают, молочные железы не развиваются, так как повышенная секреция андрогенов надпочечниками по принципу обратной связи тормозит образование и выделение гонадотропинов. У мальчиков по этой причине угнетается развитие яичек — они остаются маленькими.
При сольтеряющей форме дефицит 21-гидроксилазы более глубокий, поэтому наряду с дефицитом образования кортизола происходит резкое снижение биосинтеза альдостерона. Если при вирильной форме потеря натрия, обусловленная избыточной продукцией прогестерона, 17-гидроксипрогестерона, компенсируется избыточной секрецией альдостерона, то при сольтеряющей форме снижено образование альдостерона. Результатом такого комбинированного действия является развитие клинической картины по типу острой надпочечниковой недостаточности.
| Заболевание наследуется по аутосомно-рецессивному типу и проявляется в гомозиготном состоянии. Распространенность составляет в среднем 1:4000-5000, а гетерозиготное носительство — 1:35-40 человек |
У новорожденных при этом синдроме резко выражены симптомы вирилизации, особенно у детей женского пола — полное заращение половой щели и появление мошоночноподобного образования. На 5-10-й день наступает быстрое ухудшение состояния, связанное с частой рвотой, жидким стулом. Развивается дегидратация, ребенок становится вялым, снижается масса тела. В сыворотке крови нарастает уровень кальция и снижается содержание натрия и хлора.
Гипертоническая форма дисфункции коры надпочечников, связанная с дефицитом 11b-гидроксилазы, встречается реже. В клинической картине, помимо признаков андрогенизации в раннем возрасте, характерно повышение артериального давления. При этой патологии отсутствует гиперплазия юкстагломерулярного аппарата почки и уровень ренина в плазме не повышен.
Дифференциальный диагноз врожденной дисфункции коры надпочечников у девочек первых лет жизни следует проводить с дисгенезией гонад, анорхизмом, истинным гермафродитизмом; у мальчиков — с преждевременным половым развитием различного генеза, в том числе с опухолью яичка, с андрогенпродуцирующей опухолью надпочечника (андростерома). Сольтеряющую форму у новорожденных дифференцируют с пилороспазмом и пилоростенозом.
У девочек старшего возраста при подозрении на врожденную дисфункцию коры надпочечников требуется исключить такие заболевания, как андрогенпродуцирующая опухоль яичника, стромальный текоматоз, поликистоз яичников.
Наиболее приемлемым средством заместительной терапии является преднизолон, который в течение длительного срока сохраняет достаточную концентрацию и обладает некоторым минералокортикоидным действием. Суточная доза его подбирается индивидуально и колеблется в зависимости от возраста: от 1,5-3 мг (для детей младше 3 лет) до 5 мг для детей старшего возраста. Реже применяют преднизолон, кортизон, дексаметазон. Соответственно суточному физиологическому ритму 17-гидроксипрогестерона принимать преднизолон рекомендуется рано утром, в 6-7 часов (причем в это время следует принять 2/3-1/2 дозы) и поздно вечером (23-24 часа). Глюкокортикоиды больные должны получать постоянно, так как отмена препарата ведет к декомпенсации заболевания.
При лечении больных с сольтеряющей формой врожденной дисфункции коры надпочечников к кортикостероидам добавляют минералкортикоиды. Это либо масляный раствор дезоксикортикостерона ацетата (ДОКА), либо таблетированный препарат кортинеф (0,1 мг), который в 5-10 раз активнее первого. Препараты назначаются в течение 1-2 недель ежедневно (ДОКА по 1-2 мл, кортинеф по 1 таб.) с последующим постепенным снижением дозы до оптимальной. Возможно поддерживающую терапию проводить через каждые 1-2 дня. У некоторых больных дефицит минералкортикоидов можно компенсировать добавлением в пищу поваренной соли. Обязательный контроль за весом, артериальным давлением, калием, натрием, ЭКГ.
Начальные дозы кортикостероидов должны быть в два раза выше физиологических.
При адекватном лечении у детей уменьшается мышечная гипертрофия, перераспределяется подкожножировая клетчатка, половое оволосение не прогрессирует. Если лечение начинают до закрытия ядер окостенения, то увеличивается темп роста. В случаях же поздней терапии эти дети так и остаются низкорослыми.
Гипертоническая форма заболевания лечится аналогично вирильной.
При присоединении интеркуррентных заболеваний дозу глюкокортикоидов увеличивают в 1,5-2 раза.
В случае развития острого криза недостаточности коры надпочечников показано внутривенное капельное введение жидкости (физиологический раствор и 5%-ный раствор глюкозы 100-200 мл/кг массы тела в сутки) в 4 приема, ДОКА 2-3 мг/кг массы тела в сутки. В последующие дни доза глюкокортикоидов быстро снижается и больной переводится на пероральный прием преднизолона.
Важное место в лечении врожденной дисфункции коры надпочечников занимает психотерапия, особенно в случае необходимости перемены пола ребенка.
Большинство девочек с этим заболеванием нуждается в проведении феминизирующей пластики наружных гениталий, удалении клитора и формировании малых половых губ после вскрытия урогенитального синуса. Коррекцию наружных гениталий рекомендуется проводить через год после назначения кортикостероидной терапии.
Читайте также:
- Оценка результатов велоэргометрии. Норма показателей велоэргометрии
- Развитие грудного протока эмбриона. Образование лимфатических узлов плода
- Волшебная глина: Косметические процедуры на основе глины
- Условия труда в литейном цехе машиностроительной промышленности
- Рентгенограмма, КТ, МРТ, УЗИ при дисгенезии гонад
