Векторы. Векторы на основе РНК-содержащих вирусов. Векторы на основе ДНК-геномных вирусов. Невирусные векторы.
Добавил пользователь Валентин П. Обновлено: 01.02.2026
Биопрепараты - это фармацевтические препараты от молекул до клеток, которые выделяются из биологических источников. В то время как химические препараты составляются и синтезируются с помощью определенного упорядоченного процесса, производство биологических препаратов основывается на использовании природных механизмов получения, при этом уменьшается степень непосредственного контроля со стороны ученых и возникает необходимость принятия дополнительных мер для обеспечения стабильного производства.
Биологические препараты - это, как правило, продукты передовых биомедицинских исследований. Они часто используются для лечения заболеваний, для которых не существует альтернативного терапевтического подхода. Для получения биопрепаратов ученые должны найти или создать такую биологическую систему, которая при надлежащих условиях будет непрерывно производить целевое лекарственное средство. Системой, которую в большинстве случаев выбирают для получения биопрепаратов, является эукариотическая либо прокариотическая клетка. Как правило, оптимальными кандидатами на роль производящих клеток являются иммортализованные клеточные линии, которые имеются в нужном количестве и легко культивируются.
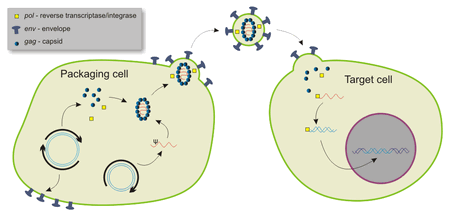
Клетки, используемые в качестве биологических фабрик, могут вырабатывать целевой препарат, но обычно не производят его в достаточном количестве в эндогенных условиях. Чтобы устранить эту проблему, ученые вводят в производящую клетку генетический материал, кодирующий нужную молекулу. Для повышения эффективности этого процесса для переноса и доставки нуклеиновых кислот ученые используют бактериальные (трансфекция) или вирусные (трансдукция) векторы. Прежде чем приступить к этому, в сами векторы должна быть интегрирована целевая последовательность, а затем они должны быть массово размножены.
Вирусам свойственно интегрировать при заражении свой генетический материал в механизмы клетки-хозяина, что делает их идеальными кандидатами на роль вектора. Существует ряд ключевых факторов, определяющих пригодность вируса для использования в качестве вектора. Идеальный вирус должен обладать стабильным геномом, избирательностью к типу клеток, эффективными показателями инфицирования, минимальным влиянием на физиологию инфицированных клеток и минимальной патогенностью.
Вирусные векторы получают аналогично другим биопрепаратам. Вирусами, содержащими необходимый ген, инфицируют культивируемые клетки. Затем эти клетки производят и выделяют в культуральную среду дополнительные копии вируса, которые собирают и очищают. Выход, чистота и качество вирусных векторов, получаемых во время этого процесса, влияют на эффективность последующей процедуры трансдукции, которая в свою очередь влияет на качество и эффективность получения конечного биологического препарата.
Эффективный метод центрифугирования является важным инструментом для оптимизации очистки вирусных векторов. С помощью высокоскоростного центрифугирования и ультрацентрифугирования вирусные частицы эффективно отделяются от клеток и продуктов клеточного распада, в то время как аналитическое ультрацентрифугирование позволяет определять и отделять вирусные частицы на основе плотности капсида - меры полезной вирусной нагрузки. Это позволяет удалить до начала трансдукции пустые вирусы и вирусы, в которые необходимый генетический материал интегрирован лишь частично. Когда речь заходит о получении конечного продукта, способность равномерно производить большие количества высококачественного вируса имеет решающее значение для обеспечения постоянства качества и эффективности от партии к партии.
Качество вирусного вектора важно для поддержания оптимального производства биологических препаратов. С помощью центрифугирования можно значительно ускорить процесс производства и очистки вирусных векторов, что в конечном итоге будет способствовать повышению эффективности и качества производства биопрепаратов. Чтобы узнать больше об использовании центрифугирования в производстве вирусных векторов, просмотрите представленный короткий видеофильм.
Генотерапевтические векторные системы на основе вирусов

Основным объектом при проведении экспертизы на возможность медицинского применения генетических конструкций на основе вирусов, предназначенных для введения генов в геном человека, являются получаемые биотехнологическим путем структуры, имитирующие в организме человека поведение вирусной частицы, но не вызывающие инфекционный процесс. В их состав входят: белки вируса, формирующие оболочку частицы, способную к узнаванию клеток-мишеней и к интернализации в цитоплазму; и трансген-экспрессирующая кассета, осуществляющая после доставки в клетку длительную экспрессию одного или нескольких генов. Распространение в практике генной терапии наследственных и инфекционных болезней приобрели векторные системы на основе лентивирусов, аденовирусов, аденоассоциированных вирусов, ортопоксвирусов, герпесвирусов и отдельных РНК-вирусов, не относящихся к ретровирусам. Достигнутый уровень генной инженерии позволяет создавать векторные системы, нацеленные на разные типы клеток и участки генома человека (векторы на основе ВИЧ). Векторные системы, полученные на основе лентивирусов и аденоассоциированных вирусов, способны интегрировать трансген-экспрессирующую кассету с геномом клеток-мишеней. Псевдотипирование векторов с гликопротеинами оболочки вируса бешенства придает им способность ретроградно транспортировать трансгены по нейрональным аксонам в ЦНС. Для изменения тропизма векторных систем исследователями используются несколько приемов: физический таргетинг, заключающийся в покрытии вирусной частицы специальной оболочкой, изменяющей ее природный тропизм и делающей ее неузнаваемой для иммунной системы человека; и генетическая модификация вируса, предполагающая модификацию белков оболочки вектора. Повышение эффективности транскрипции трансгена в клетке-мишени достигается путем транскрипционального таргетинга, предполагающего введение в трансген-экспрессирующую кассету специфических для данных тканей промоторных последовательностей.
Библиографическое описание: Супотницкий М.В. Генотерапевтические векторные системы на основе вирусов // Биопрепараты. - 2011. - № 3. - С. 15-26.
The main objects of performing the expertise of the possibility of medical application of genetic constructions based on viruses, developed for inserting genes into human genome, are structures derived by biotechnologies, imitating virus particle behavior, but not causing infectious process. They content of viral proteins, forming the particle's coat, able to recognize target-cells and to internalize into cytoplasm; and transgene expression cassettes, performing longtime expression of one or more genes after being delivered to a cell. In gene therapy of hereditary and infectious diseases vector systems based on lentiviruses, adenoviruses, adeno-associated viruses, orthopoxvirus, herpesviruses and single RNA- viruses, which do not relate to retroviruses are widespread. The achieved level of gene engineering allows to create vector systems, aimed at different cell types and parts of human genome (vectors, based on HIV). Vector systems, derived based on lentiviruses and adeno-associated viruses are able to integrate transgene expression cassette into target cells genome. Pseudotyping of vectors with lyssavirus glycoproteins coat provides them with a capability to retrograde transportation of transgenes to CNS by neuronal axons. For the purpose of changing vector systems tropism the scientists use few methods: physical targeting, which means covering virus particle with a special coat, changing it's natural tropism and making it incognoscible for human immune system; and virus genetic modification, which means modifying proteins of vector cover. Increasing of transgene transcription efficacy in a target-cell is performed by transcriptional targeting, which means inserting specific for the given tisues promotor sequences into transgene expression cassette.
Bibliographical description: Supotnitskiy M.V. Genotherapeutic vector systems based on viruses // Biopreparats (Biopharmaceuticals). - 2011. - No. 3. - P. 15-26.
Генная терапия наследственных и инфекционных болезней предполагает доставку генов в клетки-мишени. Но ни ДНК, ни РНК не могут быть использованы в «голом виде» для достижения этой цели. Сахарофосфатный остов молекул нуклеиновых кислот располагается по их периферии полярными группами наружу, придавая им анионные свойства. При физиологических значениях рН нуклеиновая кислота несет отрицательный заряд, отталкивающий ее от отрицательно заряженной наружной поверхности клеточной мембраны. Еще одно ограничение при проникновении в клетку нуклеиновой кислоте создает ее гидро- фильность. Все ее гидрофобные основания «повернуты» вовнутрь молекулы, поэтому она не может проникнуть через гидрофобный барьер клетки-мишени. В сыворотке крови нуклеиновая кислота быстро деградирует под воздействием нуклеаз. Период полужизни немодифицированной интерферирующей РНК в сыворотке крови укладывается в 5 - 60 мин, для ДНК - он составляет не более 10 мин. Кроме того, нуклеиновые кислоты не способны специфически узнавать клетки-мишени [25]. Поэтому для доставки генов в эукариотические клетки, с начала 1980-х гг. разрабатываются векторные генетические конструкции. В настоящее время сформировалось два альтернативных направления их создания - на основе вирусов и на основе искусственных векторных систем. Цель работы - анализ подходов к конструированию генотерапевтических векторных систем на основе вирусов. Данная публикация представляет собой начало цикла статей, посвященных способам и средствам, используемым при доставке генов в геном человека в рамках технологий генной терапии наследственных и инфекционных болезней.
Ретровирусные векторные системы. Ретровирусы относятся к группе вирусов, РНК-геном которых в инфицированных клетках конвертируется в ДНК. Геном ретровирусов включает три структурных гена, обозначенные как gag, pol и env, фланки- рованых элементами, названными длинными терминальными повторами (LTR, viral long terminal repeat). В LTR содержатся регуляторные элементы, выполняющие важные функции в жизненном цикле ретровируса. Эти повторы необходимы для интеграции ДНК копии генома вируса с геномом хозяина. Они определяют, где начало и где конец вирусного генома. LTR также служат энхансер-промоторными последовательностями, т.е. они контролируют экспрессию генов вируса. Большой геном ретровирусов облегчает генетические манипуляции.
После инфицирования клетки-мишени копия ретровирусной ДНК интегрируется с ее геномом строго определенным образом. Практически все инфицированные клетки способны экс- прессировать гены, привнесенные вирусом. Мощные транскрипционные энхансеры существенно повышают уровень экспрессии генов, клонированных в клетках различных типов. С их помощью можно переместить до 8 т.п.о., что в большинстве случаев более чем достаточно для синтеза крупномолекулярных белков. Весьма удобным для исследователя является то обстоятельство, что ретровирусные векторы можно размножать, достигая их высокой концентрации в небольшом объёме - более 10 9 вирусных частиц/см 3 . В опытах по инфицированию ретровирусами мозга, печени, мышц, глаз или клеток панкреатических островков грызунов показана устойчивая экспрессия трансгенов в течение более 6 мес. [9]. Ранние этапы жизненного цикла ретровирусов и векторов на их основе показаны на рис. 1.
Рис. 1. Ранние этапы жизненного цикла ретровирусов и векторов на их основе. Проникновение ретровируса в клетку сопровождается освобождением капсида от его оболочки и началом синтеза двуцепочечного ДНК-генома (провируса) на матрице вирусной РНК с помощью РНК-зависимой ДНК-полимеразы (обратной транскриптазы), входящей в состав вирусного нуклеокапсида. Затравкой (праймером) этой многоступенчатой реакции служит клеточная тРНК (для большинства MuLV - пролиновая тРНК), комплементарная PBS- участку, расположенному в 5'-концевой части вирусной РНК. Конечным продуктом полимеразной реакции является двуцепочечный ДНК-провирус, содержащий все вирусные гены и фланкированный 3'- и 5'-LTR. Вирусная ДНК, интеграза (IN) и отдельные вирусные и клеточные белки образуют вирусный преинтеграционный комплекс, который импортируется во внутрь ядра. IN катализирует интеграцию вирусной ДНК с ДНК генома клетки. По [18].
Векторы на основе ретровирусов с самого начала их разработки предназначались для введения через неповрежденные клетки за счет механизмов слияния, обеспечиваемых поверхностными белками оболочки вируса. Чувствительность дыхательного эпителия к ретровирусным инфекциям подразумевает возможность ингаляционного пути введения в организм человека векторных конструкций на основе ретровирусов. Сравнение свойств наиболее распространенных генотерапев- тических векторных систем приведено в табл. 1.
Таблица 1. Сравнение свойств наиболее распространенных генотерапевтических векторных систем
Вирусный вектор - Viral vector

Вирусные векторы - это инструменты, обычно используемые молекулярными биологами для доставки генетического материала в клетки. Этот процесс можно проводить внутри живого организма (in vivo ) или в культуре клеток (in vitro ). Вирусы развили специализированные молекулярные механизмы для эффективной транспортировки своих геномов внутри клеток, которые они заражают. Доставка генов или другого генетического материала вектором называется трансдукцией, а инфицированные клетки описываются как трансдуцированные. Молекулярные биологи впервые использовали этот механизм в 1970-х годах. Пол Берг использовал модифицированный вирус SV40, содержащий ДНК от бактериофага λ, для заражения клеток почек обезьян, поддерживаемых в культуре.
Помимо использования в исследованиях молекулярной биологии, вирусные векторы используются для генной терапии и разработки вакцин.
Содержание
- 1 Ключевые свойства вирусного вектора
- 2 Приложения
- 2.1 Фундаментальные исследования
- 2.2 Генная терапия
- 2.3 Вакцины
- 3.1 Ретровирусы
- 3.2 Лентивирусы
- 3.3 Аденовирусы
- 3.4 Аденоассоциированные вирусы
- 3.5 Вирусы растений
- 3.6 Гибриды
Ключевые свойства вирусного вектора
Вирусные векторы адаптированы к их конкретным приложениям, но обычно имеют несколько общих свойств.
- Безопасность: хотя вирусные векторы иногда создаются из патогенных вирусов, они модифицируются таким образом, чтобы минимизировать риск обращения с ними. Обычно это включает делецию части вирусного генома, критическую для репликации вируса. Такой вирус может эффективно инфицировать клетки, но после того, как заражение произошло, требуется для обеспечения недостающих белков для производства новых вирионов.
- Низкая токсичность : Вирусный вектор должен иметь минимальное влияние на физиологию клетки, которую он заражает.
- Стабильность: Некоторые вирусы генетически нестабильны и могут быстро перестраивать свои геномы. Это отрицательно сказывается на предсказуемости и воспроизводимости работы, проводимой с использованием вирусного вектора, и избегается при их разработке.
- Специфичность типа клеток: большинство вирусных векторов сконструированы так, чтобы инфицировать широкий диапазон типов клеток насколько возможно. Однако иногда предпочтительнее обратное. Вирусный рецептор можно модифицировать для нацеливания вируса на конкретный вид клетки. Вирусы, модифицированные таким образом, называются псевдотипами.
- Идентификация: вирусным векторам часто присваиваются определенные гены, которые помогают идентифицировать, какие клетки переняли вирусные гены. Эти гены называются маркерами. Обычным маркером является устойчивость к определенному антибиотику. Затем клетки могут быть легко изолированы, так как те, которые не захватили гены вирусных векторов, не обладают устойчивостью к антибиотикам и поэтому не могут расти в культуре с присутствием соответствующего антибиотика.
Приложения
Базовые исследования
Вирусные векторы были первоначально разработаны как альтернатива трансфекции голой ДНК для молекулярно-генетических экспериментов. По сравнению с традиционными методами, такими как преципитация фосфатом кальция , трансдукция может гарантировать, что почти 100% клеток инфицированы, без серьезного воздействия на жизнеспособность клеток. Кроме того, некоторые вирусы интегрируют в клеточный геном, способствуя стабильной экспрессии.
Гены, кодирующие белок, могут быть экспрессированы с использованием вирусных векторов, обычно для изучения функции конкретного белка. Вирусные векторы, особенно ретровирусы, стабильно экспрессирующие маркерные гены, такие как GFP, широко используются для постоянного маркирования клеток для отслеживания их и их потомства, например, в экспериментах по ксенотрансплантации, когда клетки, инфицированные in vitro, имплантируют животному-хозяину.
Встраивание гена дешевле выполнять, чем нокаут гена. Но поскольку молчание иногда неспецифично и оказывает нецелевое воздействие на другие гены, оно дает менее надежные результаты. Векторы животных-хозяев также играют важную роль.
Генная терапия
Генная терапия - это метод исправления дефектных генов, ответственных за развитие болезни. В будущем генная терапия может предоставить способ лечения генетических нарушений, таких как тяжелый комбинированный иммунодефицит, кистозный фиброз или даже гемофилия A. Поскольку эти заболевания являются результатом мутаций в последовательности ДНК для конкретных генов, в исследованиях генной терапии использовали вирусы для доставки немутантных копий этих генов в клетки тела пациента. Генная терапия добилась огромных успехов в лабораторных условиях. Однако необходимо преодолеть несколько проблем вирусной генной терапии, прежде чем она получит широкое распространение. Иммунный ответ на вирусы не только препятствует доставке генов к клеткам-мишеням, но может вызывать серьезные осложнения для пациента. В одном из первых испытаний генной терапии в 1999 г. это привело к смерти Джесси Гелсингера, который лечился с использованием аденовирусного вектора.
Некоторые вирусные векторы, например гамма- ретровирусы, вставляют свои геномы в кажущееся случайным место на одной из хромосом хозяина, что может нарушить функцию клеточных генов и привести к раку. В исследовании тяжелого комбинированного иммунодефицита ретровирусной генной терапии, проведенного в 2002 году, у четырех пациентов в результате лечения развился лейкоз; трое из пациентов выздоровели после химиотерапии. Векторы на основе аденоассоциированного вируса намного безопаснее в этом отношении, поскольку они всегда интегрируются в одном и том же месте в геноме человека и применяются при различных заболеваниях, таких как Болезнь Альцгеймера.
Вакцины
A живая векторная вакцина представляет собой вакцину, в которой используется химически ослабленный вирус для транспортировки частей патогена с целью стимулирования иммунный ответ. Вирусы, экспрессирующие белки патогенов, в настоящее время разрабатываются в качестве вакцин против этих патогенов, исходя из тех же соображений, что и ДНК-вакцины. Гены, используемые в таких вакцинах, обычно кодируются антигеном из патогенного организма. Затем они вставляются в геном непатогенного организма, где они экспрессируются на поверхности организма и могут вызывать иммунный ответ.
Примером может служить вакцина против гепатита B, где инфекция гепатита B контролируется с помощью рекомбинантной вакцины, которая содержит поверхностную форму вируса гепатита B. антиген, продуцируемый дрожжевыми клетками. Разработка рекомбинантной субъединичной вакцины была важной и необходимой разработкой, поскольку вирус гепатита В, в отличие от других распространенных вирусов, таких как вирус полиомиелита, не может выращиваться in vitro.
Т-лимфоцитами распознавать клетки, инфицированные внутриклеточными паразитами, на основе чужеродных белков, продуцируемых внутри клетки. Т-клеточный иммунитет имеет решающее значение для защиты от вирусных инфекций и таких заболеваний, как малярия. Вирусная вакцина индуцирует экспрессию патогенных белков в клетках-хозяевах аналогично вакцине Sabin полиомиелиту и другим аттенуированным вакцинам. Однако, поскольку вирусные вакцины содержат лишь небольшую часть генов патогенов, они намного безопаснее, и спорадическое заражение патогеном невозможно. Аденовирусы активно разрабатываются в качестве вакцин.
Ретровирусы
Ретровирусы являются одной из опор современных подходов к генной терапии. Рекомбинантные ретровирусы, такие как вирус мышиного лейкоза Молони , обладают способностью стабильно интегрироваться в геном хозяина. Они содержат обратную транскриптазу для создания ДНК-копии генома РНК и интегразу, которая обеспечивает интеграцию в геном хозяина . Они использовались в ряде одобренных FDA клинических испытаний, таких как испытание SCID-X1.
Ретровирусные векторы могут быть репликационно-компетентными или репликационно-дефектными. Векторы с дефектом репликации являются наиболее распространенным выбором в исследованиях, потому что у вирусов кодирующие области для генов, необходимых для дополнительных раундов репликации и упаковки вириона, заменены другими генами или удалены. Эти вирусы способны инфицировать свои клетки-мишени и доставлять свою вирусную нагрузку, но затем не могут продолжать типичный литический путь, который приводит к лизису и гибели клеток.
Главный недостаток использования ретровирусов, таких как ретровирус Молони, заключается в том, что клетки должны активно делиться для трансдукции. В результате клетки, такие как нейроны, очень устойчивы к инфекции и трансдукции ретровирусами.
Лентивирусы
Лентивирусы являются подклассом ретровирусов. Иногда они используются в качестве векторов для генной терапии благодаря их способности интегрироваться в геном неделящихся клеток, что является уникальной особенностью лентивирусов, поскольку другие ретровирусы могут инфицировать только делящиеся клетки. клетки. Вирусный геном в форме РНК подвергается обратной транскрипции, когда вирус проникает в клетку для производства ДНК, которая затем случайным образом вставляется в геном. положение (недавние открытия фактически предполагают, что внедрение вирусной ДНК не является случайным, а направлено на конкретные активные гены и связано с организацией генома) вирусным ферментом интеграза . Вектор, теперь называемый провирусом, остается в геноме и передается потомству клетки при делении. Пока не существует методов определения места интеграции, которые могут создать проблему. провирус может нарушать функцию клеточных генов и приводить к активации онкогенов, способствующих развитию рака, что вызывает опасения по поводу возможных применение лентивирусов в генной терапии. Однако исследования показали, что лентивирусные векторы имеют меньшую тенденцию к интеграции в местах, потенциально вызывающих рак, чем гамма-ретровирусные векторы. В частности, одно исследование показало, что лентивирусные векторы не вызывали ни увеличения заболеваемости опухолями, ни более раннего возникновения опухолей у линии мышей с гораздо более высокой заболеваемостью опухолями. Более того, клинические испытания, в которых использовались лентивирусные векторы для доставки генной терапии для лечения ВИЧ, не показали увеличения мутагенных или онкологических явлений.
По соображениям безопасности лентивирусные векторы никогда не несут гены, необходимые для их репликации. Для получения лентивируса несколько плазмид трансфицируют в так называемую упаковку клеточной линии, обычно HEK 293. Одна или несколько плазмид, обычно называемых упаковывающими плазмидами, кодируют белки вириона , такие как капсид и обратная транскриптаза. Другая плазмида содержит генетический материал, который должен доставить вектор. Он транскрибируется для получения вирусного генома с одноцепочечной РНК и маркируется наличием последовательности ψ (psi). Эта последовательность используется для упаковки генома в вирион.
Аденовирусы
В отличие от лентивирусов, аденовирусная ДНК не интегрируется в геном и не реплицируется во время деления клеток. Это ограничивает их использование в фундаментальных исследованиях, хотя аденовирусные векторы все еще используются в экспериментах in vitro, а также in vivo. Их основные применения - генная терапия и вакцинация. Поскольку люди обычно контактируют с аденовирусами, которые вызывают респираторные, желудочно-кишечные и глазные инфекции, у большинства пациентов уже выработаны нейтрализующие антитела, которые могут инактивировать вирус до того, как он достигнет клетки-мишени.. Чтобы преодолеть эту проблему, ученые в настоящее время исследуют аденовирусы, которые инфицируют различные виды, к которым у людей нет иммунитета.
Аденоассоциированные вирусы
Аденоассоциированный вирус (AAV) - небольшой вирус, поражающий людей и некоторые другие виды приматов. В настоящее время не известно, что AAV вызывает заболевание и вызывает очень слабый иммунный ответ. AAV может инфицировать как делящиеся, так и неделящиеся клетки и может включать свой геном в геном клетки-хозяина. Более того, AAV в основном остается эписомным (реплицируется без включения в хромосому); выполняя долгое и стабильное выражение. Эти особенности делают AAV очень привлекательным кандидатом для создания вирусных векторов для генной терапии. Однако AAV может передавать только до 5 КБ, что значительно меньше исходной емкости AAV.
Кроме того, из-за его потенциального использования в качестве вектора генной терапии исследователи создали измененный AAV, названный само- комплементарный аденоассоциированный вирус (scAAV). В то время как AAV упаковывает одну цепь ДНК и требует процесса синтеза второй цепи, scAAV упаковывает обе цепи, которые отжигаются вместе с образованием двухцепочечной ДНК. Пропуск синтеза второй цепи scAAV обеспечивает быструю экспрессию в клетке. В остальном scAAV обладает многими характеристиками своего аналога AAV.
Вирусы растений
Вирусы растений могут использоваться для создания вирусных векторов, инструментов, обычно используемых для доставки генетического материала в клетки растений ; они также являются источниками биоматериалов и нанотехнологических устройств. Вирус табачной мозаики (TMV) - первый обнаруженный вирус. Вирусные векторы на основе вируса табачной мозаики включают векторы, используемые в технологиях экспрессии растений magnICON® и TRBO.
Гибриды
Гибридные векторы - это векторные вирусы, которые генетически сконструированы и обладают качествами более чем одного вектора. Вирусы изменяют, чтобы избежать недостатков типичных вирусных векторов, которые могут иметь ограниченную нагрузочную способность, иммуногенность, генотоксичность и не могут поддерживать долгосрочную адекватную трансгенную экспрессию. За счет замены нежелательных элементов желаемыми способностями гибридные векторы могут в будущем превзойти стандартные векторы трансфекции с точки зрения безопасности и терапевтической эффективности.
Проблемы в применении
Выбор вирусный вектор для доставки генетического материала в клетки сопряжен с некоторыми логистическими проблемами. Существует ограниченное количество вирусных векторов, доступных для терапевтического использования. Любой из этих нескольких вирусных векторов может вызвать в организме развитие иммунного ответа, если вектор рассматривается как чужеродный захватчик. После использования вирусный вектор не может быть эффективно использован снова у пациента, потому что он будет распознаваться организмом. Если вакцина или генная терапия потерпят неудачу в клинических испытаниях, вирус не может быть снова использован у пациента для другой вакцины или генной терапии в будущем.. Ранее существовавший иммунитет против вирусного вектора также может присутствовать у пациента, что делает терапию неэффективной для этого пациента. Можно противодействовать ранее существовавшему иммунитету при использовании вирусного вектора для вакцинации путем примирования невирусной ДНК-вакциной, но этот метод требует дополнительных затрат. и препятствие в процессе распределения вакцины. Существующий ранее иммунитет также может быть вызван увеличением дозы вакцины или изменением способа вакцинации. Некоторые недостатки вирусных векторов (такие как генотоксичность и низкая трансгенная экспрессия) можно преодолеть с помощью гибридных векторов.
Вирусные векторы инструменты, обычно используемые молекулярными биологи доставлять генетический материал в клетки. Этот процесс может происходить внутри живого организма (in vivo ) или в культура клеток (in vitro ). Вирусы развили специализированные молекулярные механизмы для эффективной транспортировки своих геномы внутри клеток они заражают. Доставка гены, или другой генетический материал, вектором называется трансдукция и инфицированные клетки описаны как трансдуцированные. Молекулярные биологи впервые использовали эту технику в 1970-х годах. Пол Берг использовал модифицированный SV40 вирус, содержащий ДНК из бактериофаг λ заразить обезьяну почка клетки сохраняются в культуре. [1]
Помимо использования в исследованиях молекулярной биологии, вирусные векторы используются для генная терапия и развитие вакцина.
Вирусные векторы адаптированы к их конкретным приложениям, но обычно имеют несколько ключевых свойств.
- Безопасность: Хотя вирусные векторы иногда создаются из патогенный вирусов, они модифицированы таким образом, чтобы свести к минимуму риск обращения с ними. Обычно это включает удаление части вирусного генома, критически важной для вирусная репликация. Такой вирус может эффективно инфицировать клетки, но, как только заражение произошло, требуется вспомогательный вирус предоставить недостающий белки для производства новых вирионы.
- Низкая токсичность: Вирусный вектор должен оказывать минимальное влияние на физиология клетки, которую он заражает.
- Стабильность: Некоторые вирусы генетически нестабильны и могут быстро перестраивать свой геном. Это пагубно сказывается на предсказуемости и воспроизводимости работы, проводимой с использованием вирусного вектора, и этого избегают при их разработке.
- Специфичность типа клеток: Большинство вирусных векторов сконструированы так, чтобы инфицировать широкий спектр типы клеток насколько возможно. Однако иногда предпочтительнее обратное. Вирусный рецептор можно модифицировать для нацеливания вируса на конкретный вид клетки. Вирусы, модифицированные таким образом, называются псевдотип.
- Идентификация: Вирусным векторам часто присваиваются определенные гены, которые помогают определить, какие клетки приняли вирусные гены. Эти гены называются маркеры. Обычный маркер сопротивление к определенному антибиотику. Затем клетки могут быть легко изолированы, поскольку те, которые не захватили гены вирусных векторов, не обладают устойчивостью к антибиотикам и поэтому не могут расти в культуре с присутствием соответствующего антибиотика.
Фундаментальные исследования
Первоначально вирусные векторы были разработаны как альтернатива трансфекция из голая ДНК за молекулярная генетика эксперименты. По сравнению с традиционными методами, такими как фосфат кальция осадки, трансдукция может гарантировать, что почти 100% клеток инфицированы, не сильно влияя на жизнеспособность клеток. Кроме того, некоторые вирусы интегрировать в камеру геном облегчение стабильного выражения.
Протеин кодирующие гены могут быть выразил с использованием вирусных векторов, обычно для изучения функции конкретного белка. Вирусные векторы, особенно ретровирусы, стабильно экспрессирующие маркерные гены Такие как GFP широко используются для постоянной маркировки клеток для отслеживания их и их потомства, например, в ксенотрансплантация эксперименты, когда клетки заражены in vitro имплантируются животному-хозяину.
Внедрение гена дешевле, чем нокаут гена. Но поскольку молчание иногда неспецифично и оказывает нецелевое воздействие на другие гены, оно дает менее надежные результаты. Векторы животных-хозяев также играют важную роль.
Генная терапия - это метод исправления дефектных генов, ответственных за развитие болезни. В будущем, генная терапия может предоставить способ вылечить генетические нарушения, Такие как тяжелый комбинированный иммунодефицит, кистозный фиброз или даже гемофилия А. Потому что эти заболевания возникают в результате мутации В последовательности ДНК для определенных генов в исследованиях генной терапии использовали вирусы для доставки немутантных копий этих генов в клетки тела пациента. Генная терапия добилась огромных успехов в лабораторных условиях. Однако необходимо решить ряд проблем вирусной генной терапии, прежде чем она получит широкое распространение. Иммунная реакция к вирусам не только препятствует доставке генов к клеткам-мишеням, но может вызвать серьезные осложнения для пациента. В одном из первых испытаний генной терапии в 1999 г. это привело к смерти Джесси Гелсингер, который лечился с использованием аденовирусного вектора. [2]
Некоторые вирусные векторы, например гамма-ретровирусы, вставить свои геномы в кажущееся случайным место на одном из хостов хромосомы, которые могут нарушить функцию клеточных генов и привести к раку. В тяжелый комбинированный иммунодефицит ретровирусный генная терапия исследование, проведенное в 2002 году, у четырех пациентов в результате лечения развилось лейкозное заболевание; [3] трое из пациентов выздоровели после химиотерапии. [4] Аденоассоциированные вирусные векторы намного безопаснее в этом отношении, поскольку они всегда интегрируются в одном и том же месте в геноме человека, с применением при различных заболеваниях, таких как Болезнь Альцгеймера. [5]
Вакцина
А живая векторная вакцина это вакцина который использует химически ослабленный вирус транспортировать части патогена, чтобы стимулировать иммунная реакция. [6] Вирусы, выражающие возбудитель белки в настоящее время разрабатываются как вакцина против этих патогенов, исходя из тех же соображений, что и ДНК-вакцины. Гены, используемые в таких вакцинах, обычно антиген кодирование поверхностные белки от патогенный организм. Затем они вставляются в геном непатогенного организма, где они экспрессируются на поверхности организма и могут вызывать иммунный ответ.
Примером может служить вакцина против гепатита В, куда Гепатит Б Инфекция контролируется с помощью рекомбинантной вакцины, которая содержит форму поверхностного антигена вируса гепатита В, продуцируемого в дрожжевых клетках. Разработка рекомбинантной субъединичной вакцины была важной и необходимой разработкой, поскольку вирус гепатита В, в отличие от других распространенных вирусов, таких как вирус полиомиелита, нельзя выращивать in vitro. [7]
Т-лимфоциты распознавать клетки, инфицированные внутриклеточный паразиты на основе чужеродных белков, производимых внутри клетки. Т-клеточный иммунитет имеет решающее значение для защиты от вирусных инфекций и таких заболеваний, как малярия. Вирусная вакцина индуцирует экспрессию белков патогенов в клетках-хозяевах аналогично Сабин Вакцина от полиомиелита и другие аттенуированные вакцины. Однако, поскольку вирусные вакцины содержат лишь небольшую часть генов патогенов, они намного безопаснее, и спорадическое заражение патогеном невозможно. Аденовирусы активно разрабатываются как вакцины.
Ретровирусы являются одной из опор современных подходов к генной терапии. Рекомбинантные ретровирусы, такие как Молони вирус лейкемии мышей обладают способностью стабильно интегрироваться в геном хозяина. Они содержат обратная транскриптаза для создания ДНК-копии генома РНК и интегразы, которая позволяет интегрироваться в хозяина геном. Они использовались в ряде одобренных FDA клинических испытаний, таких как SCID-X1 испытание. [8]
Ретровирусные векторы могут быть репликационно-компетентными или репликационно-дефектными. Векторы с дефектом репликации являются наиболее распространенным выбором в исследованиях, поскольку у вирусов кодирующие области для генов, необходимых для дополнительных раундов репликации и упаковки вириона, были заменены другими генами или удалены. Эти вирусы способны инфицировать свои клетки-мишени и доставлять свою вирусную нагрузку, но затем не могут продолжать типичный литический путь, который приводит к лизису и гибели клеток.
Напротив, компетентные к репликации вирусные векторы содержат все необходимые гены для синтеза вирионов и продолжают размножаться после заражения. Поскольку вирусный геном для этих векторов намного длиннее, длина фактически вставленного интересующего гена ограничена по сравнению с возможной длиной вставки для векторов с дефектом репликации. В зависимости от вирусного вектора типичная максимальная длина допустимой вставки ДНК в вирусном векторе с дефектом репликации обычно составляет около 8-10 килобайт. [9] Хотя это ограничивает введение многих геномных последовательностей, большинство кДНК последовательности все еще могут быть размещены.
Основной недостаток использования ретровирусов, таких как ретровирус Молони, заключается в том, что клетки должны активно делиться на трансдукция. В результате такие клетки, как нейроны очень устойчивы к инфекции и трансдукции ретровирусами.
Есть опасения, что инсерционный мутагенез за счет интеграции в хост геном может привести к рак или же лейкемия. Эта проблема оставалась теоретической до тех пор, пока генная терапия в течение десяти лет. SCID-X1 пациенты, использующие Мэлони вирус лейкемии мышей [10] привели к двум случаям лейкемии, вызванной активацией LMO2 онкоген из-за близкого интегрирования вектора. [11]
![]()
Лентивирусы являются подклассом ретровирусов. Иногда их используют как векторы для генной терапии благодаря их способности интегрироваться в геном неделящихся клеток, что является уникальной особенностью лентивирусов, поскольку другие ретровирусы могут инфицировать только делящиеся клетки. Вирусный геном в виде РНК является переписанный когда вирус проникает в клетку, чтобы произвести ДНК, который затем вставляется в геном в случайном месте (недавние открытия фактически предполагают, что внедрение вирусной ДНК не является случайным, а направлено на конкретные активные гены и связано с организацией генома). [12] ) вирусным интегрировать фермент. Вектор, теперь называемый провирус, остается в геноме и передается потомству клетки при делении. Пока не существует методов определения места интеграции, которые могут создать проблему. В провирус может нарушить функцию клеточных генов и привести к активации онкогены продвижение разработка из рак, что вызывает опасения по поводу возможного применения лентивирусов в генной терапии. Однако исследования показали, что лентивирусные векторы имеют меньшую тенденцию к интеграции в местах, потенциально вызывающих рак, чем гамма-ретровирусные векторы. [13] В частности, одно исследование показало, что лентивирусные векторы не вызывали ни увеличения заболеваемости опухолями, ни более раннего появления опухолей у линии мышей с гораздо более высокой частотой возникновения опухолей. [14] Более того, клинические испытания, в которых использовались лентивирусные векторы для доставки генной терапии для лечения ВИЧ, не показали увеличения мутагенных или онкологических явлений. [15]
По соображениям безопасности лентивирусные векторы никогда не несут гены, необходимые для их репликации. Для получения лентивируса необходимо несколько плазмиды находятся трансфицированный в так называемую упаковку клеточная линия, обычно HEK 293. Одна или несколько плазмид, обычно называемых упаковывающими плазмидами, кодируют вирион белки, такой как капсид и обратная транскриптаза. Другая плазмида содержит генетический материал, который должен быть доставлен вектором. это записано для производства вирусного генома с одноцепочечной РНК и отмечен наличием ψ (psi) последовательность. Эта последовательность используется для упаковки генома в вирион.
В отличие от лентивирусов, аденовирусная ДНК не интегрируется в геном и не реплицируется при делении клетки. Это ограничивает их использование в фундаментальных исследованиях, хотя аденовирусные векторы все еще используются в in vitro а также in vivo эксперименты. [16] Их основные приложения находятся в генная терапия и вакцинация. Поскольку люди обычно контактируют с аденовирусы, которые вызывают респираторные, желудочно-кишечные и глазные инфекции, у большинства пациентов уже развились нейтрализующие антитела которые могут инактивировать вирус до того, как он достигнет целевой клетки. Чтобы решить эту проблему, ученые в настоящее время исследуют аденовирусы которые заражают разные виды, к которым у людей нет иммунитета.
Аденоассоциированный вирус (AAV) - небольшой вирус, поражающий людей и некоторые другие виды приматов. В настоящее время не известно, что AAV вызывает заболевание и вызывает очень слабый иммунный ответ. AAV может инфицировать как делящиеся, так и неделящиеся клетки и может включать свой геном в геном клетки-хозяина. Более того, AAV в основном остается как эписомальный (репликация без включения в хромосому); выполняя долгое и стабильное выражение. [17] Эти особенности делают AAV очень привлекательным кандидатом для создания вирусных векторов для генной терапии. [1] Однако AAV может передавать только до 5 КБ, что значительно меньше по сравнению с исходной емкостью AAV. [18]
Кроме того, из-за его потенциального использования в качестве вектора генной терапии исследователи создали измененный AAV, названный самокомплементарный аденоассоциированный вирус (scAAV). В то время как AAV упаковывает одну цепь ДНК и требует процесса синтеза второй цепи, scAAV упаковывает обе цепи, которые отжигаются вместе с образованием двухцепочечной ДНК. Пропуск синтеза второй цепи scAAV обеспечивает быструю экспрессию в клетке. [19] В остальном scAAV обладает многими характеристиками своего аналога AAV.
Вирусы растений можно использовать для разработки вирусные векторы, инструменты, обычно используемые для доставки генетический материал в завод клетки; они также являются источниками биоматериалов и нанотехнологических устройств. [20] [21] Вирус табачной мозаики (TMV) - первый обнаруженный вирус. Вирусные векторы на основе вирус табачной мозаики включать те из magnICON® и технологии экспрессии растений TRBO. [20]
Гибридные векторы вектор вирусы которые генно-инженерный иметь качества более чем одного вектора. Вирусы изменены, чтобы избежать недостатков типичных вирусных векторов, которые могут иметь ограниченную нагрузочную способность, иммуногенность, генотоксичность, и не в состоянии поддерживать долгосрочную адекватную трансгенная экспрессия. За счет замены нежелательных элементов желаемыми способностями гибридные векторы могут в будущем превзойти стандартные векторы трансфекции с точки зрения безопасности и терапевтической эффективности. [22]
Проблемы в приложении
Выбор популярный вектор доставлять генетический Материал в ячейки связан с некоторыми логистическими проблемами. Существует ограниченное количество вирусных векторов, доступных для терапевтического использования. Любой из этих нескольких вирусных векторов может вызвать в организме развитие иммунная реакция если вектор рассматривается как иностранный захватчик. [23] [24] После использования вирусный вектор не может быть эффективно использован снова у пациента, потому что он будет распознаваться организмом. Если вакцина или же генная терапия терпит неудачу в клинические испытания, вирус не может быть снова использован у пациента для другой вакцины или генной терапии в будущем. Ранее существовавшие иммунитет против вирусного вектора также может присутствовать у пациента, что делает терапию неэффективной для этого пациента. [23] [25] Можно противодействовать существовавшему ранее иммунитету, используя вирусный вектор для вакцинация к грунтовка с невирусным ДНК-вакцина, но этот метод представляет собой дополнительные расходы и препятствия в процессе распространения вакцины. [26] Существующий ранее иммунитет также можно поставить под сомнение, увеличив дозу вакцины или изменив вакцинация маршрут. [27] Некоторые недостатки вирусных векторов (такие как генотоксичность и низкая трансгенная экспрессия) можно преодолеть за счет использования гибридные векторы.
Не только ВИЧ. Как устроены вирусы?
Одни вирусы способны интегрироваться в геном клетки-мишени и таким образом оставаться во всех дочерних клетках, которые будут в будущем получены после ее деления. К таким вирусам относятся гаммаретровирусы и лентивирусы. Другие делать этого не умеют (например, адено- и аденоассоциированные вирусы). Но для производства белков и репликации (размножения) все они используют клетку и ее синтетический аппарат.
Несмотря на некоторую «несамостоятельность» в размножении, вирусы способны наследовать генетические мутации и подвержены эволюционному отбору. Выживает сильнейший, а в случае вируса — самый устойчивый и заразный.
Как это работает?
Для того чтобы вирус мог проникнуть в клетку, белки его оболочки должны связаться с мембранными белками клетки-мишени. Важно отметить, что проникает вирус только в те клетки, которые могут в дальнейшем помочь его репликации. Вирус ВИЧ живет в клетках иммунной системы, вирус гепатита С — в клетках печени. Есть особые вирусы, которые поражают только растения или даже только бактерии.
В целом у вирусов существуют разные стратегии доставки вирусного материала в клетку. Какие-то вирусы размножаются в ее цитоплазме, а какие-то — в ядре. Некоторые умеют «впрыскивать» свою генетическую информацию прямо через мембрану, когда сам капсид остается снаружи.
Объединяет их одно: после того как вирусная информация доставлена в клетку, та, «забывая» о своей изначальной функции, начинает заниматься в первую очередь репликацией вируса. Клетка производит матричную РНК (мРНК), с которой затем синтезируются вирусные белки и копируется геном, и сама собирает новую вирусную частицу.
![]()
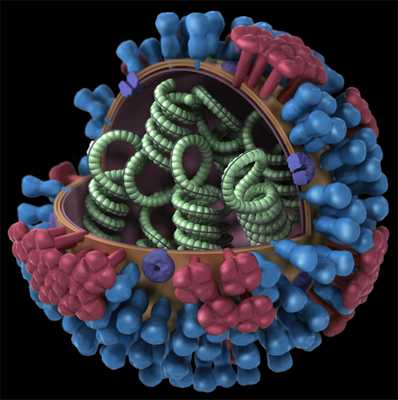
Строение вируса гриппа. Под оболочкой вириома - генетический материал вируса, необходимый для его воспроизводства в клетке.
В большинстве случаев вирус убивает клетку, чтобы выйти наружу и приступить к поиску новой «жертвы». Но иногда этого не происходит: некоторые вирусы, в том числе ВИЧ, могут отделяться от клетки, обзаведясь собственной оболочкой и оставив клетку в живых, чтобы та продолжила производить новые вирусные частицы.
Содержащие неактивный вирус и оставшиеся в живых клетки иногда сохраняют возможность нормального функционирования. В этом случае клетки могут быть заражены, но вирус проявит себя спустя длительный период времени. Так устроен герпес.
В зависимости от того, каким типом нуклеиновой кислоты представлен генетический материал, выделяют ДНК-содержащие вирусы и РНК-содержащие вирусы. И тут стоит остановиться на классификации.
Типы вирусов. Коротко о главном
Современная типология вирусов содержит 7 классов и была предложена Дэвидом Балтимором еще в 1971 году. С тех пор, впрочем, она была уточнена и расширена, в том числе советскими учеными. И выглядит в настоящее время таким образом:
Вирусы, содержащие двухцепочечную ДНК
Описание
Для репликации вирусу необходимо попасть в ядро клетки-мишени и воспользоваться ее ДНК-полимеразой. Иногда вирус вызывает незапланированное деление самое клетки, то есть становится онкогенным. Эти вирусы хорошо изучены.
Пример: Вирус герпеса, адено- и папилломавирусы
Вирусы, содержащие одноцепочечную ДНК
Попадая в ядро клетки, вирусы образуют двухцепочечную ДНК, после чего реплицируются так же, как вирусы класса I.
Пример: Парво- и цирковирусы
Вирусы, в которых РНК способна к репликации (редупликации)
Вирусы этого класса могут размножаться в цитоплазме клетки, им не нужна молекула ДНК. Каждый ген, находящийся в РНК вируса, кодирует только один вирусный белок.
Пример: Бирна- и реовирусы
Вирусы, содержащие одноцепочечную (+) РНК
Из геномной (+) РНК на рибосомах хозяина создаются вирусные белки. В одном фрагменте РНК могут быть закодированы разные белки, что увеличивает сложность вируса без удлинения генов.
Пример: Пикорнавирусы (полиомиелит, гепатит А) и коронавирусы
Вирусы, содержащие одноцепочечную (-) РНК
(-) РНК этих вирусов предварительно должна быть транскрибирована в (+) РНК вирусными РНК-полимеразами, после чего может начаться синтез вирусных белков. Вирусы этого класса делятся еще на две группы, в зависимости от их генома и места его репликации (цитоплазма или ядро).
Пример: Филовирусы, аренавирусы (геморрагическая лихорадка Ласса), ортомиксовирусы (вирусы гриппа) и так далее.
Вирусы, содержащие одноцепочечную (+) РНК, реплицирующиеся через стадию ДНК
Такие вирусы используют фермент обратную транскриптазу для превращения (+) РНК в ДНК, которая встраивается в геном хозяина ферментом интегразой. Дальнейшая репликация происходит при помощи полимераз клетки хозяина.
Пример: Ретровирусы (в том числе ВИЧ)
Вирусы, содержащие двухцепочечную ДНК, реплицирующиеся через стадию одноцепочечной РНК
Описание
Молекула ДНК замкнута в кольцо и является матрицей для синтеза мРНК и дополнительных молекул РНК, которые используются при репликации вирусного генома обратными транскриптазами.
Пример: Колимовирусы (вызывают инфекции растений) и гепаднавирусы (например, гепатит В)
Вакцинация и лечение
Как правило, организмы умеют бороться с паразитирующими на них вирусами. На примере млекопитающих и человека мы обычно говорим о главном инструменте — врожденном иммунитете.
Впрочем, наиболее эффективен этот вид защиты в отношении бактериальных инфекций и не может обеспечить продолжительную и надежную защиту, особенно от инфекций вирусных.
Именно поэтому огромное значение имеет приобретенный иммунитет, в результате которого клетки иммунной системы обучаются вырабатывать специфические к вирусу антитела, способные уничтожать как саму вирусную частицу, так и зараженные ею клетки.
Еще одна врожденная система борьбы с вирусными инфекциями — внутриклеточная. Как правило, клетка способна распознать чужеродную РНК в своей цитоплазме, куда ее сперва и доставляют многие вирусы, и имеет специальные комплексы для ее деградации. Но часть вирусов научились обходить и эту ловушку. К примеру, ротавирусы, которые даже внутри клетки сохраняют капсид с геномной РНК.
С приобретенным иммунитетом тоже не все гладко. Некоторым вирусам, например, ВИЧ, удается избежать иммунного ответа. Другим, например нейротропным вирусам, — уклониться от него, выбрав безопасную среду обитания: они распространяются среди клеток нервной системы, где их не может «достать» иммунная система. Самый известный из таких вирусов — вирус бешенства, который способен проникать в нейроны.
Миссия: уничтожить
Основная сложность в лечении вирусных заболеваний заключается в том, что они используют естественные функции клеток-мишеней для своего размножения, поэтому ученым зачастую оказывается не так-то просто придумать препарат, который будет токсичен для вируса и безопасен для самой клетки. Если такой безопасности достичь не удастся, лекарство будет иметь слишком много побочных эффектов, повреждающих сам организм, что окажется нецелесообразно для использования.
![]()
Сравнение жизненных циклов ВИЧ и вируса гриппа. Если первый использует обратную транскрипцию и живет в клетках иммунной стистемы, вирион второго, проникая в эпительные клетки дыхательных путей целиком - а именно там он и обитает - распадается уже внутри клетки, а репликация вирусной РНК происходит в ядре с помощью вирусных полимераз PA, PB1 и PB2 путем комплементарного копирования.
По принципу действия противовирусные препараты подразделяются на две группы: стимулирующие иммунную систему атаковать вирусы (например, за счет индукции синтеза белков-интерферонов) и атакующие вирусы напрямую. Препараты второй группы различаются по этапу жизненного цикла вируса, на котором они активны: это препараты, препятствующие проникновению вируса в клетку, препятствующие размножению вируса внутри клетки и препятствующие выходу копий вируса из клетки.
Такие противовирусные препараты, как уже давно известный ацикловир (им лечат инфекции, вызванные простым вирусом герпеса) или ламивудин (активен против ВИЧ и гепатита В), представляют собой синтетические аналоги нуклеозидов — «букв», из которых состоят нуклеиновые кислоты. Если эти модифицированные, неправильные нуклеозиды попадают в клетку, вирусный геном, в который они оказались встроены, становится непригоден для дальнейшего распространения вируса.
Еще один класс противовирусных препаратов блокирует ферменты, необходимые для создания и модификаций белков вируса. Такие лекарства называют протеазными ингибиторами.
Вместо заключения: а могут ли вирусы приносить пользу?
Безусловно, да. Несмотря на то, что вирусы ассоциируются у большинства людей с однозначным вредом, они могут приносить и пользу — если речь идет о так называемых вирусных векторах и терапевтических подходах на их основе.
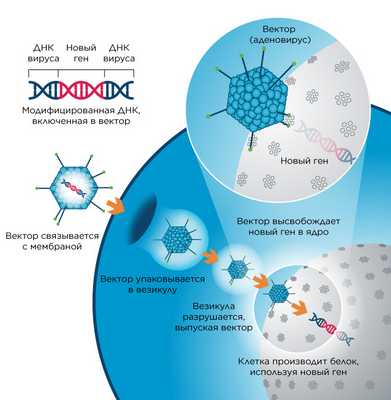
Исследователи давно научились помещать в белковую оболочку вируса интересующие их нуклеиновые кислоты, чтобы доставлять нужный ген в клетки, а также убирать те гены, которые делают вирус опасным для организма.
Это позволило сделать возможной генную терапию, помогающую бороться с заболеваниями, вызванными известными генетическими мутациями. Создание вирусных векторов — достаточно непростая задача, к тому же ограниченная свойствами самих вирусных частиц: количеством помещающейся генетической информации, местом ее вставки, стабильностью. Кроме того, вирусный вектор, используемый в медицине, не должен вызывать иммунного ответа или критично влиять на жизнедеятельность клетки. Тем не менее эти сложности решаются, поэтому уже одобрен ряд вполне успешных и безопасных генных терапий. А в качестве основы для вирусных векторов чаще всего используются ретро-, ленти-, адено- и аденоассоциированные вирусы.
Читайте также:
- Ведение родов при первичной слабости родовых сил. Акушерский наркоз. Электроаналгезия.
- Послеоперационный уход после доступа для тотального эндопротезирования коленного сустава
- Боковой амиотрофический склероз на МРТ головного мозга
- Контрастирование слезоотводящих путей при рентгенографии: преимущества и выбор контраста
- Техника операции при ранении гортани и трахеи