Влияние гипоксии на пинеалоциты. Изменения эпифиза при недостатке кислорода
Добавил пользователь Владимир З. Обновлено: 01.02.2026
Изучено влияние нормобарической гипоксии на секрецию инсулина (ИРИ) и соматотропного гормона (СТГ) у 24 практически здоровых лиц в возрасте 35—55 лет. Контрольную группу составили 18 человек, получавшие курс плацебо. Показано, что адаптация к нормобарической гипоксии сопровождается изменением содержания ИРИ и СТГ без динамики гликемических показателей. На фоне гипоксического воздействия у всех обследуемых отмечалось увеличение в плазме крови концентрации СТГ при тенденции к нормализации содержания ИРИ. Выявлена корреляция этих показателей с индексом массы тела.
Ключевые слова
Для цитирования:
For citation:
Влияние недостатка кислорода на организм человека и животных в связи со значительной ролью гипоксии практически во всех патологических процессах постоянно привлекает внимание исследователей различного профиля [1]. В мировой литературе накоплены обширные сведения, касающиеся основных путей приспособления организма к дефициту кислорода, и тем не менее вопрос о влиянии кислородной недостаточности на организм остается одной из актуальных медико-биологических проблем, решение которой направлено на поиск различных средств коррекции гипоксии [2, 3, 5].
Изменения метаболизма у человека в ответ на действие нормобарической гипоксии изучены недостаточно. Имеются единичные публикации, посвященные экспериментальному анализу гормонально-метаболических показателей в процессе кратковременной гипоксической стимуляции и патофизиологическому обоснованию описанных изменений [6, 9, 12]. Известно, что у практически здоровых людей в ответ на гипоксическое воздействие наблюдаются достоверное увеличение содержания кортизола в плазме, цГМФ в лимфоцитах, повышение экскреции адреналина в моче [2, 7, 8, 14] и разнонаправленные колебания уровней пролактина, тестостерона, эритропоэтина и инсулина в крови [9, 13, 14].
В последние годы в клинической практике с целью повышения неспецифической резистентности организма используют интервальную гипоксическую тренировку (ИГТ). Многократный переход от нормоксии к гипоксии повышает функцию различных органов и систем. Основным действующим фактором ИГТ является стимуляция всех систем транспорта кислорода в организме. При этом методе воздействия наблюдаются увеличение легочной вентиляции, минутного объема крови, усиление капилляризации тканей, повышение эритропоэза и увеличение дыхательных фракций гемоглобина [8, 10]. Показано, что в процессе долговременной адаптации к нормобарической гипоксии уменьшаются процессы свободнорадикального окисления за счет усиления активности всей группы антиоксидантных ферментов [9, 13, 14]. Имеются данные о том, что при ИГТ у спортсменов снижается содержание молочной кислоты [6, 10], а у лиц с гиперхолестеринемией — содержание холестерина и триглицеридов [6].
Экспериментальные исследования показали, что гипоксическая тренировка крыс в барокамере стимулирует синтетическую и секреторную функцию р-клеток поджелудочной железы, увеличивает в них содержание ИРИ [9], однако имеются лишь немногочисленные сведения о действии острой и долговременной нормобарической гипоксии на состояние углеводного обмена, его регуляторные механизмы.
Целью настоящей работы явилось изучение влияния нормобарической гипоксии на секрецию ИРИ и соматотропного гормона (СТГ) у практически здоровых людей.
Материалы и методы
Обследованы практически здоровые лица (п = 24) в возрасте 35—55 лет (мужчин — 5, женщин — 19). Из них 15 человек (4 мужчины и 11 женщин) имели нормальную массу тела (индекс массы тела — ИМТ = 21,7 ± 0,42 усл. ед.), а 9 (1 мужчина и 8 женщин) — избыточную массу тела (ИМТ = 26,3 ±0,12 усл. ед.).
Контрольную группу составили практически здоровые лица того же возраста (18 человек: 3 мужчины и 15 женщин), имеющие нормальную массу тела (ИМТ = 20,9 ± 0,65 усл. ед.), получающие курс плацебо (дыхание атмосферным воздухом через маску в аналогичных интервальных режимах).
Для оценки влияния острой нормобарической гипоксии на организм людей проводили гипоксическую пробу (ГП) по методике R. Levy в модификации Ф. 3. Меерсона, Е. Н. Ткачук, И. В. Эренбурга [10]. В основу ГП положено непрерывное дыхание на протяжении 10 мин гипоксической газовой смесью (ГГС), содержащей 11 — 11,5% кислорода.
Суть метода интервальной нормобарической тренировки заключается в периодическом дыхании ГГС при индивидуальных режимах на протяжении 20 мин 5 раз в неделю (19—21 сеанс). Подачу газовой смеси постоянного состава осуществляли аппаратом Типоксикатор" фирмы ’’Hypoxia Medical LTD" (Россия).
Содержание ИРИ в плазме определяли имму- ноферментным методом с применением реактивов фирмы "Dako" (Дания), концентрацию СТГ — им- муноферментным методом с помощью стандартных наборов фирмы ’'Biomar HJH Elisa" (Германия), содержание глюкозы в крови — глюкозоок- сидазным методом. Все исследования проводили исходно и сразу после окончания гипоксического воздействия.
Результаты обработаны с использованием персональной ЭВМ методом вариационной статистики, дисперсионного анализа, критериев Стьюдента и Вилкоксона.
Результаты и их обсуждение
Перед проведением гипоксического воздействия у практически здоровых лиц были выявлены некоторые различия в содержании ИРИ в плазме в зависимости от массы тела (см. таблицу). Так, у лиц с ИМТ 25—27 усл. ед. (кг/м 2 ) обращало на себя внимание повышение содержания ИРИ (ИРИ = 60,44 ± 8,90 мкЕд/мл;р 0,05), тогда каку практически здоровых людей с ИМТ до 25 усл. ед. содержание ИРИ соответствовало норме (ИРИ = = 10,60 ± 0,59 мкЕд/мл). Концентрация глюкозы в обеих подгруппах не превышала 5 ммоль/л.
Содержание СТГ до гипоксического воздействия у лиц с ИМТ 25—27 усл. ед. было снижено (СТГ = 0,61 ± 0,07 нг/мл; р 0,05), а у лиц с ИМТ до 25 усл. ед. соответствовало средневозрастным значениям (СТГ = 5,50 ± 0,25 нг/мл). Эти данные согласуются с мнением ряда авторов [4, И] о том, что у лиц с избыточной массой тела отмечаются дефицит СТГ и повышенное содержание ИРИ.
ГП выявила некоторые особенности реагирования ИРИ и СТГ у здоровых людей с нормальной и избыточной массой тела. Так, при нормальной массе тела после окончания гипоксической стимуляции отмечалось повышение содержания СТГ с 5,50 ± 0,25 до 9,40 ± 0,42 нг/мл (р < 0,05). Содержание ИРИ (10,64 ± 0,59 и 11,67 ± 0,57 мкЕд/мл) и глюкозы в крови статистически не изменялось. У лиц с ИМТ 25—27 усл. ед. в ответ на острое (кратковременное) гипоксическое воздействие отмечались повышение концентрации СТГ с 0,61 ± 0,07 до 1,92 ± 0,08 нг/мл (/? < 0,05) и тенденция к снижению содержания ИРИ с 60,44 ± 8,90 до 44,94 ± 8,73 мкЕд/мл (р = 0,2); содержание глюкозы не изменялось.
Динамика содержания глюкозы, ИРИ и СТГ в крови под влиянием ИГТ была также проанализирована в зависимости от ИМТ. На рисунке показано, что интервальная гипоксия изменяет уровень данных параметров у лиц как с нормальной, так и с избыточной массой тела. У лиц с ИМТ менее 25 усл. ед. наблюдалось повышение секреции ИРИ с 10,60 ± 0,59 до 12,29 ± 0,53 мкЕд/мл (р < 0,05) и СТГ с 5,50 ± 0,25 до 7,82 ± 0,20 нг/мл (р < 0,05) без существенного изменения уровня глюкозы в крови. В противоположность этому у лиц, имеющих ИМТ, при исходно высоком уровне ИРИ (60,44 ± 8,90 мкЕД/мл) отмечалось его снижение до 10,82 ± 0,97 мкЕд/мл (р 0,05) также без изменения концентрации глюкозы. Реакция СТГ на интервальную гипоксию в данной подгруппе оставалась прежней, и мы наблюдали увеличение содержания данного гормона в плазме с 0,61 ± 0,07 до 1,50 ± 0,09 нг/мл (р 0,05).
Полученные данные позволяют предполагать, что острое и интервальное гипоксическое воздействие способно оказывать влияние на секрецию ИРИ и СТГ в плазме в зависимости от массы тела обследуемых: при ИМТ до 25 усл. ед. наблюдалось незначительное увеличение содержания ИРИ и СТГ, а при ИМТ 25—27 усл. ед. — снижение исходно повышенной концентрации ИРИ и повышение уровня СТГ. Содержание глюкозы во всех случаях гипоксической стимуляции существенно не изменялось. Устойчивость основной гомеостатической константы — глюкозы — в процессе кратковременной и долгосрочной адаптации к нормобарической гипоксии у всех обследованных лиц позволяет предполагать существование определенных механизмов регуляции углеводного обмена, направленных на поддержание глюкозного гомеостаза в условиях экзогенного стресса.
В процессе проведения гипоксической стимуляции выявлена зависимость между ИМТ и изменением содержания ИРИ и СТГ в плазме крови. Определены прямая корреляция средней силы между ИМТ и ДИРИ (при проведении ГП г = 0,58, р 0,05, в процессе долговременной адаптации г = 0,49, р 0,05) и высокая прямая коррелятивная связь между ИМТ и ДСТГ (при проведении ГП г = 0,79, р 0,05, в процессе ИГТ г = 0,71, р 0,05). Данная корреляция показывает зависи-
мость этих показателей от исходной массы тела в процессе гипоксического воздействия.
Реакция на долговременную интервальную гипоксию у лиц с ИМТ дала нормализующий эффект, влияя на многие адаптивные механизмы в организме. В этих условиях саногенный гипоксический стимул как онто- и филогенетически свойственный развитию живых систем оказывает широкий спектр влияний на многие физиологические параметры [1, 2, 10].
В группе плацебо не отмечено существенных изменений анализируемых показателей как в процессе проведения ГП (см. таблицу), так и в ходе курса ИГТ (см. рисунок).
Несомненно, что одним из главных факторов воздействия на организм человека при ИГТ являются изменение кислородтранспортной функции, активация антиоксидантной защиты, что улучшает чувствительность тканей к ИРИ. Это более четко выявляется у лиц с повышенной массой тела. Можно предполагать и непосредственное влияние длительной гипоксической стимуляции на функцию поджелудочной железы, которое проявляется увеличением чувствительности р-клеток к глюкозе. Подтверждением этого может служить устойчивость гликемических показателей. Нельзя также исключить и особую роль гипоталамо-гипофизар-
Содержание глюкозы, ИРИ и СТГ в плазме практически здоровых лиц до и после ГП (М ± т)
Возможности применения нейропротективных препаратов в реабилитации детей первого года жизни с перинатальными гипоксическими поражениями центральной нервной системы
Ключевые слова: дети первого года жизни, гипоксия ЦНС, перинатальная патология, лечение.
The possibility of the use of neuroprotective drags in rehabilitation treatment of infants with perinatal hypoxic damage of central nervous system
G.S. Golosnaya
Pirogov Russian National Medical Research University, Moscow
Key words: infants, hypoxy of CNS, perinatal pathology, treatment.
Гипоксические повреждения головного мозга занимают одно из первых мест среди перинатальных повреждений нервной системы и являются основными причинами перинатальной смертности, составляя от 20 до 50% в ее структуре [1—3]. Это связано с тем, что развивающийся мозг новорожденного чрезвычайно чувствителен к воздействию гипоксии, которая не только нарушает клеточную дифференциацию и вызывает очаговые повреждения мозговой ткани, но и задержку развития сосудистой системы. Толерантность к воздействию повреждающих факторов у каждого ребенка различна. Поэтому при сравнительно равных условиях у детей могут развиваться различные по степени выраженности клинические проявления.
В настоящее время получено достаточно большое количество новой информации о патогенезе, молекулярных и биологических основах гипоксического перинатального поражения ЦНС. Доказано, что формирование грубых структурных изменений ткани мозга под влиянием гипоксии обусловлено в том числе и неспособностью нейрональных структур синтезировать факторы защиты. В свою очередь антигены, влияющие на деструктивные процессы, обнаруживаются в сыворотке крови новорожденных в значительно превышающих нормативные значения концентрациях уже в первые сутки жизни [3].
В соответствии с современными представлениями о механизмах нейронального повреждения при гипоксии и ишемии большое практическое значение приобретает изучение возможности применения в комплексной терапии реабилитационных программ у детей первого года жизни нейропротективных препаратов [4—8]. В связи с этим привлекают к себе внимание препараты, воздействующие на обмен центральных медиаторов, особенно лекарственные средства, влияющие на метаболизм тормозного медиатора — гамма-аминомасляной кислоты (ГАМК).
Одним из таких препаратов ГАМК является пантогам. С 1995 г. он выпускается российской компанией «ПИК-Фарма». Пантогам по химической структуре представляет собой кальциевую соль D(+)-пантоил-гамма-аминомасляной кислоты и относится к ноотропным препаратам смешанного типа с широким спектром активности, что определяет его особое место среди лекарственных средств.
От других ГАМК-производных препаратов пантогам отличается сбалансированным влиянием на центральную нервную систему. Благодаря присутствию в молекуле пантогама пантоильного радикала, препарат проникает через гематоэнцефалический барьер и оказывает выраженное воздействие на функциональную активность ЦНС.
Фармакологические эффекты пантогама обусловлены его прямым влиянием на ГАМК-рецепторно-канальный комплекс. Препарат оказывает также активирующее влияние на образование ацетилхолина, улучшает утилизацию глюкозы и кровоснабжение мозга, повышает устойчивость мозга к гипоксии, воздействию токсических веществ, стимулирует анаболические процессы в нейронах. В организме пантогам практически не метаболизируется и в течение 48 ч почти полностью выводится.
Пантогам применяется при лечении неврологических и психических заболеваний у детей разного возраста в режиме как монотерапии, так и в комбинации с другими лекарственными средствами. Сочетание мягкого психостимулирующего и умеренно седативного эффектов пантогама позволяет активировать когнитивные функции у детей, снижает тревожность, нормализует сон ребенка. Препарат хорошо переносится детьми.
В раннем возрасте применение пантогама в комплексной терапии оптимально при самых первых признаках задержки психомоторного развития (ПМР), в том числе при нарушениях темпа предречевого и речевого развития с одного года до трех лет. Обладая нейрометаболическим, нейропротекторным и нейротрофическим действием, пантогам улучшает когнитивные функции, повышает психическую активность и объем познавательной деятельности.
В настоящее время существует две лекарственные формы пантогама — таблетки и 10% сироп (не содержащий сахар). Последняя форма может применяться у детей с первых месяцев жизни.
Цель настоящей работы — изучение эффективности и переносимости препарата пантогам в форме 10% сиропа для коррекции нарушений ПМР у детей первого года жизни, перенесших гипоксическое поражение ЦНС.
Следует отметить, что выбранная нами группа пациентов состояла из перенесших гипоксию доношенных детей с задержкой ПМР легкой и средней степени. Не всегда указанные степени задержки ПМР приводят к более тяжелым расстройствам. Более того, несмотря на достаточную тяжесть состояния детей при рождении, в дальнейшем в этих случаях выявляется способность к компенсации нарушений в течение 3—4 мес жизни. Поэтому именно у таких детей показано применение ноотропных препаратов, которые могут способствовать прогрессу психофизиологического развития.
Говоря о препарате, важно отметить, что он давно и успешно используется в детской неврологической практике. Но хотелось выделить именно эффективность применения его в терапии нарушений психомоторного развития в группе доношенных детей, перенесших гипоксию. Во-первых, эти пациенты не всегда рассматриваются как угрожаемые по формированию двигательных нарушений. Это часто обусловлено тем, что, несмотря на тяжесть состояния, перенесенного при рождении, дети способны хорошо компенсировать нарушения в период до 3—4 мес жизни. Второй момент, который в определенной степени является спорным, — отсутствие четких морфологических маркеров повреждения мозга при проведении нейросонографии. В третьих, выбранная группа доношенных детей позволяет сравнить развитие с нормативным.
Несомненно, что практикующие неврологи учитывают в реабилитационных программах у детей первого года жизни все симптомы, отрицательно влияющие на развитие (внутричерепная гипертензия, судорожные состояния и т.д.), поэтому мы включили в исследование только доношенных детей с определенными нарушениями, ведущим из которых явилась задержка психомоторного развития легкой и средней степени.
Материал и методы
Под нашим наблюдением находились 60 доношенных детей в возрасте 5—12 мес. Все дети родились от женщин с отягощенным акушерско-гинекологическим и соматическим анамнезом. По данным амбулаторных карт, во всех случаях отмечалась хроническая внутриутробная гипоксия.
Критерии включения: согласие родителей, возраст детей 5—12 мес, наличие нарушений ПМР легкой и средней степени, без признаков органических поражений ЦНС.
Критерии исключения: непереносимость препарата или его компонентов, тяжелая задержка развития, наличие органических поражений ЦНС, прогрессирующая внутричерепная гипертензия, генетические заболевания, судорожные состояния в анамнезе, дети с гестационным возрастом при рождении менее 37 нед, участие в каких-либо исследованиях за 4 нед до включения в настоящее исследование, несоблюдение родителями условий исследования: непосещение врача в соответствии с установленным расписанием в течение времени наблюдения, прием препарата не по схеме.
Дети были разделены на две группы — основную и контрольную. В основную группу вошли 30 детей, лечившихся пантогамом в виде сиропа. В контрольной группе было также 30 детей, лечившихся другими ноотропными препаратами. В зависимости от использовавшегося препарата они были разделены на 2 подгруппы по 15 человек, лечившихся энцефаболом и кортексином.
Пантогам в виде сиропа назначался по 0,5 г 2 раза в день, утром и днем за 15—20 мин до еды в течение 56 дней. Энцефабол — по 50 мг 1 раз в день утром в течение 56 дней. Кортексин — по 0,5мг/кг 1 раз в сутки, внутримышечно в течение 10 дней.
Необходимо отметить, что все дети в рамках комплексной реабилитационной программы обязательно получали массаж, гимнастику, сеансы плавания, при необходимости — курсы физиотерапии.
Обследование больных начиналось только после получения информированного согласия от родителей. Все дети постоянно находились под наблюдением педиатра, невролога, офтальмолога. Всем наблюдаемым детям была проведена электроэнцефалография и повторно (в среднем 2 раза) — ультразвуковое исследование головного мозга — нейросонография, спектральная допплерография сосудов. Исследования проводили по общепринятой методике.
При оценке степени ПМР применялись шкалы О.В. Баженовой и Журбы—Мастюковой.
До начала обследования все дети находились под тщательным наблюдением невролога, который осматривал их не реже 1 раза каждые 3—4 нед.
Результаты и обсуждение
Основные клинические нарушения, отмечавшиеся в неврологическом статусе детей в раннем неонатальном периоде, свидетельствовали о том, что они перенесли длительную хроническую внутриутробную гипоксию.
Во всех группах детей преимущественными сроками формирования нарушения ПМР были периоды с 3-го по 5-й месяц жизни, и к периоду начала исследования задержка ПМР оценивалась как легкая и средней степени. Тяжелой степени задержки в изученных случаях не было.
В основной группе задержка легкой степени была выявлена у 19 детей, средней степени — у 11. Расширение боковых желудочков и наружных ликворных пространств обнаружено у 14 детей. Изменения на глазном дне сосудистого рисунка (венозное полнокровие, вазоспазм) отмечалось у 22 детей. У детей основной группы были отмечены также сопутствующие соматические заболевания: рахит у 27 детей, атопический дерматит — у 3, железодефицитная анемия легкой степени — у 1 ребенка.
В 1-й подгруппе контрольной группы (лечившихся энцефаболом) задержка моторного развития легкой степени была отмечена у 7 детей, средней — у 8. Расширение боковых желудочков и наружных ликворных пространств было у 8 детей. Изменения на глазном дне (венозное полнокровие, вазоспазм) выявлены у 13 детей. В 1-й подгруппе были отмечены также сопутствующие соматические заболевания: рахит — у 12 детей, атопический дерматит — у 2, железодефицитная анемия легкой степени — у 2.
Во 2-й подгруппе контрольной группы (лечившихся кортексином) встречались аналогичные изменения: задержка моторного развития легкой степени отмечена у 9 детей, средней — у 6. Расширение боковых желудочков и наружных ликворных пространств у 9 детей. Изменения на глазном дне сосудистого рисунка (венозное полнокровие, вазоспазм) — у 12 детей. В этой подгруппе были также отмечены сопутствующие соматические заболевания: рахит — у 10 детей, атопический дерматит — у 4, железодефицитная анемия легкой степени — у 4.
Изменения, выявленные до и после начала терапии, представлены в табл. 1.
Таблица 1.
Число больных с различными признаками задержки ПМР
Патологических изменений на ЭЭГ не было выявлено ни у одного из обследованных детей.
Изучение структуры ПМР показало различия в исходном состоянии отдельных сфер психофизиологической активности — двигательной, сенсорной, эмоциональной, голосовой, способности к манипулированию с предметами и взаимодействию со взрослыми. В дальнейшем под влиянием использовавшихся для лечения препаратов происходило их изменение, чаще в сторону уменьшения выраженности нарушений. Эти данные представлены в табл. 2.
Таблица 2.
Распределение детей разных групп с легкой и средней степенью задержки ПМР в разных сферах до и после лечения
Примечание. Здесь и в табл. 3: Л — легкая степень, С — средняя, Т — тяжелая степень задержки, которая выявлена не была.
Данные, приведенные в табл. 1 и 2, показывают, что при использовании пантогама положительные сдвиги в степени выраженности патологии отмечались во всех случаях, хотя и были разной степени выраженности по отдельным сферам ПМР. Тенденция к таким изменениям имела место и при использовании энцефабола и кортексина (в подгруппах контрольной группы), но изменения были меньше выражены, чем в основной группе. Этот вывод, естественно, нуждается в подтверждении с расширением числа наблюдений, использованием методов доказательной медицины и необходимых статистических показателей.
Дополнительно к представленным данным приводим изменения степени задержки ПМР в баллах по шкалам О.В. Баженовой (табл. 3) и Журбы—Мастюковой (табл. 4).
Таблица 3.
Характеристика ПМР и степень задержки различных сфер наблюдаемых у детей при оценке по шкале О.В. Баженовой, баллы
Таблица 4.
Результаты оценки по шкале Журбы—Мастюковой, баллы
Примечание. Норма — 30 баллов, задержка ПМР средней степени — 13—22 балла, риск развития нарушения ПМР — 23—26 баллов.
Оценка развития по шкале Журбы—Мастюковой от оценки по О.В. Баженовой принципиально не отличалась в начале и конце применения препаратов (см. табл. 4).
Что касается нежелательных явлений, то они развились только в 1 случае — высыпание на коже аллергического характера, которое исчезло в течение 3 дней.
Таким образом, в настоящем исследовании была выявлена достаточно высокая эффективность пантогама в виде 10% сиропа в лечении нарушений психомоторного развития вследствие гипоксического поражения ЦНС у детей первого года жизни. Показана его хорошая переносимость и безопасность. Установлено, что пантогам обладает более высокой эффективностью в сравнении с кортексином и энцефаболом.
Необходимо отметить, что назначение препарата пантогама в виде 10% сиропа имеет ряд преимуществ в связи с более удобной формой применения у детей первого года жизни и меньшей ценой.
ЛИТЕРАТУРА
1. Барашнев Ю.И., Розанов А.В., Панов В.О., Волобуев А.И. Роль гипоксически-травматических повреждений головного мозга в формировании инвалидности с детства. М: Рос вестн перинат и педиат 2006; 4: 41-46.
2. Белоусова Т.В. Комплексная терапия критических состояний у новорожденных с перинатальными повреждениями ЦНС. Перинатология и педиатрия 2007; 2: 30: 41-43.
3. Голосная Г.С. Нейрохимические аспекты патогенеза гипоксических поражений мозга у новорожденных. М: ИД «Медпрактика-М» 2009; 128.
4. Голосная Г.С. Применение кортексина в реабилитации детей первого года жизни с перинатальными гипоксическими поражениями ЦНС. Эффективная фармакотерапия. Педиатрия 2010; 4: 42-46.
5. Голосная Г.С. Проблемы лечения заболеваний нервной системы у детей раннего возраста. Практика педиатра 2011; 2: 33-36.
6. Петрухин А.С. Неврология детского возраста. М 2004.
7. Шабалов Н.П., Платонова Т.Н., Скоромец А.П. Кортексин в нейропедиатрии. Метод. рекомендации. СПб 2006; 63.
Гипоксия плода
Гипоксия плода - внутриутробный синдром, характеризующийся комплексом изменений со стороны плода, обусловленных недостаточным поступлением кислорода к его тканям и органам. Гипоксия плода характеризуется нарушениями со стороны жизненно-важных органов, в первую очередь, ЦНС. Диагностика гипоксии плода включает проведение кардиотокографии, допплерометрии маточно-плацентарного кровообращения, акушерского УЗИ, амниоскопии. Лечение гипоксии плода направлено на нормализацию маточно-плацентарного кровотока, улучшение реологии крови; иногда данное состояние требует досрочного родоразрешения женщины.
Общие сведения
Гипоксия плода регистрируется в 10,5% случаев от общего числа беременностей и родов. Гипоксия плода может развиваться в различные сроки внутриутробного развития, характеризоваться различной степенью кислородной недостаточности и последствиями для организма ребенка. Гипоксия плода, развившаяся в ранние сроки гестации, вызывает пороки и замедление развития эмбриона. На поздних сроках беременности гипоксия сопровождается задержкой роста плода, поражением ЦНС, снижением адаптационных возможностей новорожденного.
Причины гипоксии плода
Гипоксия плода может являться следствием широкого круга неблагоприятных процессов, происходящих в организме ребенка, матери или в плаценте. Вероятность развития гипоксии у плода повышается при заболеваниях материнского организма - анемии, сердечно-сосудистой патологии (пороках сердца, гипертонии), заболеваниях почек, дыхательной системы (хроническом бронхите, бронхиальной астме и др.), сахарном диабете, токсикозах беременности, многоплодной беременности, ИППП. Негативно на снабжении плода кислородом отражается алкоголизм, никотиновая, наркотическая и другие виды зависимости матери.
Опасность гипоксии плода возрастает при нарушениях плодово-плацентарного кровообращения, обусловленных угрозой выкидыша, перенашиванием беременности, патологией пуповины, фетоплацентарной недостаточностью, аномалиями родовой деятельности и других осложнениях беременности и родового процесса. К факторам риска в развитии интранатальной гипоксии относят гемолитическую болезнь плода, врожденные аномалии развития, внутриутробное инфицирование (герпетическая инфекция, токсоплазмоз, хламидиоз, микоплазмоз и др.), многократное и тугое обвитие пуповины вокруг шейки ребенка, длительная по времени компрессия головки в процессе родов.
В ответ на гипоксию у плода, прежде всего, страдает нервная система, поскольку нервная ткань наиболее чувствительная к дефициту кислорода. Начиная с 6-11 недели развития эмбриона, недостаток кислорода вызывает задержку созревания головного мозга, нарушения в строении и функционировании сосудов, замедление созревания гематоэнцефалического барьера. Также гипоксию испытывают ткани почек, сердца, кишечника плода.
Незначительная гипоксия плода может не вызывать клинически значимых повреждений ЦНС. При тяжелой гипоксии плода развиваются ишемия и некрозы в различных органах. После рождения у ребенка, развивавшегося в условиях гипоксии, может наблюдаться широкий диапазон нарушений - от неврологических расстройств до задержки психического развития и тяжелых соматических отклонений.
Классификация гипоксии плода
По времени течения и скорости возникновения выделяют острую и хронически развивающуюся гипоксию плода.
Возникновение острой гипоксии плода обычно связано с аномалиями и осложнениями родового акта - стремительными или затяжными родами, прижатием или выпадением пуповины, длительным сдавлением головки в родовых путях. Иногда острая гипоксия плода может развиться в ходе беременности: например, в случае разрыва матки или преждевременной отслойки плаценты. При острой гипоксии стремительно нарастают нарушения функций жизненно важных органов плода. Острая гипоксия характеризуется учащением сердцебиения плода (более 160 уд. в мин.) или его урежением (менее 120 уд. в мин.), аритмией, глухостью тонов; усилением или ослаблением двигательной активности и т. д. Нередко на фоне острой гипоксии развивается асфиксия плода.
К хронической гипоксии приводит длительный умеренный дефицит кислорода, в условиях которого развивается плод. При хроническом дефиците кислорода возникает внутриутробная гипотрофия; в случае истощения компенсаторных возможностей плода развиваются те же нарушения, что и при остром варианте течения. Гипоксия плода может развиваться в ходе беременности или родов; отдельно рассматривается гипоксия, возникшая у ребенка после рождения вследствие болезни гиалиновых мембран, внутриутробной пневмонии и т. д.
С учетом компенсаторно-адаптационных возможностей плода гипоксия может приобретать компенсированные, субкомпенсированные и декомпенсированные формы. Поскольку при неблагоприятных условиях плод испытывает не только гипоксию, но и целый комплекс сложных нарушений обмена, в мировой практике данное состояние определяется как «дистресс-синдром», который подразделяется на дородовый, развившийся в родах и респираторный.
Проявления гипоксии плода
Выраженность изменений, развивающихся у плода под воздействием гипоксии, определяется интенсивностью и длительностью испытываемой кислородной недостаточности. Начальные проявления гипоксии вызывают у плода учащение сердцебиения, затем - его замедление и приглушенность тонов сердца. В околоплодных водах может появиться меконий. При гипоксии легкой степени увеличивается двигательная активность плода, при тяжелой - движения урежаются и замедляются.
При выраженной гипоксии у плода развиваются нарушения кровообращения: отмечается кратковременный тахикардия и подъем АД, сменяющиеся брадикардией и спадом АД. Реологические нарушения проявляются сгущением крови и выходом плазмы из сосудистого русла, что сопровождается внутриклеточным и тканевым отеком. В результате повышенной ломкости и проницаемости сосудистых стенок возникают кровоизлияния. Снижение тонуса сосудов и замедление кровообращение приводит к ишемизации органов. При гипоксии в организме плода развивается ацидоз, изменяется баланс электролитов, нарушается тканевое дыхание. Изменения в жизненно важных органах плода может вызывать его внутриутробную гибель, асфиксию, внутричерепные родовые травмы.
Диагностика гипоксии плода
Подозрение на то, что плод испытывает гипоксию, могут возникнуть при изменении его двигательной активности - беспокойном поведении, усилении и учащении шевелений. Длительная или прогрессирующая гипоксия приводит к ослаблению шевелений плода. Если женщина замечает такие изменения, ей следует немедленно обратиться к гинекологу, осуществляющему ведение беременности. При прослушивании сердцебиения плода акушерским стетоскопом врач оценивает частоту, звучность и ритм сердечных тонов, наличие шумов. Для выявления гипоксии плода современная гинекология использует проведение кардиотокографии, фонокардиографии плода, допплерометрии, УЗИ, амниоскопии и амниоцентеза, лабораторных исследований.
В ходе кардиотокографии удается отследить ЧСС плода и его двигательную активность. По изменению сердцебиения в зависимости от покоя и активности плода судят о его состоянии. Кардиотокография, наряду с фонокардиографией, широко применяется в родах. При допплерографии маточно-плацентарного кровотокаизучается скорость и характер кровотока в сосудах пуповины и плаценты, нарушение которого приводит к гипоксии плода. Кордоцентез под контролем УЗИ проводится для забора пуповинной крови и исследования кислотно-щелочного равновесия. Эхоскопическим признаком гипоксии плода может служить выявляемая задержка его роста. Кроме того, в процессе акушерского УЗИ оценивается состав, объем и цвет околоплодных вод. Выраженное многоводие или маловодие могут сигнализировать о неблагополучии.
Проведение амниоскопии и амниоцентеза через канал шейки матки позволяет визуально оценить прозрачность, цвет, количество околоплодной жидкости, наличие в ней включений (хлопьев, мекония), провести биохимические пробы (измерение рН, исследование содержания гормонов, ферментов, концентрации CO2). Амниоскопия противопоказана при предлежании плаценты, кольпите, цервиците, угрозе прерывания беременности. Непосредственная оценка амниотической жидкости осуществляется после ее излития в I периоде родов. В пользу гипоксии плода свидетельствует примесь в околоплодных водах мекония и их зеленоватый цвет.
Лечение гипоксии плода
В случае выявления гипоксии плода беременная госпитализируется в акушерско-гинекологический стационар. Наличие гипоксии плода требует коррекции имеющейся акушерской и экстрагенитальной патологии матери и нормализации фетоплацентарного кровообращения. Беременной показан строгий покой, оксигенотерапия. Проводится терапия, направленная на снижение тонуса матки (папаверин, дротаверин, эуфиллин, гексопреналин, тербуталин), уменьшение внутрисосудистой свертываемости (дипиридамол, декстран , гемодериват крови телят, пентоксифиллин).
Хроническая гипоксия плода требует введения препаратов, улучшающих клеточную проницаемость для кислорода и метаболизм (эссенциальных фосфолипидов, витаминов Е, С, В6, глутаминовой кислоты, глюкозы), антигипоксантов, нейропротекторов. При улучшении состояния беременной и уменьшении явлений гипоксии плода беременной может быть рекомендована дыхательная гимнастика, аквагимнастика, УФО, индуктотермия. При неэффективности комплексных мер и сохранении признаков гипоксии плода на сроке свыше 28 недель показано родоразрешение в экстренном порядке (экстренное кесарево сечение).
Роды при хронической гипоксии плода ведутся с использованием кардиомниторинга, позволяющего своевременно применять дополнительные меры. При острой гипоксии, развившейся в родах, ребенку требуется реанимационная помощь. Своевременная коррекция гипоксии плода, рациональное ведение беременности и родов позволяют избежать развития грубых нарушений у ребенка. В дальнейшем все дети, развивавшиеся в условиях гипоксии, наблюдаются у невролога; нередко им требуется помощь психолога и логопеда.
Осложнения гипоксии плода
Тяжелая степень гипоксии плода сопровождается тяжелейшими полиорганными дисфункциями у новорожденного. При гипоксическом поражении ЦНС может развиваться перинатальная энцефалопатия, отек мозга, арефлексия, судороги. Со стороны дыхательной системы отмечаются постгипоксическая пневмопатия, легочная гипертензия; сердечно-сосудистые нарушения включают пороки сердца и сосудов, ишемический некроз эндокарда и др.
Влияние гипоксии плода на почки может проявляться почечной недостаточностью, олигурией; на ЖКТ - срыгиваниями, рвотой, энтероколитом. Нередко вследствие тяжелой перинатальной гипоксии у новорожденного развиваются ДВС-синдром, вторичный иммунодефицит. Асфиксия новорожденных в 75-80% случаев развивается на фоне предшествующей гипоксии плода.
Профилактика гипоксии плода
Предупреждение развития гипоксии плода требует от женщины ответственной подготовки к беременности: лечения экстрагенитальной патологии и заболеваний органов репродуктивной системы, отказ от нездоровых привычек, рациональное питание. Ведение беременности должно осуществляться с учетом факторов риска и своевременным контролем за состоянием плода и женщины. Недопущение развития острой гипоксии плода заключается в правильном выборе способа родоразрешения, профилактике родовых травм.
Гипоксия плода симптомы и последствия
Внутриутробная гипоксия характеризуется недостаточным поступлением кислорода и питательных элементов к тканям плода. Может развиваться на любом этапе вынашивания. Чаще всего имеет неблагоприятные последствия для ребенка гипоксия плода. Но их можно избежать, обращаясь своевременно за помощью. В этом состоянии возникают нарушения внутренних органов, особенно головного мозга и структур нервной системы.

Как часто встречается гипоксия?
От общего числа беременностей это нарушение занимает 10-11%. Гипоксия может иметь разную степень тяжести, обусловленную яркостью симптомов нарушения и кислородной недостаточности. В той или иной степени незначительная гипоксия встречается у многих беременных.
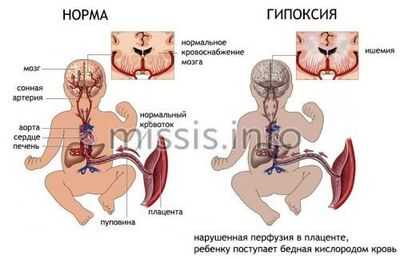
Симптомы гипоксии специалисты обнаруживают во время скринингового ультразвукового исследования или по результатам допплерографии. На поздних сроках недостаток кислорода можно заподозрить по повышенной активности плода или изменениям на КТГ.
Несмотря на высокую распространенность, гипоксия требует постоянного контроля со стороны медиков. Беременная нуждается в грамотно подобранном лечении.
Острая гипоксия плода
Острая гипоксия отличается внезапностью, требует экстренной помощи медиков.
Возможные причины такого состояния:
- Нарушение кровотока в пуповине при обвитии плода, выпадение ее петель, что может провоцировать развитие асфиксии и внутриутробной гибели ребенка;
- Отслойка плаценты с разрывом сосудов, которые отвечают за питание плода, с возникновением острой нехватки кислорода;
- Слабость родовой деятельности, возникающая на фоне малопродуктивности схваток и длительного сдавления головки в родовом канале;

Гипоксия является главным признаком фетоплацентарной недостаточности, которая сопровождается угрозой выкидыша и развитием внутриутробных отклонений.
Хроническая гипоксия плода
Хроническая недостаточность кислорода развивается преимущественно на фоне определенных заболеваний у беременных. Способствуют развитию этого отклонения в первую очередь патологии сердца и сосудов, такие как пороки сердца, гипертония, ишемия, сбои в сердечном ритме. А также хроническая анемия, эндокринные нарушения, болезни крови. Сахарный диабет, прогрессирующий у женщины, нередко вызывает гипоксические состояния во время беременности, провоцирует нарушение кровотока, многоводие.
Крайне отрицательно на кровообращении будущего ребенка сказываются эндокринные заболевания матери. При тиреотоксикозе женщина страдает от тахикардии, что неминуемо ведет к нарушению кровотока. При гипофункции щитовидной железы обменные реакции замедляются, в результате доставка вместе с кровью кислорода и питательных компонентов также ухудшается.
Особого внимания специалистов требуют женщины с ожирением. Именно такие беременные часто страдают от повышения давления на поздних сроках беременности, преэклампсии и гестоза. Если ожирение сочетается с сахарным диабетом, резко возрастает риск рождения крупного плода и возникновения определенных трудностей в родах.
Хроническая гипоксия часто является осложнением иммунологической несовместимости клеток матери и будущего ребенка, которая развивается в результате резус-конфликта. При этом нарушении происходит выработка специфических белков, разрушающих ткани плода и вызывающих гипоксическое состояние.
К хронической гипоксии приводят гестозы беременных, которые встречаются преимущественно на поздних сроках. В результате поражения сосудистых стенок, резких скачков давления, развития почечной недостаточности снижается качество кровообращения, что ведет к недостатку питательных элементов и кислорода у плода.

Маловодие и многоводие также могут приводить к кислородной недостаточности и развитию хронической гипоксии. Опасно для плода и даже незначительное перенашивание. Оно грозит внутриутробной гибелью и серьезными неврологическими нарушениями. Инфекции во время беременности, особенно венерические болезни и грипп, способны усложнять вынашивание ребенка и вызывать тяжелые инфекционные осложнения как внутриутробно, так и в будущем, в раннем неонатальном периоде.
Как проявляется внутриутробная гипоксия?
Выраженность клинической картины при гипоксии зависит в первую очередь от тяжести состояния и степени нарушения. Хроническая недостаточность кислорода обычно не проявляется внешними изменениями. Определить внутриутробные страдания плода можно только в ходе ультразвукового исследования, по результатам допплерографии или КТГ.
Острая гипоксия сопровождает серьезные нарушения в работе женского организма, развивается на фоне гестоза, почечной недостаточности и других отклонений. Поэтому специалисты обычно своевременно определяют нехватку кислорода у плода и предпринимают всё необходимое для устранения неблагоприятных последствий.
Со стороны плода при гипоксии отмечаются следующие характерные симптомы, которые могут заметить и специалисты, и сама женщина:
- Учащение сердечных сокращений;
- Активные шевеления на протяжении долгого периода времени, которые сочетаются с высоким тонусом матки;
- Аритмичность сердечных тонов плода;
- По мере прогрессирования гипоксии сердечный ритм уряжается, что говорит о развитии асфиксии;
- Появление первородного кала в околоплодных водах во время родов.
Характерные признаки гипоксии возникают чаще в хронической стадии болезни. И лишь осмотры, скрининговые исследования позволяют контролировать состояние женщины и плода.
Подход к лечению гипоксии
При выраженной стадии гипоксии беременной предлагают госпитализацию. Специалисты делают все возможное для устранения экстрагенитальной патологии женщины и восстановления фетоплацентарного кровотока. Необходимо соблюдать все врачебные рекомендации, включая ограничения активности на период лечения до нормализации самочувствие. Для снижения повышенного тонуса назначают специальные препараты, которые расслабляет маточные стенки и предупреждают угрозу прерывания. При хронической гипоксии показано использование лекарств, которые делают клетки более чувствительными и проницаемыми для кислорода. Также используются нейропротекторы, метаболики, препараты железа.

Важно устранить действие предрасполагающих факторов и уменьшить проявления главного заболевания, которое вызывает гипоксию плода. Иногда у беременной обнаруживают сочетанные патологии, требующие серьезного медикаментозного лечения. В таком случае женщина остается в стационаре вплоть до родоразрешения.
Возможные осложнения гипоксии:
- Задержка роста, развития будущего ребенка;
- Рождение маловесного плода;
- Преждевременная родовая деятельность;
- Неврологические расстройства у плода;
- Антенатальная гибель.
Профилактика
Профилактика гипоксии должна начинаться задолго до беременности. Женщине рекомендуется пройти комплексное обследование до зачатия, чтобы выявить серьезные внутренние нарушения, пройти качественное лечение. Особое внимание обратите на инфекционные заболевания, которые часто вызывают гипоксические состояния у плода.

Уже при подтверждении беременности, своевременно становитесь на учет и проходите скрининговые исследования. В случае возникновения вирусных заболеваний не занимайтесь самолечением, обращайтесь к грамотным специалистом.
Никогда не принимайте медикаменты без одобрения врача, особенно на раннем этапе вынашивания, когда плацента не выполняет своих защитных функций. При изменении в активности шевелений сразу же проходите допплерографию и КТГ. Ранее выявление гипоксии позволит своевременно провести лечебные мероприятия и избежать неблагоприятного исхода заболевания.
Следите за качеством питания, откажитесь от всех вредных привычек. Беременным рекомендованы ежедневные вечерние прогулки перед сном, которые значительно усиливают приток кислорода ко всем органам и тканям.
Гипоксия
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Гипоксия - кислородная недостаточностъ, состояние, возникающее при недостаточном снабжении тканей организма кислородом или нарушении его утилизации в процессе биологического окисления, сопровождает многие патологические состояния, являясь компонентом их патогенеза и клинически проявляясь гипоксическим синдромом, в основе которого лежит гипоксемия. Мы надеемся, вы разобрались в терминологии: гипоксия - это недостаток кислород обеспечения кислородом тканей, гипоксемия - недостаточное содержание кислорода в крови. Нарушение обмена идет на уровне мембран: альвеола - кровь; кровь - клеточная мембрана; внутритканевой обмен кислорода.
Широкое применение нашла классификация Баркрофта (1925), более поздние классификации альтернативны только по терминологии, но суть та же.
Виды гипоксий
Гипоксемии по генезу делят на 4 вида:
- дыхательная гипоксия, вызванная нарушением вентиляции легких и газообмена на уровне альвеоло-капиллярной мембраны;
- гемическая гипоксия, вызванная нарушением транспорта кислорода к тканям из-за анемии или связывания гемоглобина (отравление СО, цианидами);
- циркуляторная гипоксия, вызванная нарушением кровотока, микроциркуляции и газообмена на уровне кровь - ткань;
- гипоксия сочетанного генеза, когда имеют место все 3 первые компонента гипоксемии. По темпу развития и продолжительности различают: молниеносную, острую, подострую и хроническую гипоксемию.
Дыхательная гипоксия может быть вызвана внешними факторами в связи: со снижением парциального давления кислорода во внешней среде при нахождении в разряженной атмосфере, например, на высоте (характерно развитие синдрома Де Акоста - нехватка воздуха, учащение дыхания, цианоз, головокружение, головная боль, нарушение, слуха, зрения, сознания); с гиперкапническими условиями (с избыточным содержанием в атмосфере углекислого газа) в закрытых помещениях, шахтах и др. с плохой вентиляцией, так как гиперкапния сама по себе не вызывает расстройств газообмена, наоборот, улучшает мозговой кровоток и кровоснабжение миокарда, но при недостатке кислорода приводит к развитию ацидоза; с гипокапническими условиями, развивающимися при гипервентиляции легких вследствие усиленного и частого дыхания, в результате чего углекислота вымывается из крови, с развитием алкалоза, при этом угнетается дыхательный центр. Внутренние факторы могут быть обусловлены: альвеолярной гиповентиляцией при асфиксии, воспалительных процессах, бронхоспазме, инородных телах; уменьшением дыхательной поверхности легких при разрушении альвеолярного сурфактанта, пневмотораксе, пневмонии; патологией механики дыхания при нарушении каркасности грудной клетки, повреждении диафрагмы, спастических состояниях дыхательной мускулатуры; нарушениями центральной регуляции при повреждении дыхательного центра вследствие травмы или заболевания мозга либо угнетении химическими средствами.
Циркуляторная гипоксия формируется при сердечно-сосудистой недостаточности, когда кровоток снижается во всех органах и тканях, или при местном снижении кровотока, вызванном ангиоспазмом, стазом эритроцитов, тромбообразованием, артериовенозным шунтированием и др.
Гемическая гипоксемия определяется снижением циркулирующего гемоглобина вследствие анемий или блокады гемоглобина отравляющими веществами, например, окисью углерода, цианидами, люизитом и др.
В отдельном виде гипоксемии встречаются крайне редко, так как все они связаны патогенетической цепью, просто один из видов является пусковым, вызывая присоединение и других. Как пример может служить острая кровопотеря: гемический компонент вызывает нарушение и кровотока, который, в свою очередь, формирует «шоковое» легкое с развитием дыхательного компонента «респираторный дистресс-синдром».
Молниеносные формы гипоксии, например, при отравлении цианидами, не дают клинических проявлений гипоксического синдрома, так как смерть наступает мгновенно, больше того, при отравлениях угарным газом и цианидами связанный гемоглобин придает коже розовую «здоровую» окраску.
При острой форме (от нескольких минут до нескольких часов) развивается агональный синдром, который проявляется декомпенсацией функции всех органов и систем и, прежде всего, дыхания, сердечной деятельности и головного мозга, так как ткани головного мозга наиболее чувствительны к гипоксии.
При подострой (до нескольких суток или недель) и хронической, продолжающейся месяцами и годами, формируется выраженная клиническая картина гипоксического синдрома. При этом также в первую очередь страдает головной мозг. Развиваются разнообразные неврологические и психические сдвиги, причем преобладают общемозговые симптомы, диффузное расстройство функций центральной нервной системы.
Первоначально нарушается активное внутреннее, торможение: развивается возбуждение, эйфория, снижается критическая оценка своего состояния, появляется двигательное беспокойство. Затем, а иногда и первоначально, появляются симптомы угнетения коры головного мозга: вялость, сонливость, шум в ушах, головная боль, головокружение, общая заторможенность, вплоть до нарушения сознания. Могут быть судороги, непроизвольное мочеиспускание и дефекация. Иногда сознание просветляется, но заторможенность остается. Постепенна нарастают нарушения черепно-мозговой и периферической Иннервации, формируется очаговая симптоматика.
При длительной гипоксии головного мозга постепенно развиваются и психические расстройства: делирий, корсаковский синдром, деменция и др.
Судорожный синдром и гиперкинезы при гипоксии проявляются разнообразно. Обычно судороги возникают под воздействием внешнего раздражителя, чащ> протекают в виде миоклоний: начинаются с лица, кистей рук, затем вовлекаются другие мышцы конечностей, живота, Иногда при гипертонусе разгибателей формируется опистотонус. Судороги, как и при столбняке, носят тонический и клонический характер, но, в отличие от него, в процесс вовлечены мелкие мышцы (при столбняке стопы и кисти свободны), всегда имеет место нарушение сознания (при столбняке оно сохранено).
Со стороны других органов и систем отмечается вначале дисфункция, а затем угнетение деятельности сердечно-сосудистой системы, дыхания, развивается почечно-печеночная недостаточность за счет формирования гипоксических дистрофий жировой, зернистой, вакуольной. Чаще же развивается комплекс полиорганной недостаточности. Если гипоксия не купируется, процесс переходит в атональное состояние.
Диагностика, кроме общеклинического обследования, должна включать исследование кислотно-основного состояния крови. Несомненно, что это возможно и необходимо делать только в условиях отделения реанимации и интенсивной терапии да и лечение гипоксии должен проводить специалист-реаниматолог.
Читайте также:
