Злокачественные нейрогенные опухоли средостения. Пример саркомы средостения
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Стенограмма второй части видеолекции профессора Игоря Евгеньевича Тюрина о новообразованиях средостения из цикла передач Лучевая диагностика для терапевтов.
Игорь Евгеньевич Тюрин, профессор, доктор медицинских наук:
- Другая распространенная проблема этой же области (я ее показываю специально, чтобы было понятно, насколько иногда непросто для врача-рентгенолога определить, о чем идет речь в этой ситуации) - тератома.
Чаще эти опухоли встречаются у более молодых пациентов. Большинству из них меньше 30-ти лет, в отличие от тимом. Большинство пациентов имеют явные клинические симптомы. Это опухоли, растущие и приводящие к сдавлению или оттеснению анатомических структур в грудной полости.
Тем не менее, большинство из них доброкачественные. Это один из наиболее частых вариантов герменогенных опухолей. Лучевые признаки обычно точно там же, где и располагаются тимомы, перед восходящей аортой. Четко очерченное округлое образование. Но, в отличие от тимомы как мягкотканого образования, иногда жировые включения, костные фрагменты, иногда даже фрагменты зубов - то, что позволяет рентгенологу сформулировать, предположить правильный диагноз.
Хотя если этого нет, то на обзорных снимках очень сложно сказать, что это такое. Такое же овальное патологическое образование в переднем средостении. Контрастированный пищевод, который проходит по задней поверхности сердца и вдоль задней стенки трахеи.
Но сказать на основании обзорной рентгенограммы, что это такое, может быть крайне сложно. Любое патологическое образование. Почему мы говорим, что это термоидное образование, герменогенная опухоль. Внутри мы видим включение жировой клетчатки, кистозные включения, множественные перегородки.
Расположение точно такое же - переднее средостение, средний этаж. Но достаточно характерная картина, которая позволяет говорить о том, что это такое и предпринимать соответствующее лечение.
Еще один очень важный признак, который позволяет нам иногда правильно характеризовать характер патологического образования в средостении - это взаимосвязь с другими анатомическими структурами. Классикой жанра здесь является внутригрудной зоб. Он чаще возникает у женщин. Чаще это патология у людей старше 40 - 45 лет. Достаточно частые по статистике образования.
Несмотря на очень большие размеры, оно длительное время может протекать бессимптомно. Важно, что почти всегда мы можем наблюдать связь со щитовидной железой. Это образование располагается в области верхней апертуры. Может быть в переднем или заднем средостении. Как правило, оттесняет и суживает трахею, что на рентгеновских снимках создает очень характерную типичную картину.
Если вы посмотрите на обзорный снимок в прямой проекции, то сразу же будет видно, насколько изменилась конфигурация воздушного столба в трахее на уровне грудино-ключичных расчленений и выше в области верхней апертуры. Трахея оттеснена по дуге вправо и практически достигает контура средостения и несколько сужена.
Почему? Ответ на этот вопрос в компьютерно-томографическом исследовании. Два огромных узла, один из которых располагается на шее. Второй в переднем средостении. Оба гиперваскулярны, неоднородной структуры. Это типичная картина огромных размеров внутригрудного зоба, который занимает переднюю часть средостения.
Еще одна особенность патологических образований, когда мы говорим об их локализации. Лимфомы, если говорить о преимущественной локализации этих патологических образований, часто занимают тот же средний этаж переднего средостения, что и тимомы и герменогенные опухоли. Но очень часто по характеру клинического течения, по дополнительным признакам они отличаются.
Здесь самое главное - системные поражения. Это поражения многих групп лимфатических узлов, в том числе и периферических лимфатических узлов, с чего начинается обследование такого пациента. Патология возникает либо в молодом возрасте 20-ти лет, либо старше 50-ти лет.
Это патологическое состояние разделяется на две большие группы. Сейчас это болезнь Ходжкина и злокачественные неходжкинские лимфомы (ЗНЛ). Последние чаще встречаются у людей более старшего возраста. По количеству они значительно чаще встречаются.
Но если говорить о патологии средостения, то там болезнь Ходжкина занимает первое место по частоте. Проявления одинаковые. Мы редко можем предположить нозологическую принадлежность, гистологическую форму, тип патологического процесса. Но когда мы видим отдельные увеличенные лимфатические узлы в переднем средостении или когда это сочетается с увеличением периферических лимфатических узлов, с характерной клинической симптоматикой, тогда предположение врача-рентгенолога становится более понятным и очевидным.
Расширение тени средостения на обзорном снимке влево в области аорто-пульмонального окна, в области талии сердца и при томографическом исследовании прекрасно виден конгламерат увеличенных лимфатических узлов, которые располагаются в переднем средостении. Объемные образования, которые состоят из множества лимфатических узлов, отличают такой процесс от обычных опухолей средостений.
С другой стороны, эти лимфатические узлы могут вырастать в патологическое образование, которое совершенно неотличимо ни от каких других опухолей средостений, с признаками инвазии, с вовлечением в грудной стенке, со сдавлением крупных сосудов, со стеснением и сужением трахеи главных бронхов.
В этой ситуации требуется морфологическая верификация, чтобы ответить на вопрос: что это за патологический процесс.
В качестве иллюстрации: почему рентгенологи предпочитают разделять средостения на различные части, отделы. Патология заднего средостения, которая совершенно отличается по нозологии от того, что мы видим в передней части средостения, потому что здесь может встречаться внутригрудной зоб.
Но все-таки это территория, где чаще возникают нейрогенные опухоли, где обычно локализуются бронхо- и энтерогенные кисты, могут увеличиваться лимфатические узлы при лимфомах, но очень редко, где возникают значительные аневризмы аорты в области дуги нисходящей части. Классикой жанра здесь являются нейрогенные опухоли. Иногда совсем маленькие, они случайно выявляются при рентгеновском исследовании.
Небольшое патологическое образование, которое по форме напоминает нисходящую часть аорты в поперечном сечении. Бессимптомное течение. Обычно 3-я или 4-я декады жизни, округлая форма, четкие контуры, тканевая плотность. Очень часто кальцификация, кисты. Самое главное - абсолютно типичная локализация в большинстве случаев в реберно-позвоночном углу.
В этом случае, даже если у нас есть обычное компьютерно-томографическое исследование, без всякого контрастирования, информации, локализация в заднем средостении, которая четко определяется по обзорным снимкам, проекция патологического образования на тень позвонков, которая позволяет нам говорить, что это образование находится в реберном позвоночном углу.
Подтверждение этому томографическое исследование со всеми типичными характерными признаками. По компьютерной томографии мы хорошо видим, что это образование не внедряется в позвоночный канал. В этом случае можно не выполнять МРТ.
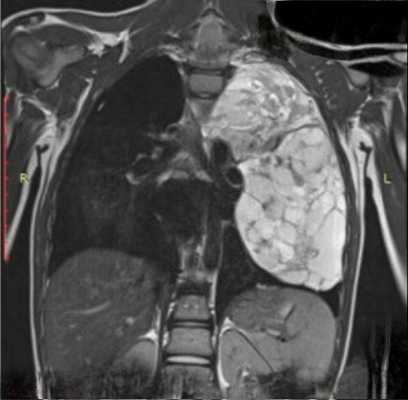
В тех случаях, когда эти опухоли (что, к счастью, бывает редко) озлокачествляются и приобретают крупные размеры, тогда судить о природе, источнике чрезвычайно сложно. Это злокачественная нейрогенная опухоль, которая привела к оттеснению средостения в противоположную сторону - в сторону правого легкого с накоплением жидкости в правой половине плевральной полости.
Огромных размеров патологическое образование, оттесняющее аорту впереди в сторону сердца, занимающее практически всю левую половину грудной полости, оттесняющее селезенку, почку и диафрагму вниз. Это злокачественная нейрогенная опухоль. Но сказать о том, что эта опухоль исходит из нервных образований, при томографическом исследовании очень сложно и не всегда возможно.
Почему мы не можем сегодня ограничиваться только этими данными, только локализацией. Конечно, возможные ошибки. Различные опухоли могут располагаться в одном и том же отделе средостения. Мы это видели на примере средней части переднего средостения.
С другой стороны, одинаковые опухоли могут располагаться в совершенно различных отделах средостения. Классикой в этом случае являются нейрогенные опухоли, которые могут встречаться не только в заднем, но и в переднем, центральном средостении.
Здесь важен еще один вид анализа при лучевом исследовании. Это структура патологического образования. То, что мы очень плохо можем различить на обычных обзорных рентгенограммах, на линейных томограммах. Мы всегда говорим о том, что подозрение на патологическое образование в средостении есть прямое показание к выполнению компьютерной томографии или магнитного резонанса.
В зависимости от того, что мы обнаруживаем в этом случае (скопление жидкости, жира или необычные реакции на контрастное вещество, его избыточное накопление или обызвествления), мы можем более глубоко и более точно оценить характер этих образований.
Жиросодержащие образования (мы сегодня уже говорили о герменогенных опухолях и тератомах), которые отличаются от всех остальных образований тем, что содержат заключения жира. Другим таким же примером являются грыжи диафрагмы, которые очень часто вызывают затруднения при обычном рентгенологическом исследовании. Избытки жира скапливаются в области реберных диафрагмальных синусов, в области сердца или позвоночника.
В этом случае возникает предположение, нет ли здесь патологического образования, опухоли, которая требует хирургического лечения. Если этот вопрос нельзя решить на основании рентгеновского исследования, то томографическое исследование четко показывает скопление чаще всего жировой клетчатки.
Никаких сомнений в том, что здесь нет злокачественной опухоли и вообще опухоли, не остается. На этом процесс диагностики заканчивается.
Грыжи различаются по локализации, по характеру. Это описано в большинстве руководств и учебников. Я не буду на этом сейчас останавливаться. Другим примером такой же дифференциальной диагностики является кистозное образование, очень частое, особенно у детей.
Речь идет в том числе о врожденных кистах. Это примерно 20% всех патологических образований средостений. Каким образом их можно отличить от солидных опухолей той же локализации. По денситометрическим характеристикам.
Наиболее частые бронхогенные кисты, которые локализуются в паратрахеальной правой области или около бифуркации трахеи. Как правило, имеют плотность жидкости, если у них не возникает или не накапливается растворимый кальций. Тогда плотность может повышаться и в существенно большей степени.
Типичная локализация расположения патологического образования в правой паратрахеальной области. Контрастированная верхняя полая вена в том и другом случае смещены впереди. Само патологическое образование прилежит к правой стенке трахеи. Типичная локализация.
Очень часто такие пациенты выявляются при первом же флюорографическом исследовании. У них определяется расширение тени средостения вправо. Это может интерпретироваться как проявление увеличения лимфатических узлов. Нередко - как проявление туберкулезного поражения лимфатических узлов. Вследствие этого начинается лечение без томографического исследования.
Выполнение томографии здесь позволяет сразу же исключить какие-то воспалительные патологические процессы.
Про обызвествления мы уже говорили. Это внутригрудной зоб, тератомы, лимфатические узлы.
В заключение на чем бы мне хотелось остановиться сейчас - это мягкотканые образования, которые в некоторых случаях имеют либо обычную, либо не совсем обычную реакцию на введение контрастного препарата.
Обычное усиление, обычная реакция - так же как реагируют тканевые структуры - наблюдаются при тимомах, невриномах, герминогенных опухолях, мезенхимальных опухолях (фибромы, миомы и так далее), при злокачественных лимфомах. Здесь нет никакой специфики.
Локализация этих патологических образований в сочетании с другими признаками иногда позволяет предположить правильный диагноз. То, что имеет важное значение - в некоторых случаях мы видим обызвествления или повышенную плотность при первичном исследовании. Это характеризует, например, внутригрудной зоб или свежие гематомы.
Самое интересное - это необычная реакция на введение контрастного вещества. Она наблюдается в виде исключительно высокого повышения плотности патологического образования. Такие изменения мы наблюдаем у больных с внутригрудным зобом, при опухолях паращитовидных желез, при болезни Кастлмана, при некоторых формах карциноидных образований средостений.
Это характерная картина, которая должна подлежать интерпретации. Мы опять возвращаемся к опухолям, исходящим из щитовидной железы, которые через верхнюю апертуру спускаются вниз в область грудной полости средостения. Типичные, это хорошо видно, характерные проявления этого патологического образования с оттеснением средостения и локализацией его в области верхней апертуры.
Насколько повышает плотность это патологическое образование. Оно практически соответствует по плотности сосудистым структурам средостения, контрастированию крови в сосудах и камерах сердца. Это характерно для тканей щитовидной железы.
Другой пример. Болезнь Кастельмана. Здесь специально оставлены денситометрические показатели. Средняя плотность образования, которое располагается между типичных образований, между восходящей и нисходящей аортой и оттесняет трахею сзади и справа, составляет почти 140 или 150 единиц (неразборчиво, 15:07).
Практически так же как контрастированная кровь. Очень немногие патологические образования средостения реагируют таким образом на введение контрастного вещества. В этом случае сочетание точной локализации и реакции на контрастный препарат позволяют предположить правильный диагноз.
Но, с другой стороны, в некоторых случаях, особенно когда речь идет о мезенхимальных опухолях, как в данном случае - ангиомиосаркоме, мы видим избыточную васкуляризацию таких патологических образований, все признаки злокачественного процесса. Но сделать здесь какое-либо морфологическое заключение очень сложно. Это может быть сделано только на основании гистологического исследования самого патологического образования.
Подводя итог сегодняшнему разговору о томографическом исследовании, вообще о лучевом исследовании при патологии средостения и при новообразованиях средостения, хочу еще раз подчеркнуть, что первичные выявления - это выявления с помощью рентгеновских исследований, рентгенографии в прямой и боковой проекции.
В качестве уточняющих методов чаще всего это компьютерная томография. Обычно с внутривенным контрастированием, чтобы мы могли точно разграничить образования на две большие части. По их локализации в средостении и по реакции на введение контрастного вещества.
В этом случае мы можем четко определить и локализацию изменений и взаимоотношения с прилежащими структурами. Нередко поставить и нозологический диагноз.
Кисты средостения
Кисты средостения - многочисленная группа полостных образований медиастинального пространства врожденного и приобретенного характера. Кисты средостения могут иметь бессимптомное течение или сопровождаться признаками компрессии окружающих органов (бронхов, пищевода, предсердий, артерий), нарушая их функцию. Диагностика кист средостения подразумевает проведение полипозиционной рентгеноскопии и рентгенографии грудной клетки, пищевода, сердца; томографии; бронхоскопии, пневмомедиастинографии, медиастиноскопии, тонкоигольной аспирационной биопсии, УЗИ средостения, парастернальной медиастинотомии. Лечение кист средостения может включать их открытое или торакоскопическое удаление, трансторакальную пункцию кисты с дренированием и склерозированием и др.
МКБ-10


Общие сведения
Кисты средостения составляют от 14 до 18,5% всей медиастинальной патологии. К кистами средостения относят полостные образования различного генеза, происходящие из разнородных тканей и объединенные анатомо-топографическими особенностями расположения. Преимущественно обнаруживаются у пациентов в возрасте 20-50 лет, при этом с одинаковой частотой у женщин и мужчин.
Кроме кист, в средостении могут развиваться истинные доброкачественные и злокачественные опухоли: тимомы, тератомы, липомы, нейрогенные опухоли, лимфомы, саркомы, лимфогенные метастазы злокачественных опухолей различных органов и др. Проблема диагностики и лечения кист средостения относится к числу наиболее сложных и актуальных разделов пульмонологии и торакальной хирургии.

Анатомия средостения
Под средостением (mediastinum) понимают сложное в анатомическом отношении пространство, расположенное в грудной полости. Спереди границами средостения служат грудина, позадигрудинная фасция и реберные хрящи; сзади - предпозвоночная фасция, передняя поверхность грудного отдела позвоночника и шейки ребер; по бокам - листки медиастинальной плевры; снизу - диафрагма; сверху - условная горизонтальная плоскость, проходящая по верхнему краю рукоятки грудины. Т.о., в медиастинальном пространстве выделяют 3 отдела (переднее, среднее и заднее средостение) и 3 этажа (верхнее, среднее и нижнее средостение).
В средостении сосредоточены жизненно важные органы и анатомические образования (крупные сосуды, нервные стволы и сплетения, лимфатические протоки, бифуркация трахеи и главные бронхи, пищевод, перикард и др.). Поэтому компрессия или инвазия этих структур может сопровождаться различными по проявлениям и нередко угрожающими жизни симптомокомплексами. Кисты средостения могут выявляться в любых отделах и этажах медиастинального пространства.
Классификация кист средостения
Кисты средостения классифицируются по происхождению и локализации. Среди множества кист средостения различают истинные (врожденные, первичные), вторичные (приобретенные).
Врожденные кисты средостения развиваются из мезодермальных образований - целома или передней кишки. К ним относятся целомические, энтерогенные, бронхогенные, дермоидные кисты, кисты тимуса и др. Приобретенные кисты средостения происходят из лимфатических сосудов, различных органов средостения и пограничных областей. В число приобретенных кист средостения входят лимфатические, тимусные, паразитарные (эхинококковые), менингеальные.
Целомические кисты и дивертикулы перикарда
Являются своеобразным врожденным пороком развития и составляют 3,3-14,2% всех медиастинальных новообразований. Наиболее часто кисты перикарда (60%) развиваются в правом кардиодиафрагмальном углу, реже (30%) - в левом кардиодиафрагмальном углу и других отделах средостения (10%). Такие кисты средостения являются полыми тонкостенными образованиями, сходными по строению с тканями перикарда, имеют гладкую поверхность серо-желтого или серого цвета.
Кисты перикарда содержат прозрачную серозную или серозно-геморрагическую жидкость. Целомические кисты перикарда могут достигать диаметра от 3 до 20 и более см. Целомические кисты средостения могут быть однокамерными или многокамерными, сообщаться с полостью перикарда, быть связанными с перикардом посредством ножки или плоскостного сращения. Приобретенные кисты перикарда встречаются редко; обычно имеют воспалительное и травматическое происхождение. Также описаны паразитарные (эхинококковые) кисты перикарда.
Бронхогенные кисты средостения
Встречаются в 30-35% наблюдений. Они также являются пороками эмбрионального развития и формируются из участков дистопированного бронхиального эпителия. Макроскопически представляют тонкостенные образования, заполненные прозрачной, реже бурой жидкостью. При гистологическом исследовании в них обнаруживается хрящевая ткань, соединительнотканные и гладкомышечные волокна слизистые железы.
Полость бронхогенной кисты средостения изнутри выстлана эпителием цилиндрического или реснитчатого типа. Внутри кисты содержится прозрачная или мутноватая желатинообразная, вязкая масса, которая, при наличии связи кисты с бронхиальным деревом, может нагнаиваться. Бронхогенные кисты средостения обычно располагаются позади бифуркации трахеи и тесно соприкасаются с трахеей или главными бронхами, иногда - пищеводом. Обычно они имеют однокамерное строение и достигают размеров 7-10 см в диаметре.
Гастроэнтерогенные кисты средостения
Энтерокистомы являются эмбриональными производными из первичной кишки. С учетом микроскопического сходства их структуры с отделами ЖКТ, выделяют пищеводные, желудочные и кишечные кисты. Гастроэнтерогенные кисты средостения встречаются в 0,7-5% случаев. Они представляют собой однокамерные округлые или овоидные образования, с толстыми стенками и ножкой; локализуются преимущественно в заднем средостении. Гастроэнтерогенные кисты средостения содержат мутноватую слизевидную массу. Желудочные кисты могут продуцировать соляную кислоту, что приводит к изъязвлению стенок, кровотечению, язвам и перфорации стенок кисты средостения. В редких случаях в стенке кисты может развиваться рак.
Дермоидные кисты средостения
Кистозные тератомы содержат в своей структуре элементы эктодермы и возникают в процессе нарушения эмбриогенеза. В медицине встречаются дермоидные кисты яичников, брюшной стенки, кожи, забрюшинной клетчатки, печени, почек и др. органов и тканей. Дермоидные кисты обычно расположены в передневерхнем отделе средостения. Величина дермоидных кист средостения может достигать 15-25 см. Форма кистозных тератом обычно неправильная овальная; консистенция эластическая или мягкая. Стенки кисты могут содержать хрящевые и известковые включения. Внутри кисты заключена густая кашицеобразная жирная масса с множеством различных включений (волос, чешуек эпидермиса, кристаллов холестерина, аморфных жиров, зубов).
Кисты вилочковой железы
Могут иметь врожденное и приобретенное (воспалительное, опухолевое) происхождение. Они преимущественно выявляются у детей и людей молодого возраста.
Симптомы кист средостения
Особенности клинических проявлений кисты средостения обусловлены типом и расположением образования, его величиной и скоростью роста. В большинстве случаев симптоматика развивается на том этапе, когда увеличение кисты средостения вызывает компрессию других органов и неизбежное нарушение их функций.
Течение кист перикарда в большинстве случае бессимптомное, гладкое. Нередко они являются находкой при прохождении профилактической флюорографии. Иногда наблюдаются сердцебиение, одышка, сухой кашель, возникающие при перемене положения туловища и физической нагрузке. При осложненном течении целомических кист средостения может иметь место провыв содержимого кисты перикарда в бронх, нагноение и разрывы кисты.
Развитие бронхогенных кист средостения нередко сопровождается надсадным кашлем, одышкой, дисфагией, тупой болью в грудной клетке. При сдавлении кистой дыхательных путей развивается стридорозное дыхание. В случае прорыва бронхогенной кисты средостения в бронх может появиться кровохарканье. При одновременном прорыве кисты в плевральную полость и в бронх, развивается гидропневмоторакс и бронхоплевральный свищ.
Гастроэнтерогенные кисты средостения проявляют себя кашлем, одышкой, тахикардией, дисфагией, болью в груди. Энтерокистомы могут прорываться в трахею, бронхи, плевральную полость, средостение, вызывая развитие кровохарканья, эмпиемы плевры, частых пневмоний, лихорадки неясного генеза, бронхоэктазов, медиастинита.
Более чем в половине случаев дермоидная киста средостения сопровождается различными сердечно-сосудистыми нарушениями: приступами стенокардии, болью в области сердца, тахикардией. У 30% больных признаком дермоидной кисты средостения служит появление продуктивного кашля с выделением кашицеобразной массы, содержащей примесь волос и жира, что наблюдается при прорыве кисты в бронх. У части пациентов отмечается выпячивание грудной стенки в проекции расположения опухоли.
Симптоматика кист вилочковой железы может быть разнообразной - от бессимптомного течения до осложненного. Достигнув известных размеров, кисты могут вызывать медиастинальный «компрессионный» синдром. В некоторых случаях на первый план выходит миастенический синдром. Опасность кист вилочковой железы заключается в риске нагноения, прорыва в плевру, кровотечения.
Осложнения
Наиболее грозным осложнением кист средостения служит так называемый синдром медиастинальной компрессии, частота которого колеблется от 27 до 39%. Сюда может входить компрессия дыхательных путей, синдром верхней полой вены (СВПВ), сдавление пищевода, сердца, возвратного нерва.
При компрессии дыхательных путей развивается стридорозное дыхание, одышка, дыхательная недостаточность. Синдром ВПВ проявляется цианозом кожи лица, видимых слизистых оболочек, шеи, верхних конечностей и грудной клетки; отечностью мягких тканей этой зоны; расширением и напряжением вен шеи; повышением давления в системе ВПВ. Сдавление кистами различных структур средостения может сопровождаться дисфагией, дисфункцией надгортанника, дисфонией, компрессией и дислокацией сердца.
К прочим осложнениям кист средостения относятся их прорывы в полости плевры, бронхи и легкое, кровотечения в средостение и плевральную полость (гемоторакс). Осложненное течение кист средостения несет в себе потенциальную угрозу жизни пациента.
Диагностика
Методы выявления кист средостения включают рентгенологическую, ультразвуковую, томографическую, эндоскопическую, морфологическую диагностику.
- Рентгенологические исследования. Полипозиционная рентгеноскопия и рентгенография грудной клетки, рентгенография пищевода и сердца, пневмомедиастинография позволяют определить локализацию, форму и размеры кисты, ее связь с соседними органами, изменение положения при дыхательных движениях.
- Томографическая диагностика. Для более детальной оценки структуры, толщины стенок кисты, характера содержимого и взаимоотношения с соседними анатомическими образованиями, производится КТ и МРТ средостения.
- Эхография. При медиастинальных новообразованиях в диагностической практике широко используется УЗИ средостения. В диагностике кист перикарда существенно помогает ЭхоКГ, позволяющая дифференцировать кисту средостения от кист легкого, дермоидных кист средостения, аневризмы аорты.
- Бронхологическое обследование. При кистах средостения, демонстрирующих интимную связь с трахеей или бронхами, прибегают к выполнению бронхоскопии и бронхографии.

Если названные методы диагностики не позволяют определиться с нозологией образования, целесообразен переход к инвазивным диагностическим исследованиям:
- Биопсия. Проведение аспирационной тонкоигольной биопсии кисты средостения позволяет осуществить цитологическое исследование полученного пунктата и верифицировать морфологию образования в 80-90% случаев. Тонкоигольная биопсия может выполняться чрескожным, чрестрахеальным, чрезбронхиальным, чреспищеводным доступом.
- Диагностические операции. С целью визуализации и открытой эксцизионной биопсии опухоли средостения может быть предпринята медиастиноскопия, диагностическая торакоскопия, парастернальная медиастинотомия.
Лечение кист средостения
Лечебная тактика в отношении кист средостения сводится к их хирургическому удалению в возможно ранние сроки. Такой подход является профилактикой развития компрессионного синдрома, разрыва и малигнизации кист средостения.
- Открытое удаление кисты средостения может проводиться путем продольной стернотомии (при расположении кисты в переднем средостении), с помощью переднебоковой торакотомии на стороне поражения (при боковом расположении образования), боковой торакотомии (при локализации опухоли в среднем средостении), заднебоковой торакотомии (при расположении кисты в заднем средостении). Открытые операции обеспечивают возможность наибольшей свободы действий и полноценной интраоперационной ревизии раны. При развитии осложнений может потребоваться проведение медиастинотомии.
- Торакоскопическое удаление кист средостения также широко и успешно применяется не только для диагностики, но и для удаления медиастинальных образований. В некоторых случаях используется миниторакотомия с видеоподдержкой.
- Пункционная аспирация. У соматически отягощенных пациентов с низкими функциональными резервами методом выбора служит трансторакальная пункция с дренированием и склерозированием кисты средостения. В качестве склерозантов обычно используется раствор спирта с йодом, глюкозы.
1. Опухоли и кисты средостения (включая патологию вилочковой железы)/ Овнатанян К.Т. Кравец В.М. - 1971.
2. Новообразования средостения: принципы дифференциальной диагностики и хирургического лечения: Автореферат диссертации/ Пищак В.Г. - 2008.
3. Клинические рекомендации по диагностике и лечению больных опухолями средостения и вилочковой желез/ Борисова Т.Н., Бредер В.В., Горбунова В.А., Иванов С.М., Лактионов К.К., Михина З.П., Реутова Е.В., Полоцкий Б.Е., Тюляндин С.А. - 2014.
Опухоли средостения: что это такое, классификация.
Опухоли средостения - общее название новообразований, которые расположены в медиастинальном пространстве груди. В 40% случаев диагностирования опухоли являются злокачественными, и тогда ставится диагноз рак средостения. Все опухоли делятся на две большие группы - первичные и вторичные. В первом случае речь идет о тех новообразованиях, которые формируются непосредственно в области средостения, во втором - опухоли образуются сначала в тканях, расположенных вне обозначенной области, а рак средостения развивается уже из метастаз. Иногда опухоли средостения называют рак тимуса, но это не совсем корректное обозначение диагноза. Дело в том, что он обозначает наличие злокачественных клеток в вилочковой железе, тогда как опухоли средостения могут начать свой рост и из других структур.
В зависимости от локализации опухоли различают следующие виды злокачественных новообразований:
- передняя часть средостения - герминогенные опухоли, тимомы, лимфомы, дизэмбриогенетические опухоли, феохромоцитомы;
- средняя часть средостения - метастатическая карцинома, лимфома;
- задняя часть средостения - нейрогенные опухоли, вторичные опухоли (меланомы, саркомы).
Отдельно в медицине рассматриваются мезенхимальные опухоли - представляют собой рак мягких тканей, к таковым относятся липомы и гемангиомы, лейомиосаркомы и фибромы. Поражают разные части средостения, относятся к группе вторичных, потому что «вырастают» из метастаз.
К редким опухолям средостения относятся липо- и фибросаркомы. Их опасность заключается в том, что они долгое время протекают бессимптомно и пациент обращается за помощью к врачу при выраженных нарушениях, когда рак находится уже на 3 и 4 стадии развития. Также к этой группе относится рак тимуса (тимома) - развивается в клетках вилочковой железы.
Какие симптомы укажут на рак средостения?
Рак может протекать в двух стадиях - бессимптомной и с выраженными признаками. Продолжительность прогрессирования опухоли средостения без симптомов зависит от нескольких факторов - место локализации новообразования, уровень общего иммунитета, возраст человека. Часто бессимптомно протекающий рак диагностируется случайно, во время проведения стандартной процедуры флюорографии в рамках диспансеризации.
К основным признакам рака средостения относятся:
- кашель - сухой, приступообразный, не проходящий даже после прохождения курса лечения;
- одышка - появляется сначала после физических нагрузок, но очень быстро начинает беспокоить человека и в покое;
- боль в области груди - возникает спонтанно, периодически исчезает, усиливается во время кашля, носит давящий характер;
- кровохарканье - симптом, присущий редким опухолям средостения, свидетельствует о стремительном росте опухоли и повреждении структур дыхательных путей;
- внезапное похудение - больной начинает терять вес даже на фоне привычного аппетита: до 15 кг в течение 3-4 недель;
- общая слабость - больной испытывает постоянное желание лечь и отдыхать, работоспособность уменьшается и не восстанавливается даже после качественного отдыха;
- незначительное повышение температуры тела - происходит спонтанно, не превышает субфебрильных показателей.
Злокачественные опухоли растут достаточно быстро, поэтому переход из бессимптомной стадии в форму с выраженной клинической картиной недолгий. Могут проявляться и дополнительные симптомы типа отечности верхней части туловища и лица, синюшного цвета лица, расширения подкожных вен шеи.
Самым ранним проявлением рака средостения считается болевой синдром, особенно часто он проявляется при раке тимуса. В таком случае боли идентичны приступам стенокардии. Существует и ряд специфичных признаков опухолей средостения:
- для мезенхимальных опухолей характерны зуд кожи и повышенная потливость в ночное время суток;
- герминогенные опухоли могут сопровождаться птозом (опущением) век, понижением уровня глюкозы в крови;
- при нейрогенных опухолях нередко отмечается спонтанное повышение артериального давления;
- редкие опухоли средостения проявляются изжогой, диареей (поносом).
Общие симптомы, слабовыраженная клиническая картина, многообразие признаков, которые присущи и другим патологиям, делают диагностику только по жалобам пациента и стандартным обследованиям практически невозможной. Кроме этого, опухоли средостения могут быть и доброкачественными - например, рак тимуса по своей клинической картине полностью идентичен признакам доброкачественных новообразований в вилочковой железе.
Диагностика опухоли средостения.
Опухоль средостения может быть диагностирован инструментальными методами, которые являются самыми информативными:
- В большинстве случае комплексного рентгенологического исследования достаточно для выявления опухоли разных отделов средостения, в том числе и рака тимуса. Врачи не только подтверждают факт наличия новообразования, но и могут дать ему характеристику - форму, размер и локализация. Если подозревается рак средостения любого вида, то пациенту назначается рентгеноскопия грудной клетки. Если есть подозрение на развитие мезенхимальной опухоли, то проводится рентгенография пищевода. Назначается для подтверждения диагноза и получения данных о нейрогенной опухоли - размер, степень распространения, форма, точная локализация. Данные такого исследования более точные, чем рентгенография. На их основе врач может проработать тактику проведения хирургического вмешательства. Дополнительно выполняется магнитно-резонансная томография, она дает возможность определить степень поражения мягких тканей средостения, подтвердить или опровергнуть факт распространения метастаз в лимфатические узлы. Опухоли средостения могут прорастать в бронхи, трахею и для исключения или подтверждения такого роста используется бронхоскопия, видеоторакоскопия или медиастиноскопия.
Если перечисленных обследований недостаточно, то назначается хирургическая биопсия. Морфологическое исследование биологического материала позволяет полностью охарактеризовать рак средостения. Эта манипуляция важна для классификации опухоли - будет ли диагностирован именно рак тимуса или опухоль представляет собой доброкачественное образование.
Если есть подозрение на тимому (рак тимуса), то целесообразно проводить ультразвуковое исследование. Оно не выявит опухоль средостения, но даст возможность оценить состояние лимфатических узлов и жировой ткани в подключичной области.
К общим методам диагностики относятся анализы крови (общий, биохимический, коагулограмма), анализ мочи (общий), ЭКГ.
Лечение опухолей средостения.
Самым эффективным методом лечения опухолей средостения считается его хирургическое удаление, которое всегда сопровождается и специфической терапией. Если диагноз был поставлен на ранней стадии, врач может четко определить размер и форму опухоли, то применяется радиохирургический метод ее удаления по системе КиберНож. В случае больших размеров опухоли средостения удаляются классическим хирургическим методом с последующей химиотерапией. Диагностирование рака на поздней стадии делает нецелесообразным оперативное удаление новообразования, поэтому пациенту назначают только поддерживающее лечение (химиотерапия или лучевая) - рак средостения прекращает стремительно разрастаться, снижается вероятность распространения метастаз, облегчается симптоматика.
Если диагностирован рак тимуса (тимома), то врач опирается на данные исследований - каков размер опухоли средостения, есть ли ее разрастание. В некоторых случаях сначала проводится несколько курсов химиотерапии и только после этого назначается хирургическое лечение. Дополнительно, после проведения операции по удалению опухоли средостения, пациенту назначают гормональные препараты, иммуноподдерживающие средства.
Принимать решение о проведении терапевтического лечения или хирургического удаления опухоли средостения может только лечащий врач. Операция выполняется только в том случае, если специалист будет уверен в том, что он сможет удалить сразу все новообразование. Так как диагноз рак средостения часто ставится на поздних стадиях заболевания, то даже хирургические методы могут быть бесполезными по причине распространения метастаз, поражения внутренних органов и мягких тканей вокруг средостения.
Прогноз рака средостения.
Теоретически прогнозы на выздоровление при диагностировании опухоли средостения (рака тимуса) положительные. Но проблема заключается в сложностях диагностики - клиническая картина не типичная для злокачественных образований, часто люди либо предпринимают попытки лечения сами, либо обращаются со стандартными жалобами к врачу и им ставят неверный диагноз. Пока проводится лечение неверного заболевания, время проходит и наступает рак, средостения достигает тяжелой стадии. При своевременном выявлении рака тимуса вероятность благоприятного исхода составляет 68%.
Опухоли средостения (рак тимуса) возможно вылечить, но при условии своевременного выявления. Хирургический метод и последующая химиотерапия дают возможность полностью выздороветь. По причине неспецифической клинической картины диагностирование на ранней стадии затруднено, поэтому важно проходит диспансеризацию - это реальный шанс полностью избавиться от злокачественных образований.
Злокачественные нейрогенные опухоли средостения. Пример саркомы средостения
Нейрогенные опухоли обычно располагаются в заднем средостении. Однако иногда они могут распространяться на шею или проникать в позвоночный канал, что требует различных подходов к лечению.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Улучшить результаты лечения нейрогенных опухолей средостения посредством использования минимально-инвазивных хирургических доступов.
МАТЕРИАЛ И МЕТОДЫ
Проведен ретроспективный анализ данных 108 пациентов, перенесших хирургическое вмешательство по поводу нейрогенных опухолей средостения с января 2001 г. по декабрь 2019 г. Изучены непосредственные результаты традиционных и минимально-инвазивных доступов: ВАТС, надключичного (при апикальной локализации) и их комбинаций с ламинэктомией (при опухолях типа «песочных часов»).
РЕЗУЛЬТАТЫ
У 71 пациента опухоль располагалась паравертебрально в заднем средостении, у 34 — апикально и у 3 — в переднем средостении. У 13 пациентов имела место опухоль типа «песочных часов». Посредством ВАТС опухоль удалена у 61 (56,5%) пациента, торакотомии — у 22 (20,4%), надключичного доступа — у 4 (3,7%), сочетания ВАТС и надключичного доступа — у 2 (1,9%), цервикостернотомии — у 10 (9,3%), комбинации ВАТС и ламинэктомии — у 2 (1,9%), торакотомии и ламинэктомии — у 3 (2,8%), надключичного доступа и ламинэктомии — у 1 (0,9%), цервикостернотомии и ламинэктомии — у 3 (2,8%). Вне зависимости от локализации опухоли минимально-инвазивные доступы характеризовались статистически значимым снижением кровопотери, осложнений, длительности дренирования, госпитализации и снижением болевого синдрома.
ВЫВОДЫ
При помощи ВАТС в большинстве случаев возможно удаление нейрогенных опухолей, располагающихся в заднем средостении. Надключичный подход рекомендуется для цервико-медиастинальных опухолей. При опухолях по типу «песочных часов» целесообразно сочетание гемиламинэктомии с ВАТС или надключичным доступом (при локализации в верхней апертуре).
ГУ «Республиканский научно-практический центр онкологии и медицинской радиологии им. Н.Н. Александрова»
Дата принятия в печать:
Введение
Нейрогенные опухоли средостения представляют собой опухоли, развивающиеся из структур периферических нервов, симпатической нервной ткани и параганглиев. На их долю приходится примерно 20% всех новообразований средостения у взрослых [1]. Частота встречаемости злокачественных нейрогенных опухолей неизвестна. По приблизительным оценкам она составляет
Чаще всего нейрогенные опухоли располагаются паравертебрально в заднем средостении, исходя из межреберных нервов или симпатического нервного ствола. Однако иногда эти опухоли могут распространяться через межпозвонковое отверстие в позвоночный канал и сдавливать спинной мозг (опухоли по типу песочных часов или гантели). Также сложности в выборе хирургического доступа вызывает ситуация, в которой опухоль проникает через верхнюю апертуру на шею (цервико-медиастинальные опухоли), вызывая синдром торакального выхода. На сегодняшний день остаются нерешенными проблемы выбора хирургического подхода в лечении этих заболеваний и роли минимально-инвазивных доступов — надключичного и видео-ассистированной торакоскопии (ВАТС).
Цель исследования — результаты лечения нейрогенных опухолей средостения путем анализа собственного опыта хирургических вмешательств с последующей разработкой лечебного подхода.
Материал и методы
Проведен ретроспективный анализ данных 108 пациентов, перенесших хирургическое вмешательство по поводу нейрогенных опухолей заднего средостения в онкологическом торакальном отделении РНПЦ онкологии и медицинской радиологии им. Н.Н. Александрова в период с января 2001 г. по декабрь 2019 г.
Всем пациентам проведено комплексное обследование, включая компьютерную томографию (КТ). При выявлении расширения межпозвонкового отверстия на уровне опухоли выполняли магнитно-резонансную томографию (МРТ) с целью определения распространения ее в спинномозговой канал. Выбор хирургического доступа осуществляли индивидуально с учетом локализации опухоли по данным лучевых методов исследования.
При свободно лежащей паравертебральной опухоли выполняли ВАТС с удалением опухоли традиционным (трехпортовым) или унипортальным (однопортовым) доступом. Положение пациента — на здоровом боку под углом от 90 до 135°. При традиционном доступе устанавливали один 10 мм торакопорт для видеокамеры и два 5 мм — для рабочих инструментов. Места торакоцентеза располагали в зависимости от локализации опухоли, но с условием полной визуализации образования и исключения эффекта «фехтования» инструментами. Выделяли непораженный участок межреберного нерва (симпатического ствола) на расстоянии 1 см от опухоли с последующим его клипированием и/или коагуляцией и пересечением. В дальнейшем за него осуществляли тракцию и выделение от окружающих тканей до межпозвоночного отверстия (при опухолях из периферических нервов) или непораженного участка симпатического нерва. После мобилизации препарат погружали в эндоскопический мешок-экстрактор и удаляли через рану торакоцентеза для видеокамеры, которую при необходимости расширяли до размера, достаточного для извлечения опухоли. В последующем ее использовали и для дренирования плевральной полости.
При однопортовом доступе выполняли единственный 3—4 см разрез кожи и мягких тканей (как правило, в 4-м или 5-м межреберье по задней подмышечной линии), через который осуществляли манипуляции, удаление опухоли и последующее дренирование (рис. 1).
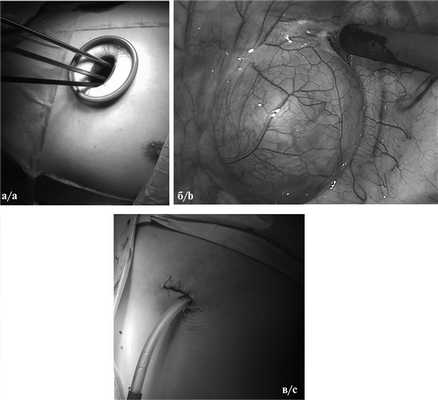
Рис. 1. Интраоперационные фотографии унипортального доступа.
а — общий вид операционной раны; б — паравертебральная опухоль; в — вид раны после операции.
Показаниями к торакотомии были размер опухоли >10 см и инвазия в окружающие органы и ткани по данным лучевых методов исследования.
При апикальных (цервико-медиастинальных) опухолях (рис. 2) выбор хирургического доступа осуществляли в зависимости от размера опухоли, ее локализации, связи с магистральными сосудами и окружающими структурами. При расположении >50% объема опухоли в плевральной полости (средостении) и небольших ее размерах (до 5 см), удаление производили посредством ВАТС по описанной выше методике.
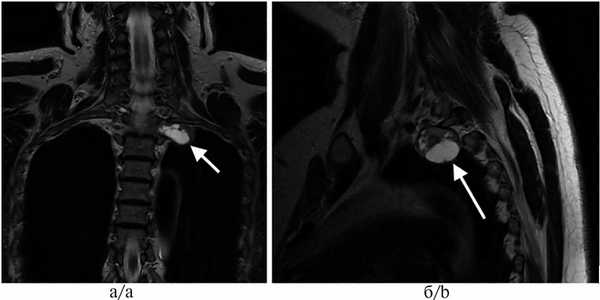
Рис. 2. Магнитно-резонансные томограммы пациента с апикальной нейрогенной опухолью, проникающей в межпозвонковое отверстие.
а — фронтальный срез, б — сагиттальный срез (опухоль указана стрелкой).
При опухолях верхней апертуры (цервико-медиастинальные опухоли), исходящих из ветвей плечевого сплетения и с локализацией >50% ее объема на шее (рис. 3), операцию начинали с надключичного доступа.
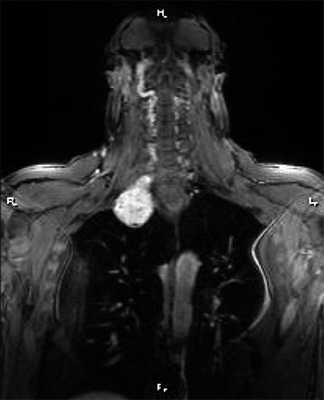
Рис. 3. Магнитно-резонансная томограмма пациента с цервико-медиастинальной нейрогенной опухолью, проникающей в средостение через верхнюю апертуру, фронтальный срез.
Надключичный доступ начинали от яремной вырезки и продолжали до трапециевидной мышцы под углом 45° по отношению к ключице (рис. 4). Этот доступ малотравматичен, обеспечивает прекрасный контроль магистральных сосудов и плечевого нервного сплетения, и в случае необходимости (при крупных опухолях, угрозе кровотечения) разрез продляли на грудину с последующей частичной стернотомией (стерноторакотомией) или дополняли ВАТС в случаях трудности мобилизации внутригрудного компонента.
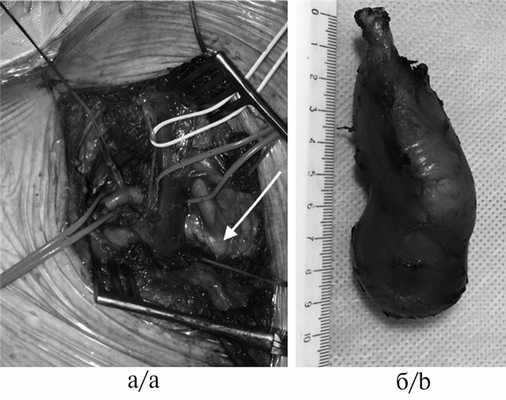
Рис. 4. Интраоперационные фотографии надключичного доступа.
а — вид операционной раны после удаления опухоли (красная держалка на подключичной артерии, синяя — на внутренней яремной вене, бифуркация плече-головного артериального ствола указана стрелкой); б — макропрепарат.
При опухолях по типу «песочных часов» (рис. 5) операцию выполняли мультидисциплинарной бригадой совместно с нейрохирургами. На первом этапе проводили ламинэктомию (гемиламинэктомию) с мобилизацией интраканального компонента опухоли, пересечением нервного корешка и погружением этого компонента в плевральную полость. Мобилизацию внутригрудного компонента и удаление опухоли осуществляли посредством ВАТС или при помощи одного из описанных выше доступов (надключичный, торакотомия, цервикостернотомия).
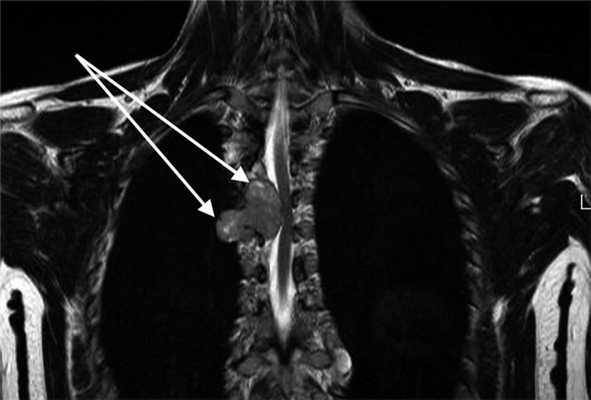
Рис. 5. Магнитно-резонансная томограмма пациента с опухолью по типу «песочных часов» (указана стрелками).
С целью оценки степени выраженности послеоперационного болевого синдрома подсчитали продолжительность системного обезболивания и число пациентов, нуждавшихся в назначении наркотических анальгетиков. При оценке безопасности выполненных операций применяли классификацию тяжести осложнений по Clavien—Dindo. При наличии у одного пациента нескольких осложнений учитывали наиболее тяжелое.
Статистический анализ проводился с использованием программы IBM SPSS Statistics v.26.
Результаты
У 87 (80,6%) пациентов опухоль выявлена случайно при прохождении ежегодного профилактического осмотра и только 21 (19,4%) — обратился в связи с возникшими жалобами. При поступлении наиболее частым беспокойством были боль в грудной клетке, которая отмечена у 31 (28,7%) пациента. В 54 (50%) случаях опухоль располагалась с правой стороны, в 54 (50%) — с левой. Клинико-демографические характеристики пациентов с нейрогенными опухолями представлены в табл. 1.
Таблица 1. Характеристика пациентов с нейрогенными опухолями средостения
Размер опухоли, мм
Примечание. ИМТ — индекс массы тела; ОФВ1 — объем форсированного выдоха за 1 с.
При гистологическом исследовании удаленного препарата доброкачественные опухоли выявлены у 96 (88,9%) пациентов, злокачественные — у 12 (11,1%). Гистологический тип опухолей представлен в табл. 2.
Таблица 2. Гистологический тип удаленных опухолей
Гистологический тип опухоли
Злокачественная опухоль оболочек периферических нервов
Примечание. PNET — примитивная нейроэктодермальная опухоль (Primitive neuroectodermal tumor).
Радикальное удаление опухоли удалось выполнить у 107 пациентов; у 1 — вынуждены были ограничится ее субтотальной резекцией. Применяемые хирургические доступы представлены в табл. 3.
Таблица 3. Хирургические доступы
Послеоперационные осложнения развились у 40 (37%) пациентов. Однако это были в основном осложнения 1—2-й степени по Clavien—Dindo. Структура осложнений представлена в табл. 4.
Таблица 4. Структура послеоперационных осложнений по Clavien—Dindo
некроз кожного лоскута
Результаты лечения паравертебральных нейрогенных опухолей
Паравертебральные нейрогенные опухоли (исключая апикальное расположение) выявлены у 71 пациента. ВАТС выполнена 49 (69,0%), торакотомия — 22 (31,0%). При анализе результатов хирургического лечения в зависимости от типа доступа выявлено преимущество ВАТС над торакотомией, которое характеризовалось снижением интраоперационной кровопотери с 287,7±124 до 36,7±21,0 мл (p=0,001), осложнений с 72,7 до 12,2% (p=0,000), длительности дренирования плевральной полости с 3,6±3,7 до 1,3±1,0 сут (p=0,000), госпитализации с 12,2±4,6 до 6,5±3,9 сут (p=0,000), необходимости в гемотрансфузии (p=0,000), наркотических анальгетиках (p=0,000), длительности системного приема обезболивающих препаратов с 6,5±3,3 до 3,7±1,4 дня (p=0,000). Однако следует отметить, что средний размер удаляемой опухоли был больше при торакотомии и составил 97,1±70,2 мм по сравнению с 45,3±21,4 мм (p=0,000) при ВАТС. Не выявлено статистически значимых различий в результатах использования унипортального и традиционного ВАТС доступов.
Результаты лечения апикальных нейрогенных опухолей
На базе нашего отделения оперированы 34 пациента с апикальными нейрогенными опухолями. У 3 из них была опухоль по типу «песочных часов». Минимально-инвазивный доступ (ВАТС, надключичный и их сочетание) выполнен у 19 (56%), традиционный — у 15 (44%). Непосредственные результаты хирургических вмешательств представлены в табл. 5.
Таблица 5. Непосредственные результаты операций при апикальных опухолях
Длительность операции, мин
Необходимость гемотрансфузии, n (%)
Длительность дренирования, сут
Длительность госпитализации, сут
Необходимость в наркотических анальгетиках, n (%)
Длительность системного приема анальгетиков, сут
Примечание. МИД — минимально-инвазивный доступ, ТД — традиционный доступ.
Результаты лечения опухолей по типу «песочных часов»
В исследуемую группу включены 13 пациентов, причем 7 (53,8%) из них имели выраженный внутриплевральный и внутрипозвоночный компоненты опухоли. Трем из них удаление опухоли осуществили с применением минимально-инвазивного подхода (у 2 — сочетание ВАТС и гемиламинэктомии и у 1 — сочетание надключичного доступа с ламинэктомией). У 6 (46,2%) — имело место проникновение опухоли в межпозвнковое отверстие. У 4 из них удалось удалить опухоль посредством ВАТС.
Применение минимально-инвазивного подхода характеризовалось снижением интраоперационной кровопотери (p=0,011), длительности дренирования с 7,0±4,4 до 2,1±2,0 (p=0,024) и госпитализации с 19,0 до 4,0 сут (p=0,024), а также длительности системного приема обезболивающих препаратов с 9,7±4,7 до 3,4±1,4 сут (p=0,006). Однако у них, как и в предыдущих группах, отмечали больший размер опухоли, который составил 86,8±43,7 мм при использовании традиционного подхода и 42,6±17,3 мм (p=0,031) — минимально-инвазивного.
Нейрогенные опухоли у взрослых обычно обнаруживаются случайно. Единственной гарантией хорошего прогноза является радикальная хирургическая резекция. ВАТС является предпочтительным и безопасным подходом для удаления нейрогенных опухолей средостения внутригрудной локализации. В медицинской литературе уже сообщалось об осуществимости и безопасности этого подхода. Так, в исследовании X. Chen и соавт. (2019) отмечалось, что посредством ВАТС удалось удалить 74 из 121 нейрогенной опухоли заднего средостения [3]. Ее преимущества заключаются в меньшей продолжительности оперативного вмешательства, интраоперационной кровопотери, длительности пребывания в стационаре и снижении потребления анальгетиков, что подтверждают и полученные нами результаты [4]. ВАТС является процедурой выбора при небольших медиастинальных нейрогенных опухолях [5]. Переход на торакотомию рекомендуется при более крупных опухолях, в случае технических трудностей, риска неполного удаления или высокой вероятности злокачественного новообразования. Удаление опухоли по частям и энуклеацию считаем недопустимыми. Полное удаление в пределах здоровых тканей важно даже при доброкачественных опухолях, так как существует риск локального рецидива [5, 6]. По нашему мнению, спорной является проблема конверсии в торакотомию при подозрении на злокачественную опухоль. В этой ситуации важен не тип доступа, а прецизионное удаление опухоли в пределах здоровых тканей, щадящие манипуляции с новообразованием с целью избежать повреждения его капсулы и диссеминации опухолевых клеток, а также обязательное использование специальных мешков-экстракторов для извлечения опухоли.
Удаление апикальных (цервико-медиастинальных) опухолей представляет технические сложности из-за тесной близости с подключичной артерией и плечевым сплетением и сопряжено с высоким риском осложнений. На сегодняшний день предложено несколько хирургических доступов при апикальных нейрогенных опухолях, однако ни один из них не стал стандартом. Исследование X. Chen и соавт., как и наш опыт, показывает значительное преимущество применения ВАТС и надключичного доступа при этой локализации опухолей [3].
Таким образом, при помощи ВАТС в большинстве случаев возможно удаление нейрогенных опухолей, располагающихся в заднем средостении. Торакоскопическое удаление нецелесообразно при больших размерах опухоли, когда для ее извлечения необходимо сделать разрез, размер которого сопоставим с размером торакотомии. Надключичный подход рекомендуется для цервико-медиастинальных опухолей, распространяющихся в области верхней апертуры, и это может сочетаться с ВАТС или торакотомией (частичной стернотомией) в случае больших опухолей. При опухолях по типу «песочных часов» целесообразно сочетание гемиламинэктомии с ВАТС или надключичным доступом (при локализации в верхней апертуре), что позволяет удалить опухоль в едином блоке и избежать потенциальной опасности рецидива.
Читайте также:
