Микробиологические исследования при инфекционных заболеваниях
(микробиологический фрагмент)
выделение их из субстратов, в норме не являющихся стерильными (кал, моча, мокрота и др.), не рассматривается как безусловное доказательство этиологической роли этих микроорганизмов в генезе заболевания. Обсемененность эндогенной микрофлорой у больных значительно выше, чем у бактерионосителей. Поэтому при постановке диагноза заболеваний, вызванных условно-патогенными возбудителями, надо проявлять осторожность и исходить из 4 критериев: многократности обнаружения данных видов, массивности их роста в посевах на плотные питательные среды, антигенной и фаговаровой однородности выделяемых субкультур и диагностического нарастания ти гров гомологичных антител при серологических исследованиях.
Условия сбора, хранення и транспортировки проб биологических материалов.При взятии проб биологического материала для проведения микробиологического исследования необходимо соблюдать следующие правила. Отбор материала следует производить до начала антибактериальной терапии и непосредственно из очага инфекции, при этом соблюдая правила асептики. При отборе проб использовать только стерильные тампоны (для отделяемого раны, мазков со слизистых оболочек, из глаза, уха, носа, зева, цервикального канала, и т.д.), транспортные среды (для отбора проб биологического материала из открытых полостей), шприцы (для крови, гноя, экссудатов), лабораторную посуду (для мокроты, мочи, фекалий). Количество материала должно быть достаточным, транспортировку проб нативного материала и траспортные среды с отобранными пробами должны доставляться в лабораторию не позднее чем через 1,5-2 ч в специальных контейнерах (пеналах или биксах). Пробы биоматериалов для культивирования ряда микроорганизмов следует транспортировать в лабораторию, соблюдая дополнительные условия хранения и транспортировки образцов с учетом биологических особенностей предполагаемых возбудителей инфекций. Так. например, для строгих анаэробов - максимально защищать пробы от воздействия кислорода воздуха, для пневмококка - учитывая его способность к аутолизу, не задерживать сроки проведения посевов, для менингококка, гонококка - учитывая чрезвычайную лабильность к низким температурам, транспортировку осуществлять в специальных контейнерах с грелками (35-40°С) и т.д.
3. Иммунологические методы - реакции обнаружения антигенов возбудителей в биологическом материале. Эту задачу лишь отчасти может разрешить реакция связывания комплемента (РСК). Более чувствительным методом Реакция непрямой (пассивной) гемагглютинации(РПГА) с антительным эритроцитарным диагностикумом относится к более чувствительным методам диагностики и широко применяется для диагностики дизентерии, сальмонеллеза и некоторых других инфекций. При этой реакции находящийся на поверхности танизированных эритроцитов специфический иммуноглобулин связывается с гомологичным антигеном. Эритроциты человека и животных (нативные и формалинизированные), предварительно обработанные танином, приобретают повышенную способность адсорбировать на своей поверхности белковые субстанции. В качестве адсорбентов кроме эритроцитов используются латекс, коллодий, бентонит и др.Реакция агглютинации латекса применяется для выявления антигенов пневмококков, палочки инфлюэнцы, менингококков. При положительной реакции частицы латекса выпадают в осадок. Практическое значение приобретает такой высоко чувствительный и специфичный метод определения бактериальных антигенов, как встречный иммуноэлектрофорез (ВИЭФ). В последние годы для диагностики различных инфекций стала применятьсяреакция коагглютинации (РКоА). Это реакция между антигеном и антителами, фиксированными на поверхности золотистых
реакции имеют лишь относительную достоверность, гак как могут быть неспецифическими или положительными у лиц, перенесших соответствующую инфекцию в прошлом (анамнестическая реакция), а также у получивших профилактические прививки (прививочная реакция). Для более объективной оценки результатов серологических исследований используют дифференцированное исследование антител различных классов иммуноглобулинов - IgM, IgA, IgG.
5. Генетические методы (полимеразная цепная реакция -ПЦР), основанные на обнаружении нуклеиновых кислот возбудителя в исследуемой проб биологического материала. ПЦР обладает уникальной чувствительностью и специфичностью. С ее помощью можно анализировать различные клинические образцы. Суть ПЦР заключается в идентификации специфического участка молекулы ДНК с последующим копированием или амплификацией этого участка с целью получения достаточного количества копий, которые могут быть выявлены доступными методами детекции (чаще всего с помощью электрофореза).
ШИГЕЛЛЕЗ. Возбудители шигеллеза - грамотрицательные палочки из рода Shigella, семейства Enterobacteriaceae, , включающего 4 вида (четырех серогрупп А,В,С и D): Shigella dysenteriae, Shigella flexneri, Shigella boydii, Shigella sonnei. В типовой вид Shigella dysenteriae в качестве отдельных сероваров входят палочки Григорьева-Шига, Штутцера-Шмитца, палочки Лардж-Сакса и др. Шигеллы Зонне, в свою очередь, разделяют на 7 ферментативных типов. Диагностика дизентерии основывается на результатах клинико-лабораторного обследования пациента. Большое диагностическое значение имеет осмотр кала, при котором можно обнаружить примесь слизи с прожилками крови. Лабораторное подтверждение дизентерии проводится бактериологическим (выделением возбудителя на среде Плоскирева и др. дифференциально-диагностических средах) и серологическим методами (РПГА с дизентерийным эритроцитарным антигенным диагностикумом). Выделение чистой культуры возбудителя при 3-кратном бактериологическом исследовании фекалий обеспечивает подтверждение диагноза у 40—60% больных. Ускоренная диагностика осуществляется высокочувствительными и специфическими методами выявления в биосубстратах (слюне, моче, кале и крови) антигенов возбудителей в ИФА, РАЛ, РКоА, РИФ (или НИФ) и определении специфической ДНК шигелл в ПЦР.
КАМПИЛОБАКТЕРИОЗ. Возбудитель - кампилобактеры, строгие анаэробы, грамотрицательные, слегка изогнутые палочки из семейства Campylobacteriaceae. Этиологическое значение в развитии кишечной формы кампилобактериоза имеют C.jejuni, С. coli и C.lari. С.fetus нередко являются возбудителями артритов, менингитов, менингоэнцефалитов, абортов, эндокардитов, тромбофлебитов и васкулитов, C.sputorum
- расцениваются как комменсалы полости рта, способных вызвать болезни периодонта, С. concisus - диареи и кожные поражения. Виды C.cinaedi и С. hyointestinalisupsaliensis региструются в кишечнике при иммунодефицитных состояниях и играют роль в патогенезе проктитов. Лабораторная диагностика играет ведущую роль в постановке этиологического диагноза кампилобактериоза. основанного на результатах микроскопии мазков нативного материала, бактериологический для выделения чистой культуры возбудителя, экспресс- методы выявления антигенов возбудителя 0 и методы ретроспективной серологической диагностики для выявления специфических антител к кампилобактерам в сыворотке крови. Материалом для исследования кишечной формы служат фекалии. Для внекишечных клинических форм используют пробы крови, ликвора, гноя из абсцессов, синовиальной жидкости, желчи и околоплодных вод. Для быстрой и ориентировочной диагностики кампилобактериоза проводят микроскопический метод исследования, позволяющий регистрировать грамотрицательные, извитые палочки. Однако этот метод дает достоверные результаты только при обсемененности исследуемого материала, пропорциональной 10 5 КОЕ\мл. Выделение чистой культуры возбудителя из фекалий является основным методом лабораторной диагностики. При необходимости транспортировки исследуемого материала применяют транспортные среды: тиогликолевая среда для контроля стерильности, среда Керри-Блэр и др. Посев проб фекалия производят на специальные среды для выделения кампилобактеров (ЖЭКА
- железо-эритрит-кровяной агар, селективный эритрит-агар, кампилобакагар, МППА - мясопептонно-печеночный агар), инкубирование посевов - в микроаэрофильных условиях при 42°С. Классический бактериологический метод исследования является дорогим и трудоемким, так как кампилобактеры - микроаэрофильные (техника выделения приближается к таковой для анаэробов) и трудно культивируемые микроорганизмы, диагностики кампилобактериоза Высокой чувствительностью отличаются экспресс- методы: ПЦР (индикация специфической ДНК), ИФА (выявление антигенов в биоматериале) и РСК (обнаружение антигенов в сыворотке крови) и методы серологической ретроспективной диагностики для выявления антител в парных сыворотках крови в динамике заболевания в РПГА с антигенным диагностикумом и в РСК.
[youtube.player]Микроскопический. С помощью микроскопии нативного патологического материала определяют вид возбудителя заболевания по форме, взаиморасположению и способности окрашиваться определенными красителями.
Бактериологический. Этот метод основан на выделении чистой культуры возбудителя заболевания и его идентификации (определение вида микроба).
Серологический. Метод основан на определении специфических антител в крови больных или переболевших инфекционными заболеваниями к соответствующим возбудителям с помощью различных реакций (агглютинации, пассивной гемагглютинации, связывания комплемента, преципитации и других).
Биологический. В основе этого метода лежит заражение лабораторных животных исследуемым материалом от больного с целью воспроизведения у них инфекционного заболевания или последующего выделения возбудителя.
Аллергический. С помощью этого метода обнаруживают повышенную чувствительность макроорганизма к определенным возбудителям инфекционных заболеваний или продуктам их жизнедеятельности. Для аллергических проб используют препараты, которые называются аллергенами.
Молекулярно-генетический. С помощью полимеразной цепной реакции (ПЦР) определяют в исследуемом материале наличие возбудителя инфекционного заболевания по специфичным для него последовательностям нуклеотидов.
ПРИЗНАКИ, ПРИМЕНЯЕМЫЕ ДЛЯ ИДЕНТИФИКАЦИИ МИКРООРГАНИЗМОВ (для определения вида микроба)
Морфологические - форма, величина и характер расположения микробов друг к другу.
Тинкториалные - способность микробов окрашиваться различными красителями.
Культуральные - особенности роста микробов на жидких и плотных питательных средах.
Биохимические - способность микроорганизмов потреблять различные вещества (углеводы, белки и другие) с образованием характерных конечных продуктов, или наличие у микроорганизмов различных ферментов (уреаза, цистиназа и другие).
Антигенные - особенности химического состава микробных клеток (антигенной структуры), выявляемые с помощью специфических диагностических иммунных сывороток,
Чувствительность к специфическим фагам - способность бактерий лизироваться эталонными специфическими фагами.
Биологические свойства. Токсигенность - способность продуцировать экзотоксин. Чувствительность к определенным колицинам или тип синтезируемых колицинов.
Определение понятий "микроорганизмы" и "вид"
Микроорганизмы - это невидимые простым глазом живые существа, включающие в себя представителей всех царств жизни - плазмиды, вирусы, прокариоты (эубактерии и архебактерии) и эукариоты. Они стоят на низших ступенях эволюции и играют важную роль как в общей экономике природы, так и в патологии человека, животных и растений.
Вид - совокупность микроорганизмов, имевших общий корень происхождения, сходный генотип (более 80% гомологии ДНК) и максимально близкие фенотипические признаки и свойства.
Метод люминесцентной микроскопии.
Люминесцентная микроскопия основана на способности некоторых веществ светиться под действием коротковолновых лучей света. При этом длина волны излучаемого при люминесценции света всегда будет больше, чем длина волны света, возбуждающего люминесценцию. Так, если освещать объект синим светом, то он будет испускать лучи красного, оранжевого, желтого или зеленого цветов.
Препараты для люминесцентной микроскопии окрашивают специальными (светящимися) люминесцентными красителями - флуорохромами (например, раствор акридинового оранжевого 1:5000 - 1:10000). Лучи света от сильного источника (обычно ртутной лампы сверхвысокого давления) пропускаются через сине-фиолетовый фильтр. Под действием этого коротковолнового излучения окрашенные акридиновым оранжевым бактерии начинают светиться красным или зеленым светом. Для того, чтобы синий свет, вызывающий люминесценцию, не мешал наблюдению, над окуляром микроскопа ставят "запирающий" желтый светофильтр, задерживающий синие, но пропускающие желтые, зеленые и красные лучи.
В результате при наблюдении в микроскопе на темном фоне будут видны микробные клетки, светящиеся желтым, зеленым или красным цветом. При окраске акридиновым оранжевым дезоксирибонуклеиновая кислота (ядерное вещество) будет светиться ярко-зеленым цветом, а находящаяся в цитоплазме рибонуклеиновая кислота - красным цветом.
Метод люминесцентной микроскопии позволяет изучать живые нефиксированные бактерии, окрашенные сильно разведенными растворами красителей, не причиняющих вреда микробным клеткам. По характеру свечения могут быть дифференцированы отдельные химические вещества, входящие в состав микробной клетки. Метод с большим эффектом может -быть использован для ускорения диагностики ряда заболеваний.
Флуоресцирующими красителями можно обрабатывать диагностические сыворотки, содержащие антитела к определенным бактериям. Краситель, например, изотиоцианат флуоресцеина, химически соединяется с глобулинами иммунной сыворотки и таким образом как бы избирательно метит антитела.
Люминесцирующие сыворотки могут быть использованы для идентификации выделенных культур бактерии и для ускоренной индикации патогенных микробов во внешней среде и в выделениях больных.
Сущность иммунофлуоресцентного метода исследования заключается в том, что из исследуемого материала готовят мазок и после высушивания и фиксации обрабатывают его люминесцирующей сывороткой. При наличии в исследуемом мазке гомологичных бактерий, вследствие адсорбции на них меченных флуоресцирующим красителем антител, в люминесцентном микроскопе на темном фоне препарата обнаруживается специфическое яркое желто-зеленое свечение по периферии бактериальных клеток. Центральная часть клеток не светится. Присутствующие в препарате посторонние микробные клетки не светятся.
Не нашли то, что искали? Воспользуйтесь поиском:
[youtube.player]Инфекционные болезни — это заболевания, вызванные проникновением в организм бактерий, грибков или вирусов. Самая важная часть диагностики инфекций — это определение возбудителя и его концентрации. Для этих целей используются разнообразные лабораторные методы, которые позволяют выяснить, чем именно и как давно атакован организм, а в некоторых случаях — спрогнозировать эффективность лечения тем или иным препаратом.
Особенности диагностики инфекционных заболеваний
В клинической практике данный тип заболеваний встречается очень часто. Именно они, по данным Всемирной организации здравоохранения, становятся причиной 26% всех смертей. В список самых распространенных инфекционных заболеваний входят инфекционная пневмония и другие воспалительные заболевания дыхательных путей, гепатит, ВИЧ, туберкулез, малярия, воспаления органов половой системы и мочевыводящих путей, гистоплазмоз, ротавирусные инфекционные заболевания, ветряная оспа, герпес, вирус папилломы человека и еще несколько десятков болезней. Хотя бы раз в жизни каждый из нас сталкивается с инфекционными заболеваниями и необходимостью быстрой постановки диагноза.
Все инфекционные болезни делятся на пять типов — прионные, вирусные, бактериальные, протозойные и грибковые поражения. Далее будут рассмотрены последние четыре типа как наиболее распространенные. Разные возбудители иногда могут вызывать одно и то же заболевание. В частности, пневмония может быть результатом как вирусной, так и бактериальной инфекции. Лечение зависит не от проявлений, а от возбудителя болезни. Противовирусные препараты бесполезны в борьбе с бактериями и грибками, антибиотики не действуют на вирусы. Поэтому основная задача лабораторной диагностики инфекционных заболеваний — выявление типа возбудителя.
Способы лабораторной диагностики инфекционных болезней можно разделить на два типа: неспецифические и специфические методы.
К неспецифическим относятся общий анализ крови и исследование соотношения ее белковых фракций, печеночные пробы, общий анализ мочи и кала. Эти методы не дают информации о виде возбудителя, но позволяют узнать, в какой мере болезнь затронула органы и системы организма, что именно в их работе нарушено и насколько далеко зашел процесс.
Специфические — вирусологический и бактериологический методы, микроскопическое исследование возбудителей, анализы на антигены и антитела — направлены непосредственно на обнаружение возбудителя.
Современная медицина располагает множеством методов выделения возбудителей бактериальной инфекции:
Бактериоскопический . Исследуется окрашенный специальным образом мазок.
Бактериологический . Биоматериал высеивается в питательную среду, и через некоторое время специалист исследует колонию бактерий, выросшую в ней.
Биологический . Направлен на определение патогенности микроорганизмов.
Серологический . Выявляет антитела и антигены в сыворотке крови — особые вещества, которые вырабатываются организмом при контакте с возбудителем определенной болезни.
Чаще всего для исследований используют кровь или сыворотку крови, реже — слюну, мочу, кал, клетки эпителия (мазок и соскоб) и другой биоматериал.
В лабораторной диагностике вирусных заболеваний используются:
Вирусологическое исследование . Световая и электронная микроскопия дает возможность выявить наличие вирусных включений и сами вирусы и идентифицировать их.
Серологическое исследование для обнаружения антител и антигенов. Этот метод дает возможность быстро выявить агрессора, как и в случае с бактериальными инфекциями. Для диагностики используются разнообразные способы исследования материала — реакции гемадсорбции, гемагглютинации или метод непрямой иммунофлюоресценции. Имунноблоттинг, в частности, позволяет выявлять антитела сразу к нескольким инфекциям и считается современным и точным диагностическим методом.
Молекулярно-генетические методы . Последнее слово в лабораторной диагностике. Позволяют обнаружить вирус даже тогда, когда его концентрация ничтожно мала — то есть на самых ранних стадиях. Самым известным из этих методов является ПЦР, при которой фрагмент вируса многократно копируется до тех пор, пока специалист не получит достаточно материала для определения типа вируса и его изначальной концентрации.
Для выявления вирусов обычно требуется сделать анализ крови.
Так называют инфекции, вызванные простейшими паразитами, например, амебами. Малярия, амёбиаз, токсоплазмоз, лямблиоз, трихомониаз, сонная болезнь — вот неполный список самых распространенных протозойных инфекций. Лабораторная диагностика таких заболеваний включает в себя следующие методы:
Микроскопический . Простейшие паразиты выявляются путем исследования под микроскопом окрашенных образцов биоматериала. Самый простой и надежный метод для многих возбудителей.
Культуральный . Посев биоматериала в питательную следу для дальнейшего исследования размножившихся простейших. У этого метода есть существенный недостаток: результатов нужно ждать долго, сам процесс может занять не менее 5-6-ти дней.
Серологический . Используют редко ввиду малой информативности.
Аллергический . Также не является распространенным. Кожные аллергопробы делают для того, чтобы подтвердить лейшманиоз и токсоплазмоз. Это вспомогательный диагностический метод.
В качестве биоматериала для исследований в основном используется кровь, иногда — – кал или моча.
Микроскопическое исследование . Препарат окрашивается и рассматривается под мощным микроскопом. Посредством иммунофлюоресцентной микроскопии исследуется проба, помеченная флюоресцеинами — специальным красителем. Наиболее быстрый способ выявления грибка по сравнению с другими методами.
Культуральный . Происходит посев пробы на питательную среду и дальнейшее исследование полученной в результате колонии грибков.
Серологический . Используется для выявления грибковых поражений, однако для микозов он считается не особенно точным.
Гибридизация нуклеиновых кислот . Самый современный способ выявления грибковых инфекций, его применяют для идентификации основных возбудителей системных микозов. Из культуры извлекается РНК и вносится особым способом помеченная молекула ДНК. Если в пробе наличествует один из основных патогенных грибков, ДНК объединится с его РНК, создав легко различимую структуру. Несомненным преимуществом метода является возможность определить инфекцию на самых ранних стадиях.
Биоматериалом для исследований являются клетки кожи, волос и ногтей, клетки слизистых оболочек (мазок или соскоб), мокрота, моча, секрет простаты, сперма, грудное молоко.
Современные методики диагностики инфекций позволяет выявить их на начальном этапе, Чем раньше болезнь будет обнаружена, тем проще ее вылечить. Поэтому сдавать анализы на инфекции желательно регулярно, даже если вы ни на что не жалуетесь и не замечаете никаких перемен в самочувствии.

Перед сдачей биоматериала для исследований иногда требуется определенная подготовка. Так, кровь обычно сдают с утра, натощак, а перед забором мазка не рекомендуется принимать душ. Эти требования очень важны: они обеспечивают точность результата, поэтому узнайте у врача заранее о подготовительных мерах и точно следуйте всем его рекомендациям.
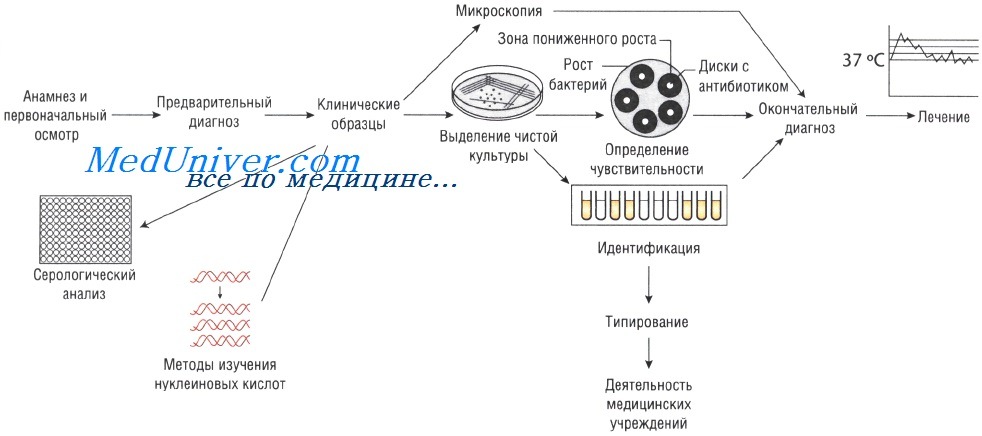
[youtube.player]Отбор проб для анализа при инфекционных заболеваниях. Для микробиологического исследования может быть отобрана любая ткань или физиологическая жидкость организма.
Выделение чистой культуры способствует увеличению количества бактерий и их точной идентификации. Для этого используют питательные среды. Если в образце присутствует нормальная микрофлора, то применяют избирательные (селективные) среды, позволяющие создать условия, неблагоприятные для роста непатогенных микроорганизмов и способствующие росту патогенной микрофлоры.
Для получения точных результатов следует выбрать оптимальный метод отбора проб и подойти к этому процессу с должной аккуратностью. При несоблюдении правил асептики контаминация проб крови микроорганизмами извне может привести к назначению неправильного лечения.
Большинство бактерий не способны существовать вне организма хозяина: облигатные анаэробы погибают под действием кислорода воздуха, а некоторые возбудители очень чувствительны к высыханию (Neisseria gonorrhoeae). Именно поэтому анализируемые образцы сразу после отбора должны быть помещены на подходящие среды или посеяны на среды для транспортировки.
Образцы могут быть проанализированы невооружённым глазом (например, для определения взрослых гельминтов в фекалиях или крови в мокроте). Микроскопия — быстрый и недорогой метод исследования, но требует высокого технического мастерства, характеризуется низкой чувствительностью: для точного определения необходимо присутствие большого количества возбудителей.
Кроме того, очень часто условно-патогенные микроорганизмы принимают за патогенные, что связано с недостаточной специфичностью метода.
Для определения возбудителя могут быть использованы различные красители (например, аурамин или окрашивание по Цилю—Нильсену для идентификации микобактерий). Уротропиновый серебряный окрашивает хитин клеточной стенки грибов и Pneumocystis jiroveci. Краситель Гимза применяют для окрашивания возбудителей малярии, лейшманий и других паразитов.
В основе иммунофлюоресцентного метода лежит применение специфических антител, помеченных флюоресцентными маркёрами. Микроскопию осуществляют в ультрафиолетовом свете, при этом возбудитель и связанные с ним антитела светятся ярко-зелёным цветом.
Лабораторные исследования при инфекционных заболеваниях
Иногда, даже при выраженных клинических симптомах, возбудитель может присутствовать в очаге инфекции в количестве, недостаточном для микроскопического определения. В этом случае выделение чистой культуры позволяет увеличить численность микроорганизмов в исследуемом субстрате.
Существует два способа выращивания микроорганизмов: на жидких (увеличивается количество возбудителей) и твёрдых (исследуют отдельные колонии, в том числе и на чувствительность к антибиотикам) питательных средах. Большинство возбудителей инфекций человека достаточно требовательны к условиям культивирования. Именно поэтому питательные среды для их выращивания должны содержать белки, сахарозу и нуклеиновые кислоты (присутствующие в крови и сыворотке).
Кроме того, необходимо поддерживать соответствующий газовый состав: для культивирования анаэробов необходимо отсутствие кислорода, в то время как для облигатных аэробов (Bordetella pertussis) — наоборот. Оптимальная температура выращивания большинства патогенных микроорганизмов составляет 37 °С; культивирование некоторых фибов осуществляют при 30 С.
Симптомы заболеваний зависят от вида возбудителей, вызвавших их. Именно поэтому идентификация микроорганизма позволяет предположить клиническую картину вызываемого им заболевания (например, симптомы инфекции, вызванной Vibrio cholerae, отличны от таковых при заражении Shigella sonnei). Большое значение имеет выделение Neisseria meningitidis именно из спинномозговой жидкости. Идентификация микроорганизмов основана на:
• изучении морфологических свойств их колоний в агаре;
• различной окраске по Граму;
• способности возбудителей к образованию спор;
• изучении биохимических свойств (каталазный или коагулазный тесты).
Точное определение штамма обычно зависит от результатов биохимического анализа (например, уреазный тест) или обнаружения продуктов жизнедеятельности бактерий (индол). Возбудителей, которые не могут быть выращены на питательных средах, идентифицируют при помощи молекулярно-генетического метода ДНК и секвенирования (например, Trophyrema whippelii).

Если для эрадикации микроорганизмов достаточно стандартной дозы антимикробного препарата, то их считают чувствительными, если необходимо увеличение дозы лекарственного средства — относительно устойчивыми. Абсолютно устойчивыми (резистентными) называют возбудителей, в отношении которых антибиотикотерапия неэффективна. Существует широкий спектр различных методов определения чувствительности к антимикробным препаратам.
Методы Британской ассоциации антимикробной химиотерапии (British Society of Antimicrobial Chemotherapy — BSAQ и Института клинических лабораторных стандартов (Clinical Laboratory Standards Institute — С LSI) основаны на определении диаметра зоны слабого роста микроорганизмов на твёрдой питательной среде при применении антимикробного препарата.
Минимальную подавляющую концентрацию антибиотика измеряют с помощью Е-теста, растворения препарата в питательном бульоне или нанесения его на плотный агар. В последнем случае на засеянный исследуемыми микроорганизмами агар наносят бумажные диски, пропитанные различными антибиотиками (метод бумажных дисков).
Уровень чувствительности зависит от диаметра зоны пониженного роста бактерий. Однако тестирование in vitro предоставляет лишь приблизительные данные, так как в клинической практике многое зависит от состояния больного.

Различные виды инфекций можно идентифицировать с помощью определения иммунного ответа, возникающего при внедрении возбудителя. Для этого существует большое количество различных методов: реакция агглютинации (РА), реакция связывания комплемента (РСК), реакция нейтрализации (РН) и иммуноферментный анализ (ИФА). Диагноз устанавливают на основании:
• определения уровня антител (IgM) в ответ на попадание в организм чужеродного белка (антигена);
• определения антигена.
Южный блоттинг и метод гибридизации нуклеиновых кислот. Методы основаны на связывании меченой ДНК с анализируемым образцом, при условии, что он имеет определённую последовательность аминокислот. Связанный комплекс определяют по активности метки. Это достаточно быстрый и надёжный способ, который, тем не менее, уступает по чувствительности молекулярно-генетическим методам.

Для диагностики инфекционных заболеваний используют несколько молекулярно-генетических методов. Механизм выделения патогенной ДНК или РНК в количестве, достаточном для постановки диагноза, для каждого метода индивидуален. Так, при молекулярно-генетическом методе ДНК возбудителя разделяют на отдельные цепи, затем синтезируют праймеры для связывания с целевыми последовательностями. Образование новой ДНК катализирует полимераза.
Основное преимущество — достижение результата даже при наличии всего лишь одной копии ДНК. Благодаря автоматизированным системам и большому выбору специальных наборов эти методы стали доступны большинству диагностических лабораторий. Новые аппараты способны выдавать результат в режиме реального времени. Генетические методы позволяют идентифицировать микроорганизмы, выращивание которых отличается сложностью или сопряжено с риском для человека (например, Mycobacterium tuberculosis и Chlamydia trachomatis).
Кроме того, их можно использовать для определения генов, кодирующих устойчивость к действию антибиотиков (например, мутационный ген rpoВ, обеспечивающий устойчивость М. tuberculosis к рифампицину). Это позволяет заранее выбрать альтернативный путь лечения инфекционных заболеваний.
Иногда необходимо проводить типирование микроорганизмов в случае их распространения в больницах или в окружающей (внебольничной) среде.
[youtube.player]Читайте также:


