Печень при системной красной волчанке
Поражение селезенки и печени при системной красной волчанке, нередко выступающие в виде гепатолиенального синдрома, представляют важную сторону патологии — участие органов ретикулоэндотелиальной системы в этом сложном заболевании.
В то же время патология печени при системной красной волчанке имеет и другие аспекты: прежде всего это поражение паренхиматозной ткани с развитием дистрофических и воспалительных изменений, особенно жировой печени, воспалительного паренхиматозного, или диффузного, гепатита (паренхиматозной желтухи), и, возможно, даже цирроза.
У больных системной красной волчанкой печень остается при этом увеличенной (большая жирная печень), и непосредственной причиной смерти являются, как правило, поражения других органов — нередко многочисленные.

В качестве примера можно привести следующую историю болезни.
У больного 21 года после инсоляции развилась картина типичной системной красной волчанки с болями в суставах, лихорадкой, увеличением лимфатических узлов (полиадения) и печени. Лечение АКТГ привело к улучшению. Однако с прекращением лечения началось обострение с клинической картиной волчаночного кардита, полисерозита и нефрита. После длительного лечения кортизоном развилась ремиссия, и последующие 3 года, когда применялись поддерживающие дозы кортизона по 25 мг в сутки, больного беспокоил главным образом кожно-суставной синдром. Затем больной без врачебного контроля стал принимать по 200 мг кортизона (в течение 2 месяцев) и был доставлен в клинику в тяжелом состоянии с лихорадкой до 40°, кровавой рвотой, затемненным сознанием, низким артериальным давлением, слабым частым пульсом, увеличенной печенью. В последующие 4 дня отмечалось прогрессивное ухудшение состояния: повторно кровавая рвота, желтуха, возбуждение, высокая лихорадка, в крови повышенный уровень прямого билирубина (1,7 мг %), резкое изменение осадочных глобулиновых проб, азотемия (остаточный азот 156 мг %), далее пневмония и смерть.
Анатомический диагноз: системная красная волчанка, длительно леченная кортизоном; геморрагическая пневмония нижней доли левого легкого; склероз митрального и трехстворчатого клапанов; облитерация плевральных и перикардиальной полостей; спайки в брюшной полости; очаговый нефрит, гиперплазия лимфатических узлов; красная атрофия печени, желтуха; кровоточащие эрозии желудка; резкая дистрофия миокарда.
Гистологически в печени выявлены обширные очаги некроза; клетки печени видны лишь в виде отдельных островков неправильной формы с тяжелыми дистрофическими изменениями в протоплазме; в строме круглоклеточная инфильтрация, стенки артерий с явлениями фибриноидного некроза, местами видны расширенные, полнокровные капилляры.
Собственно волчаночный гепатит с желтухой, увеличенной, обычно нерезко, и чувствительной печенью, нередко с одновременным набуханием селезенки течет циклически, сопутствуя, как правило, одному из обострений системной красной волчанки, протекающих с такими характерными проявлениями, как ускоренная РОЭ, выраженная лейкопения, повышение уровня фибриногена и т. д.
Волчаночный гепатит может привести к циррозу печени. Следует подчеркнуть, что последний констатируют у больных системной красной волчанкой прижизненно (или на секции) и при отсутствии в анамнезе желтухи.
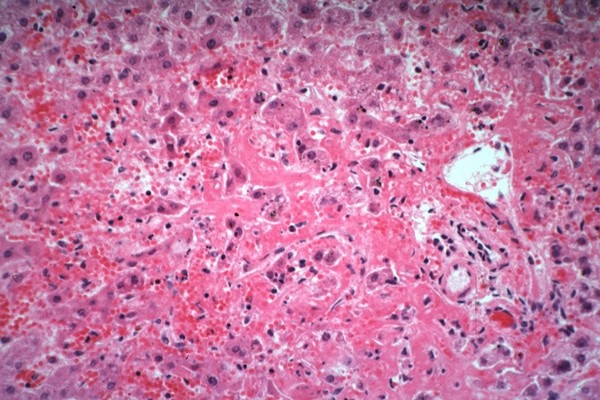
Микропрепарат поражения печени при СКВ
В одном из наблюдений Тареева Е.М. у больной с хроническим течением системной красной волчанки, со стойким кожно-суставным синдромом, периодически рецидивирующим лимфаденитом и энцефалитом при постоянной лейкопении имелась желчнокаменная болезнь, вызвавшая необходимость из-за участившихся обострений холецистэктомии.
Перечисление возможных поражений печени было бы неполным, если не упомянуть также септические заносы в печень, бактериальную инфекцию желчных путей, кандидоз печени и другие инфекционные осложнения.
В наблюдениях Тареева Е.М. ранней серии у 36 из 50 больных печень была умеренно увеличена. Из 29 секционных случаев в 22 наблюдались мелко- или крупнокапельное ожирение печеночных клеток, в 6 — мускатная печень, в одном — амилоидная дистрофия.
При гистологическом исследовании печени в ряде случаев обнаруживались гиалиноз мелких артерий, лимфоидные скопления в межуточной ткани и в строме по ходу воротной вены, утолщение стенок центральной вены, склероз капсулы и перипортальный склероз, некроз печеночных клеток.
Гепатомегалию Тареев Е.М. и его коллеги наблюдали лишь у 3 больных: у одного был волчаночный желтушный гепатит, напоминавший болезнь Боткина, у другого — застойная печень, у третьей больной в одну из волчаночных атак констатировано преходящее увеличение печени, достигавшей пупка.
Klemperer и соавторы (1941) наблюдали хронический фиброзный гепатит и фибринозный периспленит у 12-летней больной системной красной волчанкой.
О начальном циррозе наряду с диффузным ожирением и аденоматозом печени у 16-летней девушки, страдавшей туберкулезом и погибшей от системной красной волчанки, сообщил И.В. Давыдовский (1941); микроскопически было обнаружено крупноклеточное ожирение и многочисленные круглоклеточные инфильтраты с некробиозом в центре.
Harvey наряду с часто наблюдаемой жировой печенью с атрофией и некрозом центральных печеночных клеток отмечал следующую патологию:
- поражение сосудов в портальных пространствах — в 2 случаях,
- портальный цирроз — в 3,
- казеозные бугорки печени — в 2,
- желтуху — в 4 случаях, из них в 2 — гемолитическую желтуху,
- в одном — на почве эпидемического гепатита.
Среди гистологических находок автор называет также своеобразный отек желчных протоков, пузыря, фатерова соска с закупоркой желчных и панкреатических протоков.
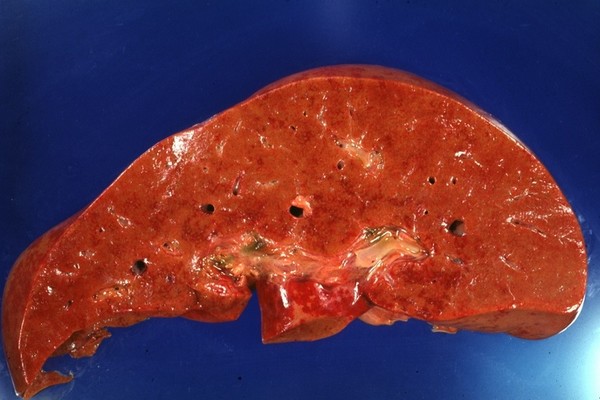
Макропрепарат поражения печени при СКВ
Частота поражения печени и симптоматика этого поражения хорошо иллюстрируются следующими литературными данными.
Из 27 больных Г.А. Раевская нашла увеличение печени у 14; из 9 секционных случаев в 4 обнаружена жировая печень, в 5 — изменения сосудов и склероз их, в 2 — инфильтраты в глиссоновой капсуле.
По наблюдениям Тареева Е.М. (1965) увеличение печени различной степени отмечается не столь редко: у 72 из 100 больных.
Отчетливые изменения функциональной деятельности печени определяются при системной красной волчанке нечасто. Имеет значение билирубинемия за счет прямой фракции пигмента, нарушение выделения желчных кислот, гипопротромбинемия (при гепатите и циррозе), гипоальбуминемия. Harvey отметил задержку бромсульфалеина у 5 из 16 исследованных больных.
Тем не менее именно значительная выраженность глобулиновых сдвигов и аналогичных показателей наряду с более характерными для системной красной волчанки иммунологическими данными привела к попытке сближения волчаночных гепатитов (lupus hepatitis, люпус гепатит, hepatitic lupus — Joske и King, 1955) с хроническим гепатитом (чаще у молодых лиц) иной природы, в частности, вирусной (lupoid hepatitis — МасКау и соавторы, 1956).
Увеличение печени при активной системной красной волчанке не сопровождается какими-либо субъективными жалобами или особенностями пальпаторных данных. Печень остается эластической консистенции, нечувствительной к пальпации, равномерно увеличенной. Такого рода увеличение печени, как и увеличение селезенки, чаще всего оказывается неожиданной находкой при систематическом обследовании больных.
Поражение желудочно-кишечного тракта
Поражение желудочно-кишечного тракта при СКВ наблюдается почти в 50% случаев. В острый период болезни характерны жалобы на отсутствие аппетита, отвращение к пище, тошноту, рвоту, изжогу, боль в различных отделах живота. При рентгенологическом исследовании вовлечение пищевода в процесс отмечают у 10—15% больных, наблюдают дилатацию пищевода, нарушение его моторики [Zizic Т., 1983]. При морфологическом исследовании нередко выявляют изъязвление слизистой оболочки пищевода, желудка и двенадцатиперстной кишки, дегенерацию коллагеновых волокон, распространенный артериит. Описана ишемия стенки желудка или кишечника с перфорацией.
При пальпации имеется болезненность по всему животу и иногда определяются участки ригидности брюшной стенки. Причин абдоминального криза достаточно много, в том числе серозит (первичный перитонит), язвенное поражение желудка и кишечника, панкреатит, поэтому необходима дифференциальная диагностика, которой помогает иногда тщательный анализ характера боли. Так, боль в эпигастрии, в верхней части живота более характерна для панкреатита, язвы желудка. Боль в нижних отделах — для брыжеечного артериита, перфоративной язвы нисходящей толстой кишки, некротизирующего энтероколита с пневматозом в тонком кишечнике.
При появлении признаков острого живота необходим точный диагноз, так как при упущенных сроках даже умело проведенная операция, включающая иссечение некротизированной части кишечника и идеальный гемостаз, не спасает от неблагоприятного исхода. Поэтому, если боль не купируется в течение 1—2 дней парентеральным введением больших доз кортикостероидов, необходима лапаротомия.
Поражение поджелудочной железы и печени при СКВ требует дальнейшего изучения. Острый панкреатит диагностируют редко, однако в сравнительно недавних исследованиях признаки острого панкреатита были выявлены у 20 (8%) из 241 больного на фоне высокой активности болезни с вовлечением многих органов и систем и наличием васкулита [Reynolds J., 1982], преимущественно артериита. Развитие панкреатита крайне неблагоприятно для прогноза.
Патология печени при СКВ проявляется от незначительного увеличения ее размеров до картины довольно тяжелого гепатита. Гепатомегалия выявлена в 23—50% случаев по данным разных авторов [Насонова В. А., 1972; Dubois E., Tuffanelli D., 1964; Zizic Т., 1983], при этом желтуха наблюдалась у 3—7%, в то же время нередко повышаются уровни АсАТ и АлАТ. При гистологическом исследовании биоптата печени отмечают полнокровие и застой в сосудах, жировую инфильтрацию и некрозы в портальной системе. Иногда выявляют артериит, приводящий к инфарктам печени, спонтанным разрывам, обусловливающим картину острого живота.
Собственно волчаночный гепатит следует дифференцировать от хронического активного гепатита (ХАГ). При сходных симптомах имеются, однако, и отличительные черты. Так, диарея в 30% случаев встречается при ХАГ и только в 5% — при СКВ, гапатомегалия при ХАГ выявляется в 75% и спленомегалия в 50%, при СКВ—в 20%. Более характерны для ХАГ такие признаки, как желтуха (80%), повышение уровня аминотрансфераз (90%) и щелочной фосфатазы (50%), гипергаммаглобулинемия (60%).
В то же время наиболее часто встречающиеся при СКВ такие показатели, как LE-клетки (75%), высокий титр антинуклеарного фактора (90%), при ХАГ выявляют в 15 и 40% соответственно. В наблюдении Т. Zizic (1983) антитела к нативной ДНК при СКВ были выявлены у 45%, а при ХАГ отсутствовали, в то же время антитела к гладкой мускулатуре при ХАГ были у 70% больных, а при СКВ отсутствовали. Такие клинические признаки, как полисерозит и гломерулонефрит, поражение ЦНС, очень редки при ХАГ. В то же время эритематозные высыпания, вульгарные угри, пурпура, витилиго могут наблюдаться достаточно часто и при ХАГ. Лейкопения, тромбоцитопения, положительная проба Кумбса характерны для обоих заболеваний.
Если клинические и лабораторные признаки не позволяют провести дифференциальный диагноз, следует прибегнуть к биопсии печени, позволяющей подтвердить диагноз ХАГ. Повышение уровня аминотрансфераз может быть обусловлено и лекарственными препаратами, в первую очередь ацетилсалициловой кислотой (гепатотоксична у 25% больных), а также циклофосфамидом. При дифференциальной диагностике следует помнить о возможности вирусного гепатита. Однако патология печени у больных СКВ на высоте активности болезни, как правило, связана с самим заболеванием.
Академический редактор: Майкл Х. Кершоу
Хотя аутоиммунные заболевания часто сосуществуют, сопутствующие случаи системной красной волчанки (SLE) и первичного билиарного цирроза (PBC) встречаются редко. В этом обзорном документе были проанализированы и обобщены 34 случая СКВ с сопутствующим ПБК, найденные на английской и японской научной литературе и японском судопроизводстве, в том числе случаи с дисфункцией печени, осложненной СКВ. Из 34 зарегистрированных сопутствующих случаев СКВ и ПБК 97,1% (33/34) были женщинами, а ПБК первоначально диагностировали в 69,0% (20/29), за исключением пяти случаев, когда одновременно были выявлены как СКВ, так и ПБК. Синдром Шёгрена был наиболее распространенным аутоиммунным заболеванием, осложняющим сопутствующие СКВ и ПБК (23,5%, 8/34). Сообщалось о пяти смертельных случаях: два пожилых пациента умерли от печеночной недостаточности из-за ухудшения ПБК, а еще два пациента умерли от легочной инфекции, связанной с фармакотерапией СКВ. Неясно, случаются ли сопутствующие случаи случайно или имеют общую иммунологическую или генетическую основу.
Аутоиммунные заболевания проявляют повышенный иммунный ответ на само-антигены и преобладают у женщин [1]. Аутоиммунные заболевания имеют некоторые аналогичные патологические пути или генетическую этиологию, и обычно бывает, что у одного пациента может наблюдаться более одного аутоиммунного состояния [2].
Системная красная волчанка (СКВ) представляет собой мультисистемное аутоиммунное заболевание, которое возникает в результате сочетания генетических, экологических и гормональных факторов 4. Он характеризуется наличием патогенных аутоантител, таких как анти-двухцепочечная ДНК или антигистоны и иммунные комплексы в сыворотке и тканях-мишенях, вызывая серьезные воспалительные состояния путем активации системы комплемента [3, 4]. Патогенез СКВ обусловлен главным образом дефицитом нескольких иммунологических механизмов, в том числе ненадлежащей функцией врожденной иммунной системы, измененными механизмами самонадеянности и апоптотическим клеточным клиренсом [4, 5]. Кроме того, СКВ часто сосуществует с другими аутоиммунными заболеваниями или коллагеновыми расстройствами, такими как ревматоидный артрит (РА) и синдром Шегрена (SjS) [6, 7].
Напротив, печень является мишенью аутоиммунных реакций, как это наблюдается при аутоиммунных заболеваниях, таких как аутоиммунный гепатит (AIH), первичный билиарный цирроз (PBC) и первичный склерозирующий холангит (PSC). Участие печени у пациентов с СКВ включает в себя несколько заболеваний печени или сам по себе СКВ, и необходимо различать причины дисфункции печени или аномальные значения фермента печени. Тем не менее, иногда сложно проводить различия между причинами поражения печени у пациентов с СКВ, а использование иммуносупрессивной терапии СКВ может искажать клинические и лабораторные данные о лежащем в основе аутоиммунного заболевания печени, что приводит к диагностической задержке или оккультной прогрессированию цирроза печени (LC) [8].
PBC считается аутоиммунным заболеванием неизвестной этиологии с органоспецифическими нарушениями, характеризующимися хроническим прогрессирующим холестазом с разрушением внутрипеченочных небольших желчных протоков, в частности, междольковыми желчными протоками 12. Причины РВС, по-видимому, связаны с экологическими и генетическими факторами [14, 15]. Кроме того, хорошо известно, что РВС является перекрывающимся состоянием между аутоиммунной гепатологией и ревматологией [16].
Сообщенные сопутствующие случаи СКВ и РВС относительно редки [8, 9, 17-32]. Некоторые пациенты с СКВ и ПБК могут иметь общую генетическую восприимчивость к развитию этих заболеваний [33]; однако считается, что совпадение SLE и PBC является чисто случайным.
В настоящее время неясно, происходит ли сопутствующая СКВ и ПБК случайно или же она имеет общую общую иммунологическую и / или генетическую основу.
На сегодняшний день было мало систематических обзоров литературы по сопутствующим случаям СКВ и ПБК, а клинические признаки и патофизиология сопутствующих случаев СКВ и ПБК остаются неясными. Тем не менее, может быть необходимо различать осложнения PBC у пациентов с СКВ с участием печени, потому что некоторые пациенты с ПБК могут прогрессировать до скрытой конечной печеночной недостаточности, а длительное использование глюкокортикостероидов для СКВ потенциально связано со значительными побочными эффектами, включая остеопороз , которая колеблется от 20% до 44% у пациентов с ПБС, увеличиваясь с прогрессированием ПБК [34].
В этом отчете был проведен поиск литературы и обзор случаев СКВ с сопутствующим ПБК, включая аутоиммунные заболевания печени, для выяснения клинических особенностей сопутствующих СКВ и случаев ПБК.
Поиск литературы по научным статьям на английском и японском и японском производствах проводился с использованием PubMed (http://www.ncbi.nlm.nih.gov/pubmed/) и Japana Centra Revuo Medicina (Igaku Chou Zasshi) (http: / /edb.kulib.kyoto-u.ac.jp/dbe/JA.html), соответственно, извлекая данные о сопутствующих SLE и PBC, опубликованных на сегодняшний день.
Были исключены подозрительные случаи СКВ и вызванные лекарственно-индуцированными волчаночными синдромами. Более того, отчет о ситуации, сделанный Tunccan et al. [35], который является примером лейшманиоза с клиническими и лабораторными признаками, имитирующими СКВ и аутоиммунными заболеваниями печени, также был исключен из этого анализа, поскольку аутоиммунные реакции, вызванные лейшманиозом, являются общими, и, как полагают, аутоиммунные реакции индуцируются лейшманиозом в этот частный случай [35]. Были включены случаи СКВ, диагностированные в соответствии с критериями Американской ассоциации ревматизма, при этом пациенты должны были иметь не менее 4/11 критериев для получения диагноза СКВ [36].
Дисфункция печени не считается основной патологией органов в СКВ [37, 38], а нарушения функции печени не включены в классификационные и диагностические критерии СКВ [36, 38]. Частота дисфункции печени или аномальные значения фермента печени в течение СКВ варьировались от 19% до 60% 37. Более того, распространенность гепатомегалии у пациентов с СКВ варьировалась от 12 до 55% [48, 49]. Флуктуации в значениях аланиновой трансаминазы, соответствующие активности СКВ, отмечались у некоторых пациентов с СКВ [45, 49]; однако никакой корреляции между активностью СКВ и частотой заболевания печени не было выявлено ни в одном из рассмотренных случаев [37, 47]. Это расхождение может быть связано с различными причинами дисфункции печени или аномальными значениями ферментов печени у пациентов с СКВ.
Несколько авторов предложили роль СКВ в инициировании часто субклинической гепатопатии, называемой волчаночным гепатитом (связанный с СКВ гепатитом), описывая это заболевание как гипертрансаминаземию, часто связанную с обострением болезни волчанки, которая возвращается к нормальным значениям после терапии глюкокортикостероидами [49]. Красная волчанка является отчетливым проявлением у 3-9% пациентов с СКВ [45, 49, 50]. В случаях волчаночного гепатита флуктуации в значениях аланиновой трансаминазы происходят параллельно с активностью СКВ и обычно субклиничны, при этом мало случаев прогрессирования до конечной стадии заболевания печени [49, 50]. Напротив, не было обнаружено явной корреляции между активностью СКВ и заболеваемостью печени при вовлечении печени, кроме волчаночного гепатита [37, 47].
Следовательно, идентификация этиологии дисфункции печени в СКВ (за исключением волчаночного гепатита) часто затруднена [38, 47] из-за существования нескольких потенциальных причин, включая АИГ, ПБК, стеатоз печени, безалкогольное жировое заболевание печени, вирусный гепатит , и вызванные лекарственными средствами заболевания печени, такие как индуцированные глюкокортикостероидами [42, 44, 47, 51]. Распространенность лекарственно-индуцированного гепатита относительно высока у пациентов с СКВ [49], а Takahashi et al. [44, 47] предположили, что лекарственный гепатит может быть распространенной причиной (около 30%) дисфункции печени у пациентов с СКВ в Японии. Статистический анализ показывает, что воздействие больших доз глюкокортикостероидов является важным фактором в этиологии тяжелой жирной болезни печени [52]. Причины вызванного лекарством гепатита часто включают терапевтические препараты для СКВ, такие как нестероидные противовоспалительные препараты, метотрексат, азатиоприн и другие неглюкокортикостероиды [49].
Кроме того, в других сообщениях было обнаружено, что дисфункция печени не является основным прогностическим фактором СКВ [42, 45, 47, 53]. Большие многоцентровые исследования, посвященные смертности в СКВ, показали, что заболевание печени не влияет на заболеваемость или смертность у пациентов с СКВ [53]. Одно из возможных объяснений этого может заключаться в том, что конечная печеночная дисфункция с сопутствующим СКВ обычно бывает редкой [2, 38, 39, 45]. Обзор Мацумото и др. [52] показали, что ЛК проявлялся только в 1,1% биопсии печени у 1468 японских пациентов с СКВ.
Хотя этиология и патогенез ПБК остаются в значительной степени неизвестными, все большее число свидетельств взаимодействия генетических ассоциаций, таких как специфические аллели антигена лейкоцитов человека и факторы окружающей среды, проявляется в индивидуальной восприимчивости к хозяину [54, 55]. РВС характеризуется селективным разрушением внутрипеченочных холангиоцитов [54], а РВС является результатом иммунологического ответа на иммунодоминантный аутоантигенный митохондрий, компонент Е2 комплекса пируватдегидрогеназы (PDC-E2) [54]. Характеристики болезни также включают наличие специфических для болезни антимитохондриальных аутоантител (АМА) и аутореактивных лимфоцитов. Ассоциации с генетическим фоном и воздействием на окружающую среду и другими подозреваемыми агентами, такими как ксенобиотики и микробы, оказывают влияние на ПБС, способствуя молекулярной мимике, приводя к потере толерантности к PDC-E2, развитию АМА и последующему развитию аутоиммунитета и последующего желчного травмы в КПБ [55, 56].
PBC влияет на женщин среднего возраста (пента- и sexagenarians) гораздо чаще, чем мужчин (соотношение женщин и мужчин, 9-10: 1) [11-13, 15, 34]. Его распространенность составляет 19-402 случая на миллион [13, 15, 34]. Коморбидность с другими аутоиммунными заболеваниями, семейными заболеваниями, прошлыми или настоящими курением, историей инфекции мочевых путей и повторным использованием косметических продуктов, таких как красители для волос, являются значимыми факторами риска развития ПБК [13, 14, 16].
Клинические особенности и естественная история ПБК значительно варьируются от бессимптомных до прогрессирующих состояний [13]. Желтуха, зуд, полученный из холестаза, и общая усталость являются типичными симптомами у пациентов с ПБК. Однако до 60% пациентов не имеют клинических симптомов (бессимптомный ПБК). PBC представляет собой приблизительно 1% всех случаев LC [34], потенциально отражающих относительно высокую частоту бессимптомных случаев.
Что касается гистопатологических особенностей ПБК, то поражение желчного протока, такое как хронический, невосприимчивый и деструктивный холангит, и формирование эпителиоидной гранулемы являются хорошо известными и полезными гистологическими данными в диагностике ПБК [13]. Другие гистопатологические данные включают портальное воспаление, хронический холестаз, печеночные изменения (межпанельный гепатит или дольчатый гепатит) и потеря желчных протоков. Классификации Scheuer или Ludwig глобально используются для постановки болезни и основаны на результатах гистопатологии PBC.
Диагноз РВС устанавливается, если присутствуют два из трех объективных критериев: (1) повышенная щелочная фосфатаза в сыворотке; (2) наличие АМА, которое полезно для серологического диагноза ПБК (90% -95% пациентов с ПБС, являющимися АМА-положительными [25, 57]); и (3) результаты гистологии печени (наличие хронического, невосприимчивого и деструктивного холангита) [13].
Аннотация научной статьи по клинической медицине, автор научной работы — Богмат Л.Ф., Шевченко Н.С., Матвиенко Е.В.
Целью исследования явилось изучение состояния печени у подростков с системной красной волчанкой (СКВ). В результате обследования 48 больных СКВ в возрасте 12-18 лет установлены частота поражения печени (22,9 %), взаимосвязь развития цитолиза со степенью активности и клиническими проявлениями заболевания, частота риска развития фиброза (27,3 %) и его вероятное наличие у 9,1 % подростков в дебюте СКВ.
Похожие темы научных работ по клинической медицине , автор научной работы — Богмат Л.Ф., Шевченко Н.С., Матвиенко Е.В.
Liver Damage in Systemic Lupus Erythematosus in Adolescents
The objective of the study was to investigate the state of the liver in adolescents with systemic lupus erythematosus (SLE). As a result of examination of 48 patients with SLE aged 12-18 years, there were established incidence of liver damage (22.9 %), correlation of cytolysis with the degree of activity and clinical manifestations of the disease. Also, the incidence of the risk of fibrosis (27.3 %) and its possible presence in 9.1 % of adolescents in the onset of SLE were detected.
КлУчна пед1атр1я / Clinical Pediatrics
БОГМАТЛ.Ф., ШЕВЧЕНКО Н.С., МАТВИЕНКО Е.В.
ПОРАЖЕНИЕ ПЕЧЕНИ ПРИ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКЕ
Резюме. Целью исследования явилось изучение состояния печени у подростков с системной красной волчанкой (СКВ). В результате обследования 48 больных СКВ в возрасте 12—18 лет установлены частота поражения печени (22,9 %), взаимосвязь развития цитолиза со степенью активности и клиническими проявлениями заболевания, частота риска развития фиброза (27,3 %) и его вероятное наличие у 9,1 % подростков в дебюте СКВ.
Ключевые слова: системная красная волчанка, подростки, печень, фиброгенез.
На современном этапе развития клинической педиатрической ревматологии одной из основных ее проблем являются системные болезни соединительной ткани, основным представителем которых остается системная красная волчанка (СКВ) [1, 2]. Благодаря эволюции диагностических возможностей, средств и методов лечения в настоящее время детские ревматологи обладают широким терапевтическим арсеналом для прерывания каскада аутоиммунных реакций и купирования активности болезни. Поэтому на первый план выступает задача сохранения структуры и функции жизненно важных органов и систем, предотвращения их необратимых изменений при развитии заболевания.
Одним из таких органов является печень, выполняющая около 500 различных функций, в связи с чем наши предки считали ее центром души и вместилищем жизни. Печеночные клетки участвуют во всех обменных процессах (углеводном, жировом, белковом, водном, минеральном, пигментном, витаминном, гормональном), синтезе множества веществ (холестерин, жирные и желчные кислоты, белки, факторы свертывания крови), сохранении энергетических ресурсов (гликоген, витамины А, D, E, К, В6 и В12, фолиевая кислота) [2].
Поражение печени, как правило, не является частью диагностического спектра при СКВ, однако выявляется у 60 % больных. Проявления ее патологии могут варьировать от незначительного увеличения до картины довольно тяжелого гепатита. При гистологическом исследовании биоптата печени отмечают полнокровие и застой в сосудах, жировую
инфильтрацию и некрозы в портальной системе [3, 4]. Редко встречается васкулит печени, приводящий к инфарктам и разрывам органа с клиникой острого живота [5]. Примерно у 25 % больных с СКВ отмечается субклиническое повреждение печени, о котором говорит повышенная активность печеночных ферментов. Лишь у 8 % пациентов выявляется повреждение печени, связанное непосредственно с самим заболеванием и возникающее, как правило, на высоте активности болезни, — собственно вол-чаночный гепатит [6]. При этом ряд авторов придерживаются мнения о том, что наиболее частыми причинами повышения уровня трансаминаз и гепа-томегалии у взрослых при СКВ являются ожирение и лекарственная терапия (гепатотоксические препараты) [5].
Адрес для переписки с авторами: Шевченко Н.С.
Определенную роль играет генетическая предрасположенность к возникновению гепатотоксиче-ских эффектов медицинских препаратов, которая определяется полиморфизмом генов, участвующих в метаболизме лекарств, что приводит к особой биотрансформации медицинских препаратов у индивидуально чувствительных лиц [7].
В условиях воздействия неблагоприятных факторов и гибели гепатоцитов (воспаление, лекарственные нагрузки, холестаз) активируется фибро-генез, сопровождающийся повышенным синтезом компонентов экстрацеллюлярного матрикса (ин-терстициальный коллаген, коллаген базальной мембраны, протеогликаны, гликопротеины, такие как ламинин и фибронектин), что в итоге приводит к структурным изменениям и функциональной недостаточности органа [8].
Развитие воспалительной реакции сопровождается гиперпродукцией широкого спектра провоспа-лительных субстанций (цитокинов, эйкозаноидов, оксида азота), которые стимулируют трансформацию звездчатых клеток печени (основные фибро-генные клетки) в миофибробласты [9]. Звездчатые клетки (известные как липоциты, клетки Йю или перисинусоидальные клетки) — это клетки мезен-химального происхождения, в норме выполняющие роль резервуара ретиноидов и регуляторов кровотока. После вовлечения печени в патологический процесс они переходят из состояния покоя (нормы) в активированное (поврежденное) состояние, что приводит к синтезу большого количества нейроэндокринных маркеров, провоспалительных цитокинов, нейтрофильных и моноцитарных хемо-аттрактантов, которые существенно усиливают воспалительную реакцию [10]. Развитие фиброгенеза зависит от длительности воздействия повреждающего фактора, то есть высокой активности аутои-мунного воспаления.
До настоящего времени фиброз печени рассматривался как необратимый процесс, представляющий собой деградацию печеночной паренхимы с замещением ее богатой коллагеном тканью. Однако в последнее время большинство исследователей рассматривают фиброобразование как результат повторяющегося во времени процесса повреждения-восстановления печеночных клеток, а замещение их соединительной тканью — как репаративный процесс, развивающийся в ответ на повреждение гепатоцитов [11]. На обратимость фиброза влияют степень выраженности заболевания, активность макрофагов и тип соединительнотканных образований, расположенных в очагах фиброза. Аутовоспаление является фактором, ускоряющим развитие фиброза, и сроки его формирования при СКВ могут исчисляться в месяцах.
Несмотря на постоянно расширяющийся объем знаний о причинах, механизмах возникновения и прогрессирования заболеваний печени, многие вопросы диагностики данной патологии остаются открытыми. Печень — сложно функционирующий
Вместе с тем анализ литературных данных указывает на недостаточную освещенность вопросов патологии печени при СКВ, особенно в детском и подростковом возрасте. Как в диагностические критерии болезни, так и в индекс повреждения (SLICC/ ACR DAMAGE INDEX, 2010) клинические и лабо-раторно-инструментальные признаки ее повреждения не включены. Однако именно печень, в силу своей компенсаторной способности, является тем скрытым органом-мишенью, где патологические изменения, диагностируемые на стадии биохимических нарушений, сопровождаются и морфологическими, зачастую уже с формированием фиброза. Раннее выявление и оценка характера патологического процесса в печени с выделением ряда лабораторных синдромов, отражающих повреждение гепатоцитов, нарушение поглотительно-экскреторной и синтетической функции печени, степень иммунопатологических расстройств, возможность своевременного адекватного назначения терапевтических мероприятий будут способствовать не только снижению выраженности воспаления, но и уменьшению необратимых изменений в организме больных в целом [12, 13].
Цель исследования: изучение состояния печени у подростков с СКВ на начальных этапах заболевания.
Материалы и методы
Для оценки функционального состояния печени у подростков использовали комплекс клинико-ла-бораторных, биохимических и инструментальных методов исследования (объективный осмотр, ультразвуковое исследование (УЗИ) печени и желчного пузыря, определение уровней билирубина и его фракций, общего холестерина, активности ала-нинтрансферазы, аспартаттрансферазы, щелочной фосфатазы). Рассчитывался коэффициент де Рити-са (отношение АСТ/АЛТ), индекс APRI (Aspartate-aminotransferase-to-Platelet Radio Index) — отношение АСТ к верхней границе ее нормы и к числу тромбоцитов, умноженное на 100.
Статистическая обработка материала проведена с использованием пакета прикладных программ (MS Excel, SPSS). Для оценки достоверности отличий использовался t-критерий Стьюдента (p), наличия взаимосвязей — корреляционный анализ. Критический уровень значимости для проверки статистических гипотез при сравнении групп принимался равным 0,05.
Результаты и их обсуждение
В дебюте СКВ признаки вовлечения печени в патологический процесс отмечены у 11 из 48 больных (22,9 %), что проявлялось увеличением размеров органа и повышением активности трансами-наз. Данную группу составили больные с возрастом дебюта заболевания 14,1 года (169,09 ± 5,91 мес.), средней длительностью СКВ 4,63 ± 1,90 мес., по-дострым вариантом начала (54,5 %) и выраженной активностью патологического процесса (63,6 %).
В клинической симптоматике отмечено наличие кожного (90,9 %) и суставного (81,8 %) синдромов, кардита (54,5 %) с перикардитом (36,4 %), трофических нарушений (45,5 %), гемопатии (36,4 %), люпус-нефрита (27,3 %), поражения центральной нервной системы (18,2 %) и пульмонита (9,1 %). Большинство пациентов (63,6 %) имели высокую степень активности заболевания, у всех больных отмечены повышенные уровни острофазовых показателей. Средние значения скорости оседания эритроцитов составили 38,90 ± 2,27 (25—72) мм/час, С-реактивного белка (СРБ) — 24,9 ± 1,1 (24-96) г/л, серомукоида — 0,216 ± 0,170 (0,245-0,592), сиало-вых кислот — 163,36 ± 0,17 (133-280) и гликопроте-идов — 0,405 ± 0,160 ед. (0,335-0,645). Уровни всех изучаемых маркеров воспаления были достоверно выше (р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
13. Poynard T., Morra R., Ingiliz P. Biomarkers ofliverfibrosis// Adv. Clin. Chem. — 2008. — Vol. 46, № 1. — P. 131-160.
14. Petri M. et al. Derivation and Validation of the Systemic Lupus International Collaborating Clinics Classification Criteria for Systemic Lupus Erythematosus//Arthr. Rheum. — 2012. — № 64. — P. 2677-2686.
15. Международная классификация функционирования, ограничений жизнедеятельности и здоровья: Пер. Г.Д. Шостка, В.Ю. Ряснянского, А.В. Квашина и др. — ВОЗ: Женева, 2001. — 342 с.
16. Volynets G.V., Potapov A.S., Polyakova S.I. et al. Evaluation of liver failure stage in children // Voprosy sovremennoi pediatrii — Current Pediatrics. — 2013. — № 12. — P. 47-51.
ураження печшки при системному червоному
вовчаку у тдл1тюв
Резюме. Метою дослщження було вивчення стану пе-чшки у тдлггшв 1з системним червоним вовчаком (СЧВ). У результата обстеження 48 хворих на СЧВ вжом 12—18 рошв встановлено частоту ураження печшки (22,9 %), взаемозв'язок розвитку цитсшзу з1 ступеней активносй та клтчними проявами захворювання, частоту ризику розвитку ф1брозу (27,3 %) 1 його ймов1рну наявшсть у 9,1 % шдли-шв у дебюта СЧВ.
Ключовi слова: системний червоний вовчак, п1дл1тки, печшка, ф1брогенез.
liver damage in systemic lupus erythematosus in adolescents
Summary. The objective of the study was to investigate the state of the liver in adolescents with systemic lupus erythematosus (SLE). As a result of examination of 48 patients with SLE aged 12—18 years, there were established incidence of liver damage (22.9 %), correlation of cytolysis with the degree of activity and clinical manifestations of the disease. Also, the incidence of the risk of fibrosis (27.3 %) and its possible presence in 9.1 % of adolescents in the onset of SLE were detected.
Key words: systemic lupus erythematosus, adolescents, liver, fibrogenesis.
Читайте также:


