Анатомия гортани для хирургов
Добавил пользователь Валентин П. Обновлено: 27.01.2026
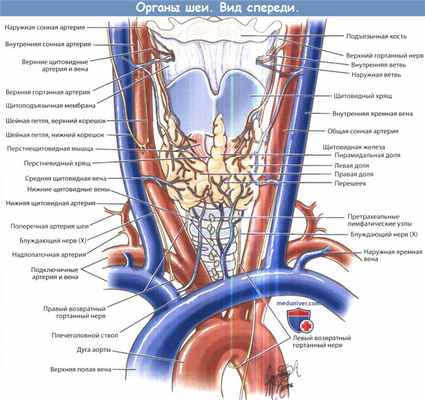
Трахея представляет собой трубку, которая связывает гортань с бронхами. Основной ее функцией является проведение воздуха в легкие и из легких. У взрослых трахея начинается на уровне 6-7 шейных позвонков и оканчивается на уровне тел 4-5 грудных позвонков делением на два главных бронха. Длина трахеи 10-13 см, ширина – 1,5 – 2,5 см.
Различают шейную и грудную части трахеи, граница между которыми соответствует яремной вырезке грудины спереди и второму грудному позвонку сзади. В грудном отделе трахеи выделяют три части: верхнегрудную, среднегрудную и надбифуркационную. Длина шейной части трахеи примерно 5 см, что соответствует 6-8 хрящевым кольцам. При разгибании шеи длина шейной части трахеи, как и число хрящей, существенно увеличивается. Начальные кольца трахеи располагаются на глубине 1,5-2см, на уровне яремной вырезкой - на глубине 4-6 см.
Спереди и с боков начальный отдел трахеи прикрыт щитовидной железой. Ниже железы спереди трахеи располагается претрахеальное клетчаточное пространство, в котором в грудной полости находится вилочковая железа. Кзади и несколько слева от трахеи лежит пищевод. В трахеопищеводной борозде слева на передней стенке пищевода проходит левый возвратный нерв. Правый возвратный нерв проходит позади трахеи на правой боковой стенке пищевода. В средостении спереди трахеи на уровне 1 ребра проходит левая плечеголовная вена. Позади нее трахею примерно посередине пересекает плечеголовной ствол, который проходит косо слева направо, непосредственно примыкая к ее передней стенке. Справа от грудной части трахеи располагаются верхняя полая вена, непарная вена и правая плечеголовная вена. К бифуркации трахеи прилежит дуга аорты и левая общая сонная артерия. Кровоснабжение шейного отдела трахеи осуществляется преимущественно ветвями нижних щитовидных артерий, надбифуркационный отдел трахеи и главные бронхи кровоснабжаются бронхиальными артериями. Кроме того, источниками кровоснабжения трахеи являются также ветви подключичной, внутренней грудной и плечеголовной артерий. Сосуды входят в трахею по боковым стенкам несколько кпереди от трахеопищеводной борозды. Венозный отток осуществляется преимущественно через вены щитовидной железы.
История хирургии трахеи
Вмешательства на трахее известны давно. Их выполняли еще за 3500 лет до нашей эры в Древнем Египте и за 2000 лет в Индии. Старейшей и наиболее распространенной в настоящее время операцией на трахее является трахеостомия. О разрезах дыхательного горла при травме, сопровождающейся обструкцией дыхательных путей сообщалось еще за 1500 лет до нашей эры. Beatrous описал, как Александр Македонский кончиком своего меча выполнил трахеостомию солдату. Galen и Aretaeus во втором-третьем веках нашей эры также описывали эту операцию. В это время трахею именовали бурной артерией или трахеальной артерией, считая, что по ней проходит не только воздух, но и кровь. Имена хирургов, возможно выполнявших трахеостомию, не известны. До 19 века многие считали это вмешательство бесперспективным и вредным. Goodall в 1934 году провел исследование, при котором установил, что до 19 века было выполнено только 28 успешных трахеотомий. Сдерживало применение метода плохое знание анатомии и неудовлетворительные результаты. В связи с высокой смертностью до 18 века при удушье, вызванном обструкцией верхних дыхательных путей, чаще применяли кровопускание.
Первая успешная трахеотомия, по мнению Goodall, была выполнена в 1546 итальянским врачом A.M.Brasavola больному, которому цирюльник, вскрыл глоточный абсцесс, но из-за развившейся в дальнейшем обструкции верхних дыхательных путей отказался что-либо делать. В 1610 году M.A.Severino из Неаполя применял трахеостомию при эпидемии дифтерии, используя вертикальный разрез по Fabrizio d Aquapendente (16 век), который также предложил трахеостомическую трубку и вертикальный разрез на шее, но сам не выполнял операцию. Первую успешную операцию удаления инородного тела из трахеи выполнил N.Habicot в 1620 году. У 14-летнего мальчика, проглотившего во время игры 9 кусочков золота, завернутых в материю, наступила асфиксия из-за обтурации трахеи куском материи. Он выполнил трахеотомию, перевел кусок материи в пищевод и переместил сверток с золотом в желудок, который в дальнейшем вышел обычным путем. В своей работе «Вопросы хирургии» в 17 веке N.Habicot демонстрировал необходимый для этого инструментарий. Операция была названа им бронхотомией.
Термин «трахеостомия» впервые применил T.Fienus в 1625 году. В 1714 году G.Detharding предложил трахеотомию для спасения утопленников. В Национальной галерее в Лондоне есть картина, соответствующая этому периоду. На берегу реки лежит женщина с раной на шее в положении на боку. Считалось, что в этой позиции вода может вытечь из легких.
 |
| Рис.5. Картина Piero di Cosima в Национальной Галерее в Лондоне. |
Первые резекции шейного отдела трахеи с анастомозом конец в конец выполнили на собаках Gluck и Zeller в 1881 году. Первую резекцию трахеи по поводу посттравматического стеноза шейного отдела трахеи успешно осуществил в 1886 году Kuster. В начале двадцатого века Nowakowski и Levit применяли для закрытия дефектов трахеи кожу, широкую фасцию бедра.
Циркулярная резекция трахеи наиболее долго из других вмешательств в торакальной хирургии внедрялась в практику, что было связано как с ее сложностью, так и с редкой необходимостью ее выполнения. Интерес к реконструктивным операциям на трахее возник в середине двадцатого века. Sanger во время Второй мировой войны и Griffith в 1949 году выполнили реконструктивные операции на бронхах и грудной части трахее. Одной из первых была публикация R.Belsey в 1950 году о резекции внутригрудной части трахеи. Belcher в 1950 году и Mathey в 1951 году осуществили анастомоз главных бронхов после случайного пересечения. J.Mathey в 1951 году впервые выполнил резекцию бифуркации трахеи. Увеличение в последние десятилетия числа больных с рубцовыми стенозами трахеи способствовало широкому внедрению реконструктивных операций на трахее в практику. Большое значение в становлении современной трахеальной хирургии имели работы хирургов, обладающих наибольшим опытом операций на трахее. Это работы J.Mathey, H.Eschapasse, F.G.Pearson, H.C.Grillo и в нашей стране М.И.Перельмана.
Стеноз трахеи
Стеноз трахеи может быть вызван рубцовыми изменениями стенки трахеи, сдавлением ее извне при опухолях средостения, новообразованиях щитовидной железы, аномалийными сосудами средостения и врожденной дезорганизацией тканей стенки трахеи, например при экспираторном стенозе.
Рубцовый стеноз трахеи характеризуется замещением нормальной стенки трахеи рубцовой тканью. Причиной ее появления является повреждение стенки трахеи с последующим развитием гнойно-некротического процесса обычно в месте давления манжеты интубационной трубки на стенку трахеи в процессе длительной искусственной вентиляции легких. Существенное значение в развитии стеноза имеет воспалительный процесс в области трахеостомы, давление конца трахеостомической трубки на стенку трахеи или рубцевание вследствие механического повреждения трахеи. Как правило, стеноз развивается в области трахеостомического отверстия или в области расположения манжеты трахеостомической трубки.
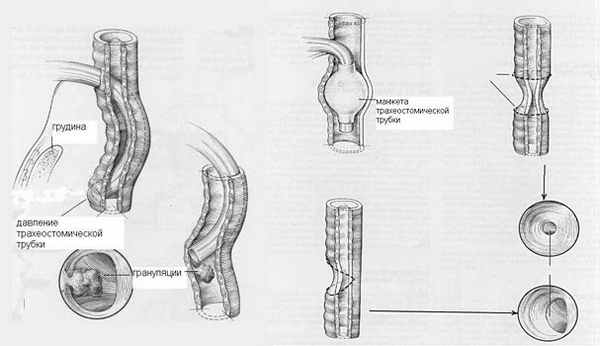 |
| Рис.6. Механизм формирования стеноза трахеи (Взято из W.W.Montgomery «Surgery of the laryngs, trachea, esophagus and neck», 2002). |
В крайне редких случаях причину стеноза трахеи установить не удается. Подобный стеноз носит название идиопатического. Как правило, им страдают женщины среднего возраста. Плотный келоидный рубец захватывает преимущественно адвентицию верхней трети трахеи, имеет протяженность 1-3 см.
В последние годы отмечается рост числа больных с рубцовыми стенозами трахеи. Благодаря достижением реаниматологии, длительной искусственной вентиляции легких стало возможным спасение больных, которые считались ранее безнадежными. Однако у многих из них через некоторое время развивается картина рубцового стеноза трахеи. По данным Корбера 1999г. стенозирование просвета трахеи после трахеостомии достигает 51%. Law 1993г. сообщил о 67% повреждений трахеи после трахеостомии. Морфологические изменения различны – от повреждения эпителия с образованием эрозий до трансмурального некроза стенки. Симптомы стеноза трахеи могут развиться через неделю или несколько месяцев после экстубации, но у 80% пациентов они появляются в течение первых 3 месяцев.
Профилактика – минимальная травма при трахеостомии, строгое соблюдение принципов асептики при любых манипуляциях на трахее, каждые 2 часа снижение давления в манжетке трахеостомической трубки, перемещение трубки по длине, замена трубки каждые 2 дня, антибиотикопрофилактика с учетом чувствительности микрофлоры.
- По этиологии: постинтубационный, посттрахеостомический, посттравматический, идиопатический.
- По локализации: гортань (с поражением подскладочного отдела, голосовых складок), шейный отдел трахеи, верхнегрудной, среднегрудной, надбифуркационный отделы трахеи, комбинированные поражения.
- По степени сужения: 1 степень (просвет сужен на 1\3 диаметра дыхательного пути), 2 степень (от 1\3 до 2\3 диаметра), 3 степень (более 2\3 диаметра).
- По распространенности: ограниченный (до 2 см), протяженный (более 2 см).
- По анатомической форме поражения: переднебоковые стенки, циркулярное сужение, атрезия.
- По состоянию стенок трахеи: с трахеомаляцией, без трахеомаляции.
- По наличию трахеостомы: с трахеостомой, без трахеостомы.
Данные анамнеза и появление одышки позволяют заподозрить стеноз трахеи. Одышка носит приступообразный характер, усиливается при небольшой физической нагрузке, уменьшается после откашливания вязкой мокроты. При прогрессирования стеноза отмечается шумное, слышное на расстоянии дыхание. Основными методами подтверждения стеноза и оценки степени сужения являются бронхоскопия и компьютерная томография.
В лечении больных с рубцовыми стенозами трахеи принимают участие не только торакальные хирургии, но и отоларингологи, эндоскописты. Наибольший опыт лечения больных с данной патологией накоплен в РНЦХ им. Б.В.Петровского. Радикальным методом лечения больных с рубцовым стенозом трахеи является циркулярная резекция трахеи, однако она возможна, как правило, при ограниченных стенозах. Консервативное лечение применяют только в начальный период формирования стеноза или как паллиативное лечение при невозможности оперативного вмешательства. Оно заключается в антибиотикотерапии, аэрозольтерапии, применении стероидных и нестероидных противовоспалительных препаратов. Нормальный просвет трахеи восстанавливают с помощью ригидной бронхоскопии, удаляя избыточные грануляции или рассекая суженный участок трахеи с помощью электрокоагуляции, лазерного воздействия. Данное вмешательство можно выполнять не более 3-4 раз. Для сохранения адекватного просвета трахеи осуществляют стентирование ее на срок 4-6 месяцев. После удаления стента добиться сохранения стойкого просвета трахеи удается не более чем у трети больных. Бужирование стеноза трахеи тубусом ригидного бронхоскопа различного диаметра или дилатационным бронхоскопом применяется также при угрозе асфиксии в качестве экстренного паллиативного вмешательства.
При обширных поражениях трахеи выполнить ее резекцию не представляется возможным. В подобных случаях возможна трансплантация трахеи. В 2006 году в РНЦХ была выполнена успешная трансплантация трахеи больному с субтотальным рубцовым стенозом трахеи. Кровоснабжение трахеи осуществляется через сосуды щитовидной железы.
Трахеопищеводные свищи
Наиболее часто трахеопищеводные свищи возникают у больных раком пищевода при распаде опухоли, прорастающей в трахею. Другими причинами являются ранения пищевода и трахеи, перфорация пищевода при его бужировании по поводу рубцовых стриктур, пролежень от трахеостомической и интубационной трубок при длительной искусственной вентиляции легких.
Частота трахеопищеводных свищей не превышает 0,5% среди больных, которым проводилась длительная искусственная вентиляция легких. Как правило, трахеопищеводные свищи у этой группы больных возникают от избыточного давления манжетки интубационной трубки или давления дистального конца трахеостомической трубки на заднюю стенку трахеи при наличии в пищеводе зонда для энтерального питания, что приводит к ее ишемии, некрозу и образованию соустья между пищеводом и трахеей. Часто трахеопищеводные свищи сочетаются со стенозом трахеи, что существенно осложняет лечение таких больных. Заброс пищи в трахею приводит к гнойному трахеобронхиту с последующим развитием абсцедирующей пневмонии, что значительно ухудшает прогноз заболевания. Питание у такого рода больных через рот исключается. Адекватное питание больного обеспечивается через энтеральный зонд или гастростому. Учитывая, что консервативное лечение больных с трахеопищеводными свищами малоэффективно, единственным радикальным способом ликвидации свища неопухолевой природы является оперативное вмешательство.
Клиническая диагностика трахеопищеводных свищей, как правило, не вызывает трудностей. Проявляются они приступообразным кашлем, который возникает во время приема пищи. Однако уточнение их локализации при рентгенологическом исследовании с барием и эзофагоскопии вызывает существенные трудности, особенно при небольших размерах свища. Более информативным оказывается трахеоскопия, при которой удается определить размеры свища, расстояние от голосовых связок и карины. Кроме того, значительную помощь в выявлении трахеопищеводных свищей оказывает также компьютерная томография.
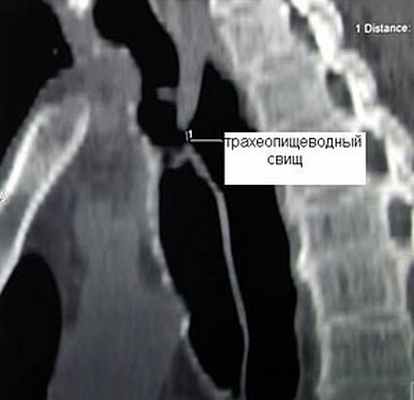 Рис.9. Компьютерная томограмма больного с трахеопищеводным свищом. | 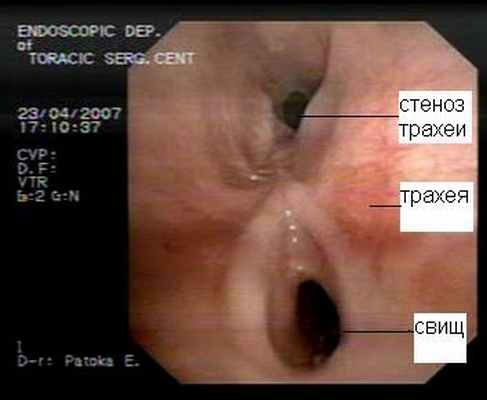 Рис. 10. Трахеоскопия больного с трахеопищеводным свищом, осложненным стенозом трахеи. |
Радикальным методом лечения трахеопищеводных свищей является разъединение пищевода и трахеи с ушиванием дефектов в них и интерпозицией мышц между ними, обычно участка грудиноключичнососцевидной мышцы.
Резекция трахеи
Радикальной операцией, позволяющей удалить стенозированный участок трахеи или опухоль, является циркулярная резекция трахеи. До недавнего времени считалось, что можно безопасно резецировать 2 см трахеи. При необходимости резекции большего участка трахеи для его замещения применяли кожу, перикард, другие ткани, а также различные протезы. Показанием к циркулярной резекции трахеи по поводу стеноза является ограниченный рубцовый стеноз. Важной задачей предоперационной подготовки является адекватное восстановление просвета дыхательного пути с целью устранения гипоксии. Для решения этой задачи выполняют бужирование трахеи жестким бронхоскопом с оставлением больного на сутки на продленной искусственной вентиляции легких через интубационную трубку.
Нецелесообразно выполнять резекцию трахеи при наличии трахеостомы. Ее необходимо предварительно ликвидировать путем эндопротезирования трахеи и ушивания дефекта за 2-3 недели до радикальной операции.
Стентирование трахеи
Различные эндоскопические методы расширения просвета трахеи широко применяются при стенозах доброкачественной и злокачественной природы. Бужирование стенозированного участка трахеи, скусывание опухоли или грануляций, лазерная резекция, фотодинамическая терапия и другие эндоскопические методы позволяют добиться быстрого, однако кратковременного восстановления просвета трахеи. Для предупреждения повторного сужения трахеи применяется ее стентирование. Этот метод является паллиативным методом лечения больных со стенозом трахеи и применяется при невозможности выполнения резекции трахеи или как этап в подготовке больного к радикальной операции. Стентирование возможно также при сужениях анастомозов после трансплантации легкого и циркулярных резекций. Наиболее часто показания для стентирования возникают при нерезектабельных злокачественных опухолях трахеи и крупных бронхов, крупных метастазах в лимфоузлы средостения, вызывающих обструкцию верхних дыхательных путей с выраженной дыхательной недостаточностью.
 Трахеальный стент. | 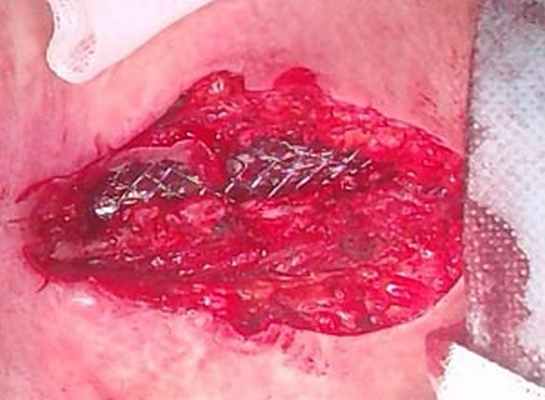 Трахеальный стент в просвете трахеи. |
© 2022 ФГБУ «НМХЦ им. Н.И. Пирогова» Минздрава России. Использование материалов сайта полностью или частично без письменного разрешения строго запрещено.
Анатомия гортани для хирургов
Анатомия гортани для хирургов
Гортань расположена в передних отделах шеи на уровне тел 3-6 шейных позвонков. Она продолжается от верхнего края надгортанника до нижнего края перстневидного хряща. Снизу она соединяется с трахеей, а сверху — с ротоглоткой. Надскладочный отдел гортани представляет собой область от надгортанника до верхушки желудочка гортани между двумя складками слизистой, истинными и ложными голосовыми складками.
Голосовое пространство начинается от верхушек желудочков и продолжается на 1 см книзу. Область между истинными голосовыми складками называется голосовой щелью. Каждая голосовая связка, имеющая форму клина, состоит из чешуйчатого эпителия, поверхностной собственной пластинки, голосовой связки и голосовой мышцы. Подскладочное пространство начинается на 1 см ниже желудочков гортани и продолжается до нижней границы перстневидного хряща. Защитная и фо-наторная функции гортани обеспечиваются действием многочисленных мышц, прикрепляющихся к хрящам гортани.
а) Хрящи гортани. Хрящевой скелет гортани состоит из девяти хрящей, соединенных связками и мембранами. Непарные хрящи представлены щитовидным, перстневидным хрящами и надгортанником; парные — черпаловидными, рожковидными и клиновидными. Наиболее крупным из всех хрящей является щитовидный, он состоит из двух пластинок, соединение которых по средней линии образует гортанный выступ. Верхняя граница щитовидного хряща соединена с подъязычной костью щитоподъязычной мембраной.
Нижний край соединяется с перстневидным хрящом перстнещитовидной связкой и перстнещитовидным суставом. Перстневидный хрящ представляет собой замкнутое кольцо, расположенное под щитовидным хрящом, образуемое сзади широкой пластинкой, а спереди дугой перстневидного хряща. Черпаловидные хрящи представляют собой трехгранные пирамиды, расположенные на задней пластинке перстневидного хряща.
У каждого черпаловидного хряща имеется изогнутая кзади верхушка, которой он соединяется с клиновидными и рожковидными хрящами, и направленный вперед голосовой отросток, который является задней границей голосовых складок, а также направленный назад и латерально мышечный отросток, место прикрепления задней и латеральной перстнечерпаловидных мышц.
б) Мышцы гортани. Мышцы гортани подразделяются на внешние и внутренние. К внешним относятся надподъязычные и подподъязычные мышцы. Группа надподъязычных мышц включает: челюстно-подъязычную, шилоподъязычную, подбородочно-подъязычную и двубрюшную мышцы. Они поднимают гортань и подъязычную кость во время глотания и при фонации. К подподъязычным мышцам относится лопаточно-подъязычная, грудино-подъязычная, грудинощитовидная и щитоподъязычная мышцы. Они опускают гортань и подъязычную кость. Внутренние мышцы гортани представлены в таблице ниже.

в) Кровоснабжение гортани. Верхнюю часть гортани и перстнещитовидную мышцу питает своей верхней гортанной ветвью верхняя щитовидная артерия. Нижние отделы гортани кровоснабжает нижняя щитовидная артерия с ее нижней гортанной ветвью. Вены гортани сопровождают одноименные сосуды и впадают в систему внутренней яремной или плечеголовной вен.
г) Иннервация гортани. Чувствительная иннервация верхних отделов гортани обеспечивается внутренней ветвью верхнего гортанного нерва, ветвью блуждающего нерва. Чувствительная иннервация ниже уровня голосовых складок обеспечивается возвратными гортанными нервами, ветвями блуждающего нерва. Также возвратные гортанные нервы обеспечивают двигательную иннервацию всех внутренних мышц гортани, за исключением перстнещитовидной, которую иннервирует верхний гортанный нерв.
Учебное видео по анатомии гортани
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Клиническая анатомия и особенности невозвратного гортанного нерва в хирургии щитовидной железы. Клинический случай
В последние десятилетия отмечается значительный успех в хирургии щитовидной железы, однако частота развития пареза гортани вследствие повреждения возвратного гортанного нерва остается высокой. Детальное изучение разных вариантов топики нерва – одно из направлений, дающих возможность снизить его травматизацию. Невозвратный нижний гортанный нерв является редкой анатомической особенностью, которая выявляется при операциях на щитовидной железе в 0,3–1% случаев. Несмотря на такую редкую встречаемость, к сожалению, атипичное расположение невозвратного гортанного нерва создает предпосылки для его ятрогенного повреждения. В статье проведен анализ литературы, описаны причины возникновения, связь с аномалией магистральных сосудов и клиническое значение. Описаны два случая выявления невозвратного нижнего гортанного нерва в хирургической клинике ФГБУ РНЦРР МЗ РФ.
Ключевые слова
Для цитирования:
Галушко Д.А., Асмарян А.Г., Пасько М.А. Клиническая анатомия и особенности невозвратного гортанного нерва в хирургии щитовидной железы. Клинический случай. Клиническая и экспериментальная тиреоидология. 2016;12(3):31-36.
For citation:
Galushko D.A., Asmaryan H.G., Pasko M.A. Clinical anatomy and features non-recurrent inferior laryngeal nerve in thyroid surgery. Case report. Clinical and experimental thyroidology. 2016;12(3):31-36. (In Russ.)
Актуальность
Возвратный нижний гортанный нерв (ВНГН) является парным нервом, иннервирующим мышцы гортани и голосовые связки. Повреждение этого нерва может привести к парезу или параличу голосовой складки на той же стороне, что проявляется осиплостью голоса. Если повреждение двустороннее, в результате смыкания паралитических голосовых связок может полностью закрыться голосовая щель, что обычно проявляется афонией и опасной для жизни одышкой, которая требует немедленного выполнения трахеостомии. Несмотря на значительные успехи в хирургии щитовидной железы, по некоторым данным литературы, частота развития пареза гортани вследствие повреждения возвратного гортанного нерва может доходить до 20%. В среднем это осложнение развивается у 2,9% больных при первичных и 8,2% – при повторных операциях. Практически всеми исследователями было продемонстрировано, что визуализация ВНГН во время хирургического вмешательства значительно снижает риск повреждения нерва [1]. Чтобы достигнуть этого, нужно иметь твердые знания нормальных и различных форм топики ВНГН.
ВНГН традиционно называют так вследствие того, что, отходя от блуждающего нерва, он, как правило, формирует петлю, поворачивая вверх, проходя под подключичной артерией справа и под дугой аорты слева, и поднимается вверх, располагаясь в борозде между пищеводом и трахеей. Возвратный нерв отдает чувствующие и двигательные ветви к мышцам пищевода и подходит к гортани. На уровне нижнего края перстневидного хряща возвратный нерв успевает отдать почти все свои чувствующие волокна. Остается лишь небольшая чувствующая ветвь, которая иннервирует слизистую оболочку в области угла и двух передних третей пластинок щитовидного хряща ниже голосовых складок. Двигательная часть нижнего гортанного нерва вступает в гортань сзади от сочленения малого рожка щитовидного хряща с дугой перстневидного и снабжает двигательными ветвями все внутренние мышцы гортани, за исключением передней перстнещитовидной мышцы, которая получает иннервацию от верхнего гортанного нерва.
Есть разные теории, объясняющие, почему этот нерв имеет возвратную природу. Самая популярная из них – теория эволюциониста Ричарда Довкинса, который, исследуя расположение сердца у рыбоподобных предков современных четвероногих, показал, что с появлением и удлинением шеи меняется расположение сердца. Последнее в эволюционном развитии “спускается” все ниже и ниже. У человеческого эмбриона нервная трубка на начальных этапах развития имеет тесную связь с жаберными дугами. Из IV–VI жаберных дуг формируются щитовидный, перстневый, черпаловидные хрящи гортани, констрикторы гортани и пищевода. Кровоснабжение данных анатомических образований осуществляется за счет соответствующих IV–VI дуг жаберных артерий. ВНГН переплетается вокруг пятой дуги, далее в процессе онтогенеза данные дуги опускаются в каудальном направлении, “унося” с собой нижний гортанный нерв вниз. Слева пятая дуга представляет собой дугу аорты и артериальный проток. Справа пятая и шестая дуги исчезают, и петля нерва окружает IV дугу, из которой формируется подключичная артерия [2, 3]. Такое анатомическое расположение ВНГН характерно для большинства млекопитающих, так, наибольшая длина нерва отмечается у жирафа, достигая 4 метров.
Невозвратный нижний гортанный нерв – более редкая аномалия, которая наблюдается в 0,3–0,9% случаев на правой стороне и в 0,004% – слева, хотя большинство исследователей утверждают, что истинных левосторонних невозвратных нервов не бывает и в описанных случаях имеет место транспозиция внутренних органов (situs inversus) [9, 10]. Различают два варианта расположения невозвратного гортанного нерва. При первом типе расположения ННГН отходит непосредственно от блуждающего нерва, располагается вместе с верхними щитовидными сосудами. При втором варианте расположения нерв лежит параллельно нижней щитовидной артерии (тип 2А – над стволом и тип 2B – под или между ветками нижней щитовидной артерии). При этом некоторые авторы сообщают о наличии еще одной атопии – медиального расположения блуждающего нерва (медиальнее общей сонной артерии), считая это “сигнальной лампочкой” для выявления невозвратного нерва [3, 11, 12].
Клинический случай №1
В клинику обратилась женщина 46 лет, у которой по месту жительства по данным УЗИ был выявлен узел правой доли щитовидной железы. При комплексном обследовании в РНЦРР у нее был установлен диагноз: папиллярный рак правой доли щитовидной железы T1N0M0. Пациентке была выполнена тиреоидэктомия с центральной шейной лимфодиссекцией. Интраоперационно был выявлен правый невозвратный нижний гортанный нерв – вариант 2А (рис. 1).
Рис. 1. Интраоперационный вид ННГН справа.
Нерв длиной около 4 см практически под прямым углом отходил от правого блуждающего нерва. Он мобилизован на всем протяжении и прослежен до впадения в гортань. Слева возвратный нижний гортанный нерв располагался в типичном для себя анатомическом месте (рис. 2).
Рис. 2. Интраоперационный вид ВНГН слева.
В послеоперационном периоде больная была дополнительно обследована: выполнена компьютерная томография шеи и органов грудной клетки с ангиографией (рис. 3 а, б) и прямая ангиография (рис. 4), по данным которых подтверждено наличие у пациентки аномалии развития ветвей аорты. Правая подключичная артерия отходит от уровня перешейка аорты по ее задней поверхности самостоятельным стволом, проходя между аортой и позвоночным столбом на уровне третьего позвонка, – a. lusoria. От правой подключичной артерии отходит правая позвоночная артерия. Правая общая сонная артерия отходила от аорты одним устьем вместе с левой общей сонной артерией, что наглядно демонстрируется на ангиограммах в виде симптома “бычьих рогов”. Послеоперационный период у больной протекал гладко, без осложнений. Фонация голосовых связок не была изменена.
Рис. 3. Результаты компьютерной томографии шеи и органов грудной клетки с ангиографией: а – аорта (вид сзади); б – предпозвоночное расположение правой подключичной артерии.
Рис. 4. Ангиография (селективное контрастирование сонных, левой и правой подключичных артерий).
Клинический случай №2
Пациент М., 54 г. Узлы в щитовидной железе выявлены при УЗИ в 2013 г. При контрольном УЗИ в 2015 г. отмечена отрицательная динамика в виде увеличения узла правой доли в размерах с 9 до 13 мм. В РНЦРР проведено комплексное обследование: произведена тонкоигольная аспирационная пункция, морфологически подтвержден папиллярный рак щитовидной железы. Регионарного и отдаленного метастазирования не выявлено. Также у пациента в анамнезе лечение по поводу рака левой молочной железы Т1N0М0: выполнена радикальная резекция левой молочной железы и проведена лучевая терапия. Непродолжительное время лечение антиэстрогенными препаратами. 13.10.2015 выполнена тиреоидэктомия с микрохирургическим невролизом возвратных гортанных нервов. Интраоперационно: при мобилизации выявлен правый невозвратный нижний гортанный нерв (вариант 2В). Выполнен невролиз правого ННГН: прослежен от правого блуждающего нерва на уровни гортани до впадения в гортань, сохранен (рис. 5).
Рис. 5. Интраоперационный вид. Белая стрелка – невозвратный нижний гортанный нерв.
В послеоперационном периоде проводились дополнительные исследования – по данным ангиографии и компьютерной томографии подтверждено наличие сосудистой аномалии в виде a. lusoria. Послеоперационный период у больной протекал гладко, без осложнений. Фонация голосовых связок не была изменена. Проведенные дополнительные исследования подтвердили наличия a. lusoria. По данным МСКТ-ангиографии правая подключичная артерия (a. lusoria) отходит отдельным стволом позади и левее от места отхождения левой подключичной артерии, расположение ее предпозвоночное позади пищевода, отмечается сдавление пищевода (рис. 6 а, б, в).
Рис. 6. Результаты рентгенологического исследования: а – МСКТ расположения a. lusoria; б – компьютерная ангиография (вид спереди); в – компьютерная ангиография (вид сзади).
По данным ангиографии – ангиографическая картина a. lusoria. Справа налево от дуги аорты отходят устья правой и левой общих сонных артерий, левой подключичной артерии и правой подключичной артерии (последние два практически на одном уровне) (рис. 7).
Рис. 7. Ангиография.
Анатомическое расположение НВГН значительно увеличивает риск его ятрогенного повреждения при выполнении тиреоидэктомии. Возможна травма нерва при выполнении тракции щитовидной железы и трахеи; во время лимфодиссекции; также нерв может быть ошибочно принят за сосуд, при этом перевязан или сожжен. Анализ литературных данных показывает высокую чувствительность компьютерной томографии для выявления сосудистой аномалии у больных, что в какой-то мере может служить предоперационным методом диагностики ННГН. Однако редкость встречаемости такой анатомической особенности не дает возможности рекомендовать метод как обязательный в предоперационном обследовании. Но при назначении этого обследования по другим показаниям в обязательном порядке должны быть изучены варианты кровоснабжения и топическая анатомия крупных сосудов, в частности подключичных и сонных артерий. Некоторые авторы сообщают о пользе проведения ультразвукового триплексного сканирования сосудов головы и шеи, при этом отмечая, что визуализация этих аномалий очень трудна и зависит от уровня подготовки специалиста. И поэтому, к сожалению, единственным достоверным методом выявления невозвратного нерва остается интраоперационный. Надо отметить, что, несмотря на многочисленные рекомендации начинать поиски невозвратного гортанного нерва только после неудачной попытки обнаружения возвратного гортанного нерва в типичном для него месте, мы придерживаемся мнения тех авторов, которые рекомендуют в каждом случае идентифицировать все структуры зоны медиальнее сонной артерии до доли щитовидной железы (так называемый transversus path – поперечный путь). Особое внимание стоит уделять области нижней щитовидной артерии и медиальной вены щитовидной железы.
Заключение
Агрессивные вмешательства в области головы и шеи, которые могут поставить под угрозу целостность гортанных нервов, являются частью повседневной хирургической практики. Твердые знания нормальной морфологии и не самых частых вариантов топики нижних гортанных нервов, включая его невозвратный вариант, могут помочь врачам минимизировать риск ятрогенного повреждения этого нерва.
Согласие пациента. Все пациенты добровольно подписали информированное согласие на публикацию персональной медицинской информации в рамках настоящей статьи.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Анатомия гортани для хирургов
Обзор литературы содержит сведения о существующих современных методах прижизненной визуализации гортани и их возможностях для изучения клинической топографической анатомии гортани человека в периоды пренатального и постнатального онтогенеза.
Целью настоящего обзора литературы является обобщение существующих сведений о прижизненной анатомии гортани, полученных с использованием современных методов визуализации этого органа, в связи с их востребованностью при выполнении диагностических и лечебных манипуляций в практике врачей оториноларингологов [9, 16, 29]. При изучении топографии и анатомического строения гортани выделяют целый ряд особенностей. Орган имеет сложную конфигурацию и труднодоступное положение, что требует использования эндоскопических методик для его исследования. Гортань выполняет речевую функцию, имеющую огромную социальную значимость. На долю злокачественных образований гортани приходится от 1 до 3 % всей онкологической патологии населения и многие другие [21]. С развитием методов прижизненной визуализации в фундаментальных исследованиях все привычней стало понятие «анатомия живого человека», сведения о котором нашли свое отражение во многих анатомических атласах и руководствах [5, 14, 32, 41]. Таким образом, с одной стороны ‒ острая потребность в сведениях о прижизненной анатомии гортани с учетом возрастных, половых, индивидуальных различий на этапах онтогенеза, а с другой стороны ‒ техническая возможность их получения являются определяющими для исследований в этой области [34, 38].
Первые сведения о прижизненной анатомии гортани могут быть получены еще в пренатальном периоде онтогенеза с использованием ультразвукового метода. Начиная с 11-14 недель внутриутробного развития, когда проводится первое скрининговое ультразвуковое исследование, становится возможным описать анатомическое строение органа с созданием объемной реконструкции гортани. Авторы подчеркивают, что ультразвуковая оценка большинства анатомических структур шеи плода вызывает затруднения ввиду их небольших размеров [12, 13]. Наиболее четко идентифицируются основные сосуды с использованием режима цветового допплеровского картирования [43]. Оптимальными сроками визуализации гортани плода являются 20-30 недель гестации, тем не менее, успешное изучение органа в сроки 16‒36 недель возможно в 82 % наблюдений. После 22-24 недель можно зарегистрировать движение голосовых связок.
В постнатальном онтогенезе информативность этого метода не утрачивает своего значения [15, 17, 23], особенно допплерография в виде так называемой дуплексной эхографии или с применением контрастного вещества, содержащего воздух и хорошо отражающего ультразвук. Еще в начале 90-х годов авторы отмечали, что УЗ-исследование гортани имеет почти двадцатилетний опыт применения. Хотя все исследователи подчеркивают, что голосовые складки имеют вид образований пониженной эхогенности, их движение определяется в основном по смещению более эхогенных черпаловидных хрящей и боковых мышц гортани, просвет виден нечетко, у взрослых мужчин данный метод исследования вообще вызывает затруднения при интерпретации полученных данных. Этот метод дает возможность оценить кровоток не только в магистральных сосудах, но и в тканях, хорошо визуализируются лимфоузлы шеи, но для изучения анатомических структур органа этот метод не информативен [27, 33].
Еще одним методом для изучения прижизненной анатомии гортани является ларингоскопия. Выделяют непрямую, прямую ларингоскопию, микроларингоскопию, видеомикроларингоскопию [1, 8].
Сложность ларингоскопии заключается в том, что продольная ось гортани расположена под прямым углом к оси полости рта, с связи с чем она не может быть осмотрена обычным путем. Непрямая ларингоскопия (ларингоскоп для непрямой ларингоскопии был изобретен в 1854 г.) [20] позволяет изучить надгортанник и все образования входа в гортань, голосовые складки, складки преддверия, форму голосовой щели. Картина является результатом зеркального отражения истинной картины. Прямая ларингоскопия вошла в практику с 1895 г. [22, 39]. Фиброэндоскопический метод исследования гортани широко используется врачами оториноларингологами. Неоспоримыми достоинствами этого метода являются небольшой диаметр оптической трубки фиброэндоскопа, мощное освещение, управляемый дистальный конец с максимальным поворотом его на угол до 180 °, что позволяет проводить исследование даже при подозрении на травматическое повреждение верхних отделов дыхательной и пищеварительной систем. Кроме того, существует возможность документировать изображение с помощью фотографирования на пленку, а также получить кино- и видеоматериалы. Оценка всех отделов гортани при этом методе может быть произведена в ее функциональном состоянии: при спокойном дыхании, форсированном вдохе, фонации, глотании и т.д. Прямая опорная микроларингоскопия позволяет оценить состояние слизистой оболочки всех отделов органа, при этом индивидуальные анатомические особенности строения и конституциональные особенности человека играют очень важную роль [28, 37].
Гортань широко исследуется с помощью лучевых методик. Самыми доступными и быстро выполнимыми являются рентгенография и томография. Их осуществляют в прямой и боковой проекциях. По боковым рентгенограммам можно дать характеристику воздушных столбов (просветов всех органов шеи), определить толщину мягких тканей между этими органами и позвоночником, т.е. дать количественную характеристику топографии гортани или ее отделов, их отношения с другими органами и структурами шеи. При обзорной рентгенографии в прямой и боковой проекциях выявляют границы входа в гортань, которые имеют вид тонких полосок. На фоне просвета органа в виде полоски просветления определяются желудочки гортани. Место пересечения линий, разграничивающих гортанную поверхность надгортанника с передним краем вестибулярных складок, называют надгортанно-желудочковым углом [3, 7, 25, 42]. Компьютерно-томографическое исследование, спиральная компьютерная томография гортани очень часто используются в медицинской практике. Это сопряжено с особенностями анатомического строения органа, такими как наличие воздушного столба и жировых пространств. Традиционный метод рентгено-томографии дает возможность получать изображения гортани во фронтальной и сагиттальной плоскостях, при выполнении компьютерной томографии появляется возможность получить изображение в аксиальной проекции [4, 6, 18, 44]. На снимках гортань представляет собой систему костных и хрящевых структур, соединенных посредством связок и мышечного аппарата в единый орган. Для гортани предпочтительным считают спиральное сканирование. К костно-хрящевому скелету гортани исследователи относят подъязычную кость, щитовидный, перстневидный хрящи, надгортанник, а также парные черпаловидные, клиновидные, рожковидные хрящи [10, 11, 35, 40]. Названия анатомических областей и частей гортани и гортаноглотки, используемые согласно Международной классификации болезней в онкологии (1976), отличаются от номенклатурных отделов, выделенных в Международной анатомической терминологии (2003). Так, онкологи в гортани выделяют три части. Первая часть - надсвязочная, расположенная выше подъязычной кости и включающая в себя часть надгортанника выше подъязычной кости (включая верхушку), черпаловидно-надгортанную складку, черпаловидный хрящ и надсвязочную, расположенную ниже подъязычной кости, состоящую из части надгортанника ниже подъязычной кости, ложные голосовые связки, полость желудочков. Вторая часть - связочная. К ней относят истинные голосовые связки, переднюю и заднюю комиссуру. Третья часть - подсвязочная [30]. С гортанью тесно связана гортаноглотка, которая также из-за своего клинико-онкологического значения делится на части при описании результатов томографии. Глоточно-пищеводное соединение - область позади перстневидного хряща, которая простирается от уровня черпаловидного хряща до нижней границы перстневидного хряща. Грушевидный синус простирается от черпаловидно-надгортанной складки до верхнего края пищевода, сбоку он ограничен щитовидным хрящом, медиально - краями черпаловидно-надгортанной складки, черпаловидными и перстневидными хрящами. Задняя стенка глотки простирается от уровня валлекул до уровня перстневидно-черпаловидного соединения. С помощью этого метода стало возможным описать возрастные изменения в хрящах гортани, которые прежде всего выражаются в появлении очагов оссификации. Оссифицированные очаги хрящей гортани видны на КТ-изображениях как плотные включения внутри этих хрящей. М.С. Плужников и др. считают, что изображения, полученные при выполнении прицельного и трех функциональных снимков, по своей информативности не уступают результатам МРТ [2, 25].
Магниторезонансная томография (ЯМР) отличается высокой контрастностью при изучении мягких тканей органа [19]. Преимущество этого метода для морфологических и медицинских исследований связано с отсутствием воздействия ионизирующего излучения, возможностью многоплоскостной визуализации (осевой, венечной, сагиттальной, косой), лучшей детализацией анатомических структур, способностью характеризовать типы ткани на основе интенсивности сигнала, лучшим контрастированием. Для выполнения анатомических исследований предпочтительным является режим Т2, который позволяет лучше визуализировать мышцы, фиброэластический и хрящевой скелет органа [24, 34, 36, 45]. Новое направление «молекулярная томография» с использованием так называемых «умных агентов» позволяет селективно изучить структуры на тканевом, клеточном и молекулярном уровнях. Суть метода заключается во введении в организм человека маркеров, тропных к различным тканевым структурам. В этом случае можно получить «гистологическую томограмму»
органа [26].
Одним из методов, который нечасто, но все же может быть использован при изучении гортани, является термография гортани. Топографо-анатомическое расположение гортани характеризуется относительно неглубоким ее залеганием, тонким слоем подкожной клетчатки и мышц. В норме область гортани на фоне общего термографического изображения передней поверхности шеи имеет вид темного гипотермического участка с наличием зон гипертермии, обусловленной поверхностно расположенными сосудами. Самая холодная точка отмечается в области щитовидного хряща. Существенных половых различий в термографическом изображении гортани не было выявлено. Изменение нормальной термографической картины может наблюдаться при опухолевых процессах различного генеза [31].
Из данного обзора можно сделать выводы, что на сегодняшний день существует большое количество методов для изучения прижизненной анатомии гортани на разных этапах онтогенеза. Высокая информативность и специфичность этих методов может быть использована для исследования как топографии всего органа, так и анатомической характеристики его отделов. Для выполнения работы надо активно использовать архивы медицинских учреждений, так как высокая стоимость обследования и наличие строгих показаний к ним не позволяют широко применять их для научных целей.
Список литературы
Рецензенты:
Маслюков Петр Михайлович, д.м.н., профессор кафедры нормальной физиологии с курсом биофизики Ярославской государственной медицинской академии;
Баландина Ирина Анатольевна, профессор, зав. кафедрой нормальной, топографической и клинической анатомии, оперативной хирургии ГОУ ВПО «Пермская государственная медицинская академия им. ак. Е.А. Вагнера».
День отоларинголога
Ежегодно 29 сентября в России отмечается профессиональный праздник – День отоларинголога. Оториноларингология (от греч. otos – ухо, rhinоs – нос, laryngos – гортань) является одной из областей медицины, которая занимается изучением анатомии и физиологии уха, горла, носа и его придаточных пазух, а также диагностикой, лечением и профилактикой заболеваний этих органов. Практикующих в данной сфере врачей Читать больше проДень отоларинголога […]

Жить здорово (выпуск от 19.09.2019)

В ПАРКЕ «СОКОЛЬНИКИ» СОСТОИТСЯ ФЕСТИВАЛЬ МОСКОВСКОЙ СКОРОЙ ПОМОЩИ «100 ЛЕТ СПАСАЕМ ЖИЗНИ»
21 сентября в парке «Сокольники» состоится фестиваль, посвященный юбилею Станции скорой и неотложной медицинской помощи им. А.С. Пучкова Департамента здравоохранения Москвы. Посетить событие смогут все желающие – столичные медики подготовили насыщенную праздничную программу и для детей, и для взрослых. В рамках мероприятия на территории парка будет проходить выставка ретро- и современных автомобилей московской скорой помощи. Читать больше проВ ПАРКЕ «СОКОЛЬНИКИ» СОСТОИТСЯ ФЕСТИВАЛЬ МОСКОВСКОЙ СКОРОЙ ПОМОЩИ «100 ЛЕТ СПАСАЕМ ЖИЗНИ» […]

18 сентября ЛОР-школа. Цикл лекций по актуальным вопросам диагностики и лечения болезней уха, горла и носа в 2019 году в рамках постоянно действующей школы амбулаторно–поликлинической оториноларингологии
ЛОР — школа Цикл лекций по актуальным вопросам диагностики и лечения болезней уха, горла и носа в 2019 году в рамках постоянно действующей школы амбулаторно–поликлинической оториноларингологии. 20.02.2019, 06.03.2019, 20.03.2019, 17.04.2019, 18.09.2019, 16.10.2019, 20.11.2019, 18.12.2019. Программа ЛОР школы 18 сентября 2019 г. 10:00 — 12: 00 Лекция: «Острые респираторные инфекции в ЛОР практике», лектор Читать больше про18 сентября ЛОР-школа. Цикл лекций по актуальным вопросам диагностики и лечения болезней уха, горла и носа в 2019 году в рамках постоянно действующей школы амбулаторно–поликлинической оториноларингологии […]

ДЕНЬ ОТКРЫТЫХ ДВЕРЕЙ
ОБУЧАЮЩИЙ ЦИКЛ «МИКРОХИРУРГИЯ ГОРТАНИ И ФОНИАТРИЯ»
4-5 декабря 2019 на базе ГБУЗ «НИКИО им. Л.И. Свержевского» ДЗМ (директор – заслуженный деятель науки, профессор, д.м.н. А.И. Крюков) будет проведен двухдневный учебный цикл, посвященный микрохирургии гортани и фонитарии. В рамках учебного цикла будут прочитаны лекции по хирургической анатомии гортани, физиологии и патофизиологии голосообразования, эндоскопической диагностике патологии гортани, применении видеоларингостробоскопии и спектрального компьютерного анализа Читать больше проОБУЧАЮЩИЙ ЦИКЛ «МИКРОХИРУРГИЯ ГОРТАНИ И ФОНИАТРИЯ» […]

Всемирный день трезвости
Департамент здравоохранения города Москвы проводит информационно-просветительские мероприятия к Всероссийскому дню трезвости. Первое празднование Дня трезвости состоялось в России в 1911 году в Санкт-Петербурге под лозунгом «В трезвости — счастье народа!». Праздник был учрежден по инициативе просвещенной общественности и Русской Православной Церкви, обеспокоенных потерей трезвеннических традиций в российском обществе. В этот день закрывались казенные винные лавки, Читать больше проВсемирный день трезвости […]
День города
Дорогие москвичи и гости столицы! Администрация и коллектив ГБУЗ НИКИО им. Л.И. Свержевского ДЗМ поздравляет Вас с Днём Города, 872-летием Москвы! От всей души желаем Вам крепкого здоровья и удачи во всех жизненных начинаниях!
Читайте также:
