Диагностика на изолированных бластомерах. Диагностика патологии на стадии бластоцисты.
Добавил пользователь Дмитрий К. Обновлено: 30.01.2026
Генные болезни плода. Пренатальная диагностика генных болезней плода.
На долю генных нарушений приходится в общей сложностидо 5% всей врожденной патологии. Это так называемый «генетический груз» популяции. Из них на собственно моногенные болезни приходится около 1%; 3-3,5% составляют заболевания с выраженной наследственной предрасположенностью (сахарный диабет, атеросклероз, ишемия сердца, многие онкологические заболевания).
Для ПД в первую очередь представляют интерес генные болезни, приводящие к тяжелой, нередко смертельной патологии, в отношении которых пока отсутствуют или еще малодоступны методы лекарственной терапии. Из более 6000 заболеваний, известных на сегодняшний день, доля заболеваний, безусловно заслуживающих ПД, составляет не более 1%, причем и в этой группе удельный вес различных нозологии существенно варьирует. Более половины случаев моногенной патологии, требующих ПД, составляют такие сравнительно частые и тяжелые болезни, как муковисцидоз, миодистрофия Дюшенна, синдром ломкой (фрагильной) Х-хромосомы, гемофилия А, фенилкетонурия, поликистоз почек, атаксия Фридрейха, синдром Верднига -Гоффмана, синдром Шарко - Мари -Туе. ПД именно этих социально значимых моногенных заболеваний является особенно актуальной.
Впервые молекулярная (ДНК) диагностика в России была осуществлена в Санкт-Петербурге в 1987 г. у женщины с высоким риском рождения ребенка, страдающего муковисцидозом. К настоящему времени встране проведено более 1000 ПД моногенных болезней. Более 500 из них выполнены в нашем центре, что позволило предотвратить рождение 154 детей с тяжелыми моногенными болезнями, в том числе с муковисцидозом, фенилкетонурией, гемофилией Аи В, миодистрофией Дюшенна, синдромом ломкой Х-хромосомы. Генетические центры страны, где проводится ДНК-диагностика наиболее частых моногенных болезней, приведены в таблице.

Основные принципы пренатальной диагностики генных болезней
Принимая во внимание высокую точность молекулярных методов, их большую чувствительность и, к сожалению, достаточно высокую себестоимость, необходимо помнить, что эффективность ДНК-диагностики у плода в значительной мере предопределяется следующими основными требованиями:
— точностью клинического диагноза;
— своевременным обследованием семьи высокого риска и больного молекулярными методами;
— правильностью оценки риска рождения больного ребенка;
— выбором оптимального срока ПД; возможностью получения материала плода;
— четкостью рекомендаций после ПД;
— наличием скринирующих программ в ДНК-диагностике.
Ниже приведена краткая характеристика каждого из этих положений.
Точность клинического диагноза
Молекулярная диагностика проводится на уровне индивидуальных генов, точнее, на уровне фрагментов ДНК самих генов или близлежащих ДНК-последовательностей. Отсутствие точного клинического диагноза моногенного заболевания по сути делает невозможным применение молекулярных методов. К сожалению, несовершенство стандартных лабораторных методов, недостаточный опыт клиницистов и медицинских генетиков, консультирующих семьи высокого риска, нередко приводят к тому, что на ПД направляют женщин, у которых диагностика ДНК-методами невозможна.
Своевременность обследования семьи высокого риска
Одно и то же моногенное заболевание может быть результатом самых разных мутаций одного и того же гена. Идентификация таких мутаций в каждой семье - необходимое условие успешной ПД. Особенно важно, чтобы идентификация мутаций и молекулярное маркирование мутантных хромосом, так называемая непрямая молекулярная диагностика, были проведены при наличии в семье больного ребенка. ДНК-обследование каждой семьи высокого риска должно быть проведено до наступления следующей беременности. При этом особую диагностическую ценность предстаатяют препараты ДНК самого больного. В случае отсутствия в семье больного ребенка и невозможности точно идентифицировать мутации у родителей ПД с использованием молекулярных методов невозможна. Своевременное обследование семей и отсылка образцов крови семей высокого риска в соответствующие центры ДНК-диагностики для выяснения информативности семьи, т.е. ее пригодности для ДНК-диагностики, — важная функция кабинетов медико-генетического консультирования.
Правильность оценки риска рождения больного ребенка
Правильность постановки клинического диагноза предполагает и правильность оценки риска рождения больного ребенка. Известно, что для аутосомно-рецессивных заболеваний он составляет 25%, для аутосомно-доминантных - 50%, для болезней, сцепленных с полом, — 50% для мальчиков и практически 0% для девочек.
Особую сложность для оценки риска представляют болезни «экспансии», наследование которых нередко существенно отклоняется от законов Менделя. К таким болезням относятся синдром ломкой X-хромосомы, миотоническая дистрофия, хорея Гентингтона и ряд других нейродегенеративных заболеваний.
При оценке риска особого внимания заслуживают заболевания, для которых велика вероятность гонадного мозаицизма (т.е. мутантные клетки присутствуют только в некоторых клеточных клонах гонад и не определяются в соматических клетках), как, например, при миодистрофии Дюшенна.
Следует также учитывать, что для ряда нозологии (например, гемофилия А, миодистрофия Дюшенна) необычно высока частота спонтанных мутаций соответствующих генов (фактора VIII свертывания крови и дистрофина соответственно), поэтому до решения вопроса о проведении ПД в таких семьях особенно важно установить наличие гетерозиготного носительства мутации соответствующих генов у матери.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Диагностика на изолированных бластомерах. Диагностика патологии на стадии бластоцисты.
Доимплантационная диагностика патологии плода.
Доимплантационная диагностика (ДД) — новое направление в ГТД наследственных болезней, возникшее в 90-х годах благодаря развитию методов вспомогательной репродукции (экстракорпорального оплодотворения), методов молекулярной цитогенетики (различные варианты FISH) и молекулярной генетики (варианты ПЦР), приемлемых для анализа генома единичных клеток. Если первые успешные попытки ДД были ограничены определением пола эмбриона при Х-сцепленных заболеваниях, то в настоящее время спектр наследственных болезней существенно увеличился и включает не только многие моногенные (муковисцидоз, фенилкетонурия), но и различные хромосомные болезни. Согласно последним данным, к 2001 г. в мире проведено около 2500 ДД. После отсева больных зародышей и трансплантации в матку реципиентов оставшихся эмбрионов в 500 случаях родились здоровые дети.
В России доимплантационная диагностика делает только первые шаги и по сути сосредоточена в нескольких центрах вспомогательных репродуктивных технологий в Москве и Санкт-Петербурге, причем и в этих центрах она ограничена диагностикой пола плода (планирование семьи и Х-сцепленные заболевания), а также исключением хромосомных аберраций.
Следует напомнить, что материалом для доимплантационной диагностики являются полярные тельца или отдельные бластомеры дробящейся яйцеклетки, полученные микрохирургическим путем от доимплантационных зародышей - продуктов экстракорпорального оплодотворения. В зависимости от материала ДД можно подразделить на преконцепционную (анализ полярных телец) и собственно доимплантационную (анализ бластомеров или клеток трофобласта). Кратко рассмотрим основные принципы ДД, возможности таких подходов, их преимущества и недостатки.
Диагностика с использованием полярных телец позволяет проводить отбор ооцитов, не несущих генных и геномных мутаций, для оплодотворения. Получены убедительные доказательства того, что удаление первого полярного тельца не нарушает процессов дробления и имплантации, а также не влияет на эмбриональное развитие. Полярные тельца чаще используют для диагностики моногенных болезней. Основная проблема — большая вероятность неточного прогноза о генотипе ооцита по результатам тестирования только первого полярного тельца. Вероятность попадания в ооцит второго порядка хромосомы, несущей мутацию в результате кроссинговера, теоретически составляет 50%, поэтому точный диагноз о наличии определенной мутации может быть поставлен только после окончания второго деления мейоза, т.е. по второму полярному тельцу, которое образуется уже после оплодотворения яйцеклетки.
Вторая проблема доимплантационной диагностики обусловлена особенностями применения молекулярно-генетических методов для диагностики единичной клетки. На результаты исследования могут повлиять различные факторы, в частности контаминация образца или условия проведения ПЦР.
Для преодоления этих проблем разработаны методы последовательного анализа 1 и 2 полярных телец при молекулярной диагностике аутосомно-рецессивных заболеваний. Достигнуты успехи и в разработке оптимальных условий для проведения ПЦР на единичных клетках, которые способствуют снижению вероятности ошибочного диагноза. Эти подходы позволяют успешно применять ДД в случаях Х-сцепленных, аутосомно-доминан-тных и рецессивных заболеваний.
Проблема цитогенетического анализа полярных телец заключается в невозможности применения традиционных методов исследования метафазных хромосом. Большинство работ выполнено FISH-методом с использованием смеси ДНК-зондов, специфичных к прицентромерным участкам отдельных хромосом.
В последние годы разработаны и апробированы методы приготовления хромосом из полярных телец человека, пригодные для стандартного цитогенетического анализа. Предложенные модификации уже позволили провести хромосомный анализ первых полярных телец с эффективностью 94,1%. Стали доступными для стандартного анализа и хромосомы второго полярного тельца после его инъекции в цитоплазму энуклеированного ооцита. Однако преодоление методических трудностей не решает проблему точности цитогенетическои диагностики по полярным тельцам. Так, анализ первого полярного тельца позволяет регистрировать анеуплоидию, возникшую вследствие аномальной сегрегации хромосом лишь в первом делении мейоза, в то время как частота анеуплоидных вторых полярных телец составляет около 25%. Более того, обнаружена высокая степень дискордантности хромосомных наборов во втором полярном тельце и в материнском пронуклеусе у мышей. Эти обстоятельства, обусловленные аномальной сегрегацией хроматид в анафазе II, ставят под сомнение корректность диагностики на основе анализа хромосом полярных телец. Таким образом, возможности для преконцепционной диагностики наследственных болезней уже реально существуют. Вместе с тем использование полярных телец для молекулярно-генетического и цитогенетического анализа пока еще не стало популярным среди специалистов ДД. Сложности методических приемов работы с единичными клетками и большая вероятность диагностических ошибок не оправдывают значительных финансовых затрат на проведение преконцепционной диагностики.
Выбор метода молекулярной диагностики определяется спецификой исследуемой мутации и включает как ПЦР для одновременной детекции нескольких мутаций (мультиплексная ПЦР), так и более сложные ДНК-методы. Их применение позволяет проводить диагностику наиболее распространенных аутосомно-рецессивных моногенных болезней - муковисцидоза, талассемии, спинальной мышечной атрофии, болезни Тея — Сакса, а также аутосомно-доминантных - миотонической дистрофии, синдрома Марфана, хореи Гентингтона и Х-сцепленных — миодистрофии Дюшенна и синдрома ломкой Х-хромосомы.
Цитогенетическая доимплантационая диагностика проводится на 1-2 бластомерах FISH-методом с использованием ДНК-зондов, специфичных к прицентромерным районам хромосом 16, 18, 21, 13, X, Y. В случае гетерозиготного носительства транслокации одним из родителей предпринимаются попытки использования цельнохромосомных ДНК-зондов.

Диагностика на стадии бластоцисты является одним из перспективных направлений ДД. На стадии бластоцисты зародыш состоит примерно из 60-100 клеток. При визуализации трофо- и эмбриобласта без ущерба для развития эмбриона можно удалить до 10 клеток трофобласта. Однако следует учитывать, что культивирование эмбрионов in vitro в программах экстракорпорального оплодотворения (ЭКО) редко доводят до стадии бластоцисты, так как способность таких эмбрионов к имплантации может оказаться существенно сниженной. В то же время частота морфологически нормальных эмбрионов с мозаичной формой численных хромосомных аберраций остается достаточно высокой и достигает 40%.
Таким образом, основное (и единственное) преимущество доимплантационой диагностики заключается в возможности трансплантации генетически полноценных эмбрионов. Недостатками этого подхода являются: методические трудности, связанные с необходимостью работы с микроколичествами материала, ограничения диагностики рамками программ ЗКО и большая вероятность ошибочной диагностики, обусловленной сложностями анализа единичных клеток. Перспективы анализа большего числа клеток, безусловно, повысят разрешающую способность методов ДД. Однако при анализе даже нескольких клеток трофобласта проблема хромосомного мозаицизма остается нерешенной и, следовательно, не исключает необходимости проведения последующей ПД на постимплантационных стадиях.
В заключение отметим два основных обстоятельства, сдерживающих развитие доимплантационой диагностики в России. Во-первых, эти исследования даже в наиболее развитых отечественных центрах вспомогательных репродуктивных технологий пока находятся на стадии научных разработок. Это означает, что после проведения ДД и наступления долгожданной беременности после трансплантации оперированных зародышей на постимплантационных стадиях целесообразно провести ПД стандартными методами.
Во-вторых, доимплантационая диагностика невозможна без наличия высокоточного оборудования для молекулярных и цитогенетических исследований, прецизионной техники для микрохирургических операций яйцеклеток и бластоцист, высококвалифицированных специалистов - цитогенетиков, молекулярных биологов и эмбриологов и, конечно, специальных высококачественных реактивов, в том числе хромосом- и локус-специфических ДНК-зондов и расходных материалов. В результате этого ДД, безусловно, существенно увеличивает и без того высокую стоимость процедуры ЭКО и делает ее малодоступной для жителей России.
Бластоцистоз - симптомы и лечение
Что такое бластоцистоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Определение болезни. Причины заболевания
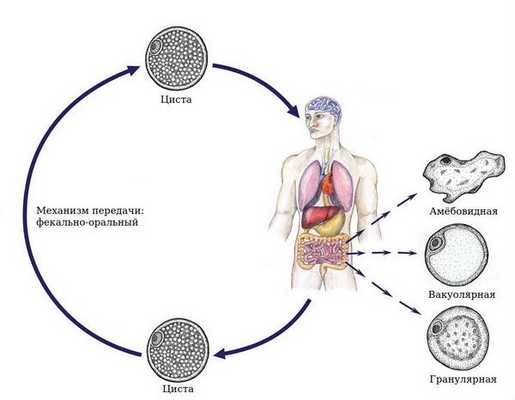
Бластоцистоз — это заболевание человека, вызываемое простейшим одноклеточным микроорганизмом Blastocystis, который колонизирует желудочно-кишечный тракт и при определённых условиях вызывает срыв функционирования кишечника (запоры или диарея, дискомфорт и боли в животе). Также Blastocystis повышает частоту развития иммунодепрессии, проблемной кожи и патологии суставов. Паразит проникает в организм посредством фекально-орального механизма. Чаще всего болезнь протекает в форме неактивного носительства.
Этиология
- домен — Eukaryota;
- тип — cтраменопилы (также входят водоросли, водяная плесень и диатомовые водоросли);
- учебный класс — Blastocystae;
- порядок — Blastocystida;
- семья — Blastocystidae;
- род — Blastocystis;
- вид — Blastocystis hominis (рекомендуется использовать общий термин — Blastocystis sp).
Впервые эти простейшие были описаны А. Алексеевым (А. Alexieff) в 1911 году, а уже в 1912 году Е. Брумпт (Е. Brumpt) выделил и описал основные признаки бластоцисты в материале человека.
Бластоцисты — очень разнообразные по генетическим вариациям простейшие одноклеточные. Они выявляются в кишечнике как у человека, так и у множества животных (свиней, приматов, собак, птиц, тараканов и др.), т. е. не являются строго специфичными к хозяину. Отсюда рекомендуемое наименование — Blastocystis sp. (species subtype n., где n — число, указывающее субтип простейшего ). До сих пор ведутся дискуссии по поводу патогенности их для человека, однако в экспериментах на мышах заражение бластоцистами вызывало у животных воспаление кишечника, выраженное нарушение его работы и преждевременную смерть, а у высших приматов — хроническую диарею [16] .
Для людей характерно нахождение подтипа ST (при генетическом типировании). Всего 9 видов (ST1-ST9), наиболее распространены ST1, ST2, ST3 и ST4, причём они могут сосуществовать в организме одного хозяина в разных сочетаниях. На сегодняшний день конкретная патогенность разных подтипов для человека не выяснена, однако есть предположения, что заболевание вызывают лишь некоторые подтипы паразита, тогда как другие в основном приводят лишь к носительству.
Жизненный цикл Blastocystis до конца не изучен. Размножаются микроорганизмы бинарным делением. Тело покрыто специальной мембраной, с которой соприкасается цитоплазма и органеллы. Паразиты могут находиться в кишечнике от недели до нескольких лет.
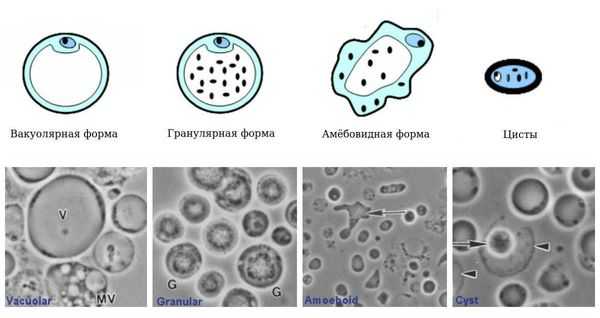
Бластоцисты имеют 4 формы жизни:
- Вакуолярная форма. В культуре у бессимптомных носителей бластоцисты выявляются в форме круглого или овального образования размерами 5-50 (редко больше) мкм. Основную часть тела занимает большая центральная вакуоль (вероятно, предназначена для хранения), окружённая тонким кольцом цитоплазмы. В цитоплазме могут находиться от 1 до 6 ядер.
- Гранулярная форма. В просвете кишечника выявляются тонкостенные простейшие, напоминающие вакуолярную форму, но с наличием в вакуоли и цитоплазме гранул различной формы (участвуют в химических процессах поддержания жизнедеятельности и размножении).
- Авакуолярная (амёбовидная) форма. Выявляется в культуре у больных кишечными расстройствами. Амёбовидные бластоцисты в кишечнике адгезированы (прикреплены) к эпителию и неподвижны.
- Цисты. Они меньше по размеру и имеют толстую многослойную стенку, выявляются в культуре (кале). Данная форма лишена центральной вакуоли, имеет несколько небольших вакуолей с отложениями пищи и несколько ядер. Это самая устойчивая во внешней среде форма.
Паразиты к ультивируются на питательных средах, причём образуют множество нетипичных форм (промежуточные стадии развития).
Бластоцисты достаточно быстро погибают при действии бытовых дезинфектантов, кипячении и замораживании. В окружающей среде при 4 °C могут сохранять жизнеспособность до 2 месяцев, при 25 °C — до 1 месяца, длительно не погибают в дистиллированной воде [1] [2] [6] [12] .
Эпидемиология
Бластоцисты распространены повсеместно, это один из самых часто встречающихся паразитов в мире (заражены, вероятно, не менее 1 млрд. человек), распространённость подтипов пока изучается. В некоторых регионах, особенно в тропиках, ими инфицировано до 100 % населения, в США — около 23 % популяции. Заболеваемость выше в тех регионах, где присутствует антисанитария и не уделяется должного внимания соблюдению правил личной гигиены. Чаще болезнь выявляется среди людей, которые контактируют с животными и имеют сопутствующую патологию ЖКТ или хронический вирусный гепатит. Во многих случаях они выявляются в сочетании с другими патогенами ЖКТ (лямблиями, возбудителями острых кишечных инфекций и др.).
Механизм передачи — фекально-оральный, пути — водный (через загрязнённую воду), пищевой (через заражённую пищу) и контактно-бытовой (при несоблюдении правил гигиены, возможно распространение насекомыми, например мухами и тараканами).
Риск распространения в семье, где соблюдают правила гигиены, минимален. В странах, где проводят централизованное обеззараживание водопроводной воды, вода из под крана безопасна (т. е. бластоцисты в ней не содержатся) [1] [7] [8] [10] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы бластоцистоза
Во множестве случаев выявления бластоцист у людей симптомы не проявляются или их нельзя напрямую связать с паразитом (по крайней мере, на сегодняшнем уровне развития медицины). Возможно, люди (и врачи в том числе) оказались "ослеплены" фактами исчезновения и уменьшения количества некоторых паразитарных заболеваний (например, малярии и дракункулёза), что создало неверное представление о победе над паразитами. Однако постоянное увеличение числа больных с патологией кишечника неустановленной этиологии, иммунодефицитами и кожными заболеваниями может быть вызвано распространением именно тех микроорганизмов, которые раньше считались непатогенными или условно-патогенными.
Чаще всего при манифестной форме заболевания (когда болезнь начинает проявляться) больные указывают на следующие признаки:
- дискомфорт и боли в животе;
- неустойчивый стул, диарея, запор, изменение консистенции стула, его цвета и запаха;
- метеоризм;
- тошнота;
- перианальный зуд, иногда зуд кожи;
- повышенная утомляемость, снижение работоспособности;
- снижение массы тела (похудание);
- необъяснимые высыпания на коже;
- дискомфорт в суставах;
- частые простудные заболевания;
- повышенная нервная возбудимость, плохой сон;
Есть публикации, описывающие связь бластоцист с воспалительными заболеваниями кишечника (ВЗК). Дело в том, что ВЗК связаны с нарушением барьерной функции эпителия, а у пациентов с бластоцистозом повышена кишечная проницаемость [16] . Это позволило предположить, что паразиты могут повреждать стенку кишечника [15] .
Есть некоторые предпосылки, указывающие на более частое развитие манифестных форм болезни, в основном это:
- генетическая предрасположенность (связанная с повышенной секрецией цитокинов);
- возраст (чем старше человек, тем больше вероятность симптоматики);
- более патогенные подтипы бластоцист.
Бластоцистоз у беременных
Каких-то обособленных проявлений инфекции у беременных не наблюдается. Возможно более раннее начало и тяжесть токсикоза, чаще развиваются функциональные нарушения работы желудочно-кишечного тракта. Возможное влияние на плод ограничивается повышенным риском гипотрофии ( недостаточной массы тела) , анемии, отставании по срокам развития, после рождения может быть отмечена склонность к аллергизации и патологиям кожи (атопический дерматит, псориаз) [3] [4] [7] [13] .
Патогенез бластоцистоза
Бластоцисты могут нарушать расположение и функционирование актиновых филаментов эпителиальных клеток кишечника (нитей из специальных белков, находящихся в цитоплазме клеток, их основная функция — сократительная). Таким образом они влияют на барьерную функцию кишечной стенки, что приводит к диарее, нарушению процессов пищеварения и обмена биологически активных веществ.
Выявлена способность бластоцист стимулировать выработку провоспалительных цитокинов клетками толстого кишечника (ИЛ-8, гранулоцитарно-макрофагальный колониестимулирующий фактор), которые играют роль в развитии ревматоидного артрита.
Классификация и стадии развития бластоцистоза
Единой официально принятой классификации бластоцистоза не существует, обобщённо можно представить следующую градацию:
По клинической форме:
- Манифестная (с симптомами):
- типичная (с проявлениями желудочно-кишечных расстройств);
- атипичная (с поражениями кожи и суставов).
- Субклиническая (проявления болезни минимальны или выражаются только лабораторными изменениями).
- Бессимптомная ("неактивное" паразитоносительство).
В Международной классификации болезней 10-го пересмотра (МКБ-10) о бластоцистозе нет информации. Однако заболевание можно отнести к группе А07 — Другие протозойные кишечные болезни.
Осложнения бластоцистоза
- Белково-энергетическая недостаточность (гипо- и авитаминоз, снижение веса, анемия и др.).
- Развитие дисбиотического состояния кишечника (стойкое нарушение количества, состава и функционирования нормальной флоры кишечника).
- Артрит — дискомфорт и боли в суставах. — зудящие обширные высыпания на теле.
- Появление и обострение генетически обусловленных заболеваний кожи (атопический дерматит, псориаз и др.). В данном случае бластоцисты выступают как провоцирующий фактор [3][4][12][14] .
Диагностика бластоцистоза
Для верной диагностики важно целенаправленно определить бластоцисты в биологическом материале. Врач принимает решение, являются ли именно они причиной симптомов у конкретного человека: часто симптомы обнаруживаются в ассоциации с другими патогенами или имеется сопутствующая патология неинфекционного характера.
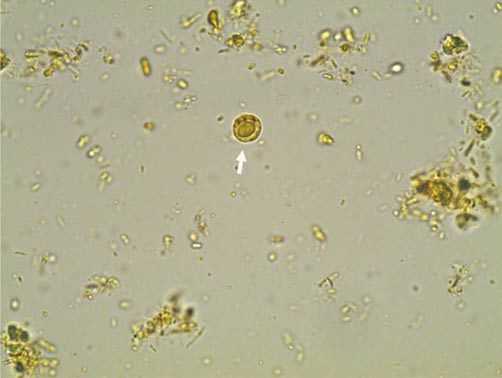
- ПЦР диагностика (выявление бластоцист в кале путём молекулярно-генетической детекции). Достаточно надёжный и чувствительный метод, за одно исследование выявляемость составляет 88 %.
- Посев кала (культивирование бластоцист на средах). Надёжный метод выявления, однако сложен в реализации и коммерчески невыгоден [1][7][12][14] .
Дифференциальная диагностика
- Паразитарные заболевания другой этиологии (лямблиоз, аскаридоз, энтеробиоз, дифиллоботриоз и др.).
- Кишечные инфекции (сальмонеллёз, дизентерия, энтеровирусная, ротавирусная и др.).
- Синдром раздражённого кишечника (при полном отсутствии этиологического фактора кроме питания и стресса).
- Воспалительные заболевания кишечника неинфекцонной природы (болезнь Крона, язвенный колит).
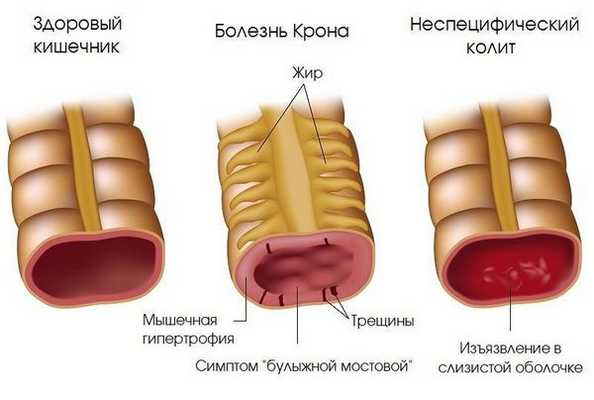
- Заболевания желудка и верхнего отдела кишечника гастроэнтерологического характера (гастрит, дуоденит). (сборное понятие, характеризующееся неустойчивостью стула, дискомфортом в животе различного характера, снижением веса и другими симптомами) [1][4][12][14] .
Лечение бластоцистоза
Терапия бессимптомного носительства в каком-либо медицинском вмешательстве не нуждается. Не стоит заниматься лечением и тем более самолечением при отсутствии симптоматики и сомнении в роли данного микроорганизма в болезни. Нет гарантии, что применение препаратов благотворно скажется на здоровье кишечной экологической системы и организма в целом и не ухудшит проявления заболевания.
При развитии симптомов, в патогенезе которых нельзя исключить роль бластоцист, и подтверждении паразитирования их в кишечнике проводятся следующие мероприятия:
- диета с ограничением сладкого, газообразующего и мучного (улучшает микроклимат кишечника, в какой-то мере лишает бластоцист энергетических запасов, снижает метеоризм);
- противопротозойная терапия. Применяются препараты нитроимидазольной группы, ингибиторов дигидрофолат-редуктазы и некоторые пробиотические дрожжи;
- применение пробиотических препаратов (лактобактерии, бифидобактерии и энтерококки);
- повышение иммунитета кишечника. Применение иммуномодулирующих средств и прямое восполнение дефицита IgA в просвете кишечника.
На сегодняшний день не существует какого-либо препарата или стратегии лечения, позволяющих со 100 % вероятностью избавиться от бластоцист [5] [7] [12] [13] .
Прогноз. Профилактика
При сохранном иммунитете прогноз благоприятный (даже при развитии клинически выраженного заболевания), при иммунодефиците (особенно СПИДе) прогноз серьёзный.
Меры профилактики неспецифичны, их можно разделить на общественно-значимые (социальные) и индивидуальные.
Миелодиспластический синдром
Миелодиспластический синдром – группа гематологических заболеваний, при которых наблюдаются цитопения, диспластические изменения костного мозга и высокий риск возникновения острого лейкоза. Характерные симптомы отсутствуют, выявляются признаки анемии, нейтропении и тромбоцитопении. Диагноз устанавливается с учетом данных лабораторных анализов: полного анализа периферической крови, гистологического и цитологического исследования биоптата и аспирата костного мозга и т. д. Дифференциальный диагноз может представлять значительные затруднения. Лечение – переливание компонентов крови, химиотерапия, иммуносупрессивная терапия, пересадка костного мозга.
Общие сведения
Миелодиспластический синдром – группа заболеваний и состояний с нарушениями миелоидного кроветворения и высоким риском развития острого лейкоза. Вероятность развития увеличивается с возрастом, в 80% случаев данный синдром диагностируется у людей старше 60 лет. Мужчины страдают несколько чаще женщин. У детей миелодиспластический синдром практически не встречается. В последние десятилетия гематологи отмечают увеличение заболеваемости среди лиц трудоспособного возраста. Предполагается, что причиной «омоложения» болезни могло стать существенное ухудшение экологической обстановки.
До недавнего времени лечение миелодиспластического синдрома было только симптоматическим. Сегодня специалисты разрабатывают новые методы терапии, однако эффективное лечение этой группы болезней все еще остается одной из самых сложных проблем современной гематологии. Пока прогноз при миелодиспластическом синдроме, в основном, зависит от особенностей течения болезни, наличия или отсутствия осложнений. Лечение осуществляют специалисты в сфере онкологии и гематологии.
Причины и классификация миелодиспластического синдрома
С учетом причин развития различают два типа миелодиспластического синдрома: первичный (идиопатический) и вторичный. Идиопатический вариант выявляется в 80-90% случаев, диагностируется преимущественно у пациентов старше 60 лет. Причины возникновения установить не удается. В числе факторов риска первичного миелодиспластического синдрома – курение, повышенный уровень радиации при выполнении профессиональных обязанностей или проживании в неблагоприятной экологической зоне, частый контакт с бензином, пестицидами и органическими растворителям, некоторые наследственные и врожденные заболевания (нейрофиброматоз, анемия Фанкони, синдром Дауна).
Вторичный вариант миелодиспластического синдрома наблюдается в 10-20% случаев, может возникать в любом возрасте. Причиной развития становится химиотерапия или радиотерапия по поводу какого-то онкологического заболевания. В число лекарственных средств с доказанной способностью вызывать миелодиспластический синдром включают циклофосфан, подофиллотоксины, антрациклины (доксорубицин) и ингибиторы топоизомеразы (иринотекан, топотекан). Вторичный вариант отличается более высокой резистентностью к лечению, более высоким риском развития острого лейкоза и более неблагоприятным прогнозом.
В современной редакции классификации ВОЗ различают следующие типы миелодиспластического синдрома:
- Рефрактерная анемия. Сохраняется более полугода. В анализе крови бласты отсутствуют либо единичные. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная анемия с кольцевыми сидеробластами. Сохраняется более полугода. В анализе крови бласты отсутствуют. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная цитопения с многолинейной дисплазией. В анализе крови тельца Ауэра отсутствуют, бласты отсутствуют либо единичные, выявляются панцитопения и увеличение количества моноцитов. В костном мозге диспластические изменения менее 10% клеток в 1 миелоидной клеточной линии, бластов менее 5%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-1. В анализе крови тельца Ауэра отсутствуют, бластов более 5%, цитопения и увеличение количества моноцитов. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 5-9%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-2. В анализе крови увеличение количества моноцитов, цитопения, бластов 5-19%, могут выявляться тельца Ауэра. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 10-19%, обнаруживаются тельца Ауэра.
- Неклассифицируемый миелодиспластический синдром. В анализе крови цитопения, бласты отсутствуют либо единичные, тельца Ауэра отсутствуют. В костном мозге дисплазия одного мегакариоцитарного либо гранулоцитарного ростка, бластов более 5%, тельца Ауэра отсутствуют.
- Миелодиспластический синдром, ассоциированный с изолированной делецией 5q. В анализе крови анемия, бластов более 5%, возможен тромбоцитоз. В костном мозге более 5% бластов, тельца Ауэра отсутствуют, изолированная делеция 5q.
Симптомы миелодиспластического синдрома
Клиническая симптоматика определяется степенью нарушений миелопоэза. При мягко протекающих расстройствах возможно длительное бессимптомное или стертое течение. Из-за слабой выраженности клинических проявлений некоторые больные не обращаются к врачам, и миелодиспластический синдром обнаруживается во время проведения очередного медицинского осмотра. При преобладании анемии наблюдаются слабость, одышка, плохая переносимость физических нагрузок, бледность кожных покровов, головокружения и обморочные состояния.
При миелодиспластическом синдроме с тромбоцитопенией возникает повышенная кровоточивость, отмечаются десневые и носовые кровотечения, на коже появляются петехии. Возможны подкожные кровоизлияния и меноррагии. Миелодиспластический синдром с выраженными нейтропенией и агранулоцитозом проявляется частыми простудами, стоматитом, синуситом или стрептодермией. В тяжелых случаях возможно развитие пневмонии или сепсиса. Инфекционные заболевания нередко вызываются грибками, вирусами или условно-патогенными микробами. У каждого пятого пациента с миелодиспластическим синдромом выявляется увеличение лимфоузлов, селезенки и печени.
Диагностика миелодиспластического синдрома
Диагноз выставляется с учетом данных лабораторных исследований: анализа периферической крови, биопсии костного мозга с последующим цитологическим исследованием, цитохимических и цитогенетических тестов. В анализе периферической крови больных миелодиспластическим синдромом обычно обнаруживается панцитопения, реже выявляется дву- или одноростковая цитопения. У 90% пациентов наблюдается нормоцитарная либо макроцитарная анемия, у 60% - нейтропения и лейкопения. У большинства больных миелодиспластическим синдромом отмечается тромбоцитопения.
При исследовании костного мозга количество клеток обычно нормальное либо повышенное. Уже на ранних стадиях обнаруживаются признаки дизэритропоэза. Количество бластов зависит от формы миелодиспластического синдрома, может быть нормальным либо увеличенным. В последующем наблюдаются дисгранулоцитопоэз и дисмегакариоцитопоэз. У некоторых больных признаки дисплазии костного мозга выражены очень слабо. В процессе цитогенетического исследования у ¾ больных выявляются хромосомные нарушения. Дифференциальный диагноз миелодиспластического синдрома проводят с В12-дефицитной анемией, фолиево-дефицитной анемией, апластической анемией, острым миелолейкозом и другими острыми лейкозами.
Лечение и прогноз при миелодиспластическом синдроме
Тактика лечения определяется выраженностью клинической симптоматики и лабораторных изменений. При отсутствии явных признаков анемии, геморрагического синдрома и инфекционных осложнений осуществляется наблюдение. При миелодиспластическом синдроме с выраженной анемией, тромбоцитопенией и нейтропенией, а также при высоком риске возникновения острого лейкоза назначают сопроводительную терапию, химиотерапию и иммуносупрессивную терапию. При необходимости осуществляют пересадку костного мозга.
Сопроводительная терапия является самым распространенным методом лечения миелодиспластического синдрома. Предусматривает внутривенные инфузии компонентов крови. При длительном применении может провоцировать повышение уровня железа, влекущее за собой нарушения деятельности жизненно важных органов, поэтому переливания гемокомпонентов производят при одновременном приеме хелаторов (лекарственных средств, связывающих железо и способствующих его выведению).
Иммуносупрессоры эффективны при лечении миелодиспластического синдрома с отсутствием хромосомных аномалий, наличием гена HLA-DR15 и гипоклеточном костном мозге. Химиотерапию применяют при невозможности трансплантации костного мозга. Высокие дозы препаратов используют при трансформации миелодиспластического синдрома в острый лейкоз, а также при рефрактерных анемиях с избытком бластов при нормоклеточном и гиперклеточном костном мозге, низкие – при невозможности пересадки костного мозга. Наряду с перечисленными средствами пациентам назначают гипометилирующие средства (азацитидин). Наиболее надежным способом достижения полноценной длительной ремиссии является трансплантация костного мозга.
Прогноз зависит от типа миелодиспластического синдрома, количества хромосомных аномалий, необходимости в регулярных переливаниях компонентов крови, выраженности клинических проявлений и наличия осложнений. Различают 5 групп риска. Средняя выживаемость больных миелодиспластическим синдромом, входящих в группу с самым низким уровнем риска, составляет более 11 лет; с самым высоким – около 8 месяцев. Вероятность отторжения костного мозга после трансплантации – около 10%.
Читайте также:
