Генетическая регуляция формирования кишечной трубки
Добавил пользователь Валентин П. Обновлено: 30.01.2026
Общий принцип строения пищеварительной трубки, его особенности в различных отделах.
Источники и эмбриональное развитие пищеварительной трубки.
В состав пищеварительной системы входят пищеварительный тракт и крупные железы, лежащие за пределами этой трубки – печень, поджелудочная железа, крупные слюнные железы. Основная функция пищеварительной трубки (ПВТ) – механическая, химическая, ферментативная обработка пищи, всасывание питательных веществ, используемых в последующем как энергетический и пластический (строительный) материал.
По особенностям строения и функции в пищеварительной трубке выделяют:
Передний отдел – ротовая полость с ее производными (губа, язык, зубы, небо, миндалины и слюнные железы) и пищевод. Функция переднего отдела ПВТ – механическая обработка пищи зубочелюстным аппаратом и формирование пищевого комка. Кроме этого, в ротовой полости начинается расщепление углеводов мальтазой и амилазой слюны; выполняется защитная функция (миндалины образуют глоточное лимфоэпителиальное кольцо; в слюне содержится бактерицидное вещество лизоцим); рецепция вкуса, консистенции и температуры пищи; и глотание и транспортировка пищевого комка в средний отдел ПВТ; участвует в формировании речи.
Средний отдел – является главным отделом ПВТ и включает желудок, тонкий и толстый кишечник, начальный отдел прямой кишки, печень и поджелудочную железу. В среднем отделе происходит химическая, ферментативная обработка пищи, продолжается механическая переработка, происходит полостное и пристеночное пищеварение, всасывание питательных веществ, из непереваренных остатков пищи формируются каловые массы. В составе среднего отдела ПВТ для выполнения защитной функции имеется в значительном количестве лимфоидная ткань, для гормональной регуляции местных функций (синтез и выделение ферментов и гормонов железами, перистальтику ПВТ и т.д.) в составе эпителия имеются одиночные гормонпродуцирующие (АПУД) клетки.
Пищеварительная трубка имеет общий план строения. Стенка ПВТ состоит из 3 оболочек: внутренняя – слизистая оболочка с подслизистой основой, средняя – мышечная, наружная – адвентициальная (рыхлая волокнистая сдт) или серозная (покрыта брюшиной). В каждой оболочке в свою очередь выделяют слои.
Слизистая оболочка состоит из 3 слоев:
а) в переднем отделе ПВТ (ротовая полость и пищевод) эпителий многослойный плоский неороговевающий – выполняет функцию защиты от механических повреждений твердыми частицами пищи;
б) в желудке - однослойный призматический железистый эпителий, погружаясь в собственную пластинку слизистой образует желудочные ямки и железы желудка; эпителий желудка постоянно секретирует слизь для защиты стенки органа от самопереваривания, соляную кислоту и пищеварительные ферменты: пепсин, липазу и амилазу;
в) в тонком и толстом кишечнике эпителий однослойный призматический каемчатый – свое название получил благодаря эпителиальным клеткам – энтероцитам: призматической формы клетки, на апикальной поверхности имеют большое количество микроворсинок (всасывательная каемка) – органоид специального назначения, увеличивают рабочую поверхность клетки, участвуют при пристеночном пищеварении и всасывании питательных веществ.
Этот эпителий погружаясь в подлежащую собственную пластинку слизистой образует крипты – кишечные железы;
г) в конечных отделах прямой кишки эпителий вновь становится многослойным плоским неороговевающим.
собственная пластинка слизистой лежит под эпителием, гистологически представляет собой рыхлую волокнистую сдт. В собственной пластинке слизистой имеются кровеносные и лимфатические сосуды, нервные волокна, скопления лимфоидной ткани. Функции: опорно-механическая (для эпителия), трофика эпителия, транспортировка всасавшихся питательных веществ (по сосудам), защитная (лимфоидная ткань).
мышечная пластинка слизистой – представлена слоем гладкомышечных клеток – миоцитов. Отсутствует в слизистой ротовой полости. Мышечная пластинка слизистой обеспечивает изменчивость рельефа поверхности слизистой оболочки.
Слизистая распологается на подслизистой основе – состоящей из рыхлой волокнистой сдт. Подслизистая основа содержит кровеносные и лимфатические сосуды, нервные волокна и их сплетения, вегетативные нервные ганглии, скопления лимфоидной ткани, а в пищеводе и 12-перстной кишке еще и железы, выделяющие секрет в просвет этих органов. Подслизистая основа обеспечивает подвижность слизистой оболочки по отношению к остальным оболочкам, участвует в кровоснабжении и иннервации органов, обеспечивает защитную функцию. Подслизистая основа в некоторых участках слизистой ротовой полости (спинка языка, десна, твердое небо) отсутствует.
Мышечная оболочка в большей части ПВТ представлена гладкой мышечной тканью, за исключением переднего отдела ПВТ (до средней трети пищевода) и анального отдела прямой кишки (сфинктер) – в этих участках мускулатура из поперечно-полосатой мышечной ткани скелетного типа. Мышечная оболочка обеспечивает продвижение пищевых масс по ПВТ.
Наружная оболочка ПВТ в переднем (до грудной диафрагмы) и заднем отделе (после диафрагмы малого таза) адвентициальная – состоит из рыхлой волокнистой сдт с кровеносными и лимфатическими сосудами, нервными волокнами, а в брюшной полости (желудок, тонкий и толстый кишечник) – серозная, т.е. покрыта брюшиной.
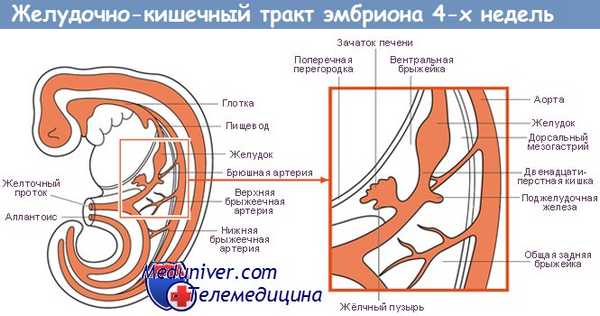
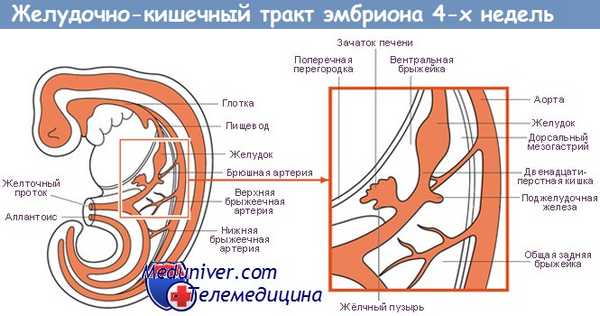
Источники, закладка и развитие ПВТ. В конце 3-й недели эмбрионального развития плоский 3-х листковый зародыш человека сворачивается в трубку, т.е. формируется тело. При этом энтодерма, висцеральный листок спланхнотомов и мезенхима между ними сворачиваясь в трубку образуют I кишку – это замкнутая в краниальном и каудальном конце полая трубка, выстланная снутри энтодермой, снаружи – висцеральным листком спланхнотомов, слоем мезенхимы между ними. В переднем отделе зародыша эктодерма впячиваясь навстречу краниальному слепому концу I кишки образует I ротовую бухту, в каудальном конце зародыша эктодерма впячиваясь навстречу другому слепому концу I кишки образует анальную бухту. Просвет I кишки от полостей этих бухт отграничен соответственно глоточной и анальной мембраной. Энтодерма переднего отдела замкнутой I кишки состоит из клеточного материала бывшей прехордальной пластинки эпибласта, остальные участки энтодермы I кишки – материал гипобласта. В заднем отделе I кишки образуется слепое выпячивание – формируется аллантоис (“мочевой мешок”), являющийся рудиментарным провизорным органом эмбриона человека. Глоточная и анальная мембраны в последующем прорываются и ПВТ становится проточной.
В отношении вопроса, какому уровню ПВТ у взрослого соответствует линия перехода эктодермы ротовой бухты в материал прехордальной пластинки у исследователей единого мнения нет, существуют 2 точки зрения:
Эта граница проходит по линии зубов.
Граница проходит в области заднего отдела ротовой полости.
Трудность определения этой границы объясняется тем, что в дефинитовном организме эпителии (и их производные), развивающиеся из эктодермы ротовой бухты и прехордальной пластинки морфологически не отличаются друг от друга, так как их источники являются частями единого эпибласта и, следовательно, не чужеродны друг к другу.
Граница между эпителиями, развивающегося из материала прехордальной пластинки и из материала гипобласта четко прослеживается и соответствует линии перехода многослойного плоского неороговевающего эпителия пищевода в эпителий желудка.
Из эктодермы ротовой бухты образуется эпителий предверья ротовой полости (согласно 2-ой точки зрения – и эпителий переднего и среднего отдела ротовой полости и его производные: эмаль зубов, крупные и мелкие слюнные железы ротовой полости, аденогипофиз), из энтодермы переднего отдела I кишки (материал прехордальной пластинки) – эпителий ротовой полости и его производные (см. выше), эпителий глотки и пищевода, эпителий дыхательной системы (трахеи, бронхиального дерева и респираторного отдела дыхательной системы); из остальной части энтодермы (материал гипобласта) образуется эпителий и железы желудка и кишечника, эпителий печени и поджелудочной железы; из эктодермы анальной бухты образуется многослойный плоский неороговевающий эпителий и эпителий желез анального отдела прямой кишки.
Из мезенхимы I кишки образуется рыхлая волокнистая сдт собственной пластинки слизистой, подслизистой основы, адвинтициальной оболочки и прослойки рыхлой сдт мышечной оболочки, а также гладкая мышечная ткань (мышечная пластинка слизистой и мышечная оболочка).
Из висцерального листка спланхнотомов I кишки образуется серозный (брюшинный) покров желудка, кишечника, печени и частично поджелудочной железы.
Печень и поджелудочная железа закладываются как выпячивание стенки I кишки, т. е. тоже из энтодермы, мезенхимы и висцерального листка спланхнотомов. Из энтодермы образуются гепатоциты, эпителий желчевыводящих путей и желчного пузыря, панкретоциты и эпителий выводных путей поджелудочной железы, клетки островков Лангерганса; из мезенхимы образуются сдт элементы и гладкая мышечная ткань, а из висцерального листка спланхнотомов – брюшинный покров этих органов.
Энтодерма аллантоиса участвует при развитии переходного эпителия мочевого пузыря.
Генетическая регуляция формирования кишечной трубки
Регуляция специализации энтодермы при формировании желудочно-кишечного тракта у плода
Развитие ЖКТ происходит в три этапа. Первый этап — первичная специализация энтодермы. Второй этап заключается в формировании и структурировании кишечной трубки, что определяет передне-заднюю ось эмбриона и границы между различными органами. На третьем этапе начинается образование органов, которые в процессе развития выходят за границы кишечной трубки, например печени и поджелудочной железы.
В экспериментах на лабораторных животных установлены эволюционно консервативные группы генов, принимающих участие в специализации энтодермы, и ряд других генов, участвующих только в процессе развития ЖКТ позвоночных. Эпителий этого тракта формируется из энтодермы — одного из эмбриональных зародышевых листков, возникающих в процессе гаструляции. Исследования, проведенные на таких лабораторных организмах, как круглые черви (почвенные нематоды Caenorhabdilis elegans), плодовые мушки (род Drosophila), африканские шпорцевые лягушки (род Xenopus), аквариумные рыбки Danio rerio и лабораторные мыши, позволили установить некоторые основные молекулярные механизмы регуляции процесса развития энтодермы. Моделирование на лабораторных мышах, у которых был проведен нокаут определенных генов для исследования их функций, в настоящее время рассматривается в качестве основы для изучения таких заболеваний ЖКТ у человека, как стеноз привратника, различные атрезии, неперфорированный анус.
Специализация энтодермы может быть прослежена на самых ранних стадиях развития эмбриона. В классических экспериментальных исследованиях продемонстрирована способность эксплантатов куриных эмбрионов еще до процесса гаструляции, в культуре, к развитию ЖКТ, что свидетельствует о четкой детерминации процесса уже на данном этапе эмбрионального развития. Энтодерма куриных эмбрионов, выделенная и помещенная в лабораторных условиях в культуру до формирования ЖКТ, характеризуется экспрессией молекулярных маркеров, которые должны в норме появиться in vivo, что свидетельствует о наличии феномена ранней специализации.
Появляются доказательства в поддержку гипотезы, что отличительные особенности энтодермы обусловлены функциональной клеточной независимостью, однако для нормального развития органов необходимо тесное взаимодействие энтодермы и мезодермы. В настоящее время на многочисленных лабораторных организмах установлены целые группы генов, способствующих специализации энтодермы. Один класс генов кодирует факторы транскрипции, которые, в свою очередь, непосредственно активируют гены-мишени. Второй класс генов кодирует синтез сигнальных молекул, обеспечивающих процесс межклеточной кооперации. Как минимум несколько факторов транскрипции, участвующих в процессе специализации энтодермы, продолжают экспрессироваться в тканях ЖКТ в течение всего последующего его развития, например семейства генов Fox и факторов GATA (семейство факторов транскрипции, характеризующихся способностью связываться с фрагментом дезоксирибонуклеиновой кислоты (ДНК) и с GATA-последовательностью нуклеотидов).
В регуляции развития ЖКТ принимают участие, действуя в строго определенное время в различных локусах, сигнальные пути, или механизмы передачи регуляторных стимулов внутри клетки через определенную цепь молекул-посредников, представители группы факторов роста — трансформирующие факторы роста b в том числе непосредственно трансформирующий фактор роста b (TGF-b), и белок морфогенеза костной ткани (BMP), а также сигнальные пути hedgehog (сигнальные системы млекопитающих, представленные тремя различными белками). Продемонстрировано, что фактор транскрипции Sox-17 играет крайне важную роль в развитии энтодермы у мышей на ранних этапах эмбриогенеза, однако роль Sox-17 в дальнейшем не установлена. В последнее время выявлено, что сигнальный путь Notch (рецепторзависимый латентный фактор транскрипции, локализованный в клеточной цитоплазме) также выполняет важную функцию в регуляции развития ЖКТ.
До настоящего времени не удалось выяснить, существует ли «главный ген», запускающий формирование энтодермы и последующее развитие ЖКТ. При исследовании некоторых животных моделей установлены гены, присутствие которых является необходимым и в то же время достаточным условием для формирования энтодермы, например ген mixer у шпорцевых лягушек. Ген мышей mixl1 играет основную роль в дифференцировке эмбриональных клеток в энтодерму. У других лабораторных животных обнаружены гены, необходимые для обеспечения данного процесса, однако недостаточные для формирования полноценной энтодермы.
В исследованиях на лабораторных животных установлены начальные этапы индукции образования энтодермы. Энтодерма у мышей формируется из передней части первичной полоски эпибласта. Ключевой регулятор ранних этапов развития энтодермы — nodal-лиганд факторов роста суперсемейства TGF-b. Nodal экспрессируется в расположенном в бластодерме организационном центре или в узелке первичной бороздки эмбриона мыши. В отсутствие экспрессии nodal эмбрионы мыши не способны к гаструляции или к формированию дифинитивной энтодермы. Аналогично у эмбрионов Danio rerio в отсутствие экспрессии гомологов nodal также не образуется энтодерма. Напротив, экспрессия функционально активных рецепторов к TGF-b способствует преобразованию эмбриональных клеток в энтодерму. Реализация сигнального пути TGF осуществляется посредством стабильного комплекса промежуточных белков Smad.
Необходимым для развития энтодермы является белок Smad2, и нокаут этого белка приводит к нарушению формирования энтодермы задней кишки, а разные мутации в гене, кодирующем Smad2, вызывают различные аномалии передней/головной кишки. FoxA2 также играет важную роль в развитии энтодермы, являясь мишенью сигнального пути, запущенного фактором nodal через белок Smad2. Smad2 и Smad3 совместно регулируют процесс развития энтодермы у мышей, оказывая различное влияние на формирование передней кишки и задней кишки. Кроме того, сигнальная система Smad необходима для развития печени. Основную роль в формировании печени играет ген Hex, экспрессия которого отсутствует либо существенно снижена при нарушенной продукции белков Smad.
Этапы развития желудочно-кишечного тракта у плода
Установлено, что энтодерма находится в тесном контакте с мезодермой на протяжении всего ЖКТ. В экспериментальных исследованиях, выполненных на культурах тканей, было показано, что формирование энтодермы и ее дифференцировка в отдельные органы представляет собой результат взаимодействия мезодермы и энтодермы. Раньше всего было показано, что для формирования переднезадней оси энтодермы мышей необходимо сигнальное воздействие мезодермы на энтодерму посредством фактора роста фибробластов (FGF).
Другие члены семейства FGF и рецепторы к ним необходимы для формирования печени. Еще три семейства генов крайне необходимы в процессе взаимодействия мезодермы и энтодермы — гены, кодирующие факторы сигнальных путей hedgehog и BMP, гены box.
У почвенной нематоды Caenorhabditis elegans для специализации клеток, из которых развивается кишечный эпителий, необходимы два гена, кодирующие факторы транскрипции GATA, в то время как фактор GATA у плодовых мушек рода Drosophila кодируется одним геном serpent, наличие которого нужно для дифференцировки кишечной энтодермы. В кишечнике позвоночных экспрессируются три фактора группы GATA. Предполагается, что в процессах пролиферации и дифференцировки кишечного эпителия факторы GATA4, -5 и -6 выполняют различные функции, однако их функциональное значение на ранних этапах развития кишечной трубки у млекопитающих пока не установлено. Помимо факторов GATA, представители семейства forkhead-related факторов (кодируемые генами Fox) и сигнального пути WNT/Tcf являются важными регуляторами развития энтодермы.
У позвоночных важную роль в инициации формирования энтодермы играют представители суперсемейства TGF-b. Молекула цитоскелета ELF3 задействована в сигнальном пути через факторы TGF-P, а также необходима для развития энтодермы. В отсутствие гена, кодирующего ELF3, у мышей полностью отсутствует кишечная энтодерма.
Многочисленные факторы транскрипции, первоначально считавшиеся специфическими для формирования печени, играют роль и в развитии кишечника. При изучении эмбрионов мыши было отмечено, что некоторые из факторов транскрипции имеют характерные паттерны экспрессии, что позволило предположить их участие в развитии кишечника. Например, нуклеарный печеночный фактор (HNF) 3b (сейчас известный как FoxA2) оказался важным элементом в процессе самых ранних этапов дифференцировки ЖКТ и продолжает экспрессироваться в производных энтодермы у взрослых. Гомозиготные мутанты с полным отсутствием HNF3b не способны к формированию первичной полоски, предшествующей образованию кишечной трубки и ряда других структур. HNF3b участвует в образовании передней и средней, но не задней кишки.
Идентифицировано большое количество факторов семейства Fox, некоторые из которых характеризуются преимущественной или специфической экспрессией в кишечнике. Один из представителей данного семейства, Foxl1, в норме экспрессируется кишечной мезодермой и представляет собой основной медиатор взаимодействия между эпителием и мезенхимой. Отсутствие указанного фактора сопровождается патологической пролиферацией эпителиальных клеток и нарушением развития кишечника. Этот фактор действует через экспрессию протеогликанов, проявляющих себя как корецепторы к компонентам сигнального пути WNT, и таким образом активирует комплекс WNT/P-катенин, регулирующий пролиферацию клеток. Группа исследователей во главе с Zaret предложила модель, в которой факторы FoxA2 и GATA открывают ДНК в клетках энтодермы, обеспечивая ее доступность для последующего связывания с факторами транскрипции, регулирующими клеточно-специфические гены. Таким образом, вероятно, при развитии кишечника многочисленные представители семейства факторов Fox играют важную роль в этом сложном процессе, который окончательно не изучен.
У мышей некоторые гены, гомологичные гену caudal у дрозофил, экспрессируются исключительно в кишечнике. Cdx-1, экспрессирующийся в кишечнике взрослых организмов, также широко экспрессируется в тканях развивающегося эмбриона. Другой ген, Cdx-2, экспрессируется в висцеральной энтодерме на ранних стадиях эмбрионального развития, но впоследствии его паттерн экспрессии ограничен исключительно кишечником. Чрезмерная экспрессия Cdx-2 приводит к дальнейшей дифференцировке популяции клеток кишечника, которые в норме должны оставаться недифференцированными. В то же время эктопическая экспрессия Cdx-2 в стенке желудка приводит к формированию ткани, аналогичной кишечнику. Cdx-2 представляет собой важный фактор дифференцировки кишечника, однако до настоящего времени его роль в формировании кишечной трубки на ранних стадиях эмбрионального развития точно не установлена.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Органогенез — это формирование органов у эмбриона
Во время эмбрионального развития образуются три зародышевых слоя, известных как эндодерма, мезодерма и эктодерма. Эти зародышевые слои дают начало различным частям развивающегося организма: эндодерма формирует желудочно-кишечный тракт и связанные с ним органы, мезодерма формирует мышцы и скелет, а также сердечно-сосудистые органы и мочеполовые органы, а эктодерма формирует эпидермис и нервные ткани.
Процесс органогенеза – это формирование органов в процессе эмбрионального развития. Это скоординированное событие, включающее миграцию и дифференцировку клеток с образованием “первичного”, которое в дальнейшем развивается, а также подвергается гистогенезу до полного формирования органа.
Как эндодерма развивается в органы?
Эндодерма – это зародышевой слой, который развивается в желудочно-кишечном тракте и железах, а также в других органах, которые ответвляются от желудочно-кишечного тракта.
Образование “кишечной трубки”
Как в эндодерме, так и в мезодерме трубка формируется из плоского листа клеток. Для формирования кишечной трубки клетки эндодермы образуют передний кишечный портал (AIP), складку в форме полумесяца, возникающую из передней части развивающегося эмбриона.
AIP и CIP встречаются в желточном мешке, где клетки с переднего конца эмбриона образуют часть ростральной кишечной трубки до желточного мешка, а клетки с заднего конца образуют часть кишечной трубки, каудальную до желточного мешка. Они образуют вентральную часть кишечной трубки, а вентральная часть кишечной трубки образована клетками в средней линии эндодермы. Исследования на мышах показали, что GATA4 является важным фактором транскрипции в формировании кишечной трубки.
Формирование органов
Как только кишечная трубка сформирована, клетки начинают набухать, распускаться и сворачиваться, образуя железы и органы: это включает щитовидную и паращитовидную железы, тимус, легкие, печень и поджелудочную железу.
Первый процесс – это утолщение эпителиального слоя, который затем может либо отпочковаться и мигрировать из кишечной трубки в мезенхимальные клетки (железы, образованные из ветвистых дуг, т. е. щитовидной железы), либо оставаться соединенным с кишечной трубкой протоком (печень, желчный пузырь, поджелудочная железа). Как только положение этих органов и желез определяется изменениями в эпителиальном слое, упомянутыми выше, такие процессы, как пролиферация/гибель клеток, адгезия и подвижность, работают на формирование органов.
Формирование сердца и сердечной трубки
Сердце возникает из мезодермы и является первым органом, который полностью функционирует у эмбриона. Процесс, посредством которого формируется сердце, сохраняется у всех позвоночных животных: образование сердечной трубки, петля справа и удлинение сердечной трубки и образование сердечных камер и клапанов.
Как и в случае с органами, полученными из эндодермы, первым процессом в формировании сердца является формирование сердечной трубки. Клетки-предшественники мигрируют латерально, что создает переднюю латеральную мезодерму. Дифференцировка и спецификация сердца происходит в этой области, более конкретно в передней боковой спланхнической мезодерме. Это осуществляется с помощью ряда сигнальных молекул, включая фактор транскрипции GATA4, и приводит к образованию сердечного полумесяца. По мере закрытия передней части происходят изменения, так что сердечный полумесяц меняет форму сердечной трубки, образованной внутренним эндокардиальным слоем и наружным слоем миокарда.
После формирования сердечная трубка поворачивается вправо – это первый случай, когда в эмбрионе устанавливается ось справа налево. Это сопровождается увеличением длины сердечной трубки, обусловленным добавлением клеток-предшественников сердца, а не пролиферацией клеток.
Формирование сердечных камер
Контролируемая экспрессия ряда генов приводит к образованию сердечных камер: “раздувающийся морфогенез” закольцованной сердечной трубки приводит к росту внешней кривизны, которая в конечном итоге сформирует сердечные камеры. Отчасти это происходит за счет поддержания более низких темпов роста во внутреннем цикле.
Перегородка и формирование клапанов сердца
Наряду с сердечными камерами также разрабатывается “сердечная подушка”, которая развивается в сердечные клапаны. Еще одной стадией развития сердца, необходимой для жизни, является разделение легочного и системного кровообращения, и это достигается образованием перегородок внутри сердца. Вкратце, это происходит путем слияния межжелудочковой перегородки, тракта оттока, межжелудочковой перегородки и межпредсердной перегородки.
Генетическая регуляция формирования органов желудочно-кишечного тракта
У плодовых мушек Drosophila экспрессируются многочисленные гомеобоксные гены в строгом соответствии с переднезадней осью тела. Гомеобоксные гены содержат консервативную последовательность ДНК гомеобокс и регулируют процессы деления клеток и формирования ряда структур. У позвоночных гены hox, гомологичные гомеобоксным генам плодовых мушек Drosophila, играют важную роль в формировании зон головного мозга и скелета.
У позвоночных существуют четыре группы генов box — а, b, с и d, формирующие сходные группы гомологов, в частности hox а-1, hox b-1 и hox d-1. Гены каждой из групп экспрессируются в строгой последовательности в направлении от головных к каудальным сегментам развивающегося эмбриона с перекрыванием зон их экспрессии. Например, hox а-1 экспрессируется в головных, a hox а-11 — в каудальных сегментах эмбриона.
При детальном исследовании развивающейся задней кишки куриных эмбрионов установлена взаимосвязь между сегментами с экспрессией hox а-9, hox а-10, hox а-11 и hox а-13 в мезодерме и формированием границ анатомических структур. Также установлены локальные различия в паттернах экспрессии гомеобоксных генов в развивающейся кишке эмбрионов мыши.
Отклонения от нормального паттерна экспрессии генов hox приводят к возникновению органоспецифических аномалий развития ЖКТ. Нарушения экспрессии hox с-4 сопровождаются развитием обструкции пищевода вследствие патологической пролиферации эпителиальных клеток и аномального развития мышечного слоя этого органа. Смещение паттерна экспрессии hox с-8 на сегменты, расположенные ближе к головному концу, приводит к аномалиям формирования желудочного эпителия.
Отсутствие экспрессии мезенхимного hox а-5 сочетается с изменениями фенотипа эпителиальных клеток желудка. У мышей с нарушением паттернов экспрессии hox d-12 и hox d-13 отмечают аномалии развития мышц заднего прохода. Делеция комплекса генов hox d (hox d-4, hox d-8, hox d-9, hox d-10 и hox d-11) сочетается с отсутствием илеоцекальной заслонки. У человека экспрессия гомологичных гомеобоксных генов также характеризуется специфичностью паттернов для различных сегментов развивающегося эмбриона. Представленные данные свидетельствуют о важной роли генов hox в формировании паттернов органов вдоль переднезадней оси тела эмбриона.
Появление эктопических паттернов экспрессии генов hox у цыплят изменяет морфологию кишечника. Так называемые каудальные, или хвостовые, гены обширного семейства гомеобоксных генов hox определяют переднюю границу паттернов экспрессии генов hox, участвуют в развитии ЖКТ. Почти все исследованные гены hox экспрессируются в мезодермальной ткани, воздействуя на развитие энтодермы, вероятно при взаимодействии эпителия и мезенхимы.
Желудок впервые выявляется в виде утолщения мезодермальной пластинки. На ранних стадиях формирования его паттерна ВМР-4 экспрессируется всей мезодермой. Shh экспрессируется энтодермой и регулирует экспрессию ВМР-4. Паттерн экспрессии ВМР-4 регулирует рост мезодемы желудка и определяет его положение во фронтальной плоскости по отношению к центру тела.
Расположение сфинктера привратника определяется паттернами экспрессии ВМР-4 и его ингибиторов. Сигнальная система факторов BMP независимо регулирует гены Sox9 и Nkx2.5, определяющие развитие пилорического сфинктера. Формирование концентрических мышечных слоев определяется сигнальным путем Shh, приводящим к образованию базальной мембраны и подслизистого слоя, одновременно препятствуя развитию гладкомышечных волокон и кишечных нейронов в непосредственной близости к энтодерме.
Учебное видео по развитию желудочно-кишечного тракта (эмбриогенезу)
Генетический контроль и регуляция генной активности на примере лактозного оперона кишечной палочки.
Лактозный оперон (lac оперон) — полицистронный оперон бактерий, кодирующий гены метаболизма лактозы.
Регуляция экспрессии генов метаболизма лактозы у кишечной палочки (Escherichia coli) была впервые описана в 1961 году учеными Ф. Жакобом и Ж. Моно (получившими в 1965 году Нобелевскую премию совместно с А. Львовым). Бактеральная клетка синтезирует ферменты, принимающие участие в метаболизме лактозы, лишь в том случае, когда лактоза присутствует в окружающей среде и клетка испытывает недостаток глюкозы.
Структура. Лактозный оперон (lac operon) состоит из трех структурных генов, промотора, оператора и терминатора. Принимается, что в состав оперона входит также ген-регулятор, который кодирует белок-репрессор.
Структурные гены лактозного оперона — lacZ, lacY и lacA:
lacZ кодирует фермент β-галактозидазу, которая расщепляет дисахарид лактозу на глюкозу и галактозу,
lacY кодирует β-галактозид пермеазу, мембранный транспортный белок, который переносит лактозу внутрь клетки.
lacA кодирует β-галактозид трансацетилазу, фермент, переносящий ацетильную группу от ацетил-КoA на бета-галактозиды.
Для катаболизма лактозы необходимы только продукты генов lacZ и lacY, роль продукта гена lacA не ясна.
Регуляция. РНК-полимераза начинает транскрипцию с промоторного района, который перекрывается с операторным районом. В отсутствие или при низкой концентрации лактозы в клетке белок-репрессор, который является продуктом моноцистронного оперона LacI, обратимо соединяется с операторным районом и препятствует транскрипции. Таким образом, в отсутствие лактозы в клетке ферменты для метаболизма лактозы не синтезируются.
Даже в случае, когда в плазматической мембране клетки отсутствует фермент β-галактозидпермеаза, лактоза из окружающей среды может попадать в клетку в небольших количествах. В клетке две молекулы лактозы связываются с белком-репрессором, что приводит к изменению его конформации и далее к диссоциации белка-репрессора от операторного участка. Может осуществляться транскрипция генов лактозного оперона. При снижении концентрации лактозы новые порции белка-репрессора взаимодействуют с операторными последовательностями и препятствуют транскрипции. Данный механизм регуляции активности лактозного оперона называют позитивной индукцией. Веществом-индуктором служит лактоза; при её связывании с белком-репрессором происходит его диссоциация от операторного участка.
Если в клетке концентрация глюкозы достаточная для поддержания метаболизма, активация лактозного оперона не происходит. Промоторная последовательность лактозного оперона «слабая», поэтому даже при отсутствии белка-репрессора на операторном участке транскрипция практически не инициируется. Когда концентрация глюкозы в клетке снижается, происходит активация фермента аденилатциклазы, которая катализирует превращение АТФ в циклическую форму — цАМФ (циклическую форму АМФ в данном случае также называют «сигналом клеточного голода»). Глюкоза является ингибитором фермента аденилатциклазы и активирует фосфодиэстеразу — фермент, катализирующий превращение молекулы цАМФ в АМФ. цАМФ соединяется с белком, активирующим катаболизм (англ. САР, catabolism activating protein), при этом образуется комплекс, который взаимодействует с промотором лактозного оперона, изменяет его конформацию и приводит к повышению сродства РНК-полимеразы к данному участку. В присутствии лактозы происходит экспрессия генов оперона. Данный механизм регуляции активности лактозного оперона называют негативной индукцией. «Негативным индуктором» служит глюкоза, которая подавляет активность лактозного оперона.
Итак, ферменты для усвоения лактозы синтезируются в клетке кишечной палочки при двух условиях: 1) наличие лактозы; 2) отсутствие глюкозы. Регуляция работы лактозного оперона в зависимости от концентрации лактозы происходит по принципу отрицательной обратной связи: чем больше лактозы — тем больше ферментов для её катаболизма (положительная прямая связь); чем больше ферментов — тем меньше лактозы, чем меньше лактозы — тем меньше производится ферментов (двойная отрицательная обратная связь).
Биологический смысл. Благодаря описанному механизму регуляции транскрипции генов, входящих в состав лактозного оперона, бактерии оптимизируют энергетические затраты, синтезируя ферменты метаболизма лактозы не постоянно, а лишь тогда, когда клетке это необходимо. Сходный механизм регуляции имеется у большинства прокариот; у эукариот он устроен значительно сложнее.
Читайте также:
