Изъязвление опухолей пищевода. Злокачественные лимфомы пищевода
Добавил пользователь Владимир З. Обновлено: 08.01.2026
Изъязвление опухолей пищевода. Злокачественные лимфомы пищевода
Опухоли пищевода часто изъязвляются. Величина кратера и его форма варьируют в зависимости от размеров и характера изъязвления опухоли. При этом ниши имеют ряд особенностей: продольный размер ниши больше ее поперечника и глубины, изъязвление располагается ближе к нижнему краю опухоли, имеет неправильной формы бухтообразные очертания, обычно не выводится за пределы контура пищевода. Инфильтративный опухолевый вал вокруг ниши объемен, вытянут в продольном направлении, имеет неровные, фестончатые, «размытые» края.
Сравнительно редко (при блюдцеобразном раке) ниша располагается почти в центре дефекта наполнения, а форма ее может приближаться к округлой. Однако и в этих случаях она отличается от пептической язвы небольшой глубиной, неровной поверхностью дна кратера и более массивным инфильтративным (опухолевым) валом у основания.
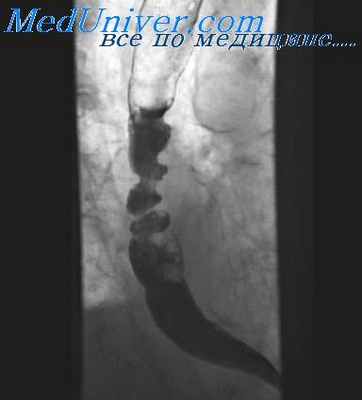
Для определения наружной границы опухоли и ее отношения к окружающим тканям, а также выявления метастазов в лимфатические узлы средостения прибегают к исследованию пищевода в условиях пневмомедиастинума. Эффективность пневмомедиастинографии значительно повышается, если она выполняется в сочетании с томографией в сагиттальной и фронтальной- проекциях, а при локализации опухоли в абдоминальном сегменте пищевода — и с введением газа в брюшную полость (пневмоперитонеум). Еще увереннее эти вопросы решаются при компьютерной томографии средостения, выполняемой на уровне поражения пищевода. Остающиеся дифференциально-диагностические трудности обычно преодолеваются с помощью эзофагоскопии с биопсией.
Дефект наполнения и сужение дистального отдела пищевода могут быть обусловлены ретроградным желудочно-пищеводным пролапсом (инвагинация) слизистой оболочки и более глубоких слоев желудка [Соколов Ю. Н., Усова А. Н., 1966; Антонович В. Б., 1971; Кевеш Л. Е., 1970; Fagan, Palmer, 1963], нередко сочетающимся с грыжей пищеводного отверстия диафрагмы, пептической язвой или даже раком нижнего отдела пищевода. Изменчивость рентгенологической картины в процессе исследования вплоть до полного исчезновения дефекта наполнения (релапс слизистой оболочки желудка), устанавливаемая на серии прицельных рентгенограмм или при видеомагнитной записи изображения, и отсутствие ригидности стенок и разрушения складок в области пищеводно-желудочного перехода позволяют исключить опухоль этой локализации.
Злокачественные лимфомы. Поражение пищевода при некоторых злокачественных заболеваниях лимфоидной ткани наблюдается очень редко, обычно при генерализации процесса. Процесс, начавшись в лимфатических узлах средостения, может прорастать стенку пищевода либо переходить на нее лимфогематогенным путем. Описано также первичное (изолированное) его поражение, которое чаще рассматривается как первое (раннее) проявление системного заболевания. Макроскопические проявления злокачественных лимфом пищеварительного тракта отличаются большим многообразием. В практической же работе обычно ограничиваются выделением трех форм: инфильтративной, узловатой, или опухолевидной, и смешанной [Соколов Ю. Н., 1972; Вознюк Е. И., Кичерман А. П., 1972, и др.].
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Опухоли пищевода

Встречаются редко, протекают бессимптомно до определенных размеров, могут выявляться как случайная находка при рентгенологическом исследовании или фиброгастродуоденоскопии. Опухоли могут расти преимущественно в просвет (экзофитные эпителиальные опухоли, полипы) или интрамурально (эндофитные, неэпителиальные опухоли).
Внутрипросветные или эпителиальные:
1. Папиллома (из многослойного плоского эпителия пищевода) — единичные или множественные папилломы имеют четкие, ровные или бугристые контуры с характерным внутренним рельефом (сосочковый, бородавчатый или шагреневый). Иногда выступающие в просвет пищевода папилломы напоминают цветную капусту. Опухоли растут на ножке или широком основании. Врожденные папилломы (папиллярная фиброма из эктопированных клеток) чаще выявляются в раннем возрасте, приобретенные обычно развиваются на фоне хронического эзофагита
2. Аденома (аденоматозные полипы) — из железистого эпителия или в нижней трети пищевода — из эктопированных участков слизистой желудка; чаще встречается в абдоминальном отделе пищевода; бывает на ножке, на широком основании, имеет гладкую поверхность ярко-розового цвета; на длинной ножке — флоттирующая папиллома.
Внутрипросветные опухоли могут осложниться кровотечением.
Опухоли имеют высокий процент малигнизации, поэтому их необходимо удалять.
Внутристеночные, или интрамуральные, являются подслизистыми, выявляются тогда, когда опухоль больших размеров, происходит выбухание слизистой:
• лейомиомы (75% от общего числа внутристеночных опухолей) ;
Внутристеночные опухоли могут осложняться кровотечением, изъязвляться, нарушать нормальную проходимость пищевода вплоть до субстеноза, малигнизироваться.
Лейомиома пищевода — доброкачественная опухоль, которая выявляется в виде выбухающего в просвет округлого образования на широком основании с гладкой поверхностью и четкими границами, которая при инструментальной «пальпации» имеет плотноэластичную консистенцию и легко смещается. Лейомиомы растут в плотно-эластичной капсуле, рост медленный, слизистая оболочка под опухолью хорошо смещается, подвижна (это очень важный диагностический симптом). Как правило, слизистая над образованием не изменена, но в ряде случаев слизистая над опухолью может воспаляться вплоть до эрозирования и изъязвления. При выявлении лейомиомы, если слизистая над опухолью не изменена, биопсия не рекомендуется.
Наблюдать через полгода и впоследствии 1 раз в год в зависимости от характера дисплазии, если производилась биопсия слизистой оболочки, покрывающей опухоль, так как при этом возрастает риск малигнизации.
Если опухоль растет, нарушает проходимость пищевода, изъязвляется, осложняется кровотечением, показано оперативное лечение.
Липома пищевода — размерами до 10 мм, имеет вид уплощенного образования с фестончатыми краями серо-желтого цвета.
Злокачественные опухоли пищевода
Рак пищевода встречается у 5% больных злокачественными опухолями.
Преобладают мужчины пожилого и старческого возраста (80% пациентов старше 60 лет). На долю аденокарциномы приходится 5-10% злокачественных опухолей, а более 90% всех злокачественных опухолей пищевода являются плоскоклеточным раком.
К предрасполагающим факторам относят курение, злоупотребление алкоголем, особенности питания (горячая, жирная пища, копчености), ахалазию кардии, гастроэзофагеальную рефлюксную болезнь, стриктуры, полипы, дивертикулы пищевода.
Эзофагоскопия с биопсией имеет ключевое значение в диагностике злокачественных опухолей пищевода, в том числе для выявления ранних признаков рака и морфологической верификации диагноза.
Ранними эндоскопическими признаками рака пищевода являются локальное утолщение и ригидность стенки, сглаженность складки или складок, выявление участка измененного цвета, контактное кровотечение.
Раки пищевода могут расти как экзофитно, так и эндофитно или иметь смешанный рост.
Для экзофитной формы рака пищевода характерны раковые узлы с неровными краями и грубой поверхностью, на которой наблюдаются кровоточащие изъязвления, некротические массы и фибринозные налеты, сужение просвета. Нередко опухоль изъязвляется и имеет вид кратера с распадом в центре, плотными и ригидными краями.
При эндофитном росте наблюдаются стенозирующий (характерны циркулярное сужение просвета пищевода с ригидными стенками, сглаженность складок, измененная окраска с цианотичным оттенком и контактной кровоточивостью) и инфильтративно-язвенный (сопровождается также плоскими кровоточащими изъязвлениями, создающими картину «рваного рельефа») варианты опухоли.
Во всех случаях выявления злокачественных опухолей пищевода необходима множественная биопсия, особенно на границе опухоли со здоровыми тканями.
Аденокарцинома эндоскопически выглядит следующим образом:
• мозговидно-язвенная форма имеет вид бугристых образований серо-желтого цвета или узлов, похожих на цветную капусту, с геморрагиями и очагами некроза на поверхности; опухоль обычно распространяется вдоль пищевода и деформирует его просвет, имеет тенденцию быстро изъязвляться, а при инструментальной «пальпации» и биопсии определяется ригидность образующих опухоль тканей;
• сосочковая форма представлена разрастающимися полиповидными образованиями красного цвета, деформирующими просвет пищевода; при инструментальной «пальпации» и биопсии ткани опухоли мягкие, отделяются крупными фрагментами, легко и обильно кровоточат;
• фунгоидная, или грибовидная, форма представляет собой одиночный сплющенный узел на широком основании;
• язвенная форма выявляется как язва неправильной формы с несколько приподнятыми и изъязвленными краями, дно язвы неровное, с серо-грязным налетом; при инструментальной «пальпации» и биопсии определяется ригидность дна, краев язвы и периульцерозной зоны.
Плоскоклеточные ороговевающие или базально-клеточные раки обычно растут эндофитно, подслизисто, равномерно циркулярно суживая просвет пищевода, стенка в зоне опухолевого роста ригидная, имеет белесый оттенок, легко контактно ранима, кровоточит.
ЭНДОСКОПИЧЕСКАЯ КЛАССИФИКАЦИЯ РАКА ПИЩЕВОДА
1. Ранний рак пищевода. Его обнаружение зависит от оценки изменений цвета. И белые, и красные пятна могут быть первым проявлением небольшого рака.
Выделяются следующие типы:
а) белый — приподнятый;
б) красный — эрозивный;
в) смешанный — эрозивный и приподнятый;
г) скрытый (диагностируется только с помощью окрашивания).
2. Более поздние стадии рака пищевода
а) полиповидный «злокачественный полип»;
б) язвенная форма («злокачественное изъязвление»).
• Рак более поздних стадий, неклассифицируемый.
По данным В. Т. Ивашкина и соавт. при эндоскопии рак пищевода I стадии выглядит как небольшое выбухание слизистой оболочки. У больных II стадией рака отмечается ригидность стенки пищевода — она остается неподвижной не только под влиянием пульсаций сердца, аорты,
дыхательных движений, но и при инструментальной «пальпации». Рак III и IV стадии выглядит как бугристая сероватая масса, легко кровоточащая при инструментальной «пальпации». При развитии распада виден кратер с подрытыми краями. Рекомендуется брать биопсийный материал
из не менее чем 5-6 мест из краев кратера.
Саркомы пищевода встречаются в 200 раз реже рака и составляют 8% сарком пищеварительного тракта; эндоскопически делятся на экзоэзофагеальные, интрамуральные (инфильтрирующие), эндоэзофагеальные. Наиболее частыми видами саркомы являются изолированный лимфогранулематоз, ретикулосаркома и лимфосаркома (злокачественные лимфомы), имеющая очаговую и диффузную формы. Реже встречаются фибросаркомы, миосаркомы, меланосаркомы и другие виды сарком.
Саркома пищевода мало отличима от рака, ей более свойственны плоские и многочисленные изъязвления, мягкость консистенции, сохраненная эластичность стенок, меньшая контактная кровоточивость, большая протяженность поражения, отсутствие супрастенотического расширения, яркость цвета.
Более точный ответ дают биопсия и цитологическое исследование биоптата.
Опухоли пищевода могут осложняться кровотечением, нарушением проходимости (стенозом), пенетрацией, перфорацией.
Опухоли пищевода
Опухоли пищевода – доброкачественные и злокачественные новообразования, возникающие из различных слоев пищеводной стенки. Клинически проявляются нарушением глотания, рвотой и отрыжкой, болями и тяжестью за грудиной, ощущением комка в горле, кашлем, исхуданием, анемией. В диагностике используются рентгенография пищевода с контрастированием, эзофагоскопия, эндоскопическая биопсия, обзорная рентгенография органов грудной клетки, МРТ и КТ органов грудной клетки. Лечение доброкачественных опухолей пищевода только хирургическое, злокачественных – комплексное (оперативное, лучевая и полихимиотерапия).
Общие сведения
За термином «опухоли пищевода» практически всегда скрывается рак, так как доброкачественные новообразования этого органа встречаются чрезвычайно редко. В литературе по гастроэнтерологии описано примерно 400 случаев выявления доброкачественных опухолей пищевода, в подавляющем большинстве у мужчин в возрасте около 40 лет. Злокачественные новообразования встречаются намного чаще – рак пищевода занимает седьмое место среди всех опухолей, а по уровню смертности – третье (после онкологических заболеваний легких и желудка). Общая распространенность данного заболевания – 5-6%. Средний возраст выявления онкологии пищевода составляет 60-65 лет. Замечено, что в странах с высокой распространенностью эзофагеального рака имеется тенденция к омоложению этой патологии, выравниванию различий по полу (мужчины и женщины болеют одинаково часто). В последние десятилетия в России отмечается некоторое снижение заболеваемости новообразованиями пищевода.
Классификация опухолей пищевода
Все опухоли пищевода разделяют на две большие группы: доброкачественные (менее 1%) и злокачественные (более 99%). Доброкачественные опухоли классифицируют по гистологическому строению и характеру роста. Гистологически выделяют следующие виды доброкачественных опухолей пищевода: эпителиальные (полипы, аденомы, папилломы), неэпителиальные (липомы, фибромы, ангиомы, миомы, нейрофибромы, хондромы, миксомы и др.). Неэпителиальные опухоли встречаются гораздо чаще. По характеру роста опухоль пищевода может быть внутрипросветной и интрамуральной (внутристеночной).
Злокачественные опухоли пищевода классифицируют по гистологическому строению, расположению, распространенности процесса и т. д. В морфологическом плане выделяют эпителиальные злокачественные новообразования - плоскоклеточный ороговевающий и неороговевающий рак (более 95%), базальноклеточный, переходноклеточный, мукоэпидермоидный и анапластический рак, аденокарцинома (менее 5%); неэпителиальные – саркома, лимфома, меланома.
Классификация TNM систематизирует рак пищевода по следующим критериям:
1. Анатомическая область – шейный отдел пищевода, внутригрудной отдел (верхний, средний, нижний). Если опухоль поражает одновременно пищевод и желудок, то ее локализация определяется исходя из преимущественного поражения органа (более 50% образования находится в пищеводе или желудке). В случаях, когда новообразование равномерно распространяется в обе стороны, опухолью пищевода считают плоскоклеточный и мелкоклеточный рак, недифференцированные опухоли; опухолью желудка – аденокарциному и перстневидноклеточный рак.
2. Вовлечение в патологический процесс регионарных и отдаленных лимфоколлекторов.
3. Первичная опухоль – какие слои пищевода поражены, есть ли инвазия опухоли в соседние органы и ткани.
4. Степень дифференцировки – высокая, средняя, низкая, недифференцированная опухоль пищевода.
Доброкачественные опухоли пищевода
Симптомы доброкачественных опухолей пищевода
Доброкачественные опухоли пищевода встречаются достаточно редко и насчитывают не более 1% всех новообразований этого органа пищеварения. Львиная доля доброкачественных новообразований - это неэпителиальные опухоли, 70% из которых занимает лейомиома пищевода. Интрапросветные опухоли обычно представлены полипами эпителиального (железистые полипы, папилломы, аденомы) либо мезенхимального (фибромы, липомы, смешанные полипы) происхождения. В отдельную группу выделяют такие редко встречающиеся опухоли, как миксома, хондрома, гамартома, гемангиома.
Доброкачественные новообразования обнаруживаются во всех отделах пищевода. Обычно это одиночные опухоли на широкой ножке, имеющие гладкую или бугристую структуру. Учитывая достаточно медленный рост таких новообразований, клиническое течение часто бывает бессимптомным, а по достижению опухолью больших размеров появляются признаки непроходимости пищевода и сдавления органов средостения. Однако чаще всего доброкачественные опухоли пищевода являются случайной находкой во время обзорной рентгенографии органов брюшной полости.
Различные виды доброкачественных опухолей имеют определенные особенности клинической и рентгенологической картины. Так, полип пищевода может быть одиночным либо множественным, располагаться в любом отделе органа. Он явно выступает в просвет пищевода, имеет выраженную подвижность за счет широкого основания и ножки. Проявляется дисфагией, периодически возникающей в течение многих лет. Характерным признаком при рентгенологическом исследовании является смещаемый дефект наполнения барием с четкими и ровными контурами, сохраненная рельефность и перистальтика на уровне дефекта.
Папиллома обычно имеет большие размеры, чем полип, дольчатую или бородавчатую поверхность. Склонна к малигнизации. Лейомиомы являются наиболее распространенными опухолями пищевода. Располагаются в нижних и средних его отделах, интрамурально на широком основании. Течение обычно бессимптомное, первыми признаками являются изъязвление опухоли и кровотечение. Липомы встречаются очень редко, не имеют четких клинических отличий от других опухолей.
Диагностика и лечение доброкачественных опухолей пищевода
При проведении рентгенографии пищевода с контрастированием выявляются дефекты наполнения, деформация просвета пищеводной трубки, изменения рельефа слизистой. По рентгенологической картине можно выделить опухоли, полностью находящиеся в просвете органа; растущие как в просвет, так и интрамурально; распространяющиеся из внутренних слоев пищевода кнаружи и сдавливающие его извне. Отличием доброкачественных неэпителиальных опухолей от рака является сохраненный рельеф слизистой и эластичность стенок пищевода на уровне расположения новообразования. Диагноз подтверждается гистологически.
Дифференциальная диагностика проводится с такими заболеваниями, как инородное тело, варикозное расширение вен, злокачественные новообразования пищевода. Для установления правильного диагноза в условиях стационара проводится эзофагоскопия и хромоскопия пищевода, эндоскопическая биопсия тканей опухоли с последующим гистологическим исследованием, обзорная рентгенография грудной полости и рентгенография пищевода с контрастированием. При трудностях диагностики показано проведение магнитно-резонансной или компьютерной томографии органов грудной клетки.
Следует обращать внимание на такие неблагоприятные прогностические признаки, как быстрый рост опухоли, изъязвление, нетипичная форма опухолевого узла, изменение рельефа слизистой и эластичности стенок пищевода в месте локализации новообразования. Данные симптомы могут говорить о малигнизации доброкачественной опухоли и требуют от гастроэнтеролога обязательного назначения эзофагоскопии с биопсией.
Лечение только хирургическое, удаление доброкачественных опухолей пищевода может проводиться эндоскопическим либо полостным способом. В послеоперационном периоде назначается специальная диета, ингибиторы протонного насоса длительным курсом (в случае, если опухоль сопровождалась явлениями эзофагита, недостаточности кардии).
Злокачественные опухоли пищевода
Симптомы злокачественных опухолей пищевода
Злокачественные опухоли пищевода в подавляющем своем большинстве представлены раком. Это новообразование коварно тем, что выявляется обычно уже на поздних стадиях, в связи с чем доля операбельных опухолей составляет не более 30%, а летальность превышает 15%. Достаточно часто встречаются множественные злокачественные опухоли пищевода. По гистологической структуре чаще выявляется плоскоклеточный неороговевающий рак, реже базальноклеточный и ороговевающий, крайне редко – аденокарцинома и другие злокачественные новообразования. Чаще всего злокачественные новообразования локализуются в средней части пищевода, а расположение опухоли в дистальных отделах обычно связано с ее распространением из желудка. Растущая опухоль может поражать трахею, крупные артерии и вены, корень легкого, лимфатический проток, печень и диафрагму. Метастазы при раке пищевода выявляются в 60% случаев.
Злокачественные опухоли пищевода имеют характерную клинику: медленно прогрессирующая дисфагия, боль при глотании, отрыжка, слюнотечение. Часто отмечается отвращение к мясу. На поздних стадиях развиваются симптомы опухолевой интоксикации, гнойный медиастинит. Бессимптомное течение злокачественных новообразований возможно только на начальных этапах развития опухоли.
Саркома пищевода может происходить из соединительной, мышечной, сосудистой, нервной, пигментной тканей; также встречаются смешанные и дисэмбриопластические опухоли. Чаще всего диагностируются лейомиосаркомы. По характеру роста выделяют инфильтрирующие опухоли и полиповидные. Рентгенологические признаки сарком неспецифичны, напоминают доброкачественные опухоли. Отличительной чертой может служить множественность опухолевых узлов.
Злокачественные лимфомы пищевода обычно развиваются при генерализованных онкологических заболеваниях лимфатической ткани. Выделяют опухолевую, инфильтративную и комбинированную формы лимфом. Рентгенологически данные новообразования весьма схожи с эзофагеальным раком, отличает их менее выраженный стеноз пищевода, высокая частота изъязвлений с разрывом пищевода, формированием свищей. Также для лимфом характерно сохранение перистальтики пищеводной стенки над опухолью.
Диагностика и лечение злокачественных опухолей пищевода
Диагностирование злокачественных опухолей пищевода обычно включает в себя эзофагоскопию с биопсией, контрастную рентгенографию пищевода, МРТ и компьютерную томографию. Признаки, которые говорят в пользу злокачественного новообразования: нетипичное изменение рельефности слизистой; неравномерность контуров пищеводной стенки или дефект наполнения, сопровождающийся отсутствием перистальтики на этом уровне; неравномерность просвета пищевода, стеноз пищевода с расширением просвета над опухолевым узлом, подрытые контуры стенки пищевода на границе здоровой ткани и опухоли. Компьютерная томография позволяет с большой вероятностью определить возможности оперативного лечения, составить прогноз для выздоровления и жизни пациента.
Лечение злокачественных опухолей пищевода является весьма сложной задачей. Учитывая тип опухоли, стадию и распространенность процесса, может использоваться оперативное лечение (резекция, экстирпация пищевода с последующей эзофагопластикой), лучевая и полихимиотерапия в различных комбинациях. На поздних этапах заболевания терапия паллиативная (гастростомия).
Прогноз опухолей пищевода
При доброкачественных опухолях пищевода прогноз благоприятный, однако пациенты требуют пожизненного диспансерного наблюдения из-за высокой частоты рецидивов. При злокачественных новообразованиях прогноз зависит от сроков выявления и начала лечения опухоли. При наличии метастазов прогноз для выздоровления и жизни неблагоприятный. Специфической профилактики опухолей пищевода не существует.
Статьи: ЭНДОСКОПИЧЕСКАЯ ПОДСЛИЗИСТАЯ ДИССЕКЦИЯ АДЕНОКАРЦИНОМЫ ПИЩЕВОДНО-ЖЕЛУДОЧНОГО ПЕРЕХОДА У ПАЦИЕНТА ПОСЛЕ КОМПЛЕКСНОГО ЛЕЧЕНИЯ ПЕРВИЧНОЙ ЛИМФОМЫ ГОЛОВНОГО МОЗГА. КЛИНИЧЕСКИЙ СЛУЧАЙ
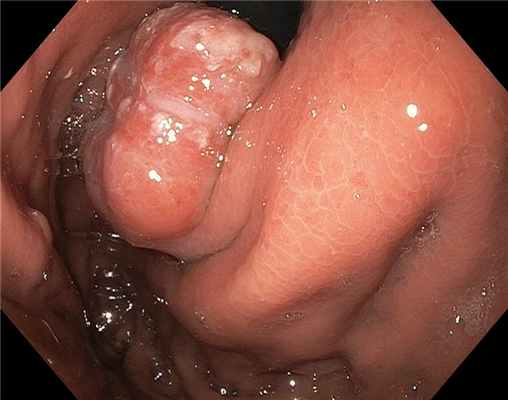
Иллюстрация №6: Рис. 6. Аденокарцинома пищеводно-желудочного перехода. Осмотр в режиме NBI со стороны желудка. По центру опухоли признаки инвазии в подслизистый слой (участок депрессии, смазан ямочный и сосудистый рисунок).
Иллюстрация №7: Рис. 7. Эндоскопическая ультрасонография радиальным эхоэндоскопом (частота 5-10 МГц). Опухоль размерами 25 х 20 мм, исходит из слизистого слоя стенки, подслизистый слой прослеживался фрагментарно, мышечный слой сохранен, интактен, наружный контур стенки п
Иллюстрация №8: Рис. 8. Подготовка к эндоскопическому удалению опухоли пищеводно-желудочной перехода. Маркировка слизистой оболочки вокруг опухоли.
Иллюстрация №10: Рис. 10. Аденокарцинома пищеводно-желудочного перехода. Окраска Гематоксилин-Эозином, увеличение х 100. Инвазивные криброзные очаги аденокарциномы.
Иллюстрация №11: Рис. 11. Иммуногистохимическое исследование. А. Окраска мышечной пластинки слизистой оболочки маркером Десмин, увеличение х 200. Опухолевые комплексы расположены ниже окрашенной мышечной пластинки - инвазия в подслизистый слой. B. Окраска эндотелия сосу
Иллюстрация №12: Рис. 12. Контрольная ЭГДС через 6 месяцев после диссекции. Продолговатый гладкий рубец в зоне удаленной опухоли пищеводно-желудочного перехода.
Полный текст статьи:
ЭНДОСКОПИЧЕСКАЯ ПОДСЛИЗИСТАЯ ДИССЕКЦИЯ АДЕНОКАРЦИНОМЫ ПИЩЕВОДНО-ЖЕЛУДОЧНОГО ПЕРЕХОДА У ПАЦИЕНТА ПОСЛЕ КОМПЛЕКСНОГО ЛЕЧЕНИЯ ПЕРВИЧНОЙ ЛИМФОМЫ ГОЛОВНОГО МОЗГА. КЛИНИЧЕСКИЙ СЛУЧАЙ.
Соколов С.А., Ленский Б.С., Шипулева И.В., Москалец М.В., Каннер Д.Ю., Федоров Е.Д.
Государственное бюджетное учреждение здравоохранения города Москвы «Московская городская онкологическая больница № 62 Департамента здравоохранения города Москвы»
Основным критерием первично-множественного злокачественного заболевания является выявление в организме нескольких независимых друг от друга очагов злокачественного роста. Первично множественные злокачественные заболевания принято разделять на синхронные (опухоли диагностированы одновременно) и метахронные (с интервалом выявления опухолей не менее 6 месяцев). Возникновению опухолей способствуют самые разнообразные факторы: генетические, вирусные, физические, химические, ионизирующее излучение и др.
В последние годы возрастает частота выявления первично-множественных новообразований. В Российской Федерации в 2015г. этот показатель составлял 6,7 %, а в 2018г. уже 8,8 % от всех впервые выявленных злокачественных новообразований [2]. С одной стороны, это можно связать с совершенствованием диагностики, с другой стороны, выявление опухолей новых локализаций может быть связано с увеличением продолжительности жизни онкобольных после эффективного лечения по поводу первичного рака. И если еще несколько десятилетий назад выявление у пациента двух и более злокачественных заболеваний ставило под сомнение эффективность терапии, то сегодня первично-множественные опухоли не являются препятствием для выполнения радикального лечения.
В настоящей статье рассмотрено клиническое наблюдение редкого первично-множественного синхронного злокачественного заболевания: первичной лимфомы головного мозга и аденокарциномы пищеводного-желудочного перехода. В доступной нам литературе встретилось всего одно схожее клиническое наблюдение [8]. Однако, в отличие от нашего случая, пациенту была выполнена гастрэктомия с последующим химиолучевым лечением по поводу лимфомы головного мозга.
Первичная лимфома центральной нервной системы (ПЛЦНС) - редкая опухоль центральной нервной системы (5-7 % от всех первичных опухолей ЦНС), относится к редким формам неходжкинских экстранодальных лимфом [3,4]. ПЛЦНС определяется поражением паренхимы головного или спинного мозга, оболочек мозга, глаза, и в большинстве случаев (более 70%) манифестирует очаговой неврологической симптоматикой. Более чем в 90% случаев лимфома головного мозга представлена В-клеточным вариантом. Пациентам с первичной лимфомой ЦНС рекомендована химиотерапия на основе высокодозного метотрексата. В случае неполного ответа на лечение пациенту с первичной лимфомой ЦНС рекомендовано проведение лучевой терапии [3,4].
В последние годы во всем мире наблюдается тенденция к росту заболеваемости раком пищеводно-желудочного перехода [6,7,9,10]. Аденокарциномы ПЖП с эпицентром роста выше Z-линии, на уровне Z-линии и до 2,0 см ниже от Z-линии (I-II типы по Siewert) классифицируются и стадируются как рак пищевода и подлежат лечению согласно алгоритмам, соответствующим раку пищевода. Опухоли ПЖП с эпицентром роста дистальнее 2 см от Z-линии (III тип по Siewert) классифицируются и стадируются как рак желудка и подлежат лечению согласно алгоритмам, соответствующим раку желудка [1,5].
При росте опухоли ПЖП в пределах слизистой оболочки (Tis, T1a) признанным методом лечения считается эндоскопическое удаление опухоли методом резекции слизистой оболочки с диссекцией подслизистого слоя. Абсолютными показаниями являются: умеренно- и хорошо-дифференцированные опухоли, отсутствие изъязвлений, размер опухоли до 2 см включительно. Расширенными показаниями для эндоскопической диссекции служат: умеренно- и хорошо-дифференцированные поверхностные опухоли более 2 см, образования до 3 см включительно с изъязвлением или начальной подслизистой инвазией, а также плохо-дифференцированные поверхностные опухоли размером до 2 см включительно [6].
Клинический случай.
Пациент, 72 лет, по профессии физик-ядерщик, считает себя больным с ноября 2017 г., когда стал отмечать головные боли. Обратился к невропатологу по месту жительства, при обследовании по данным МРТ головного мозга выявлены два образования: в правой лобной и левой височных долях, размерами 31 х 35 х 33 мм и 14 х 12 х 10 мм соответственно, расцененные как очаги вторичного поражения. При комплексном обследовании (включая компьютерную томографию органов грудной клетки и брюшной полости (КТ ОГК и БП), позитронно-эмиссионную томографию совмещенную с КТ (ПЭТ-КТ), эзофагогастродуоденоскопию с биопсией) в области пищеводно-желудочного перехода была выявлена ещё одна опухоль. По результатам планового гистологического исследования - высокодифференцированная аденокарцинома ПЖП.
В связи с увеличением размеров опухоли правой лобной доли и нарастанием неврологической симптоматики, 26.12.2017г. в «НМИЦ нейрохирургии им. академика Н.Н. Бурденко» пациенту была выполнена операция: удаление внутримозговой опухоли правой лобной доли с использованием интраоперационного УЗИ. По данным гистологического исследования операционного материала и результатам иммунофенотипирования: диффузная В-крупноклеточная лимфома головного мозга. В послеоперационном периоде пациенту выполнено 2 курса химиотерапии по схеме темозоломид - ретуксимаб (17.01-21.02.2018г).
В связи с наличием второй синхронной опухоли пищеводно-желудочного перехода, в марте 2018 г. пациент обратился в нашу клинику за консультативной помощью. Пациент предъявлял жалобы на выраженную слабость. Грубой очаговой симптоматики выявлено не было, но сохранялись нарушения в координационной сфере, астенический синдром, присутствовали дизартрия и тремор рук.
При эндоскопическом осмотре в области ПЖП определялась экзофитная опухоль, размерами 20 х 15 мм, на широком основании, высотой до 5-7 мм, с красной шероховатой поверхностью и налетом фибрина (рис. 1). При инструментальной пальпации опухоль легко смещалась, пролабировала в просвет желудка и пищевода. Аксиальная хиатальная грыжа и особенности расположения опухоли в зоне пищеводно-желудочной перехода не позволили создать необходимую акустическую среду и провести мини-зондовое эндоскопическое ультразвуковое исследование.
При пересмотре стеклопрепаратов и гистологических блоков ранее выполненной биопсии из области ПЖП морфологическая картина соответствовала тубулярной аденоме желудка с признаками интраэпителиальной неоплазии высокой степени с очагами подозрительными в отношении аденокарциномы.
По данным МРТ головного мозга от 21.03.2018г. отмечалась отрицательная динамика в виде увеличения размеров образования в левой височной доле до 36 х 25 мм, увеличения перифокального отека (рис. 2).
Решением общебольничного консилиума удаление опухоли кардиоэзофагеального перехода было отложено в связи с признаками прогрессии опухоли головного мозга, наличием дефицита в неврологической симптоматике, а также высоким риском осложнений после хирургического вмешательства под наркозом. На момент принятия решения опухоль ПЖП, в отличие от опухоли ЦНС, не представляла угрозы для жизни пациента. Было рекомендовано продолжить лечение у гематолога, после стабилизации процесса ЦНС повторно вернуться к вопросу об удалении опухоли ПЖП.
С марта по октябрь 2018г. пациенту проводилось специализированное лечение в гематологическом отделении «ГКБ им. С.П. Боткина ДЗ г. Москвы»: 2 цикла полихимиотерапии (ПХТ) по схеме R-I-R, 5 курсов ПХТ по схеме TMR и 1 курс ПХТ по схеме R-HD-CE. По окончании химиотерапии, по данным МРТ головного мозга от 09.10.2018г. в зоне ранее выявляемого образования в левой височной доле сохранялись отдельные участки слабого накопления контрастного препарата с нечеткими контурами.
Вторым этапом комплексного лечения лимфомы головного мозга, с 20.11.18г. по 26.12.18г. в ФГАУ «Лечебно-реабилитационный центр» был выполнен курс 3D конформной дистанционной лучевой терапии на весь объем головного мозга в РОД -2 Гр до СОД 36 Гр с последующим увеличением на зону остаточной опухоли в РОД -2Гр до СОД 46 Гр. По данным контрольной МРТ головного мозга от 31.01.2019г: постоперационные кистозно-глиозные изменения в правой лобной доле, уменьшение постоперационной гидромы справа. МР-признаки опухолевого поражения в левой височной доле не обнаружены (рис 3). Таким образом, удалось добиться стабилизации опухолевого процесса в головном мозге. Реабилитационный период продлился три месяца.
В марте 2019г., через один год после первичной консультации, пациент повторно обратился к нам в клинику для дообследования и решения вопроса об удалении аденокарциномы кардиоэзофагеального перехода. На момент обращения у пациента сохранялись жалобы на общую слабость, вялость, повышенную утомляемость, утрату способности к длительному умственному и физическому напряжению, раздражительность, расстройство памяти, нарушение координации движений.
КТ ОГК и БП с контрастным усилением указывала на наличие гиперваскулярного образования по левому контуру области кардиоэзофагеального перехода, размерами 23 х 11 мм, с наличием кратерообразного углубления на поверхности, без признаков инфильтрации окружающей клетчатки (рис 4). Нижние параэзофагеальные лимфоузлы (ЛУ) размером до 7 х 5 мм, кардиальные ЛУ, ЛУ по малой и большой кривизне, пилорические и по ходу левой желудочной артерии размером до 2-4 мм, в области чревного ствола и общей печеночной артерии единичные ЛУ размером до 6 х 11 мм.
Эндоскопическое исследование пищевода и желудка проводилось в смежном режиме c применением осмотра в белом свете (White Light Endoscopy) и осмотре в узком спектре (Narrow Band Imaging). По результатам эндоскопического осмотра зубчатая линия располагалась по верхнему краю кардиальных складок, на 39 см от резцов, на этом же уровне по задней полуокружности определялся проксимальный край экзофитной опухоли, протяженностью 25-30 мм, шириной до 20 мм, высотой до 12‑14 мм, с контактно ранимой поверхностью покрытой фибрином. Кардия смыкалась не полностью, отмечалось пролабирование кардиальных складок слизистой оболочки с опухолью в просвет пищевода. Уровень пищеводного отверстия диафрагмы определялся на 44 см от резцов. При инверсионном осмотре зоны кардии опухоль смещалась вместе со слизистой оболочкой как в просвет пищевода, так и в просвет желудка. По центру опухоли имелся участок депрессии размерами до 5 х 8 мм, неправильной формы, с четкой демаркационной линией, ямочный и сосудистый рисунок не прослеживались. (рис. 5,6).
Для оценки глубины инвазии опухоли в стенку пищевода и желудка, а также состояния регионарных лимфоузлов была выполнена ультрасонография эхоэндоскопом с радиальным УЗ-датчиком (частота 5-10 МГц). По результатам исследования в области кардиоэзофагеального перехода по задней полуокружности определялось гипоэхогенное образование до 25 х 20 мм, исходящее из слизистого слоя стенки, подслизистый слой прослеживался фрагментарно, мышечный слой был сохранен, интактен, наружный контур стенки пищевода и желудка ровный, четкий (рис. 7). Увеличенные и патологически измененные лимфатические узлы не определялись.
На основании жалоб, анамнеза, данных осмотра и обследований был сформулирован предварительный диагноз: Первично-множественное синхронное злокачественное заболевание: 1) диффузная В-крупноклеточная лимфома с мультифокальным поражением головного мозга, удаление опухоли 26.12.2017г., состояние после двух курсов химиотерапии. Прогрессирование. Состояние после 2 циклов ПХТ по схеме R-I-R. Прогрессирование. Состояние после 5 курсов ПХТ по схеме TMR и 1 курса ПХТ по схеме R-HD-CE. Частичная ремиссия. Состояние после ЛТ в СОД 46 Гр. Стабилизация. 2) кардиоэзофагеальный рак, тип II по Siewert, стадия IА, cT1аN0M0. Сопутствующие заболевания: ишемическая болезнь сердца, гипертоническая болезнь 3 степени, риск 4. Грыжа пищеводного отверстия диафрагмы.
Учитывая данные комплексного предоперационного обследования, а также общее состояние пациента и связанные с этим высокие риски развития тяжёлых операционных и послеоперационных осложнений, на общебольничном консилиуме было принято решение отказаться от хирургического лечения в пользу лечебно-диагностического эндоскопического удаления опухоли ПЖП методом резекции слизистой оболочки с диссекцией подслизистого слоя.
Операция была выполнена 09.04.2019г. через 13 месяцев после диагностики опухоли, под эндотрахеальным наркозом с использованием помпы для подачи воды в дополнительный канал эндоскопа и инсуффляцией углекислого газа. Точечная маркировка слизистой оболочки была выполнена отступя от видимых краев опухоли 4-5 мм с помощью эндоскопического ножа Triangle Knife (рис. 8), циркулярный разрез слизистой оболочки вокруг опухоли (отступя от эндоскопических меток 2‑3 мм) был выполнен с помощью ножей Triangle Knife и IT Knife после введения в подслизистый слой раствора гиалуроновой к‑ты с индигокармином. Далее с помощью эндоскопических ножей была выполнена диссекция подслизистого слоя. Опухоль была удалена единым блоком. Гемостаз видимых сосудов в ложе удаленной опухоли был осуществлён щипцами типа Coagrasper. По окончании операции признаков перфорации, кровотечения не выявлено (рис.9). Операционный препарат (50 х 45 мм) был извлечен, фиксирован и погружен в формалин.
Макроскопическое описание удаленного препарата: фрагмент слизистой оболочки неправильной формы, размерами 48 х 44 х 14 мм. На слизистой определяется изъязвленное экзофитное крупно‑бугристое образование неправильной формы с четкими границами, размерами 30 х 32 х 12 мм, располагающееся на расстоянии 2 мм от проксимального края.
Микроскопической описание: фрагмент слизистой оболочки области пищеводно‑желудочного перехода, представленный слизистой оболочкой пищевода с прилежащими участками слизистой оболочки желудка, с наличием в центральной части, а также ближе к проксимальному краю очагов инвазивного роста аденокарциномы. В области фронта инвазии определяются очаги инвазии лимфатических сосудов. Признаков пищевода Барретта не выявлено. Опухоль прорастает в подслизистый слой. Наибольший горизонтальный размер инвазивного компонента - 25 мм. Во всех исследованных краях препарата признаков опухолевого роста не выявлено.
Морфологическое и иммуногистохимическое заключение: умеренно дифференцированная аденокарцинома пищеводно-желудочного перехода, grade II (рис. 10). Опухоль прорастает в подслизистый слой (sm3), в просветах сосудов определяются очаги опухоли (Ly «+», V «+»), в краях препарата признаков опухолевого роста не выявлено, (LM «-», VM «-»), рис. 11.
Учитывая жалобы, анамнез, результаты исследований, интраоперационную картину, результаты морфологического и иммуногистохимического исследований был сформирован окончательный диагноз:
Первично-множественное синхронное злокачественное заболевание: 1) диффузная В-крупноклеточная лимфома с мультифокальным поражением головного мозга, удаление опухоли 26.12.2017г., состояние после двух курсов химиотерапии. Прогрессирование. Состояние после 2 циклов ПХТ по схеме R-I-R. Прогрессирование. Состояние после 5 курсов ПХТ по схеме TMR и 1 курса ПХТ по схеме R-HD-CE. Частичная ремиссия. Состояние после ЛТ в СОД 46 Гр. Стабилизация. 2) кардиоэзофагеальный рак, тип II по Siewert, стадия IB, pT1bN0M0. Эндоскопическое удаление опухоли методом резекции слизистой оболочки с диссекцией подслизистого слоя 09.04.2019г.
Послеоперационный период протекал без осложнений, пациент получал ингибиторы протонной помпы в дозировке 40 мг 2 раза в день внутривенно на протяжении 3 дней, далее по стандартной схеме.
Решением консилиума в послеоперационном периоде дополнительного противоопухолевого лечения назначено не было, пациент оставлен под строгий динамический контроль.
Эзофагогастродуоденоскопия от 03.10.2019г. (через 6 месяцев после операции): на расстоянии 40 см от резцов по задней полуокружности определяется проксимальный край едва заметного плоского белесоватого рубца, протяженностью около 4,0 см, без признаков опухолевого поражения (рис. 12).
КТ ОГК и БП с внутривенным контрастированием от 06.12.19г. (через 8 месяцев после операции): дополнительные образования в пищеводе и желудке не дифференцируются, абдоминальный сегмент пищевода расположен частично выше диафрагмы. КТ данных за мтс-поражение регионарных лимфоузлов и прогрессирование заболевания нет.
МРТ головного мозга от 25.11.19г.: появление мелких опухолевых очагов по оболочкам постоперационной гидромы справа. Зона постоперационных кистозно‑глиозных изменений в правой лобной доле; глиоз в области островка и левой височной доли без динамики.
Таким образом, через 8 месяцев после удаления опухоли кардии, по данным комплексного обследования (включая КТ ОГК и БП с внутривенным контрастированием, эзофагогастродуоденоскопию), признаков местного и отдаленного рецидива кардиоэзофагеального рака не выявлено. Однако, по данным МРТ головного мозга отметилась отрицательная динамика в виде появления мелких опухолевых очагов в зоне удаленной опухоли правой лобной доли. Учитывая исчерпанные резервы химиолучевого лечения лимфомы головного мозга, изменения выявленные при контрольной МРТ головного мозга требуют динамического наблюдения. Пациент чувствует себя удовлетворительно, планируется очередное контрольное обследование.
Список литературы:
Рак пищевода
Среди злокачественных опухолей проксимальных двух третей пищевода наиболее распространен плоскоклеточный (сквамозно-клеточный) рак; аденокарцинома – самая частая злокачественная опухоль в дистальной трети пищевода. Проявления включают прогрессирующую дисфагию Дисфагия Дисфагия представляет собой затрудненное глотание. Данное состояние препятствует продвижению жидкости, твердой пищи или одновременно и того и другого от глотки до желудка. Дисфагию не следует. Прочитайте дополнительные сведения , похудание. Диагноз ставится на основании эндоскопии, дополняемой КТ и эндоскопическим УЗИ для определения стадии. Лечение зависит от стадии болезни и обычно включает хирургическое вмешательство с или без химио- и лучевой терапии. Уровень длительной выживаемости низкий, за исключением пациентов с местным распространением опухоли.
В США ежегодно регистрируют 18 440 случаев рака пищевода и около 16 170 летальных исходов от данного заболевания ( 1 Общие справочные материалы Среди злокачественных опухолей проксимальных двух третей пищевода наиболее распространен плоскоклеточный (сквамозно-клеточный) рак; аденокарцинома – самая частая злокачественная опухоль в дистальной. Прочитайте дополнительные сведенияОбщие справочные материалы
1. Siegel RL, Miller KD, Jemal A: Cancer statistics, 2020. CA Cancer J Clin 70(1):7–30, 2020. doi: 10.3322/caac.21590
Плоскоклеточный рак пищевода
Плоскоклеточная карцинома является наиболее распространенным раком пищевода во всем мире, но в США аденокарцинома встречается примерно в два раза чаще ( 1 Справочные материалы по плоскоклеточному раку пищевода Среди злокачественных опухолей проксимальных двух третей пищевода наиболее распространен плоскоклеточный (сквамозно-клеточный) рак; аденокарцинома – самая частая злокачественная опухоль в дистальной. Прочитайте дополнительные сведенияОсновными факторами риска развития рака пищевода являются
употребление табака (в любой форме)
К другим факторам риска относятся: ахалазия Ахалазия Ахалазия нейрогенное заболевание, в основе которого лежит нарушение моторики пищевода, характеризующееся нарушением его перистальтики и недостаточной релаксацией нижнего пищеводного сфинктера. Прочитайте дополнительные сведения , папилломавирусная инфекция человека Инфекция, вызванная вирусом папилломы человека (ВПЧ) Вирус папилломы человека (ВПЧ) вызывает развитие бородавок. Некоторые типы ВПЧ вызывают бородавки кожи, а другие типы вызывают возвышающиеся или плоские генитальные кондиломы (поражения кожи. Прочитайте дополнительные сведения , облучение пищевода. Генетические факторы остаются неясными, однако у 50% пациентов с кератодермией (гиперкератозом ладоней и подошв) – заболевания с аутосомно-доминантным типом наследования, рак пищевода развивается к 45 годам, у 95% – к 55 годам.
Справочные материалы по плоскоклеточному раку пищевода
1. Patel N, Benipal B: Incidence of esophageal cancer in the United States from 2001-2015: A United States cancer statistics analysis of 50 states. Cureus 10(12):e3709, 2018. doi: 10.7759/cureus.3709
Аденокарцинома пищевода
Аденокарцинома развивается в дистальной части пищевода. Распространенность этой опухоли растет; в США она составляет две трети всех случаев рака пищевода. У лиц европеоидной расы она встречается в 4 раза чаще, чем у афроамериканцев. Курение рассматривается как важный фактор риска, тогда как употребление алкоголя – нет. Аденокарциному дистальной части пищевода сложно отличить от аденокарциномы кардиального отдела желудка, распространяющейся в дистальный отдел пищевода.
В большинстве случаев аденокарциномы развиваются на фоне пищевода Баррета, осложняющего хроническое течение гастроэзофагеальной рефлюксной болезни Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) Несостоятельность нижнего пищеводного сфинктера способствует рефлюксу желудочного содержимого в пищевод, вызывая жгучую боль. Длительный рефлюкс может привести к эзофагиту, стриктуре и редко. Прочитайте дополнительные сведенияДругие злокачественные опухоли пищевода
К менее распространенным опухолям относятся веретеноклеточный рак (низкодифференцированный вариант плоскоклеточного рака), бородавчатый рак (высокодифференцированный вариант плоскоклеточного рака), псевдосаркома, мукоэпидермоидная карцинома, железисто-плоскоклеточная карцинома, цилиндрома (железисто-кистозная карцинома), первичная овсяноклеточная карцинома, хориокарцинома, карциноид Обзор карциноидных опухолей (Overview of Carcinoid Tumors) Карциноидные опухоли развиваются из нейроэндокринных клеток из желудочно-кишечного тракта (90%), поджелудочной железы, бронхов и реже из мочеполовых путей. Более 95% всех карциноидных опухолей. Прочитайте дополнительные сведения и первичная злокачественная меланома Меланома Меланома возникает из меланоцитов в тканях, содержащих пигмент (например, на коже, слизистых оболочках, глазах или в центральной нервной системе). Метастазирование коррелирует с глубиной проникновения. Прочитайте дополнительные сведенияМетастазы рака другой локализации составляют 3% случаев злокачественных опухолей пищевода. Чаще это метастазы меланомы и рака молочной железы, кроме того, в пищевод метастазируют опухоли головы и шеи, легкого, желудка, печени, почки, предстательной железы, яичка, костной ткани. Метастазы этих опухолей обычно распространяются в соединительнотканной строме, окружающей пищевод, тогда как первичный рак пищевода начинает расти из слизистой оболочки или подслизистой основы самого пищевода.
Симптомы и признаки рака пищевода
На ранних стадиях рак пищевода, как правило, протекает бессимптомно. Когда диаметр просвет сокращается до < 14 мм, как правило, появляется дисфагия Дисфагия Дисфагия представляет собой затрудненное глотание. Данное состояние препятствует продвижению жидкости, твердой пищи или одновременно и того и другого от глотки до желудка. Дисфагию не следует. Прочитайте дополнительные сведения . Вначале затрудняется глотание плотной пищи, затем – полужидкой и, в конце концов, – жидкости и слюны; такое неуклонное прогрессирование дисфагии указывает на увеличивающуюся злокачественную опухоль и не характерно для спазма, доброкачественного пищеводного кольца, пептической стриктуры. Может возникать боль в грудной клетке, обычно иррадиирущая в спину.
Похудание, даже при сохранении хорошего аппетита, наблюдается почти всегда. Сдавление возвратного гортанного нерва может приводить к парезу голосовых связок и охриплости голоса. Сдавление нерва может вызывать боль в спине, икоту или паралич диафрагмы. Плевральный выпот злокачественной природы и метастазы в легкие вызывают одышку. Изменения ткани внутрипросветного опухолевого узла могут сопровождаться болезенным глотанием (одинофагией), рвотой, в т.ч. с примесью крови, меленой, развитием железодефицитной анемии, аспирацией, кашлем. Образование фистул между пищеводом и трахеобронхиальным деревом сопровождается развитием пневмонии, абсцесса легкого. Также могут проявляться признаки сдавления верхней полой вены, асцит опухолевой природы, боли в костях.
Типично лимфогенное распространение опухоли во внутренние югулярные, шейные, надключичные, медиастинальные, чревные лимфоузлы. Также, как правило, происходит метастазирование в легкие, печень, иногда – в более отдаленные области (в частности, в кости, сердце, головной мозг, надпочечники, почки, брюшину).
Диагностика рака пищевода
Эндоскопическое исследование с биопсией
Вторым этапом проводятся КТ и эндоскопическое УЗИ
Скрининговые исследования не разработаны. При подозрении на рак пищевода проводится эндоскопия с цитологическим исследованием и биопсией. Даже если при рентгеновском исследовании обнаружено образование с сужением просвета, необходимо проводить эндоскопию с биопсией для гистологического подтверждения диагноза.
При установленном диагнозе рака пищевода показано проведение КТ грудной клетки и брюшной полости для определения распространенности процесса. Если при КТ метастазы не выявлены, следует провести эндоскопическое УЗИ для определения глубины прорастания опухоли в стенку пищевода и степень вовлечения регионарных лимфоузлов. Выявленные изменения определяют схему лечения и прогноз болезни.
Необходимо провести основные исследования крови, включая общий анализ крови, измерение уровня электролитов и тесты на функциональные показатели печени.
Прогноз при раке пищевода
Прогноз во многом зависит от стадии заболевания, но, в целом, неблагоприятный (5-летняя выживаемость: < 5%), т.к. клинические проявления развиваются на поздних стадиях. При опухолевом росте, ограниченном слизистой оболочкой, выживает 80% пациентов; при распространении в подслизистый слой этот показатель составляет < 50%, при прорастании собственного мышечного слоя – 20%, при вовлечении прилежащих структур – 7% и при наличии отдаленных метастазов < 3%.
Лечение рака пищевода
Резекция пораженного отдела, часто в комбинации с химио- и лучевой терапией
Иммунотерапия плюс химиотерапия на некоторых стадиях рака
Выбор тактики лечения рака пищевода зависит от стадии опухоли, ее размера, локализации, а также выбора самого пациента (многие предпочитают более активное лечение).
Общие принципы
При стадиях опухолевого роста 0, I или IIa (см. таблицу Стадирование рака пищевода Стадии рака пищевода* ) наблюдается хороший эффект от хирургической резекции; предоперационная химио- и лучевая терапии оказывают дополнительный благоприятный эффект. При стадиях IIb и III изолированное хирургическое лечение существенно не влияет на выживаемость; результаты улучшаются при проведении предоперационной (неоадъювантной) лучевой и химиотерапии, которые способствуют уменьшению размеров опухоли. При невозможности выполнения хиругического вмешательства или отказе от него некоторого улучшения можно достичь благодаря лучевой и химиотерапии. Как самостоятельные методы лечения лучевая и химиотерапия малоэффективны. На IV стадии болезни требуется паллиативное лечение, хирургическое вмешательство не проводится.
Стадии рака пищевода*
Опухоль (максимальное распространение)
Метастазы в регионарные лимфатические узлы
Любое значение T
Любое значение N
Классификация *cTNM (Определение клинической стадии заболевания):
Tis = карцинома in situ; T1 = распространение в пределах собственной пластинки слизистой или подслизистого слоя; Т2 = прорастание в мышечную оболочку; Т3 = прорастание адвентиции; Т4 = распространение в прилежащие структуры.
N0 = отсутствуют; N1 = имеются.
M0 = отсутствуют; M1 = имеются.
После проведенного лечения продолжается наблюдение пациентов с целью выявления признаков рецидива: в первые 3 года с интервалом в 6 месяцев проводятся эндоскопия и КТ шеи, грудной клетки и брюшной полости; по истечении 3 лет исследования проводятся ежегодно.
При наличии пищевода Баррета необходимо интенсивное длительное лечение гастроэзофагеальной рефлюксной болезни Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) Несостоятельность нижнего пищеводного сфинктера способствует рефлюксу желудочного содержимого в пищевод, вызывая жгучую боль. Длительный рефлюкс может привести к эзофагиту, стриктуре и редко. Прочитайте дополнительные сведенияХирургическое лечение
Рак на начальных стадиях, а также поверхностные, неинвазивные формы рака можно лечить с помощью эндоскопической резекции слизистой оболочки или эндоскопического подслизистого расслоения (как правило, проводится гастроэнтерологами в центрах высокоспециализированной медицинской помощи), если поверхностный характер поражения был подтвержден эндоскопическим ультразвуковым исследованием. Тем не менее, в подавляющем большинстве случаев, радикальная резекция единым блоком подразумевает удаление опухоли целиком, проксимальных и дистальных краев здоровой ткани, всех лимфоузлов, которые могут быть поражены метастазами, и части проксимального отдела желудка в объеме, достаточном для удаления дистальных дренирующих лимфатических протоков. При этом желудок подтягивают вверх и накладывают желудочно-пищеводный анастомоз, либо проводят замещение сегментом тонкой или толстой кишки. Поскольку эзофагэктомия неизбежно сопровождается двусторонней ваготомией, для обеспечения адекватного оттока из желудка проводится пилоропластика (хирургическое расширение привратника). Пациенты в возрасте > 75 лет могут плохо переносить обширные операции, особенно при наличии фоновой патологии сердечно-сосудистой или дыхательной системы (фракция выброса < 40% или объем форсированного выдоха за 1 с [ОФВ1] < 1,5 л/минуту). Общая операционная летальность составляет около 5%.
Предоперационная химиотерапия в сочетании с лучевой терапией может улучшить выживаемость после хирургической резекции грудной локализации рака пищевода. Также можно рассматреть применение химиотерапии без лучевой терапии с последующим оперативным вмешательством ( 1 Справочные материалы по лечению Среди злокачественных опухолей проксимальных двух третей пищевода наиболее распространен плоскоклеточный (сквамозно-клеточный) рак; аденокарцинома – самая частая злокачественная опухоль в дистальной. Прочитайте дополнительные сведенияК осложнениям хирургичексих вмешательств относятся: несостоятельность анастомоза, образование фистул и стриктур; желчный желудочно-пищеводный рефлюкс; демпинг-синдром. Жгучая боль в грудной клетке вследствие рефлюкса желчи после дистальной эзофагэктомии может доставлять даже больший дискомфорт, чем предшествующая дисфагия, и в ряде случаев служит показанием к последующему проведению еюностомии Roux-en-Y для отведения желчи. Сегмент тонкой или толстой кишки, замещающий пищевод, в грудной клетке получает недостаточное кровоснабжение; есть угроза его перекрута, ишемии и гангрены.
Наружная (внешняя) пучковая лучевая терапия
Для лечения пациентов, которым невозможно провести радикальное хирургическое лечение, в т.ч. на поздних стадиях, как правило, применяется лучевая терапия, в комбинации с химиотерапией. Лучевая терапия противопоказана больным с трахеоэзофагеальной фистулой, т.к. сморщивание опухоли вызывает увеличение размеров фистулы. При наличии выраженной сосудистой сети, окутывающей опухоль, и сокращении размеров последней может возникать массивное кровотечение.
В начале курса лучевой терапии развивающийся отек может ухудшить проходимость пищевода и усилить дисфагию и одинофагию. Эта проблема может потребовать предварительного расширения и/или установки стента. Некоторые пациенты могут нуждаться в установке чрескожного гастростомического питательного зонда. К другим осложнениям лучевой терапии относятся тошнота, рвота, отсутствие аппетита, усталость, эзофагит, избыточное образование слизи в пищеводе, сухость во рту, стриктуры, лучевой пневмонит, лучевой перикардит, миокардит, миелит (воспаление спинного мозга).
Химиотерапия
Изолированная химиотерапия малоэффективна в лечении опухолей. Эффективность лечения (которая оценивается как уменьшение всех поддающихся измерению размеров опухоли ≥ 50%) варьирует от 10 до 40%, однако ответ, как правило, неполный (наблюдается минимальное сокращение опухоли) и непродолжительный. Ни один из препаратов не обладает явным преимуществом.
В большинстве случаев применяется комбинация цисплатина и 5-фторурацила. При плоскоклеточном раке активны также некоторые другие препараты, в т.ч. митомицин, доксорубицин, виндезин, блеомицин, метотрексат.
Иммунотерапию
Иммунотерапия в сочетании с химиотерапией в настоящее время рекомендуется в качестве терапии первой линии при запущенном плоскоклеточном раке пищевода независимо от статуса лиганда программируемой смерти клеток 1 (PD-L1). Данный метод лечения предлагается в качестве терапии первой линии при прогрессирующей аденокарциноме пищевода с избыточной экспрессией PD-L1 ( 1 Справочные материалы по лечению Среди злокачественных опухолей проксимальных двух третей пищевода наиболее распространен плоскоклеточный (сквамозно-клеточный) рак; аденокарцинома – самая частая злокачественная опухоль в дистальной. Прочитайте дополнительные сведенияПаллиативное лечение
Паллиативные меры направлены на уменьшение степени выраженности обструкции пищевода, достаточной для восстановления возможности принимать пищу через рот. Пациент может испытывать существенные страдания вследствие нарушения проходимости пищевода, при этом наблюдаются саливация и аспирация. Паллиативные методы включают расширение пищевода (бужирование), эндоскопическую установку стентов, лучевое воздействие, лазерную фотокоагуляцию, фотодинамическую терапию. В ряде случаев может потребоваться проведение цервикальной эзофагостомии, еюностомии для кормления.
Облегчение после расширения пищевода, как правило, продолжается лишь несколько дней. Гибкие металлические сетчатые стенты более эффективны в поддержании проходимости пищевода. Для закрытия опухолевых трахеоэзофагеальных фистул также применяются модели стентов, покрытые пластиком; при необходимости установки стента вблизи нижнего пищеводного сфинктера применяют модели, оснащенные антирефлюксным клапаном.
Эндоскопическое лазерное лечение помогает уменьшить проявления дисфагии за счет коагуляции опухоли и создания канала для прохождения пищи; данное вмешательство можно повторять. При фотодинамической терапии используется введение порфимера натрия – производного гематопорфирина, который захватывается тканями и играет роль фотосенсибилизатора. После активации пучком лазера, направленного на опухоль, порфимер высвобождает цитотоксичный синглетный кислород, разрушающий опухолевые клетки. Пациенты должны избегать пребывания на солнце до 6 недель после окончания фотодинамической терапии, поскольку светочувствительность кожи также повышена.
Справочные материалы по лечению
1. Wang H, Xuan T, Chen Y, et al: Investigative therapy for advanced esophageal cancer using the option for combined immunotherapy and chemotherapy. Immunotherapy 12(10):697–703, 2020. doi: 10.2217/imt-2020-0063
Основные положения
Факторы риска развития плоскоклеточного рака пищевода – употребление алкоголя, курение, инфекция вирусом папилломы человека; пищевод Баррета при хроническом рефлюксе (часто связанного с ожирением) – фактор риска развития аденокарциномы.
Ранние стадии рака, как правило, протекают бессимптомно; к первым проявлениям относится прогрессирующее затруднение глотания вследствие значительного сужения просвета и в ряде случаев – дискомфорт в грудной клетке.
В целом выживаемость низкая (5-летняя выживаемость < 5%), т.к. в большинстве случаев болезнь проявляется на поздней стадии.
Лечебное хирургическое вмешательство обширное, нередко плохо переносится в пожилом возрасте и при наличии сопутствующих заболеваний.
Паллиативные меры включают стентирование или эндоскопическое лазерное лечение с целью уменьшения обструкции и обеспечения приема пищи через рот.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Читайте также:
