Катаболизм жиров и жирных кислот бактериями. Эндогенный энергетический метаболизм бактерий.
Добавил пользователь Владимир З. Обновлено: 29.01.2026
Питательное вещество, поступившее внутрь клетки микроорганизма, участвует во множестве разнообразных химических реакций. Все химические проявления жизнедеятельности микроорганизмов носят общее название метаболизма, или обмена веществ. Метаболизм включает две группы жизненно важных процессов — катаболизм (энергетический обмен) и анаболизм (биосинтез).
Основные понятия
. Катаболизм и анаболизм. Катаболизм — это комплекс процессов расщепления пищевых веществ — углеводов, жиров и белков, которые происходят в основном за счет реакций окисления, в результате чего выделяется энергия. У микроорганизмов различают основные формы катаболизма — брожение и дыхание (аэробное или анаэробное). При брожении наблюдается неполный распад органических веществ с высвобождением незначительного количества энергии и накоплением богатых энергией конечных продуктов (этилового спирта, молочной, масляной и других кислот). При аэробном дыхании обычно осуществляется полное окисление органических веществ с выходом большого количества энергии и образованием бедных энергией конечных продуктов (С02 и Н20). Высвобождающаяся при катаболизме органических веществ свободная энергия аккумулируется в форме энергии фосфатных связей аденозинтри- фосфата (АТФ).
Биосинтез, или анаболизм, объединяет процессы синтеза макромолекул клетки (нуклеиновых кислот, белков, полисахаридов и т. д.) из более простых соединений, присутствующих в окружающей среде. Реакции биосинтеза связаны с потреблением свободной энергии, которая вырабатывается в процессах дыхания, брожения (а также фотосинтеза) и сохраняется в форме АТФ. Катаболизм и биосинтез протекают одновременно, многие реакции и промежуточные продукты для них общие.
Ферменты. Глубокое понимание процессов метаболизма микроорганизмов вряд ли возможно без предварительного знакомства с ролью и значением ферментов. Ферменты — биологические катализаторы. Они катализируют тысячи химических реакций, из которых слагается метаболизм организма. Известно уже около двух тысяч ферментов. По химической природе ферменты — глобулярные белки молекулярной массой от К) тыс. до нескольких миллионов. Название ферменту во многих случаях дают по веществу, на которое он действует, с изменением окончания на «-аза». Например, целлю- лаза катализирует гидролиз целлюлозы до целлобиозы, уреаза — гидролиз мочевины
Современная классификация ферментов также строится с учетом природы реакций, которыми они управляют. Согласно разработанной Комиссией по ферментам Международного биохимического союза классификации, выделяют шесть главных классов ферментов.
- 1. Оксидоредуктазы. Эти ферменты катализируют окислительно-восстановительные реакции, играют большую роль в процессах биологического получения энергии. К ним относятся дегидрогеназы (НАД, НАДФ, ФАД), цитохромы (b, с, с, а, я3), ферменты, участвующие в переносе водорода, электронов и др.
- 2. Т ра нефе разы. Катализируют перенос отдельных радикалов, частей молекул или целых атомных группировок от одних соединений к другим. Например, ацетилтрансферазы переносят остатки ацетата —СН3СО, а также молекулы жирных кислот; фосфо- трансферазы, или киназы, обусловливают перенос остатков фосфорной кислоты Н3РО5 . Известны и другие трансфсразы (амино- трансфсразы, фосфорилазы и т. д.).
- 3. Г ид рол азы. Катализируют реакции расщепления и синтеза белков, жиров и полисахаридов с участием воды. К данному классу относят протеолитические ферменты (или пептидгидролазы), действующие на белки или пептиды; гидролазы глюкозидов, осуществляющие каталитическое расщепление углеводов и глюкозидов ((5-фрукгофуранозидаза, а-глюкозидаза, а- и (5-амилаза, (5-галактози- даза и др.); эстеразы, катализирующие расщепление и синтез сложных эфиров (липазы, фосфатазы).
4. Л и азы. Включают ферменты, катализирующие отщепление от субстратов определенных химических групп с образованием двойных связей или присоединение отдельных групп радикалов к двойным связям. Так, пируватдекарбоксилаза катализирует отщепление С02 от пирувата:
К лиазам относится также фермент альдолаза, расщепляющий шестиуглеродную молекулу фруктозо-1,6-бисфосфата на два трехуглеродных соединения.
- 5. Изомеразы. Участвуют в превращении органических соединений в их изомеры. При изомеризации происходит внутримолекулярное перемещение атомов, атомных группировок, различных радикалов и т. п. Изомеризации подвергаются углеводы и их производные, органические кислоты, аминокислоты и т. д. К данной группе относятся триозофосфатизомсраза, глюкозофосфатизомераза и др.
- 6. Л и газы. Катализируют синтез сложных органических соединений из простых. Например, аспарагинсинтетаза управляет синтезом амида аспарагина из аспарагиновой кислоты и аммиака с обязательным участием АТФ. дающей энергию для этой реакции:
К группе лигаз относят карбоксилазы, катализирующие присоединение С02 к различным органическим кислотам. Например, фермент пируваткарбоксилаза катализирует синтез оксалоацетата из пирувата и С02.
В соответствии со строением ферменты делят на два больших класса: простые белки и сложные белки. К первому классу относят гидролитические ферменты, ко второму, более многочисленному, — ферменты, управляющие окислением и участвующие в реакциях переноса различных химических групп. Ферменты второго класса кроме белковой части, называемой апоферментом, имеют небелковую группу, определяющую активность фермента, — кофактор. В отдельности белковая и небелковая части лишены ферментативной активности. Они приобретают свойства ферментов после соединения. Комплекс апофермента с кофактором называют голоферментом.
Кофакторами могут быть ионы металла (Fe, Си, Со, Zn, Мо и др.), сложные органические соединения (называемые кофермен- тами) либо те и другие вместе. Кофсрменты обычно играют роль промежуточных переносчиков электронов, атомов, групп, которые в результате ферментной реакции перемещаются с одного соединения на другое. Кофермент, прочно связанный с ферментным белком, называют простетической группой фермента. Многие кофсрменты идентичны определенным витаминам группы В или представляют собой их производные.
К кофсрмснтам относят, например, активные группы дегидрогеназ — никотинамидадениндинукдеотид (НАД) или никотин- амидадениндинуклеотидфосфат (НАДО). В перечисленные кофер- менты входит никотиновая кислота (витамин группы В). Витамины есть в составе и других коферментов: тиамин (витамин В,) в составе тиаминпирофосфокиназы, участвующей в обмене пирувата; панто- теновая кислота — в составе кофермента А; рибофлавин (витамин В2) представляет собой простетическую группу флавопротеиновых ферментов. Значение витаминов в питании живых организмов обусловлено как раз тем, что они входят в состав коферментов.
По современным представлениям, ферменты ускоряют химические реакции, понижая свободную энергию активации (количество энергии, необходимое для перевода при данной температуре всех молекул одного моля вещества в активированное состояние).
Ферменты обладают следующими основными свойствами: увеличивают скорость реакции, но сами в данной реакции не расходуются; их присутствие не влияет ни на природу, ни на свойства конечного продукта (продуктов) реакции; очень незначительное количество фермента вызывает превращение больших количеств субстрата; активность ферментов определяется реакцией среды, температурой, давлением и концентрацией как субстрата, так и самого фермента; для каждого фермента характерен свой оптимум температуры и реакции среды.
Многие ферментативные реакции обратимы, хотя активность фермента редко бывает одинаковой в обоих направлениях.
Обычно ферментативная реакция начинается со связывания ферментом определенного субстрата. Как правило, фермент взаимодействует только с одним субстратом и катализирует его трансформацию в другой субстрат до установления равновесия. Следовательно, каждый фермент характеризуется субстратной специфичностью (т. е. взаимодействует только с одним субстратом и продуктом его трансформации) и специфичностью действия (катализируют только одну из многочисленных реакций, которым может подвергнуться данный субстрат).
В связи с высокой специфичностью ферментативных реакций полагают, что участок молекулы фермента, называемый каталитическим центром, к которому присоединяется молекула субстрата, обладает специфичной пространственной конфигурацией, которая «впору» лишь «своей» молекуле субстрата и не соответствует никаким другим молекулам.
Несмотря на незначительные размеры, каждая клетка микроорганизма может производить множество разнообразных ферментов с различными функциями. Обычно ферменты, участвующие в метаболизме, содержатся в клетке организма и поэтому называются внутриклеточными ферментами, или эндоферментами. Отдельные ферменты выделяются клетками микроорганизмов в окружающую среду и называются внеклеточными ферментами, или экзоферментами. Как правило, во внешнюю среду выделяются гидролитические ферменты, разлагающие соединения большой молекулярной массы, которые не могут проникнуть в клетку микроорганизма. Продукты же разложения легко поглощаются клеткой и используются ею в качестве питательных веществ. В разнообразии ферментов, позволяющих микроорганизмам усваивать соединения различной химической природы, заключается огромная роль микрофлоры в круговороте веществ в природе.
мм Получение энергии. Клетка любого организма запасает энергию в форме соединений, обладающих так называемыми макроэргическими связями. При гидролитическом расщеплении макроэргических связей энергия освобождается и может быть использована для биосинтетических реакций. Аккумуляторами и переносчиками энергии служит ряд соединений: аденозинтрифосфат (АТФ), аденозиндифосфат (АДФ), цитозинтрифосфат (ЦТФ), уридинтрифосфат (УТФ), гуано- зинтрифосфат (ГТФ), креатинфосфат, ацетилфосфат и другие соединения. Важнейшим переносчиком энергии является АТФ.
Образование АТФ идет с расходом энергии, поэтому эта реакция происходит только сопряженно с энергетически полезными реакциями. Так, АТФ образуется в результате фотосинтстического фосфорилирования, окислительного фосфорилирования (фосфорилирование в дыхательной цепи) и фосфорилирования на уровне субстрата, т. е. фотосинтеза, дыхания и брожения, которые будут рассмотрены ниже.
Энергетически богатые связи (макроэргические фосфатные связи) обозначают символом ~Р04. Отщепление концевого фосфата сопровождается выделением 3,4* 10 4 - 5,0* 10 4 Дж вместо 1,3* I0 4 Дж, как при разрыве обычных химических связей.
Следовательно, образование соединений с макроэргическими связями составляет основной механизм, благодаря которому в клетках микроорганизмов запасается и сохраняется некоторое количество энергии, расходуемое по мере надобности для биосинтеза, а также для механического движения и осморсгуляции. Следовательно, АТФ представляет собой универсальный переносчик химической энергии между реакциями, поставляющими энергию, и реакциями, потребляющими се.
Окисление и восстановление органических соединений (биологическое окисление) начали изучать в 1780 г., когда французский ученый А. Л. Лавуазье обнаружил, что животные поглощают кислород из воздуха и выделяют С02. Процесс биологического окисления назвали дыханием. Оно свойственно и высшим растениям. Под понятием «окисление» в то время подразумевали процесс соединения вещества с кислородом, а под понятием «восстановление» — процесс отщепления кислорода от вещества.
Сейчас окисление представляют как процесс отнятия от вещества двух атомов водорода, что равносильно удалению двух электронов и двух протонов. Поэтому процесс теперь носит название дегидрирования. В противоположность ему восстановление того или иного соединения представляет собой присоединение двух атомов водорода или двух электронов и двух протонов. Последний процесс называют гидрированием.
Окисление может быть представлено следующим образом:
Суммарная реакция показывает окисление АН2 при помощи В:
В этой реакции АН, — восстановитель, или донор водорода, В — окислитель, или акцептор водорода.
Понятие окисления применимо и к реакциям, связанным только с переносом электронов. Так, реакцию, при которой атомы или молекулы теряют электроны (е~), называют окислением, обратный процесс — присоединение электронов — восстановлением. Например, превращение закисного железа в окисное происходит с потерей электрона и представляет собой реакцию окисления:
Ни электроны, ни атомы водорода не могут накапливаться в среде как таковые. Они должны быть акцептированы каким-либо другим химическим соединением. Поэтому каждое окисление обязательно сопровождается восстановлением.
Переносчиками водорода в реакциях биологического окисления и восстановления служат главным образом два пиридиновых нуклеотида (коферменты анаэробных дегидрогеназ) — никотин- амидадениндинуклеотид (НАД) и никотинамидадениндинуклеотид- фосфат (НАДО). Отнимая водород от окисляемого субстрата, эти соединения переходят в восстановленную форму (НАД*Н2 и НАДО* Н2) и переносят водород на другой акцептор. НАД* Н2 передает водород главным образом на промежуточные продукты брожения или в дыхательную цепь. НАДО* Н2 чаше участвует в реакциях биосинтеза клетки.
Катаболизм жиров и жирных кислот бактериями. Эндогенный энергетический метаболизм бактерий.
Катаболизм углеводов у бактерий. Гликолиз. Гликолитический путь окисления. Путь Эмбдена-Мейерхофа-Парнаса. Пентозофосфатный путь окисления. Схема Варбурга-Диккенса-Хореккера-Рэкера.
В качестве источника питания и энергии при выращивании в искусственных условиях бакте рии наиболее часто используют углеводы. Способность утилизировать различные углеводы -важный диагностический признак. Базовый субстрат — глюкоза, которую бактерии разла гают в процессе дыхания либо брожения. Многие реакции катаболизма глюкозы протекают одинаково у аэробных и анаэробных бактерий, в частности три пути превращения гексоз в триозы (гликолиз, пентозофосфатный путь и путь Энтнера-Дудорова).
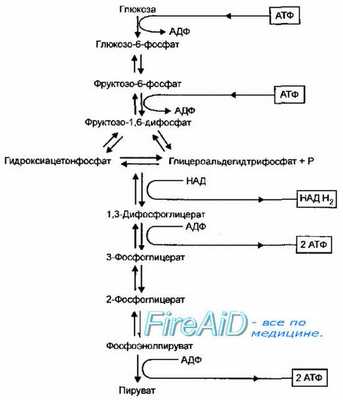
Рис. 4-8. Гликолиз (путь Эмбдена-Мейерхофа-Парнаса)
Гликолиз. Гликолитический путь окисления. Путь Эмбдена-Мейерхофа-Парнаса.
Гликолитический путь (гликолиз, путь Эмбдена-Мейерхофа-Парнаса, фруктозо-1,6-дифосфатный путь) доминирует у большинства аэробных и анаэробных микроорганизмов — кишечной палочки, бацилл, пенициллов, дрожжей, стрептомицетов и многих других. Характерная реакция гликолиза — расщепление фруктозо-1,6-дифосфата альдолазой, в результате чего образуется смесь триозофосфатов, состоящая из дигидрооксиацетонфосфата и глицероальдегидтрифосфата, которые затем превращаются в пируват (рис. 4-8). Фермент обратной связи, лимитирующий скорость процесса, — фруктозо-6-фосфат дегидрогеназа (фосфофруктокиназа). В этом процессе образуется 2 моля АТФ и 2 моля восстановленного НАД (НАДН+ на 1 моль глюкозы.
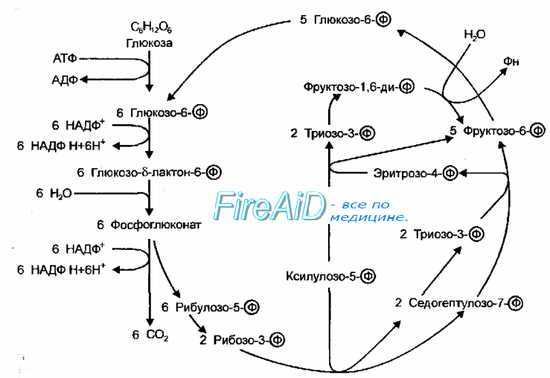
Рис. 4-9. Пентозофосфатный путь окисления. Схема Варбурга-Диккенса-Хореккера-Рэкера.
Пентозофосфатный путь окисления. Схема Варбурга-Диккенса-Хореккера-Рэкера.
Пентозофосфатный путь (схема Варбурга-Диккенса-Хореккера-Рэкера, фосфоглюконатный путь) включает не только образование пентозофосфатов, но и реакции превращения пентозофосфатов в триозо-3-фосфаты (рис. 4-9). В результате изомеризации фруктозо-6-фосфата в глюкозо-6-фосфат и конденсации двух молекул триозо-3-фосфата в гексозофосфат все перечисленные реакции замыкаются в цикл, при одном обороте которого из 3 молекул глюкозо-6-фосфата образуются 2 молекулы фруктозо-6-фосфата, одна молекула триозо-3-фосфата, 3 молекулы С02 и трижды по 2 восстановленных НАДФ (НАДФН+). Последовательность подобных превращений глюкозы у бактерий идентична таковой у высших организмов. Этот путь катаболизма глюкозы следует рассматривать как второстепенный, но имеющий специальное назначение — источник пентоз для синтеза нуклеиновых кислот, а также источник восстановительных эквивалентов НАДФН+.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Тема 14
Метаболизм – это совокупность биохимических процессов, протекающих в клетке и обеспечивающих ее жизнедеятельность. Клеточный метаболизм складывается из двух противоположно направленных процессов: энергетического метаболизма и конструктивного метаболизма. Промежуточные или конечные продукты, образующиеся в соответствующей последовательности ферментативных реакций, в результате которой разрушается или синтезируется ковалентно связанный скелет конкретной биомолекулы, называют метаболитами.
Энергетический метаболизм (катаболизм) – это совокупность реакций окисления различных восстановленных органических и неорганических соединений, сопровождающихся выделением энергии, аккумулируемой клеткой в форме фосфатных связей.
Конструктивный метаболизм (анаболизм) – это совокупность реакций биосинтеза, в результате которых за счет веществ, поступающих извне, и промежуточных продуктов (амфиболитов), образующихся при катаболизме, синтезируется вещество клеток. Этот процесс связан с потреблением свободной энергии, запасенной в молекулах АТФ или других богатых энергией соединениях.
Конструктивный и энергетический метаболизм состоит из ряда последовательных ферментативных реакций, протекание которых условно можно представить следующим образом.
На начальном этапе воздействию подвергаются молекулы химических веществ, которые служат исходными субстратами для метаболизма обоих типов. Иногда эту часть метаболического пути называют периферическим метаболизмом, а ферменты, катализирующие первые этапы превращения субстрата, – периферическими. Последующие превращения включают ряд ферментативных реакций и приводят к синтезу промежуточных продуктов (промежуточный метаболизм). Образующиеся на последних этапах конечные продукты конструктивных путей используются для построения вещества клеток, а энергетических путей – выделяются в окружающую среду.
Конструктивные и энергетические процессы протекают в клетке одновременно. У большинства прокариот они тесно связаны между собой. В процессе анаболизма синтезируются многочисленные ферменты, участвующие в энергетическом метаболизме. С другой стороны, в реакциях катаболизма образуется не только энергия для биосинтетических целей, но и многие промежуточные продукты, которые необходимы для синтеза веществ, входящих в состав клеточных структур.
Метаболизм прокариот, как энергетический, так и конструктивный, отличается чрезвычайным разнообразием. Это является результатом того, что бактерии в качестве источников энергии и углерода могут использовать самый широкий набор органических и неорганических соединений. Соответственно, можно выделить различные типы энергетического и конструктивного обмена микроорганизмов (табл. 1)
Такая способность обусловлена различиями в наборе клеточных экзоферментов, относящихся к классу гидролаз, которые выделяются наружу и разрушают макромолекулы исходных субстратов до веществ с низкой молекулярной массой. Образующиеся в результате действия таких ферментов вещества поступают в клетку бактерий и подвергаются действию эндоферментов. Многие из эндоферментов локализованы на мембранах или на рибосомах, в таком состоянии они называются связанными ферментами. Другие ферменты находятся в свободном, растворенном состоянии в цитоплазме.
Таблица 1 - Типы энергетического и конструктивного обмена микроорганизмов
Метаболизм бактериальной клетки
2) энергетический обмен (протекает в дыхательных мезосомах):
В зависимости от акцептора протонов и электронов среди бактерий различают аэробы, факультативные анаэробы и облигатные анаэробы. Для аэробов акцептором является кислород. Факультативные анаэробы в кислородных условиях используют процесс дыхания, в бескислородных – брожение. Для облигатных анаэробов характерно только брожение, в кислородных условиях наступает гибель микроорганизма из-за образования перекисей, идет отравление клетки.
В микробной клетке ферменты являются биологическими катализаторами. По строению выделяют:
1) простые ферменты (белки);
2) сложные; состоят из белковой (активного центра) и небелковой частей; необходимы для активизации ферментов.
1) конституитивные ферменты (синтезируются постоянно независимо от наличия субстрата);
2) индуцибельные ферменты (синтезируются только в присутствии субстрата).
Набор ферментов в клетке строго индивидуален для вида. Способность микроорганизма утилизировать субстраты за счет своего набора ферментов определяет его биохимические свойства.
По месту действия выделяют:
1) экзоферменты (действуют вне клетки; принимают участие в процессе распада крупных молекул, которые не могут проникнуть внутрь бактериальной клетки; характерны для грамположительных бактерий);
2) эндоферменты (действуют в самой клетке, обеспечивают синтез и распад различных веществ).
В зависимости от катализируемых химических реакций все ферменты делят на шесть классов:
1) оксидоредуктазы (катализируют окислительно-восстановительные реакции между двумя субстратами);
2) трансферазы (осуществляют межмолекулярный перенос химических групп);
3) гидролазы (осуществляют гидролитическое расщепление внутримолекулярных связей);
4) лиазы (присоединяют химические группы по двум связям, а также осуществляют обратные реакции);
5) изомеразы (осуществляют процессы изомеризации, обеспечивают внутреннюю конверсию с образованием различных изомеров);
6) лигазы, или синтетазы (соединяют две молекулы, вследствие чего происходит расщепление пирофосфатных связей в молекуле АТФ).
Виды пластического обмена
Основными видами пластического обмена являются:
Белковый обмен характеризуется катаболизмом и анаболизмом. В процессе катаболизма бактерии разлагают белки под действием протеаз с образованием пептидов. Под действием пептидаз из пептидов образуются аминокислоты.
Распад белков в аэробных условиях называется тлением, в анаэробных – гниением.
В результате распада аминокислот клетка получает ионы аммония, необходимые для формирования собственных аминокислот. Бактериальные клетки способны синтезировать все 20 аминокислот. Ведущими из них являются аланин, глютамин, аспарагин. Они включаются в процессы переаминирования и трансаминирования. В белковом обмене процессы синтеза преобладают над распадом, при этом происходит потребление энергии.
В углеводном обмене у бактерий катаболизм преобладает над анаболизмом. Сложные углеводы внешней среды могут расщеплять только те бактерии, которые выделяют ферменты – полисахаридазы. Полисахариды расщепляются до дисахаров, которые под действием олигосахаридаз распадаются до моносахаров, причем внутрь клетки может поступать только глюкоза. Часть ее идет на синтез собственных полисахаридов в клетке, другая часть подвергается дальнейшему расщеплению, который может идти по двум путям: по пути анаэробного распада углеводов – брожению (гликолизу) и в аэробных условиях – по пути горения.
В зависимости от конечных продуктов выделяют следующие виды брожения:
1) спиртовое (характерно для грибов);
2) пропионионово-кислое (характерно для клостридий, пропиони-бактерий);
3) молочнокислое (характерно для стрептококков);
4) маслянокислое (характерно для сарцин);
5) бутиленгликолевое (характерно для бацилл).
Наряду с основным анаэробным распадом (гликолизом) могут быть вспомогательные пути расщепления углеводов (пентозофосфатный, кетодезоксифосфоглюконовый,фруктозодифосфатный и др.). Они отличаются ключевыми продуктами и реакциями.
Липидный обмен осуществляется с помощью ферментов – липопротеиназ, летициназ, липаз, фосфолипаз.
Липазы катализируют распад нейтральных жирных кислот, т. е. ответственны за отщепление этих кислот от глицерина. При распаде жирных кислот клетка запасает энергию. Конечным продуктом распада является ацетил-КоА фермент.
Биосинтез липидов осуществляется за счет ацетилпереносящих белков. При этом ацетильный остаток переходит на глицерофосфат с образованием фосфатидных кислот, а они уже вступают в химические реакции с образованием сложных эфиров со спиртами. Эти превращения лежат в основе синтеза фосфолипидов.
Бактерии способны синтезировать как насыщенные, так и ненасыщенные жирные кислоты, но синтез последних более характерен для аэробов, так как требует кислорода.
Нуклеиновый обмен бактерий связан с генетическим обменом. Синтез нуклеиновых кислот имеет значение для процесса деления клетки. Синтез осуществляется с помощью ферментов: рестриктазы, ДНК-полимеразы, лигазы, ДНК-зависимой-РНК-полимеразы.
Рестриктазы вырезают участки ДНК, убирая нежелательные вставки, а лигазы обеспечивают сшивку фрагментов нуклеиновой кислоты. ДНК-полимеразы ответственны за репликацию дочерней ДНК по материнской. ДНК-зависимые-РНК-полимеразы отвечают за транскрипцию, осуществляют построение РНК на матрице ДНК.
8. Энергетический и конструктивный метаболизм бактерий.
За исключением некоторых специфических моментов биохимические пути, по которым осуществляется синтез белков, жиров, углеводов и нуклеотидов, у бактерий схожи с таковыми у других организмов. Однако по числу возможных вариантов этих путей и, соответственно, по степени зависимости от поступления органических веществ извне они различаются.
Часть из них может синтезировать все необходимые им органические молекулы из неорганических соединений (автотрофы), другие же требуют готовых органических соединений, которые они способны лишь трансформировать (гетеротрофы).
Наибольшей степенью гетеротрофности отличаются внутриклеточные паразиты. Если при этом они способны существовать на богатых искусственных средах, они называются факультативными (факультативными иногда также называют паразитов, способных проделывать весь свой жизненный цикл во внешней среде, без участия хозяина). Некоторые облигатные (обязательные) внутриклеточные паразиты утратили часть путей биосинтеза и получают многие органические вещества, вплоть до АТФ, из клеток хозяина. Велика степень зависимости от хозяев также многих бактерий-эндосимбионтов. Большинство бактерий принадлежит к сапрофитам: они не питаются непосредственно веществами других организмов, но используют синтезированные ими органические вещества после их смерти. Существует также ряд бактерий, требующих наличия в среде небольшого круга определённых органических веществ (аминокислот, витаминов), которых они не могут синтезировать самостоятельно и, наконец, гетеротрофы, которые нуждаются лишь в одном довольно низкомолекулярном источнике углерода (сахар, спирт, кислота). Некоторые из них отличаются высокой специализацией (Bacillus fastidiosus может использовать только мочевую кислоту), другие в качестве единственного источника углерода и энергии могут использовать сотни различных соединений (многие Pseudomonas).
Удовлетворять потребности в азоте бактерии могут как за счёт его органических соединений (подобно гетеротрофным эукариотам), так и за счёт молекулярного азота (как и некоторые археи). Большинство бактерий используют для синтеза аминокислот и других азотсодержащих органических веществ неорганические соединения азота: аммиак (поступающий в клетки в виде ионов аммония), нитриты и нитраты (которые предварительно восстанавливаются до ионов аммония). Фосфор они способны усваивать в виде фосфата, серу — в виде сульфата или режесульфида.
Энергетический метаболизм
Способы же получения энергии у бактерий отличаются своеобразием. Существует три вида получения энергии (и все три известны у бактерий): брожение, дыхание и фотосинтез.
Брожение — серия окислительно-восстановительных реакций, в ходе которых образуются нестабильные молекулы, с которых остаток фосфорной кислоты переносится на АДФ с образованием АТФ (субстратное фосфорилирование). При этом возможно внутримолекулярное окисление и восстановление.
Дыхание — окисление восстановленных соединений с переносом электрона через локализованную в мембране дыхательную электронтранспортную цепь, создающую трансмембранный градиент протонов, при использовании которого синтезируется АТФ (окислительное фосфорилирование). В то время как эукариоты в конечном итоге почти всегда «сбрасывают» электрон накислород (лишь в редких случаях акцептором электронов могут служить нитраты), бактерии могут использовать вместо него окисленные органические и минеральные соединения (фумарат,углекислый газ, сульфат-анион, нитрат-анион и др.; см. анаэробное дыхание), а вместо окисляемого органического субстрата использовать минеральный (водород, аммиак, сероводород и др.), что часто бывает сопряжено с автотрофной фиксацией CO2 (см. хемосинтез).
Фотосинтез бактерий может быть двух типов — бескислородный, с использованием бактериохлорофилла (зелёные, пурпурные и гелиобактерии) и кислородный с использованиемхлорофилла (цианобактерии (хлорофилл a), прохлорофиты (a и b)). Цианобактерии, глаукоцистофитовые, красные и криптофитовые водоросли — единственные фотосинтезирующие организмы, содержащие фикобилипротеины. У архей встречается бесхлорофилльный фотосинтез с участием бактериородопсина (правда, энергия света используется при этом не для фиксации CO2, а непосредственно для синтеза АТФ, так что в строгом смысле это не фотосинтез, а фотофосфорилирование).
Бактерии, осуществляющие только бескислородный фотосинтез, не имеют фотосистемы II. Во-первых, это пурпурные и зелёные нитчатые бактерии, у которых функционирует только циклический путь переноса электронов, направленный на создание трансмембранного протонного градиента, за счёт которого синтезируется АТФ (фотофосфорилирование), а также восстанавливается НАД(Ф) + , использующийся для ассимиляции CO2. Во-вторых, это зелёные серные и гелиобактерии, имеющие и циклический, и нециклический транспорт электронов, что делает возможным прямое восстановление НАД(Ф) + . В качестве донора электрона, заполняющего «вакансию» в молекуле пигмента в бескислородном фотосинтезе используются восстановленные соединения серы (молекулярная, сероводород, сульфит) или молекулярный водород.
Читайте также:
