Лекарства при инфекциях. Фармакология инфекционных болезней
Добавил пользователь Дмитрий К. Обновлено: 30.01.2026
Необходимость госпитализации больного в стационар определяется тяжестью течения заболевания, его контагиозностью. Существуют инструкции, которые определяют перечень тех заболеваний, при которых больные, независимо от их желания и тяжести течения болезни, должны быть госпитализированы. Обязательной госпитализации подлежат больные с особо опасными инфекциями.
В стационаре должен соблюдаться принцип максимального разобщения больных с различными инфекционными заболеваниями и даже желательно — с учетом периода болезни.
Режим больного определяется не только его состоянием, но и особенностями патогенеза заболевания (вероятность осложнения в различные периоды), наличием и характером сопутствующих заболеваний. Следует всегда помнить, что больные нередко не могут объективно и критически оценить тяжесть своего состояния. Это задача врача.
Диета имеет большое значение в лечении инфекционных больных, особенно при заболеваниях кишечника, печени, почек. При первой беседе с больным и его родственниками врач должен подробно объяснить им особенности питания, связанные с заболеванием.
Определение объема и характера медикаментозной терапии, назначаемой больному, — один из наиболее сложных и ответственных моментов. И до настоящего времени не потеряли актуальность пять заповедей академика А.Ф.Билибина, которым нужно следовать при лечении больных с инфекционной патологией.
Лечение должно подражать естественному ходу освобождения организма от болезни.
Воздействовать следует на ведущее звено в патогенетической цепи.
Помнить о единстве: возбудитель, макроорганизм, среда.
Повышать функцию защитных механизмов.
Учитывать фон, на котором возникла болезнь.
При лечении больных важно четко определить характер и объем этиотропной, патогенетической и симптоматической терапии.
Этиотропная терапия (от греч. aitia — причина, tropos — направление; этиотропный — направленный против причины заболевания, устраняющий или ослабляющий действие фактора, вызвавшего заболевание). Этиотропное действие может быть направлено на возбудителя или (и) его токсины.
Для борьбы с живыми возбудителями широко используют химиоте-рапевтические средства. Термин «химиотерапия» был введен еще в
конце XIX ст. Эрлихом и означал «использование лекарственных средств для поражения паразитов без вреда для организма хозяина».
Этиотропные средства (то есть воздействующие на причинный фактор инфекционной болезни) можно условно разделить на специфические и неспецифические (химиопрепараты и биологические препараты) (рис. 3).

антибактериальные (антибиотики,сульфаниламиды, нитрофураны и др.) противовирусные (виролекс, ремантадин, бонафтон и др.) противопротозойные (ятрен, делагил, примахин и т.д.) антигельминтные (нафта-мон, декарис и др.) и т.д.
иммунные сыворотки иммуноглобулины бактериофаги
бактисубтил и др.
Характеристика этиотропных средств
Химиопрепараты — наиболее обширная группа этиотропных средств.
Антибиотики — один из основных компонентов лечения инфекционных больных. «Эра антибиотиков» начинается с открытия в 1929 г. А. Флемингом пенициллина, и в настоящее время их насчитывается несколько сотен. При назначении антибиотиков следует учитывать множество самых различных факторов, влияющих на эффективность лечения, а именно:
механизм действия препарата (бактерицидный или бактерио-статический), особенно это важно при генерализованных инфекциях во избежание развития ИТШ. Нужно помнить, что один и тот же антибиотик может на одних возбудителей оказывать бактерицидное, на других — бактериостатическое действие;
с осторожностью назначать «ударные дозы» (увеличение вероятности развития ИТШ!);
не назначать один и тот же препарат длительно (не более 7—10 дней) из-за увеличения вероятности аллергических и токсических реакций, привыкания к нему микроорганизмов и формирования устойчивых форм;
при длительном применении антибиотики могут вызвать канди-доз, кишечный дисбактериоз и как следствие последнего — авитаминозы и даже суперинфекцию;
увеличение числа аллергических реакций на антибиотики требует перед их назначением тщательного изучения аллергологи-ческого анамнеза больного, а в ряде случаев постановки пробы на чувствительность к препарату (например, при назначении пенициллина);
назначать антибиотики следует в достаточных дозах. Помнить, что избыточные дозы увеличивают вероятность токсических реакций, малые — формируют устойчивость возбудителя к препарату; лучше всего рассчитывать необходимую дозу с учетом массы тела больного (на 1 кг массы тела). Обязательно при этом учитывать возможность кумуляции препарата в организме, состояние всех органов и систем, способных отрицательно отреагировать на данный препарат;
не следует уменьшать дозу препарата в процессе лечения, даже если состояние больного явно улучшается, так как это способствует формированию устойчивых штаммов и очищение организма от инфекции идет медленнее. А при нейроинфекциях по мере уменьшения воспаления к тому же уменьшается проницаемость гематоэнцефалического барьера для антибиотика и возможен рецидив болезни;
избегать комбинации из двух и более антибиотиков, так как при этом усиливается токсическое и аллергическое действие. Комбинации кратковременно допустимы лишь при неясном диагнозе для расширения спектра их действия;
учитывать избирательную высокую чувствительность некоторых возбудителей к отдельным препаратам и при выборе лечебных средств отдавать им предпочтение (при брюшном тифе —
левомицетину, при сыпном тифе — тетрациклину, при дифтерии — эритромицину). Иногда при неясном диагнозе такая терапия помогает в дифференциальной диагностике;
помнить об органотоксичности некоторых антибиотиков. Не назначать, например, тетрациклины при паренхиматозных гепатитах (для лечения сопутствующих патологических процессов), стрептомицин — при поражении почек;
важен способ введения антибиотика с учетом его свойств. При локализованных инфекциях (некоторых кишечных) предпочтительнее пероральное назначение препарата, который плохо всасывается из кишечника и таким образом способен более длительно оказывать местное действие, при генерализованных — парентеральное. Учитывать способность препарата проникать в межклеточные пространства и через гематоэнцефали-ческий барьер;
соблюдать оптимальную кратность введения препарата, которая определяется сроками выведения его из организма (то есть длительностью циркуляции);
при выборе антибиотиков по возможности предпочтение отдавать тем, у которых наиболее велик разрыв между лечебной и токсической дозами;
не спешить с отменой назначенного антибиотика только на том основании, что заметного улучшения в состоянии больного не наблюдается в течение первых 1—2 дней лечения. Об эффективности средства можно с определенной степенью точности судить не ранее чем через 3 дня от начала его применения. Лишь по прошествии этого срока можно ставить вопрос о пересмотре лечебной тактики. Более того, при назначении бактерицидного препарата возможно даже кратковременное ухудшение самочувствия больного, обусловленное усилением эндоток-сикоза (существует даже мнение, что при тяжелых генерализованных инфекциях лечение следует начинать с половины необходимой дозы);
необходимо учитывать характер взаимодействия антибиотиков друг с другом, с другими медикаментами, пищей и иными факторами, которые могут ослаблять или усиливать взаимный эффект.
Антибиотики, обладая широким спектром действия, влияют на различные бактерии, спирохеты, лептоспиры, хламидии, грибы, но неэффективны при вирусных, протозойных инфекциях, гельминтозах. В табл. 2 представлены самые общие сведения лишь о небольшой части применяемых в настоящее время антибиотиков с учетом их происхождения и характера действия на бактериальную клетку (бактерицидное или бактериостатичес-кое). Следует отметить, что существует большое количество различных
Таблица 2. Антибиотики, применяющиеся для лечения больных с инфекционной патологией
Лекарства при инфекциях. Фармакология инфекционных болезней
Бактериальные инфекции и лекарства. Классификация антибактериальных препаратов
Бактериальные инфекции очень широко распространены и все еще остаются существенной причиной заболеваемости и смертности.
Бактериальная диарея является основной причиной детской смертности во всем мире, а туберкулез часто служит причиной летального исхода инфекционных заболеваний. Применение антибактериальных лекарственных препаратов представляет собой одно из важнейших терапевтических достижений XX в., позволившее существенно изменить характер многих бактериальных заболеваний благодаря снижению смертности (например, от бактериального менингита и бактериального эндокардита) и заболеваемости. С другой стороны, в настоящее время антибиотики принадлежат к числу средств, очень часто назначаемых без достаточных оснований. Отчасти это происходит потому, что многие из них обладают высокой степенью безопасности. Это приводит к их неправильному использованию, например при вирусных инфекциях.
Кроме того, некоторые из старых, давно открытых антибиотиков используют в качестве стимуляторов роста животных, мясо которых употребляют в пищу, вследствие чего антибиотик включается в пищевую цепочку у человека в субтерапевтических дозах. В результате чрезмерного использования антибиотиков все более актуальной становится глобальная проблема возникновения резистентности к антибиотикам. Особую тревогу вызывает распространение резистентных к метициллину стафилококковых инфекций как в больницах, так и среди населения.
Антибактериальные препараты в зависимости от их происхождения (способа получения) классифицируют на антибиотики, химиотерапевтические или синтетические лекарства и полусинтетические лекарства.
• Продукты жизнедеятельности микроорганизмов (антибиотики).
• Лекарства, получаемые исключительно в лабораторных условиях (химиотерапевтические или синтетические).
• Лекарства, которые готовят, используя комбинацию двух указанных способов (полусинтетические).

На практике термин «антибиотик» стал синонимом антибактериального препарата, и сейчас такое вольное определение антибиотиков получило всеобщее распространение.
В идеальном случае антибактериальные лекарства блокируют жизненно важные функции бактерий, не влияя на подобные функции клеток организма-хозяина.
Когда говорят, что антибиотики обладают избирательной токсичностью, имеют в виду, что они нарушают жизненно важные функции бактерий, не оказывая влияния (или оказывая минимальное влияние) на клетки инфицированного организма. Причина такой избирательности заключается в том, что бактерии обладают специализированной и особым образом построенной клеточной стенкой, тогда как клетки млекопитающих — обычной клеточной мембраной. В связи с этим вещества, нарушающие синтез или целостность стенки бактериальной клетки, являются токсичными для бактерий, но безвредными для клеток организма-хозяина.
Подобным же образом прокариотическая бактериальная рибосома (70S) настолько сильно отличается от рибосомы эукариот (80S), что служит хорошей мишенью для антибактериальных препаратов. На рис. 6.7 изображены места действия антибиотиков различных классов. В результате избирательной токсичности многие антибиотики имеют высокий терапевтический индекс (т.е. соотношение между токсической и терапевтической дозами). Разумеется, как врожденный иммунный ответ, так и специфические иммунологические механизмы способствуют устранению бактериальной инфекции вместе с антибиотиками, назначаемыми для ускорения этого процесса и предотвращения развития генерализованной инфекции. Применение антибиотиков в борьбе с инфекциями особенно важно в тех случаях, когда функции иммунной системы у пациентов нарушены, например при ВИЧ-инфекции или нейтропении.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лекарства для лечения вирусных инфекций
Вирусы состоят в основном из генетического материала (нуклеиновой кислоты) и защитной оболочки, образованной белками, которая часто покрыта фосфолипидным бислоем со встроенными белками. У них отсутствует метаболическая система, а рост и репликация зависят от инфицированной клетки.
Целенаправленная терапевтическая супрессия репликации вируса достигается за счет ингибирования метаболических процессов, которые являются специфическими для вирусной репликации в инфицированных клетках.
I. Вирусная репликация рассмотрена на примере вируса простого герпеса:
1. Вирусные частицы связываются с мембраной клетки хозяина (адсорбция) посредством оболочечных гликопротеидов, которые контактируют со специфическими структурами клеточной мембраны.
2. Вирусная оболочка сливается с плазмолеммой клеток хозяина, а нуклеокапсид (нуклеиновая кислота + капсула) проникает во внутреннюю среду клетки (пенетрация).
3. Капсид сбрасывается («раздевание» вируса) около ядерных пор, а вирусная ДНК направляется к клеточному ядру. С этого момента генетический материал вируса начинает управлять системой клеточного метаболизма.
4а. Синтез нуклеиновой кислоты. Происходит репликация генетического материала (ДНК в данном примере) и продукция РНК с целью синтеза белка.
4b. Белки используются в качестве вирусных ферментов, катализирующих размножение вирусов (ДНК-полимераза и тимидинкиназа), при встраивании в клеточную мембрану хозяина капсомеров или компонентов оболочки.
5. Отдельные компоненты образуют новые вирусные частицы (созревание).
6. Высвобождение дочерних вирусов приводит к распространению вируса внутри и вне организма.
У вируса герпеса репликация приводит к разрушению клеток хозяина и развитию симптомов заболевания.
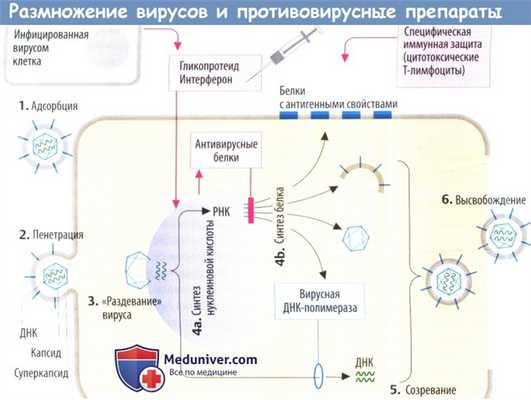
II. Противовирусные механизмы. Организм нарушает репликацию вируса с помощью цитотоксических Т-лимфоцитов, которые распознают и разрушают вируспродуцирующие клетки (на их поверхности находятся вирусные белки) или с помощью антител, которые связывают и инактивируют внеклеточные вирусные частицы. Вакцинация разработана с целью запуска специфической иммунной защиты.
а) Интерфероны (IFN) — гликопротеиды, которые в отличие от других препаратов высвобождаются из инфицированных вирусом клеток. В соседних клетках интерферон стимулирует образование антивирусных белков. Они ингибируют синтез вирусных белков за счет (предпочтительного) разрушения вирусной ДНК или ингибирования трансляции. Интерфероны не направлены против конкретного вируса, а имеют широкий спектр антивирусной активности, который, тем не менее, является видоспецифическим.
Следовательно, интерферон для использования у человека необходимо получать из его клеток, а именно лейкоцитов (IFN-a), фибробластов (IFN-β; или лимфоцитов (IFN-y). Интерфероны используются при лечении определенных вирусных заболеваний, а также злокачественных новообразований и аутоиммунных расстройств. Например, IFN-a применяется при хроническом гепатите С, волосатоклеточном лейкозе и рассеянном склерозе.
б) Вирусостатические антиметаболиты являются ложными «строительными блоками» ДНК или нуклеозидами. Нуклеозид (тимидин) состоит из нуклеотидного основания (тимин) и углевода дезоксирибозы. В антиметаболитах один из компонентов имеет дефект. В организме измененные нуклеозиды подвергаются биоактивации путем присоединения трехфосфатных остатков.

в) Идоксуридин и синергисты встраиваются в ДНК с отрицательными последствиями, в т. ч. нарушением синтеза ДНК человека. Поэтому идоксуридин и аналоги подходят только для местного использования (при простом герпетическом кератите).
г) Среди вирусостатических антиметаболитов ацикловир имеет высокую специфичность, т. к. его биоактивация происходит только в инфицированных клетках, где он предпочтительно ингибирует синтез вирусной ДНК.
1. Кодируемая вирусом тимидинкиназа (специфичная для вирусов простого герпеса и ветряной оспы) осуществляет первый этап фосфорилирования. Два других фосфатных остатка присоединяются клеточной киназой.
2. Полярные фосфатные остатки делают мембрану непроницаемой для ацикловира трифосфата, что приводит к его накоплению в инфицированных клетках.
3. Ацикловира трифосфат является предпочтительным субстратом вирусной ДНК-полимеразы. Он ингибирует активность ферментов, а после встраивания в вирусную ДНК вызывает расщепление нити, т. к. у него отсутствует З'-ОН-группа дезоксирибозы, которая необходима для присоединения дополнительных нуклеотидов. При тяжелых инфекциях, вызванных вирусом простого герпеса (энцефалит, генерализованная инфекция) и вирусом ветряной оспы (тяжелый опоясывающий лишай), его вводят в виде в/в инфузии.
Ацикловир также применяют внутрь, несмотря на неполное (15-30%) кишечное всасывание. Кроме того, он используется местно.

г) У валацикловира гидроксильная группа этерифицирована с аминокислотой L-валином. Это позволяет использовать дипептидный переносчик тонкой кишки, что почти удваивает скорость кишечного всасывания препарата по сравнению с ацикловиром. В дальнейшем при отщеплении остатка валина образуется ацикловир.
д) Ганцикловир используется при лечении тяжелых цитомегаловирусных инфекций (тоже принадлежащих к группе герпеса). Они не образуют тимидинкиназу, поэтому фосфорилирование начинается другим вирусным ферментом. Ганцикловир хуже переносится, нередко приводит к развитию лейкопении и тромбопении. Он вводится в виде инфузии или внутрь как эфир валина (валганцикловир).
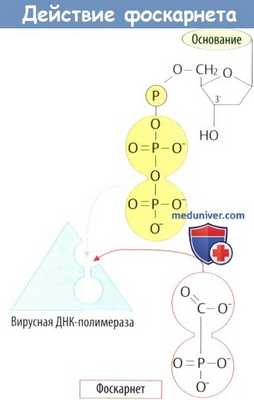
е) Фоскарнет представляет собой аналог дифосфата. Встраивание нуклеотида в нить ДНК приводит к отщеплению дифосфатного остатка. Фоскарнет ингибирует ДНК-полимеразу за счет взаимодействия со связывающим участком. Показания: системная терапия тяжелых цитомегаловирусных инфекций у больных СПИДом; местное лечение герпесвирусных инфекций.
ж) Препараты для лечения вирусных гепатитов. Интерферон-а действует против вирусов гепатитов В и С (HBV, HCV) во время репликации. Присоединение молекулы полиэтиленгликоля к IFN-a (пегилирование) позволяет пегилированному IFN-a медленнее высвобождаться из места инъекции и выводиться почками, что увеличивает продолжительность действия пегилированного препарата.
Вирусостатические антиметаболиты необходимо рассматривать индивидуально в зависимости от возбудителя. Гепатит В: ламивудин, первоначально использовавшийся только как анти-ВИЧ препарат, в низких дозах эффективен против HBV. Телбивудин и энтекавир тоже являются производными нуклеозидов. Фосфонат адефовира дипивоксил, который активен против ламивудин-резистентного HBV, является атипичным нуклеотидом. Гепатит С: молекулярный механизм действия рибавирина, в котором изменены основание и остаток сахара (D-рибоза), неясен.

з) Препараты против вируса гриппа. Амантадин обладает специфическим свойством в отношении репликации вирусов гриппа А (РНК), этиологических факторов истинного гриппа. Эти вирусы захватываются клетками путем эндоцитоза. Для «раздевания» вирусной РНК и дальнейшего проникновения вируса внутрь клетки необходимы протоны водорода из кислотного содержимого эндосом. Амантадин блокирует белок канала в вирусной оболочке, через который входят протоны. Таким способом предотвращается «раздевание».
Препарат используется для профилактики, и поэтому его принимают до обострения симптомов. Он также является антипаркинсоническим средством.
Ингибиторы нейраминидазы предупреждают высвобождение вирусов гриппа А и В. Обычно вирусная нейраминидаза отщепляет N-ацетилнейраминовые (сиаловые) кислотные остатки на поверхности клеточной оболочки, что дает возможность вновь образованным вирусным частицам отделиться от клетки хозяина. Занамивир вводится в виде ингаляции. Оселтамивир подходит для применения внутрь, т. к. представляет собой сложный эфир пролекарства. Он используется при лечении и профилактики инфекций, вызванных гриппом.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лечение инфекционной диареи — препараты, снижающие моторику и антисекреторные средства

Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 13.01.2022
- Reading time: 7 минут чтения
Инфекционная диарея – это инфекционное заболевание с дисбалансом в кишечном микробиоме. Этиологическим фактором могут быть вирусы, бактерии и паразиты. Патология включает в себя большинство случаев гастроэнтерита, диареи путешественников и острой диареи продолжительностью не менее двух недель.
Инфекционная диарея, после сердечно-сосудистых заболеваний, — вторая по значимости причина смерти в мире. Особенно это касается бедных стран с низким уровнем жизни. По статистике, ротавирусные инфекции вызывают 120-140 млн случаев заболеваний в год.
Инфекционная диарея – причины и источники инфекции
Наиболее распространенные причины инфекционной диареи:
- Вирусы: ротавирус, аденовирус, астровирус и др;
- Бактерии, например, сальмонелла, шигелла, кампилобактер;
- Паразиты: лямблии, амебы;
- Грибы.
Источником инфекции может быть вода или пища, загрязненная микроорганизмами. Резервуар патогенных микробов — больные люди и животные. Заражение происходит после приема пищи, загрязненной выделениями из пищеварительной системы инфицированного человека. Также заразиться можно от продуктов, полученных от больного животного, подвергшихся неправильной термической обработке: непастеризованное молоко, яйца, мясо. Иногда заражение происходит при прямом контакте.
Инфекционная диарея может протекать в виде единичных случаев или коллективного заражения, вызванного воздействием патогена, например, во время приема. Вид пищевого отравления связан с сезонностью:
- инфекции, вызванные Campylobacter jejuni, чаще возникают весной;
- инфекции, связанные с Shigella и Salmonella летом;
- ротавирусные и энтерокольные инфекции Yersinia фиксируются в основном в зимние месяцы.
Вирусная диарея
Острая диарея вирусной этиологии характеризуется повышенным количеством водянистого или полужидкого стула (обычно более трех раз в сутки). Наиболее частая причина этого заболевания в развитых странах, при хороших санитарных условиях, — вирусные инфекции желудочно-кишечного тракта.
Патология часто сопровождается другими симптомами, характерными для вирусной инфекции — рвотой и лихорадкой.
Заболевание передается фекально-оральным путем и легко распространяется в среде больного человека. Вирусная диарея очень заразна, и для заражения достаточно небольшого количества инфекционного материала, содержащего от 10 до 100 вирусных частиц. Заражение происходит через загрязненную воду или пищу, грязные руки.
Источником инфекции может быть больной человек, выздоровевший человек, который вместе с калом выделяет вирусы или человек, инфицированный бессимптомно. Основной этиологический фактор — несколько типов вирусов:
- ротавирусы (особенно у младенцев и маленьких детей, но могут вызывать инфекции и у взрослых);
- норовирусы;
- саповирусы (относятся к семейству калицивирусов);
- кишечные аденовирусы (тип 40, 41).
В умеренном климате наибольшая выраженность вирусных инфекций (около 80% случаев) отмечается в осенне-зимний период. Чаще всего болеют маленькие дети (6 месяцев – 2 года). У взрослых заболевание протекает реже, обычно бессимптомно или в легкой форме.
Независимо от типа вируса, течение болезни схоже. Заболевание характеризуется внезапным началом диареи или рвоты, сопровождающейся лихорадкой, болями в животе, отсутствием аппетита и недомоганием. Стул обильный и водянистый по своей природе, обычно не содержит слизи или крови.
Вирусы, чаще всего вызывающие диарею:
- Ротавирусы . Вызывают диарею у младенцев и маленьких детей до 2 лет, взрослые подвергаются легкой форме заболевания или бессимптомно; . Период инкубации составляет 8–10 дней. Вызывает диарею у детей младше 2 лет. Они не характеризуются сезонностью, встречаются круглый год;
- Астровирусы . Вызывают диарею у детей до 7 лет, период инкубации составляет 24-36 часов, короче, чем в случае с аденовирусами. Наибольший пик заболевания приходится на осенне-зимний период;
- Норавирусы. Характеризуются высокой инфекционной способностью. Заражение происходит в результате контакта с больным человеком, предметами или загрязненной пищей и водой. Чаще всего встречаются в больницах, столовых, домах престарелых, детских садах. Помимо диареи, наблюдаются сильные боли в суставах и головная боль. Продолжительность диареи у детей составляет неделю, а у взрослого 1–3 дня.
Бактериальная диарея
Причина бактериальной диареи — инфекции пищеварительной системы, вызванные болезнетворными бактериями. Чаще всего они вызваны плохими санитарными условиями или отсутствием гигиены. Заражение часто происходит в развивающихся странах с более низкими санитарными нормами и теплым климатом, где бактерии имеют благоприятные условия для размножения в воде и пище.
Место бактериальной инфекции чаще всего — толстая кишка, из-за чего стул менее обильный, чем при вирусной диарее. Кроме того, кал может содержать слизь, кровь или гной. Характерная черта бактериальной диареи — отсутствие рвоты.
Бактериальная диарея распространяется фекально-оральным путем. Однако она менее заразна, чем вирусная диарея. Чаще всего это зоонозные заболевания. Источник инфекции не только больной или носитель, но и больное животное или пища животного происхождения. Основные этиологические факторы кишечные бациллы:
- токсин-продуцирующие штаммы кишечной палочки;
- Salmonella enteritidis;
- Shigella;
- Yersinia;
- Campylobacter jejuni.
Бактериальная диарея — наиболее распространенное заболевание путешественников (80–85% случаев). Практически каждый человек, который путешествует в страны с более низкими гигиеническими стандартами, испытывает, по крайней мере, один эпизод инфекционной диареи. Инфекционная диарея, вызванная бактериями, возникает чаще всего в летний сезон.
Лечение диареи
Диарея — реакция организма на заражение патогенными микроорганизмами и обычно является самоограничивающейся. Проблема для больных – осложнения после диареи: электролитные нарушения или обезвоживание. Лечение инфекционной диареи направлено на противодействие обезвоживанию и восполнение электролитов.
Пероральная регидратация включает в себя прием большого количества жидкости, которая хорошо всасывается. Специализированные регидратационные жидкости содержат натрий (основной внеклеточный электролит) и глюкозу, что облегчает ее всасывание (независимо от механизма диареи). Жидкость не должна содержать слишком много осмотически активных веществ, сахаров и электролитов.
Помимо специализированных жидкостей, имеющихся в аптеках, можно принимать минеральную воду, чай, натуральные йогурты без добавления сахара. Взрослому человеку нужно пить примерно 100-200 мл жидкости на каждый стул. Также следует помнить о легкоусвояемой диете.
Дополнительное средство, не заменяющее лекарства, при лечении диареи — пробиотики, которые содержат в своем составе бактерии, благотворно влияющие на восстановление кишечного микробиома. Согласно текущим рекомендациям, пациентам с инфекционной диареей назначают пробиотики с документированными эффектами, содержащие штаммы Lactobacillus или Saccharomyces boulardii. Терапия с применением пробиотиков рекомендуется во время и после диареи. При выборе пробиотического препарата стоит обратить внимание, что он имеет статус лекарственного средства.
Чтобы быстро восстановить бактериальную флору, разрушенную после диареи, стоит использовать синбиотики. Это комбинации пробиотика с пребиотиком. Помимо бактерий, они содержат питательные вещества, которые поддерживают бактерии и позволяют им быстро размножаться.
Лекарственная противодиарейная терапия
Существует два основных класса противодиарейных средств, использующихся для уменьшения частоты стула, спазмов в животе и объема стула.
- снижающие моторику;
- антисекреторные агенты.
Чаще всего используются средства, снижающие моторику: лоперамид и комбинация дифеноксилат-атропин. Действуют за счет удлинения времени прохождения химуса через кишечник и повышения способности реабсорбции жидкости и электролитов. Оказывают умеренное влияние на сокращение потерь воды со стулом.
Лоперамид
Изобретен в 1969 г, внесен в перечень основных ЛС (ВОЗ). Производится с 1973 г под брендом Имодиум®. В РФ производится под торговыми наименованиями: Диара, Лопедиум, Веро-лоперамид, Лоперамид-Акри, Лоперамид.
Лоперамид обладает антисекреторной активностью, но этот вклад в его клиническую эффективность незначителен. Считается препаратом первой линии при самолечении. Изучался в различных рандомизированных контролируемых исследованиях, польза препарата установлена. Правда, в сочетании с антибиотиком, в одних испытаниях эффект есть, в других – нет.
Лоперамид, и другие агенты, снижающие моторику, не рекомендуются для детей и младенцев из-за потенциальных побочных эффектов со стороны ЦНС и теоретической возможности угнетения дыхания. Обычно не рекомендуются и при дизентерии из-за риска расширения толстой кишки, связанного с инфекционным колитом.
Тем не менее доказано, что лоперамид безопасен при лечении бактериальной дизентерии, если используется в сочетании с антибиотиками. Предполагается, что средства, снижающие моторику, увеличивают перенос кишечных энтеропатогенных бактерий в фекалиях, но доказательств мало.
Самые частые причины внебольничной инфекционной диареи – вирусы. Наиболее подходящий подход в большинстве случаев: консервативное лечение, включающее пероральную регидратацию с лоперамидом (или без него).
По клинико-фармакологической и фармакотерапевтической группам лоперамид относится к противодиарейным средствам.
- Снижение тонуса, моторики гладких мышц кишечника. Эффект достигается за счет связи с опиоидными рецепторами, расположенными в стенке;
- Снижение перистальтики, удлинение продолжительности прохождения химуса по кишечнику. Эффект достигается за счет ингибирования высвобождения ацетилхолина, простагландинов;
- Замедление секреции и жидкости, и электролитов. Эффект доказан in vivo и in vitro, на животных и на людях. Достигается различными путями. Например, лоперамид воздействует на простагландин Е2, а PGE2 способствует выведению воды и солей. Кроме того, лоперамид напрямую воздействует на эпителиальные клетки кишечника, что приводит к ингибированию ионов хлора (хлоридов);
- Урежение позывов и повышение тонуса анального сфинктера.
Действие наступает быстро, продолжается 4-6 часов.
- Фармакокинетика . Абсорбция – около 40%. При первом прохождении через печень, подвергается интенсивному метаболизму. Через ГЭБ (гематоэнцефалический барьер) не проникает. В системный кровоток поступает лишь незначительное количество. Основной метаболизм – через печень.
- Показания . Снятие симптомов диареи различного происхождения (вирусная, аллергическая, лекарственная, инфекционная). При бактериальной диарее назначают в комбинации с противомикробными средствами.
- Дозирование . Взрослым принимать первоначально однократно 4 мг, затем 2 мг после каждого опорожнения кишечника. Максимальная дозировка в сутки – 16 мг. Для применения у детей необходима предварительная консультация со специалистом, детям от 9 до 12 лет назначают 2 мг (кратность 4 раза в день), детям 4-8 лет по 1 мг (кратность 3-4 раза в день).
- Побочные действия . Со стороны ЖКТ: вздутие, тошнота, запоры. Также сонливость, головокружение, утомляемость (со стороны ЦНС). Иногда кожная сыпь.
- запор;
- метеоризм;
- кишечная непроходимость;
- язвенный колит (в фазе обострения);
- псевдомембранозный колит, вызванный антибиотиками широкого спектра действия;
- дети до 4 лет;
- беременность (I триместр);
- непереносимость.
- Во время беременности (II и III триместры) назначают, если польза превышает риск для плода. В период лактации не рекомендуется, поскольку проникает в грудное молоко.
- При нарушении функции печени назначают с осторожностью, особенно при недостаточности.
- Если эффект отсутствует в течение 1, максимум 2 дней, необходимо обратиться к врачу.
- колестирамин уменьшает эффективность (но предположительно);
- ко-тримоксазол, ритонавир при одновременном приеме повышают биодоступность лоперамида, поскольку его метаболизм при первом прохождении через печень замедляется.
Антисекреторные средства при инфекционной диарее
Поиск идеального антисекреторного агента, т.е. лекарства, способного напрямую ингибировать секреторные процессы в энтероците, продолжается. Начальной фармакологической мишенью были внутриклеточные сигнальные механизмы, особенно ассоциированные с кальцием и кальций-связывающим белком кальмодулином. Разработки были прекращены из-за отсутствия дополнительных преимуществ по сравнению со стандартными противодиарейными средствами.
В последнее время внимание сосредоточено на энтеральной или кишечной нервной системе (ЭНС). Точно установлено, что ЭНС участвует в стимулировании секреции. Ряд нейротрансмиттеров идентифицирован, многие участвуют в кишечной секреции и, следовательно, рассматриваются в качестве потенциальных фармакологических мишеней для лечения водянистой диареи.
Другой подход заключался в разработке ингибитора энкефалиназы. К веществу этой группы относится рацекадотрил. Рацекадотрил обладает проабсорбционной активностью за счет способности потенцировать эндогенные энкефалины в кишечнике. Это эффективное средство для снижения массы стула и частоты дефекации, его можно безопасно применять у детей, не вызывает запоров (в отличие от противодиарейных средств, снижающих моторику).
Гидрасек
Действующее вещество рацекадотрил 100 мг, выпускается в капсулах.
По клинико-фармакологической и фармакотерапевтической группам относится к противодиарейным средствам.
- Механизм действия . Пролекарство. Путем гидролиза превращается в активный метаболит тиорфан. Тиорфан относится к ингибитору энкефалиназы. Фермент энкефалиназа находится на клеточной мембране), локализован в разных тканях, особенно в эпителии тонкого кишечника. Отвечает за гидролиз экзогенных пептидов и эндогенных пептидов (называются энкефалины). В результате рацекадотрил пролонгирует их антисекреторное действие.
- Рацекадотрил ослабляет повышенную секрецию воды и электролитов, вызванную воспалением. Поэтому относится к антисекреторным средствам. На базальную секрецию отделов кишечника не влияет. Не вызывает вздутие.
- Фармакокинетика . Абсорбция быстрая. Прием пищи не влияет на биодоступность, но после еды активность замедляется примерно на 1,5 часа. Максимальная концентрация – через 2,5 часа.
- Показания . Диарея различного генеза.
- Дозирование . Взрослым первоначально 100 мг в любое время суток. Затем 100 мг три раза в день до еды. Курс до 7 дней. Длительный прием не рекомендуется.
- Побочные эффекты . Головная боль (часто). Эритема, кожная сыпь (нечасто). Были случаи отеков (лица, ангионевротический отек), токсического дерматита, папулезной сыпи, узловатой эритемы, кожного зуда. Данных для определения частоты этих побочных действий недостаточно.
- Противопоказания . Непереносимость, дети до 18 лет, беременность, лактация. Назначают с осторожностью при почечной и печеночной недостаточности.
Особые указания: при бактериальной диарее назначается в комбинации с антибиотиками.
Во время приема рацекадотрила пероральная регидратация, показанная для лечения инфекционной диареи, обязательна. Многократная рвота снижает биодоступность препарата.
Другие антисекреторные средства
Доказано, что салицилат висмута эффективен при лечении диареи путешественников. Это противодиарейное средство, уменьшающее количество несформированного стула примерно на 50%. Эффект объясняется антисекреторным действием его салицилатной составляющей, также он обладает антибактериальными и противовоспалительными свойствами.
Плюс висмута субсалицилата – кроме противодиарейного, обладает противоязвенным свойством. Однако, необходимо принимать большое количество таблеток (восемь), имеет отсроченное начало действия (до 4-х часов), мешает абсорбции других лекарств (доксицилин), имеет определенные неприятные побочные эффекты (шум в ушах, черный язык).
Клиническая фармакология лекарственных средств для лечения заболеваний инфекционно-воспалительного генеза
К заболеваниям инфекционно-воспалительного генеза относятся такие заболевания, причинами которых являются микробные инфекции: бронхиты, пневмонии, пнелонефриты, уретриты и др.
Этиотропной терапией для их лечения является противомикробная терапия.
Кроме того, для лечения данных заболеваний с целью скорейшего выведение из организма циркулирующих в крови токсинов используют и дезинтоксикационную терапию.
√К дезинтоксикационым ЛС и мероприятиям относятся:
1) реополиглюкин, гемодез, желатиноль, гидролизин, аминопептид, (по 200, 400 мл) в/в капельно;
2) порошок «энтеродез» по 5,0 или 50,0 для приема per. os (применяется в основном при инфекциях ЖКТ, токсикозах беременности)
3) обильное питьё (чай, отвары и настои трав, минеральная вода)
Средствами симптоматической терапии инфекционно-воспалительных заболеваний являются:
1. Жаропонижающие и противовоспалительные ЛС: парацетамол, ацетилсалициловая кислота, индометацин, бутадион (влияют на иммунную систему, поэтому в острой фазе болезни противопоказаны)
2. Бронхолитики: эуфилин, теопек, теотард (при бронхитах, пневмонитах)
3. Отхаркивающие: терпенгидрат, термопсис, Na иодид, К иодид, бромгексин, амброксол, ацетилцистеин (АЦЦ)
4. Антиоксиданты: мембраностабилизирующий эффект: вит.:А, Е, С.
5. Иммуномодуляторы: интерферон (циклоферон, виферон,), темалин, Т-активин.
Антибиотики
Антибиотики – это вещества микробного растительного или животного происхождения, которые способны избирательно повреждать или подавлять жизнедеятельность микроорганизмов.
Антибиотики классифицируются по спектру действия, по химической структуре и механизму действия.
Принципы противомикробной терапии
Назначать строго по показаниям в дозировке, достаточной для полного преодоления болезни, предварительно собрав сведения о степени чувствительности бактерий к антибиотику (устанавливается предварительным посевом биоматериала), его переносимости.
В зависимости от выбранного антибиотика курс лечения при остром течении болезни – 5-10 дней, хроническом до 14 дней.
При отсутствии эффекта от приема антибиотика следует заменить его другим препаратом.
Возможно ранние лечение заболевания.
Возможно применение комбинированных препаратов для предупреждения развития резистентносити (устойчивости) у микроорганизмов, а также при лечении тяжелом течении инфекционного процесса, в том числе при сочетанных инфекциях.
Возможно назначение в профилактических целях при хирургических вмешательствах, а также для предупреждения обострения хр.пиелонефрита и возникновения инфекций (холера, малярия, чума) в эпидемиологически неблагоприятных районах.
Степени чувствительности бактерий к антибиотикам:
- чувствительные – рост возбудителей прекращается при терапевтических концентрациях препарата в крови;
- умеренно чувствительные – для угнетения роста требуются максимальные дозы препарата;
- резистентные (устойчивые) – подавление роста бактерий возможно только в токсических дозах;
Общие противопоказания к применению антибиотиков:
- лихорадка неясного генеза («смазывает» клинику, затрудняет диагностику)
- нельзя использовать как жаропонижающее средство
- вирусные инфекции (ОРВИ, грипп, герпес и т.п.)
- в профилактических целях, при хронических инфекционных заболеваниях (если отсутствуют данные за обострение), кроме случаев, указанных в принципах терапии
Резистентность (устойчивость) бывает:
- природная – это генетически обусловленное отсутствие чувствительности микроорганизмов к антибиотикам;
пример: вирусов к пенициллинам, аэробной флоры к цефалоспоринам 1поколения и т.п.
- приобретенная, которая, в свою очередь, делится на:
* первичную (до начала лечения антибиотиками); пример: устойчивость некоторых штаммов пневмококка к пенициллину
* вторичную (развивается в результате мутации штаммов бактерий в процессе лечения антибиотиками)
Читайте также:
