Методы активации эпилептических приступов. Фотостимуляция при эпилепсии
Добавил пользователь Alex Обновлено: 28.01.2026
Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского
Противоэпилептические препараты и аггравация приступов
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2014;114(11‑2): 32‑36
У пациентов с эпилепсией учащение приступов может происходить по разным причинам. К основным описанным в литературе провокаторам приступов относятся стресс, депривация сна, снижение концентрации алкоголя в крови и ритмическая фотостимуляция [1, 2]. Но клиническая практика показывает, что учащение приступов может являться следствием назначения того или иного противоэпилептического препарата (ПЭП) [3]. В данной статье для таких случаев мы будем использовать термин «аггравация» в его нынешнем значении - учащение, утяжеление или изменение характера приступов вследствие назначения определенного медицинского препарата (в данном случае - ПЭП).
Цель нашей работы - анализ случаев аггравации приступов ПЭП у взрослых пациентов с эпилепсией.
Материал и методы
Были обследованы 1407 больных, обратившихся за специализированной помощью к эпилептологу, в возрасте от 18 до 89 лет. Их обследование включало клинический и неврологический осмотр, запись ЭЭГ и/или ночной ЭЭГ-видеомониторинг и проведение магнитно-резонансной томографии (МРТ) головного мозга.
У 1305 пациентов был подтвержден диагноз эпилепсии; 983 - обследовались катамнестически в течение 6 мес - 10 лет. Были получены данные об ухудшениях в течении эпилепсии до обращения за специализированной помощью.
Результаты и обсуждение
По данным анамнеза и клинического обследования учащение, утяжеление или нежелательное для пациента видоизменение приступов, связанные с приемом ПЭП, были выявлены у 103 больных. Их распределение по формам эпилепсии было следующим: идиопатические генерализованные эпилепсии (ИГЭ) были выявлены у 31, криптогенные фокальные (КФЭ) - у 35, симптоматические фокальные (СФЭ) - у 19, неуточненная эпилепсия - у 18.
Наиболее часто аггравация приступов была связана с применением карбамазепина (55 больных), реже ухудшение приступов ассоциировалось с применением топирамата (26), вальпроатов (22) и еще реже - при использовании ламотриджина (6), леветирацетама (3), фенобарбитала (1) и клоназепама (1). При этом у 12 пациентов отмечалось учащение приступа от двух, а у 1 - от трех различных последовательно назначенных ПЭП. В 4 случаях причиной аггравации была резкая замена одного препарата или комбинации препаратов на другой, т.е. в основе учащения приступов лежала депривация ранее используемых препаратов, а не назначение новых. Наконец, в 5 случаях наблюдалось ухудшение самочувствия после назначения ПЭП, первоначально ошибочно трактованное как утяжеление течения эпилепсии.
Пациенты, у которых отмечалась аггравация приступов, были разделены на несколько групп по особенностям развития этих изменений.
Так, одной из причин аггравации приступов была замена препарата на аналог другой фирмы-производителя. Этот вариант аггравации был выявлен у 32 пациентов. Наиболее часто причиной учащения приступов после замены препарата на аналог оказался топирамат (12 больных). При этом во всех случаях учащение приступов отмечалось при вынужденной замене оригинального препарата на более дешевый дженерик. Аггравация после замены на аналог имела место также при применении вальпроатов (8), во всех случаях она была связана либо с заменой оригинального препарата на дженерик, либо брендового дженерика на более дешевый аналог. Менее часто аггравация отмечалась при замене карбамазепина (5 случаев), во всех случаях имела место вынужденная замена оригинального препарата на дешевый аналог. В единичных случаях учащение приступов было связано с заменой ламотриджина (1 больной) и леветирацетама (1), в обоих случаях аггравацию потенцировала замена оригинального препарата на дженерик. Типы приступов, которые учащались при замене препарата на аналог, зависели от формы эпилепсии, имеющейся у пациента, никаких закономерностей в аггравации конкретных видов приступов в зависимости от используемого препарата в данной группе выявлено не было.
Для оценки риска аггравации абсансов и/или миоклоний карбамазепином мы подсчитали общее количество пациентов с различными формами ИГЭ среди всех вошедших в исследование больных, а также установили, сколько из них получали карбамазепин. Различные формы ИГЭ были диагностированы у 261 включенного в исследование пациента, из них чаще всего (у 97 больных) встречалась ювенильная миоклоническая эпилепсия (ЮМЭ), далее следовали эпилепсия с изолированными генерализованными судорожными приступами (ИГЭ с ИГСП) - 83 пациента, ювенильная абсанс-эпилепсия (ЮАЭ) - 33 больных, детская абсанс-эпилепсия (ДАЭ) - 25 больных, миоклонии век с абсансами (синдром Дживонса, МВА) - 11 пациентов, неуточненные формы ИГЭ - 11 и эпилепсия с миоклоническими абсансами (синдром Тассинари, ЭМА) - 1. Из всех пациентов с ИГЭ 193 получали карбамазепин в какой-либо период их жизни. Для оценки риска аггравации абсансов и/или миоклоний карбамазепином мы выбрали 4 четко очерченных синдрома, имеющих среди клинических проявлений абсансы и/или миоклонии (табл. 1).
Полученные данные подтверждают высокий потенциал аггравации карбамазепином абсансов/миоклоний при данных синдромах ИГЭ, что особенно заметно в относительно больших выборках пациентов с ЮМЭ и ЮАЭ, с которыми нередко сталкиваются «взрослые» эпилептологи. Интересно, что все 83 пациента с ИГЭ с ИГСП в какой-либо период своей жизни получали карбамазепин, при этом учащения приступов под влиянием карбамазепина не было зафиксировано ни в одном случае, зато у 2 больных отмечалось учащение ГСП от вальпроатов.
Всего при использовании вальпроатов в 2 случаях наблюдалось учащение абсансов при замене препарата на дженерик (более подробно данный паттерн аггравации описан выше), в 2 - учащение приступов (абсансов и ГСП соответственно) - при увеличении дозы препарата выше средней терапевтической и в 2 - учащение и видоизменение ГСП непосредственно после назначения вальпроата (при этом у 1 больного повторное назначение вальпроатов не привело к аггравации приступов). Аналогичная картина отмечалась и при использовании топирамата - у 4 из 6 пациентов учащение приступов (абсансов в 2 случаях, ГСП и миоклоний - по 1 случаю) было связано с заменой оригинального препарата на дженерик и лишь у 2 больных произошло учащение абсансов и миоклоний век с абсансами соответственно непосредственно после назначения топирамата. После назначения ламотриджина у 1 больного произошло резкое учащение ГСП, также в 1 случае отмечалось возобновление ГСП после замены оригинального леветирацетама на дженерик.
Еще одним типичным паттерном аггравации было наличие в анамнезе у пациента 2 и более случаев учащения приступов, связанных с назначением различных ПЭП (13 пациентов). Из 13 больных 12 страдали КФЭ и СФЭ и лишь 1 - ИГЭ. Отличительной особенностью пациентов данной подгруппы было длительное течение заболевания (от 9 до 35 лет, в среднем - 20 лет), как следствие, наличие в анамнезе множества попыток терапии и побочных эффектов ПЭП (у 12 из 13 пациентов, причем у 4 из них тяжесть побочных эффектов была выражена настолько, что потребовала отмены ПЭП), а также неблагоприятный прогноз: на момент завершения исследования свободным от приступов был лишь 1 больной из 13, а снижение числа приступов на 50% и более отмечалось лишь у 2 пациентов.
Еще одним вариантом аггравации было учащение приступов на препарат, предыдущие или последующие попытки терапии которым не вели к ухудшению течения эпилепсии. Этот вариант был выявлен у 6 пациентов, 4 из которых получали карбамазепин, а 2 - вальпроаты. Из них у 1 была диагностирована ИГЭ, у 3 - КФЭ и у 2 - СФЭ. Прогноз в данной подгруппе зависел от формы эпилепсии: пациент с ИГЭ на момент завершения исследования был свободен от приступов (причем он получал вальпроаты, на которые отмечалась аггравация приступов при первой попытке терапии), 2 из 3 больных КФЭ отмечали снижение частоты приступов на 50% и более, оба пациента с СФЭ и 1 пациент с КФЭ не имели снижения частоты приступов по сравнению с исходной.
Говоря об аггравации приступов, нельзя не упомянуть об их учащении вследствие отмены ранее используемых ПЭП, которое пациенты ошибочно связывают с началом приема новых препаратов.
В нашей работе подобный феномен встречался в 4 случаях: в первом произошло резкое учащение абсансов и ГСП у пациента с ДАЭ после одномоментной замены комбинации диазепам + фенитоин на вальпроаты, во втором - учащение вторично-генерализованных судорожных приступов у пациента с СФЭ после одномоментной замены комбинации карбамазепин + фенобарбитал на комбинацию окскарбазепин + вальпроаты, в третьем - учащение сложных парциальных приступов после резкой замены комбинации фенобарбитал+фенитоин+карбамазепин на вальпроаты, в четвертом - учащение сложных парциальных приступов после резкой замены карбамазепина на вальпроаты. Таким образом, в 3 случаях из 4 аггравации приступов послужила резкая депривация барбитуратов/бензодиазепинов - двух классов препаратов, к которым формируется привыкание и при отмене которых возникает «феномен отдачи» [3, 8, 9, 11]. По нашему мнению, одномоментная замена одного ПЭП на другой допустима лишь в исключительных случаях, при этом отмена барбитуратов/бензодиазепинов у лиц, которые годами получали данные препараты (даже если она проводится медленно) в большинстве случаев ведет к рецидиву приступов.
В 5 случаях за аггравацию приступов было ошибочно принято ухудшение самочувствия у пациентов (у 3 - после назначения вальпроатов, у 2 - карбамазепина). Для дифференциальной диагностики истинного ухудшения течения эпилепсии и других факторов (например, сонливость, заторможенность, сильный мышечный тремор, аффективные нарушения, что ошибочно трактуется как учащение приступов) необходим тщательный сбор анамнеза и ведение дневника приступов.
При оценке рассматриваемых случаев следует учитывать субъективную тяжесть приступов для самого больного, а также его желание их фиксировать. Важно также иметь в виду, что у ряда пациентов эпилептические приступы сосуществуют с неэпилептическими (чаще всего - психогенными) и учащение последних, например на фоне психотравмирующей ситуации, может ошибочно трактоваться как аггравация приступов. Кроме того, могут иметь место и расстройства невротического уровня, характеризующиеся мнительностью и внушаемостью больных, поэтому в таких случаях нередко наблюдается появление побочных эффектов, про которые они прочитали в инструкции. Помимо дневников, в которых фиксируются приступы, в сомнительных случаях мы рекомендуем больным вести детальную запись своих ощущений и событий в течение дня. Детальный анализ последних позволяет отличить истинное учащение приступов от эпизодов плохого самочувствия, ухудшения течения сопутствующих заболеваний, в ряде случаев при анализе записей становится очевидным наличие у пациента тех или иных психических нарушений. Огромное значение для дифференциальной диагностики имеет видеофиксация приступов, которая становится все более доступной.
С учетом множества приведенных выше проявлений аггравации возникает вопрос о диагностических критериях последней. По нашему мнению, универсальным определением истинной аггравации приступов может служить следующее: объективно зафиксированное учащение, утяжеление или нежелательное для пациента видоизменение приступов, возникшее после назначения нового ПЭП и претерпевшее обратное развитие после его отмены при исключении других причин учащения приступов. Основываясь на данном определении, мы выделили в нашем исследовании 5 случаев аггравации приступов вальпроатами, 13 - топираматом, 5 - ламотриджином, 2 - леветирацетамом, 1 - клоназепамом и 34 - карбамазепином. Заметим, что в 16 случаях отмечалось учащение приступов в структуре различных синдромов ИГЭ.

Для оценки как общего риска аггравации, так и особенностей препаратов при конкретных синдромах эпилепсии пациенты были разделены на две группы: 1-я - пациенты с ИГЭ, 2-я - с другими формами эпилепсии. При этом учитывались только пациенты с подтвержденным диагнозом эпилепсии (1305) (табл. 2).
Таким образом, у всех приведенных в табл. 2 ПЭП потенциал аггравации был относительно невысок, наиболее часто учащение приступов ассоциировалось с применением карбамазепина у пациентов с ИГЭ (8,3%), а также ламотриджина, топирамата и карбамазепина у лиц с другими формами эпилепсии (в первую очередь - КФЭ и СФЭ) - 4,9, 4 и 3,7% соответственно.
Для снижения риска аггравации при использовании трех вышеуказанных препаратов особенно важно титровать их дозу постепенно, обычно начиная с ½ стандартной таблетки. Также необходимо тщательное ведение дневника приступов, без которого крайне сложно отличить ухудшение самочувствия от истинного учащения/утяжеления приступов.
Таким образом, аггравация приступов может встречаться при использовании различных ПЭП. Учащение приступов при замене препарата на аналог наиболее характерно для топирамата. Такие паттерны аггравации, как учащение приступов при увеличении дозы препарата или учащение приступов от двух и более ПЭП с разным механизмом действия, характерны для пациентов с резистентной эпилепсией и ассоциируются с неблагоприятным прогнозом заболевания. Наиболее часто учащение приступов ассоциировалось с применением карбамазепина у пациентов со специфическими синдромами ИГЭ. Среди всех пациентов с эпилепсией лидерами по аггравации были ламотриджин (4,7%), карбамазепин (3,7%) и топирамат (3,3%). Для снижения риска аггравации показаны медленная титрация ПЭП и ведение дневника приступов.
Методы активации эпилептических приступов. Фотостимуляция при эпилепсии
Выявляемость эпилептической активности на ЭЭГ увеличивается при использовании определенных методических приемов. Наиболее часто применяются фотостимуляция, гипервентиляция, темновая адаптация, ночной сон и депривация сна. Используются также методы фармакологической активации.
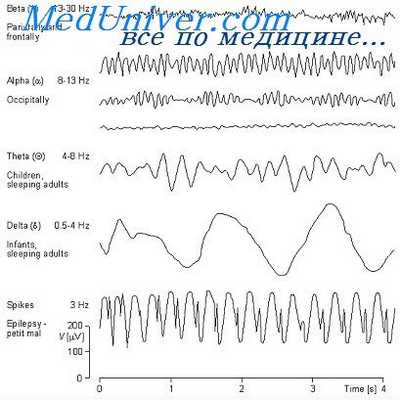
Ритмическая фотостимуляция (т. е. предъявление дискретных световых раздражений большой интенсивности в ритме 4—50 в секунду) может вызывать появление или усиление эпилептических феноменов на ЭЭГ. Этот факт впервые установил W. G. Walter в 1946 г.
В настоящее время ритмическая световая стимуляция является облнгатным методом обследования больных эпилепсией. Наиболее эффективная частота световых мельканий 10—20 в секунду.
Среди больных эпилепсией различают две категории лиц, характеризующихся повышенной чувствительностью к световой стимуляции: больных фотосенситивной эпилепсией и эпилепсией с фотосенситивностью.
Эпилепсия с фотосенситивностью — это эпилепсия, при которой ритмическая световая стимуляция вызывает на ЭЭГ аномальную биоэлектрическую активность, что в ряде случаев может привести к возникновению эпилептического припадка. Представляет известный интерес то обстоятельство, что фотосенситивность существенно уменьшается при моноиуклеарной фотостимуляции.
В других случаях ритмические световые раздражения могут вызывать ответы только в проекционной зрительной коре в виде билатерально-синхронной дельта-активностн или затылочных спайков. Наконец, на ЭЭГ могут регистрироваться мышечные ответы — синхронные с вспышками света колебания, возникающие вследствие сокращения мышц головы и шеи (фотомиоклонический ответ). Специфическим является только фотоконвульсивный ответ.
Он описывается как высоковольтные множественные пики и волны или комплексы пик — волна в лобных отведениях обоих полушарий. Как отметили в свое время W. Penfield и Н. Jasper (1954), фотоконвульснвный ответ нередко генерализован, но амплитуда ответа максимальна в лобно-центральных отведениях.
Гипервентиляция (ГВ) использовалась в клинике как метод провокации эпилептических припадков еще в доэлектроэнцефалографический период. В настоящее время она является обязательным компонентом электроэнцефалографического исследования. Обычно применяется глубокое дыхание гиперпноэ) в течение 3 мни.
У всех людей реакцией на гипервентиляцию является синхронизация биоэлектрической активности — замедление и возрастание амплитуды альфа-ритма. Для детей особенно характерно появление высокоамплитудиых билатерально-синхронных медленных волн (3—6 в секунду). Иногда они могут возникать н в юношеском возрасте. При эпилепсии ГВ часто вызывает появление или нарастание эпилептической активности, в особенности при ПГЭ.
Сонная активация при эпилепсии. Депривация сна при эпилепсии
F. A. Gibbs л Е. L. Gibbs в 1946 г. обратили внимание на то, что эпилептическая активность у больных эпилепсией во время сна регистрируется в 2 раза чаще, чем при бодрствовании. После открытия в 1953 г. быстрого сна этот факт привлек особое внимание. Было установлено, что изменения происходят главным образом во второй фазе медлеиновол-нового она — стадии таламокортикального рекрутирования.
В дельта сне если и происходит повышение эпилептической активности, то последняя «забивается» дельта-активностью н не может быть выявлена. Особенно эффективно исследование биоэлектрической активности головного мозга во время ночного сна для обнаружения эпилептических феноменов, отсутствующих в случае обычной регистрации ЭЭГ при ВЭ.
Несмотря на высокую частоту выявления эпилептической активности во время ночного сна с помощью полиграфической записи, этот метод ие может найти массового применения из-за трудоемкости и значительных материальных затрат. Для практических целей более пригоден метод депрнвации сна.
Депривация сна
Как и ночной сон, депривация сна повышает прежде всего билатерально-синхронную эпилептическую активность; следовательно, этот метод наиболее результативен при ПГЭ. Однако если учесть, что у больных с ПГЭ процент выявляемости эпилептической активности при банальном электроэнцефалографическом исследовании наиболее высок, то реальное практическое значение депривации сна приобретает при исследовании больных парциальной эпилепсией.
Результаты наших полиграфических исследований показывают, что важным фактором, влияющим на конечный результат (степень выявляемости эпилептической активности), следует считать функциональное состояние мозга. Эпилептическая активность в большинстве случаев выявляется у тех больных, у которых во время исследования регистрируются поверхностные стадии фазы медленного сна.
Перед депривацией сна и во время нее запрещается употребление тонизирующих напитков. Регистрацию ЭЭГ проводят в течение 60— 90 мин, а затем применяют фотостимуляцию н гипервентиляцию. ДС сопровождается изменением самочувствия больных: ощущением слабости, тяжести в голове, головной болью. Очаговая неврологическая симптоматика после ДС обычно выявляется более четко. У 6,3% обследованных нами больных ДС вызывала эпилептические приладки.
Наибольший интерес представляет влияние депривации сна на фокальную эпилептическую активность. У 31,1% больных с судорожными припадками, которые трактовались как первично-генерализованные, депривация сна приводила к обнаружению на ЭЭГ фокуса эпилептической активности. У 52,6% больных, у которых судорожные припадки расценивались как вторично-генерализованные, ДС способствовала выявлению или усилению эпилептического фокуса, и только у 10,5% больных обнаруженный ранее очаг эпилептической активности не удавалось определить.
Фармакологическая активация при эпилепсии. Темновая адаптация при эпилепсии
Для фармакологической активации эпилептической активности используют два типа фармакологических агентов — с проконвульсивными свойствами и снижающие уровень бодрствования. В качестве проконвульсантов обычно применяют коразол и бемегрид. Коразол (метразол) вводят внутривенно из расчета 2,2 мг/кг, затем каждые 30 с вводят половину этой дозы до появления на ЭЭГ эпилептической активности.
Общая доза препарата не должна превышать 8,8 мг/кг, а для детей—4,4—6,6 мг/кг.
Бемегрид применяют внутривенно по 1 мл 0,5% раствора каждые 10—20 с Предельно допустимую суммарную дозу бемегрида в миллиграммах рассчитывают по формуле: Масса тела (кг) • 100/65. По окончании исследования с применением бемегрида обязательно вводят виутривеиио или внутримышечно 5—10 мг диазепама.
В настоящее время метразол и бемегрид с целью эпилептической активации применяют весьма ограниченно, так как они часто вызывают судорожный припадок, как правило, приводят к появлению генерализованной эпилептической активности, на фоне чего фокальная эпилептическая активность может даже нивелироваться.
Коразол и бемегрид в основном находят применение в нейрохирургической клинике, где использование метода долгосрочных виутримовговых электродов создает большие возможности для обнаружения эпилептического очага.
В качестве средств, приводящих к снижению уровня бодрствования, обычно применяют внутривенно барбитураты ультракороткого действия—гексабарбитал (эвипан) и сомбревии.
Эвипан вводят внутривенно в 2% растворе в суммарной дозе до 150—200 мг со скоростью 20 мг за 10—15 с. Доза сомбревина ие должна превышать 6—8 мг/кг; вводят внутривенно по 1 мл (50 мг) каждые 10—20 с.
Темновая адаптация при эпилепсии
Сущность метода темновой адаптации (ТА) состоит в регистрации ЭЭГ у больных, находящихся в свето- и звукоизолированной камере в расслабленном состоянии с закрытыми глазами в течение 60—90 мни.
Это ведет к нарастанию синхронизации биоэлектрической активности головного мозга, нередко к возникновению сонного состояния. У больных с эпилепсией она ТА часто вызывает появление на ЭЭГ разрядов генерализованных синхронных симметричных пик-волн в ритме 3 Гц.
В нашей клинике темновая адаптация была применена у 39 больных (Г. А. Коваленко). Отмечены увеличение индекса и амплитуды альфа-ритма, нарастание его упорядоченности, распространение на передние отделы головного мозга, появление или усиление билатерально-синхронных заостренных парохоизмальных колебаний тета- и дельта-диапазона.
Последнее явление было более выражено у тех больных, у которых припадки расценивались как первично-генерализованные, по сравнению с больными с вторично-генерализованными припадками. ТА позволила дополнительно обнаружить фокальную эпилептическую активность у 10% больных с первично-геиерализованными припадками. На оборот, у больных с вторично-генерализованными припадками выявляемая эпилептическая активность не нарастала.
Таким образом, темновая адаптация оказалась недостаточно эффективным методом выявления фокальной эпилептической активности.
Московский государственный медико-стоматологический университет
Фотосенситивность, эпилепсия, затылочная и лобная кора
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2015;115(4): 4‑8
В статье рассматривается структурно-функциональная организация дистантной зрительной перцепции, которая имеет не только афферентную, но и эфферентную часть — лобное зрительное поле и соответственно обслуживающую зрение гладкую и поперечнополосатую мускулатуру глаза. Показано возрастающее значение эфферентного звена зрительной системы в современных условиях реального и виртуального движения объектов зрения. На примере фотосенситивности при эпилепсии обосновывается возможность защитных односторонних реакций эфферентного звена зрительной системы на ритмическую фотостимуляцию.
В опубликованной ранее монографии «Неврология лица» [1] была обоснована уникальность этой области тела человека, поскольку в ней представлены оральные концы дыхательной и пищеварительной систем и располагаются аппараты дистантной рецепции — обонятельной, зрительной, слуховой и соответствующие им образования. В рассматриваемом аспекте функция зрения является наиболее сложной.
Напомним, что затылочная и лобная кора относятся к разным корковым блокам: затылочная — к блоку приема, обработки и хранения информации, лобная — принятия решений, их реализации и коррекции, однако обе они имеют отношение к зрению. Затылочная кора «считывает» зрительную информацию как непосредственную визуально-пространственную (правое полушарие у правшей), так и опосредованную, символическую (левое полушарие). Сенсорный блок, включая затылочную кору, связан с лобной корой посредством верхнего и нижнего продольных пучков в составе дугообразного пучка. В премоторной области (дорсолатеральная кора) находится поле БА 8 — корковый центр произвольного взора, который в англоязычной литературе носит название «лобное глазное поле» (frontal eye field). Имеется еще один стратегический блок: «сердцевина мозга» — лимбико-ретикулярный комплекс, который прежде всего обеспечивает различные функциональные состояния мозга в циркадном ритме (расслабленное и активное бодрствование, фазы медленного и быстрого сна, компонентом последнего, в частности, являются быстрые движения глаз, что и определило название этой фазы сна).
Е.К. Сепп в монографии «История развития нервной системы позвоночных» [2] показал всю сложность иннервационного аппарата региона лица, в особенности структур системы, обеспечивающей функцию зрения. Здесь есть афферентная часть — зрение как таковое и обслуживающие его эфферентные структуры, включающие также те, которые обеспечивают обзорность. Соответственно этому существуют стволовые ассоциативные системы, реализующие непроизвольное автоматизированное (в основном задний продольный пучок) и произвольное (в основном затылочно-лобный путь) зрение, стволовый и корковый центры взора.
Одним из важных неврологических феноменов является фотосенситивность. Есть мнение, что она в основном обусловливается генетически [3], однако может иметь и бытовой характер. Такая фотосенситивность в свое время была обозначена как «нелюбовь к солнцу» [4]. Она характеризует людей, самочувствие которых в пасмурную погоду более комфортно, чем в солнечные дни (что они не могут объяснить). По данным C. Binnie и P. Jeavons [5], фотосенситивность в общей популяции составляет 2%, по другим данным [6] — от 0,5 до 8,9%.
Фотосенситивность — частое явление при эпилепсии [3, 7, 8], особенно рефлекторной — форме заболевания, при которой приступы всегда вызываются первичным сенсорным воздействием. Это связано с тем, что фотогенная стимуляция является мощным сенсорным раздражителем для мозга, вызывающим различные виды неспецифической активации — усвоение ритма световых мельканий и/или появление кратных к этому ритму биоэлектрических колебаний, затылочные спайки, синхронные с мельканиями; асинхронные затылочные спайки в затылочных областях, фотомиоклонический ответ, регистрирующийся в виде синхронных со вспышками света колебаний, возникающих вследствие сокращений мышц головы и шеи.
Для больных эпилепсией характерен пароксизмальный ответ на фотостимуляцию — возникновение эпилептиформной активности на ЭЭГ и эпилептические приступы. Могут возникать различные паттерны фотопароксизмального ответа: затылочные спайки, теменно-затылочные спайки с бифазной медленной активностью, теменно-затылочные спайки с бифазной медленной активностью и распространением на лобный регион, генерализованные спайки и/или полиспайки и волны [7, 9]. При этом подчеркивается роль следующих механизмов: триггерных факторов, вовлекающих клетки зрительной коры; иктальной активации, которая может ограничиваться зрительной корой или распространяться на другие кортикальные области, часто используя предпочтительные пути вовлечения критической массы нейронов; эпилептогенного воздействия ритмической световой стимуляции, которое подтверждается не только резким увеличением амплитуды, но и патогномоничным преобразованием зрительного вызванного потенциала по спайк-волновому типу с последующим ритмическим послеразрядом [10].
Фотосенситивность модулируется возрастом и полом — она преобладает в пубертатном возрасте и у женщин [3, 9]. Последнее связывается с преобладающими гормональными влияниями [6, 9].
Среди 300 проконсультированных нами пациентов с фотосенситивностью эпилепсия была обнаружена у 262, а у 38 — выявлялась только эпилептиформная активность на ЭЭГ. Таким образом, фотосенситивность может быть не только проявлением эпилепсии, но и фактором риска ее развития. Факторами провокации эпилептических приступов в быту у 90% обследованных нами пациентов могли быть просто ощущения дискомфорта, вызванные ритмическими зрительными раздражителями (мелькание солнечных лучей через деревья при движении субъекта в транспорте, солнечные блики от воды, снега и т. п., а в лабораторных условиях — применение ритмической световой стимуляции), например так называемый шахматный паттерн (лабораторный термин). В быту таким воздействием могут быть контрастные черно-белые или цветные полосы, особенно вибрирующие, иногда просто яркий цветной фон, например зеленый.
В зарубежной литературе механизм стимулзависимой эпилепсии, впрочем как и любой другой, рассматривается исключительно с позиций процессов, происходящих в эпилептогенном очаге и нервной сети. Одним из замечательных достижений отечественной нейрофизиологической школы является системный подход к анализу механизмов формирования реакции организма на те или иные внешние воздействия и потребности. Соответствующие представления впервые были четко изложены Н.А. Бернштейном [11] в монографии «О построении движений», а также П.К. Анохиным [12]. Они большое внимание уделяли формированию функциональной системы для достижения цели. Функциональная система включает динамическое отслеживание посредством обратной связи текущего действия (акцептор действия), что позволяет не только контролировать действие, но и сличать реалии с намеченной целью и вносить соответствующие коррекции в процесс исполнения. Более сложная ситуация складывается в патологии, даже если изменения происходят лишь в одном из звеньев многоуровневой функциональной системы: изменения в одном звене сопровождаются теми или иными сдвигами в других звеньях. Так, нами было показано, что при невралгии тройничного нерва, при которой первичная патология заключается в изменении афферентного потока вследствие компрессии периферии (ветвь или, как правило, корешок тройничного нерва), вторичные изменения происходят не только в релейной стволовой структуре (спинномозговое ядро тройничного нерва), но и в проекционной мозговой коре: при исследовании зрительных вызванных потенциалов в наибольшей степени ответ регистрируется не в проекционной зрительной коре, а в центральном корковом регионе, т. е. сенсомоторной коре. При этом ответ изменен качественно: перестроен по спайк-волновому типу с последующим ритмическим послеразрядом (рис. 1), что, как указывалось выше, считается патогномоничным для эпилепсии. Таким образом была визуализирована алгогенная система пароксизмального типа; дано сущностное объяснение старого названия невралгии тройничного нерва «болевой тик», основанного на клинике пароксизма: ошеломленный ужасающей болью пациент замирает, и у него на стороне боли наблюдаются клонические подергивания мимических мышц, т. е. вовлечение проекционной зоны моторной коры. Речь идет о том, что при данной модели заболевания тестирование зрительной системы позволяет выявить уровень сверхвозбудимости вне афферентного звена зрительной системы в проекционной сенсомоторной коре (зона проекции лица). Это расширяет наши представления о механизмах организации патологических систем.
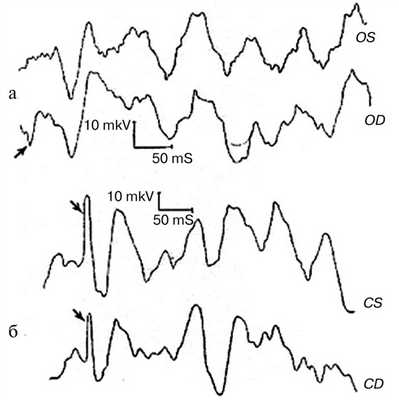
Рис. 1. Спайк-волновой тип реакции с последующим ритмическим послеразрядом. Объяснение в тексте.
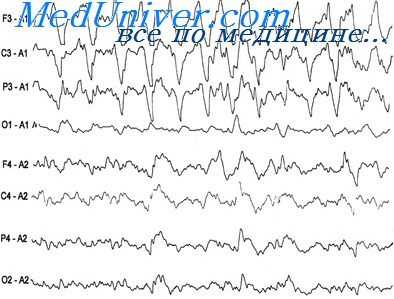
Теперь вернемся к реакции головного мозга на ритмическую фотостимуляцию. Исходя из представленных выше данных, существуют как генерализованный, так и моносистемный варианты реагирования организма на внешние стимулы. Генерализованный вариант реализуется как старт-рефлекс, т. е. активирует все каналы получения информации и гомеостатические системы готовности к немедленному действию. Моносистемный вариант задействует только ту или иную афферентную систему специфической модальности: зрительную, слуховую и др., активируя внимание. Хорошо известно, что за активацию целенаправленного внимания ответственна прежде всего лобная кора. Более того, у детей с синдромом дефицита внимания с гиперактивностью патологию объясняют расстройствами функции поддержания внимания, специфически связанной с правым полушарием [13]. Поскольку речь идет о правом полушарии, это побуждает вернуться к поднятой нами проблеме взаимоотношений затылочной и лобной коры с позиций функциональной межполушарной асимметрии коры больших полушарий головного мозга. Мы наблюдали 2 пациентов с доминантностью по визуально-пространственному анализу правого полушария и наличием эпилептиформной активности в заднекорковых отделах головного мозга. На приводимом фрагменте ЭЭГ 26-летнего пациента, с детства страдавшего эпилепсией, регистрируется стойкий эпилептогенный очаг в затылочно-височном отведении правого полушария (рис. 2). В ответ на ритмическую фотостимуляцию (на рис. 3, отмечено стрелкой) с частотой 10, а затем и 12 Г.возникает локальный фотомиоклонический ответ в левом лобном отведении. Это ставит вопрос о роли правого (или, строго говоря, доминантного по визуально-пространственному анализу) полушария в реализации своеобразного моторного глазодвигательного ответа — закрывания глаза на каждый из фотогенных стимулов эпилептогенного диапазона ритмической фотостимуляции. Однако реализуется только фотомиоклонический, но не фотопароксизмальный ответ, что дает основание предполагать защитную роль локального фотомиоклонического ответа на фотогенные стимулы. Более того, ответ реализуется односторонне — только слева, т. е. за счет круговой мышцы левого глаза. Следовательно, по своей сути он является мигательным рефлексом, поэтому его односторонность вряд ли можно объяснить стволовым механизмом и, таким образом, следует признать его корковое происхождение за счет лобного зрительного поля.
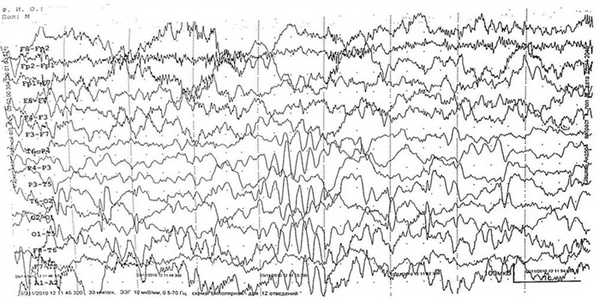
Рис. 2. Фрагмент ЭЭГ больного эпилепсией 26 лет. Регистрируется стойкий эпилептогенный очаг в затылочно-височном отведении правого полушария.
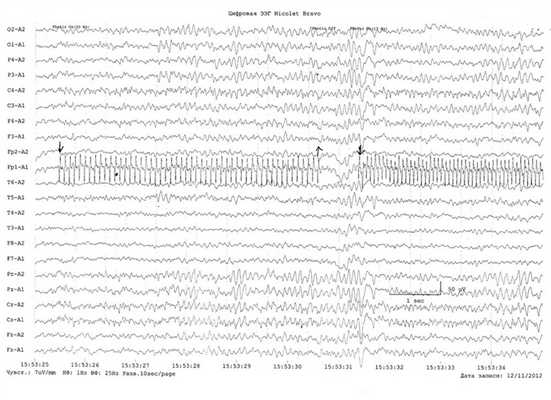
Рис. 3. Возникновение локального фотомиоклонического ответа в левом лобном отведении под влиянием ритмической фотостимуляции с частотой 10 Гц, а затем 12 Гц (отмечено стрелкой). Объяснение в тексте.
В последнее время широкое внедрение методов функциональной нейровизуализации позволило получить новые данные о функциональной анатомии головного мозга в норме и патологии, в том числе относительно взаимодействия затылочной и лобной коры. Так, у страдающих шизофренией пациентов обнаружено снижение как толщины коры в поле БА 9, так и плотности зрительной коры [9]. Более того, применение специального антисаккадного теста в 20—75% случаев выявляет у них нарушения в контроле движения глаз [14]. Показано, что в норме во время фазы быстрого движения глаз с целью последующего поиска и фиксации перемещающегося объекта (саккадированные движения глаз, саккады) зрение ингибируется. Недавно установлено, что у человека в лобном зрительном центре существует специальный субцентр, отвечающий за слежение глазами и саккады глаз [15, 16]. Взаимоотношения между корковым блоком информации и лобным полем произвольного контроля движений глаз оцениваются в качестве одного из высших алгоритмов когнитивного процесса у приматов, включая человека [17]. При этом мы хотели бы еще раз обратить внимание на механизм саккад, предусматривающий исключение зрения во время их быстрой фазы. Это дает основание к сформулированным испанским гистологом Р.С. Кахалем [18] трем основополагающим принципам структурно-функциональной организации головного мозга (экономия протяженности проводников, объема структур и времени проведения импульса) добавить еще один — экономия энергии, что позволяет отсрочить усталость. На наших глазах опасно нарастают количество и темп движущихся объектов. Можно сказать, что сейчас почти все вокруг нас движется и/или мы постоянно перемещаемся относительно внешних объектов, и таким образом механизм саккад фактически постоянно или почти постоянно является задействованным, особенно, если принять во внимание виртуальную жизнь (телевидение и др.). В этом плане механизм, выключающий зрение во время быстрой фазы саккад, следует рассматривать как приспособительный, адаптивный, позволяющий избегать быстрого утомления. Видимо, подобным образом следует объяснить обнаруженный нами феномен усвоения при заднекорковых эпилептических очагах зрительных мельканий не зрительной корой, а упомянутым выше лобным зрительным полем: адаптивный феномен, избавляющий при эпилепсии организм от потенциально неблагоприятных (приступ) воздействий. В этом плане приходится удивляться редкости данного феномена. Вероятно, это связано с тем, что его механизм находится еще в процессе формирования.
Читайте также:
- Лучевая диагностика острого бескаменного холецистита
- Кости при болезни Эрдгейма-Честера - лучевая диагностика
- Побочные реакции на введение антибиотиков. Токсико-аллергические реакции на антибиотики
- Многоформная эритема, синдром Стивенса-Джонсона и токсический эпидермальный некролиз. Причины
- КТ, МРТ при менингиоме основания черепа
