Нарушения функции моноцитов и макрофагов иммунитета
Добавил пользователь Владимир З. Обновлено: 29.01.2026
Сто тридцать лет назад замечательный русский исследователь И.И. Мечников в опытах на личинках морских звезд из Мессинского пролива сделал удивительное открытие, круто изменившее не только жизнь самого будущего Нобелевского лауреата, но и перевернувшее тогдашние представления об иммунной системе.
Втыкая в прозрачное тело личинки розовый шип, ученый обнаружил, что занозу окружают и атакуют крупные амебоидные клетки. И если чужеродное тело было небольшим, эти блуждающие клетки, которые Мечников назвал фагоцитами (от греч. пожиратель), могли полностью поглотить пришельца.
Долгие годы считалось, что фагоциты выполняют в организме функции «войск быстрого реагирования». Однако исследования последних лет показали, что благодаря своей огромной функциональной пластичности эти клетки еще и «определяют погоду» многих метаболических, иммунологических и воспалительных процессов, как в норме, так и при патологии. Это делает фагоциты перспективной мишенью при разработке стратегии лечения ряда тяжелых заболеваний человека
Подвижные клетки иммунной системы – фагоциты или макрофаги, присутствуют практически во всех тканях организма. Они осуществляют активный захват, переваривание и обезвреживание чужеродных микроорганизмов (вирусов, бактерий, одноклеточных, паразитов), а также утилизацию биологического «мусора», такого как «невостребованные» и погибшие клетки (например, «стареющие» эритроциты).
В зависимости от своего микроокружения тканевые макрофаги могут выполнять и различные специализированные функции. Например, макрофаги костной ткани – остеокласты, также занимаются выведением из кости гидроксиапатита кальция. При недостаточности этой функции развивается мраморная болезнь – кость становится чрезмерно уплотненной и при этом хрупкой.
Но самым, пожалуй, удивительным свойством макрофагов оказалась их огромная пластичность, т. е. способность изменять свою транскрипционную программу («включение» тех или иных генов) и свой облик (фенотип). Следствием этой особенности является высокая разнородность клеточной популяции макрофагов, среди которых присутствуют не только «агрессивные» клетки, встающие на защиту организма-хозяина; но и клетки с «полярной» функцией, отвечающие за процессы «мирного» восстановления поврежденных тканей.
Липидные «антенны»
Своей потенциальной «многоликостью» макрофаг обязан необычной организации генетического материала – так называемому открытому хроматину. Этот не до конца изученный вариант структуры клеточного генома обеспечивает быстрое изменение уровня экспрессии (активности) генов в ответ на различные стимулы.
Выполнение макрофагом той или иной функции зависит от характера получаемых им стимулов. Если стимул будет распознан как «чужой», то происходит активация тех генов (и соответственно функций) макрофага, которые направлены на уничтожение «пришельца». Однако макрофаг могут активировать и сигнальные молекулы самого организма, которые побуждают эту иммунную клетку участвовать в организации и регуляции обмена веществ. Так, в условиях «мирного времени», т. е. при отсутствии патогена и обусловленного им воспалительного процесса, макрофаги участвуют в регуляции экспрессии генов, отвечающих за метаболизм липидов и глюкозы, дифференцировку клеток жировой ткани.
Интеграция между взаимоисключающими «мирным» и «военным» направлениями работы макрофагов осуществляется путем изменения активности рецепторов клеточного ядра, представляющих собой особую группу регуляторных белков.
Среди этих ядерных рецепторов следует особо выделить так называемые липидные сенсоры, т. е. белки, способные взаимодействовать с липидами (например, окисленными жирными кислотами или производными холестерина) (Смирнов, 2009). Нарушение работы этих чувствительных к липидам регуляторных белков в макрофагах может быть причиной системных обменных нарушений. Например, дефицит в макрофагах одного из этих ядерных рецепторов, обозначаемых как PPAR-гамма, приводит к развитию диабета 2 типа и дисбалансу липидного и углеводного обмена во всем организме.
Клеточные метаморфозы
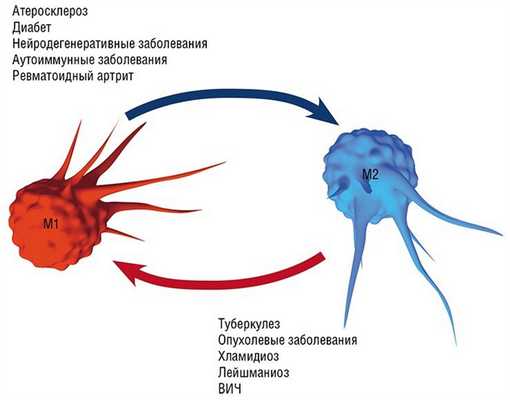
В разнородном сообществе макрофагов на основе базовых характеристик, определяющих их принципиальные функции, выделяют три основных клеточных субпопуляции: макрофаги М1, М2 и Мox, которые участвуют, соответственно, в процессах воспаления, восстановления поврежденных тканей, а также защите организма от окислительного стресса.
«Классический» макрофаг М1 формируется из клетки-предшественника (моноцита) под действием каскада внутриклеточных сигналов, запускающихся после распознавания инфекционного агента с помощью специальных рецепторов, расположенных на поверхности клетки.
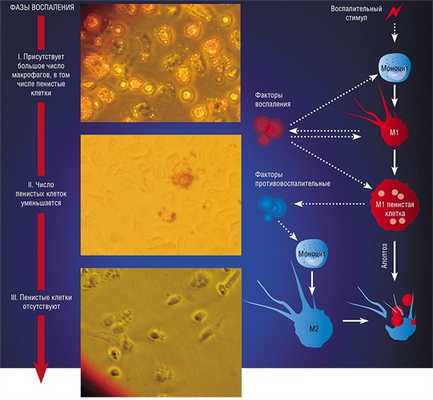
Образование «пожирателя» М1 происходит в результате мощной активации генома, сопровождаемой активацией синтеза более чем сотни белков – так называемых факторов воспаления. К ним относятся ферменты, способствующие генерации свободных радикалов кислорода; белки, привлекающие в очаг воспаления другие клетки иммунной системы, а также белки, способные разрушать оболочку бактерий; воспалительные цитокины – вещества, обладающие свойствами активировать иммунные клетки и оказывать токсическое действие на остальное клеточное окружение. В клетке активируется фагоцитоз и макрофаг начинает активно разрушать и переваривать все, что встретится на его пути (Шварц, Свистельник, 2012). Так появляется очаг воспаления.
Однако уже на начальных этапах воспалительного процесса макрофаг М1 начинает активно секретировать и противовоспалительные субстанции – низкомолекулярные липидные молекулы. Эти сигналы «второго эшелона» начинают активировать вышеупомянутые липидные сенсоры в новых «рекрутах»-моноцитах, прибывающих в очаг воспаления. Внутри клетки запускается цепь событий, в результате которых активирующий сигнал поступает на определенные регуляторные участки ДНК, усиливая экспрессию генов, отвечающих за гармонизацию обмена веществ и одновременно подавляя активность «провоспалительных» (т. е. провоцирующих воспаление) генов (Душкин, 2012).
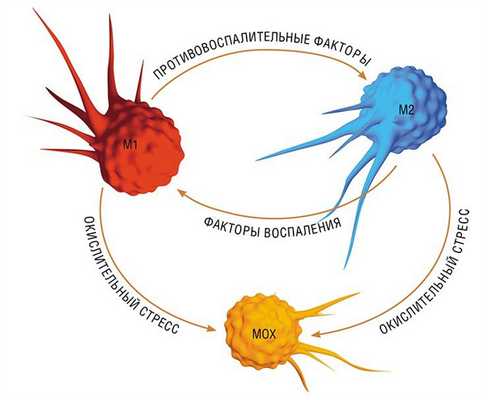
Так в результате альтернативной активации образуются макрофаги М2, которые завершают воспалительный процесс и способствуют тканевому восстановлению. Популяцию М2 макрофагов можно, в свою очередь, разделить на группы в зависимости от их специализации: уборщики мертвых клеток; клетки, участвующие в реакции приобретенного иммунитета, а также макрофаги, секретирующие факторы, которые способствуют замещению погибших тканей соединительной тканью.
Еще одна группа макрофагов – Мох, формируется в условиях так называемого окислительного стресса, когда в тканях возрастает опасность повреждения их свободными радикалами. Например, Мох составляют около трети всех макрофагов атеросклеротической бляшки. Эти иммунные клетки не только сами устойчивы к повреждающим факторам, но и участвуют в антиоксидантной защите организма(Gui et al., 2012).
Пенистый камикадзе
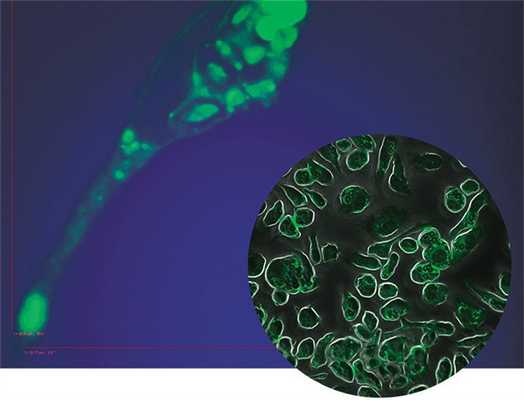
Одной из самых интригующих метаморфоз макрофага является его превращение в так называемую пенистую клетку. Такие клетки были обнаружены в атеросклеротических бляшках, а свое название получили из-за специфического внешнего вида: под микроскопом они напоминали мыльную пену. По сути, пенистая клетка – это тот же макрофаг М1, но переполненный жировыми включениями, преимущественно состоящими из водонерастворимых соединений холестерина и жирных кислот.
Была высказана гипотеза, ставшая общепринятой, что пенистые клетки образуются в стенке атеросклеротических сосудов в результате неконтролируемого поглощения макрофагами липопротеинов низкой плотности, переносящих «плохой» холестерин. Однако впоследствии было обнаружено, что накопление липидов и драматическое (в десятки раз!) возрастание скорости синтеза ряда липидов в макрофагах можно спровоцировать в эксперименте только лишь одним воспалением, без всякого участия липопротеинов низкой плотности (Душкин, 2012).
Это предположение подтвердилось клиническими наблюдениями: оказалось, что превращение макрофагов в пенистую клетку происходит при разнообразных заболеваниях воспалительной природы: в суставах – при ревматоидном артрите, в жировой ткани – при диабете, в почках – при острой и хронической недостаточности, в ткани мозга – при энцефалитах. Однако понадобилось около двадцати лет исследований, чтобы понять, как и зачем макрофаг при воспалении превращается в клетку, нафаршированную липидами.
Оказалось, что активация провоспалительных сигнальных путей в М1 макрофагах приводит к «выключению» тех самых липидных сенсоров, которые в нормальных условиях контролируют и нормализуют липидный обмен (Душкин, 2012). При их «выключении» клетка и начинает накапливать липиды. При этом образующиеся липидные включения представляют собой вовсе не пассивные жировые резервуары: входящие в их состав липиды обладают способностью усиливать воспалительные сигнальные каскады. Главная цель всех этих драматических изменений – любыми средствами активировать и усилить защитную функцию макрофага, направленную на уничтожение «чужих» (Melo, Drorak, 2012).
Однако высокое содержание холестерина и жирных кислот дорого обходится пенистой клетке – они стимулируют ее гибель путем апоптоза, запрограммированной клеточной смерти. На внешней поверхности мембраны таких «обреченных» клеток обнаруживается фосфолипид фосфатидилсерин, в норме расположенный внутри клетки: появление его снаружи является своеобразным «похоронным звоном». Это сигнал «съешь меня», который воспринимают М2 макрофаги. Поглощая апоптозные пенистые клетки, они начинают активно секретировать медиаторы заключительной, восстановительной стадии воспаления.
Фармакологическая мишень
Воспаление как типовой патологический процесс и ключевое участие в нем макрофагов является, в той или иной мере, важной составляющей в первую очередь инфекционных заболеваний, вызванных различными патологическими агентами, от простейших и бактерий до вирусов: хламидиальные инфекции, туберкулез, лейшманиоз, трипаносомоз и др. Вместе с тем макрофаги, как уже упоминалось выше, играют важную, если не ведущую, роль в развитии так называемых метаболических заболеваний: атеросклероза (главного виновника сердечно-сосудистых заболеваний), диабета, нейродегенеративных заболеваний мозга (болезнь Альцгеймера и Паркинсона, последствия инсультов и черепно-мозговых травм), ревматоидного артрита, а также онкологических заболеваний.
Разработать стратегию управления этими клетками при различных заболеваниях позволили современные знания о роли липидных сенсоров в формировании различных фенотипов макрофага.
Так, оказалось, что в процессе эволюции хламидии и туберкулезные палочки научились использовать липидные сенсоры макрофагов, чтобы стимулировать не опасную для них альтернативную (в М2) активацию макрофагов. Благодаря этому поглощенная макрофагом туберкулезная бактерия может, купаясь как сыр в масле в липидных включениях, спокойно дожидаться своего освобождения, а после гибели макрофага размножаться, используя содержимое погибших клеток в качестве пищи (Melo, Drorak, 2012).
Если в этом случае использовать синтетические активаторы липидных сенсоров, которые препятствуют образованию жировых включений и, соответственно, предотвращают «пенистую» трансформацию макрофага, то можно подавить рост и понизить жизнеспособность инфекционных патогенов. По крайней мере в экспериментах на животных уже удалось в разы снизить обсемененность легких мышей туберкулезными бациллами, используя стимулятор одного из липидных сенсоров или ингибитор синтеза жирных кислот (Lugo-Villarino et al., 2012).
Еще один пример – такие болезни, как инфаркт миокарда, инсульт и гангрена нижних конечностей, опаснейшие осложнения атеросклероза, к которым приводит разрыв так называемых нестабильных атеросклеротических бляшек, сопровождаемый моментальным образованием тромба и закупоркой кровеносного сосуда.
Формированию таких нестабильных атеросклеротических бляшек и способствует макрофаг М1/пенистая клетка, который продуцирует ферменты, растворяющие коллагеновое покрытие бляшки. В этом случае наиболее эффективная стратегия лечения – превращение нестабильной бляшки в стабильную, богатую коллагеном, для чего требуется трансформировать «агрессивный» макрофаг М1 в «умиротворенный» М2.
Экспериментальные данные свидетельствуют, что подобной модификации макрофага можно добиться, подавляя в нем продукцию провоспалительных факторов. Такими свойствами обладает ряд синтетических активаторов липидных сенсоров, а также природные вещества, например, куркумин – биофлавоноид, входящий в состав корня куркумы, хорошо известной индийской пряности.
Нужно добавить, что такая трансформация макрофагов актуальна при ожирении и диабете 2 типа (большая часть макрофагов жировой ткани имеет М1 фенотип), а также при лечении нейродегенеративных заболеваний мозга. В последнем случае в мозговых тканях происходит «классическая» активация макрофагов, что приводит к повреждению нейронов и накоплению токсичных веществ. Превращение М1-агрессоров в мирных дворников М2 и Mox, уничтожающих биологический «мусор», может в ближайшее время стать ведущей стратегией лечения этих заболеваний (Walace, 2012).
С воспалением неразрывно связано и раковое перерождение клеток: например, имеются все основания считать, что 90 % опухолей в печени человека возникает как следствие перенесенных инфекционных и токсических гепатитов. Поэтому с целью профилактики раковых заболеваний необходимо контролировать популяцию М1 макрофагов.
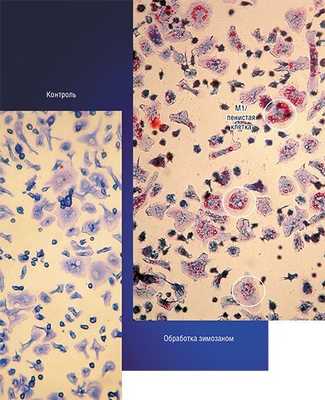
Однако не все так просто. Так, в уже сформированной опухоли макрофаги преимущественно приобретают признаки статуса М2, который содействует выживанию, размножению и распространению самих раковых клеток. Более того, такие макрофаги начинают подавлять противораковый иммунный ответ лимфоцитов. Поэтому для лечения уже образовавшихся опухолей разрабатывается другая стратегия, основанная на стимулировании у макрофагов признаков классической М1-активации (Solinas et al., 2009).
Примером такого подхода служит технология, разработанная в новосибирском Институте клинической иммунологии СО РАМН, при которой макрофаги, полученные из крови онкобольных, культивируют в присутствии стимулятора зимозана, который накапливается в клетках. Затем макрофаги вводят в опухоль, где зимозан освобождается и начинает стимулировать классическую активацию «опухолевых» макрофагов.
Сегодня становится все более очевидно, что соединения, вызывающие метаморфозы макрофагов, оказывают выраженное атеропротективное, антидиабетическое, нейропротективное действие, а также защищают ткани при аутоиммунных заболеваниях и ревматоидном артрите. Однако такие препараты, имеющиеся на сегодня в арсенале практикующего врача, – фибраты и производные тиазолидона, хотя и снижают смертность при этих тяжелых заболеваниях, но при этом имеют выраженные тяжелые побочные действия.
Эти обстоятельства стимулируют химиков и фармакологов к созданию безопасных и эффективных аналогов. За рубежом – в США, Китае, Швейцарии и Израиле уже проводятся дорогостоящие клинические испытания подобных соединений синтетического и природного происхождения. Несмотря на финансовые трудности, российские, в том числе и новосибирские, исследователи также вносят свой посильный вклад в решение этой проблемы.
Так, на кафедре химии Новосибирского государственного университета было получено безопасное соединение TS-13, стимулирующее образование Мox фагоцитов, которое обладает выраженным противовоспалительным эффектом и оказывает нейропротективное действие в экспериментальной модели болезни Паркинсона (Дюбченко и др., 2006; Зенков и др., 2009).
В Новосибирском институте органической химии им. Н. Н. Ворожцова СО РАН созданы безопасные антидиабетические и противоатеросклеротические препараты, действующие сразу на несколько факторов, благодаря которым «агрессивный» макрофаг М1 превращается в «мирный» М2 (Dikalov et al., 2011). Большой интерес вызывают и растительные препараты, получаемые из винограда, черники и других растений с помощью механохимической технологии, разработанной в Институте химии твердого тела и механохимии СО РАН (Dushkin, 2010).
С помощью финансовой поддержки государства можно в самое ближайшее время создать отечественные средства для фармакологических и генетических манипуляций с макрофагами, благодаря которым появится реальная возможность превращать эти иммунные клетки из агрессивных врагов в друзей, помогающих организму сохранить или вернуть здоровье.
Душкин М. И. Макрофаг/пенистая клетка как атрибут воспаления: механизмы образования и функциональная роль // Биохимия, 2012. T. 77. C. 419—432.
Смирнов А. Н. Липидная сигнализация в контексте атерогенеза // Биохимия. 2010. Т. 75. С. 899—919.
Шварц Я. Ш., Свистельник А. В.Функциональные фенотипы макрофагов и концепция М1-М2-поляризации. Ч. 1 Провоспалительный фенотип. // Биохимия. 2012. Т. 77. С. 312—329.
Нарушения функции моноцитов и макрофагов иммунитета
При хронической гранулематозной болезни способность мононуклеарных фагоцитов и нейтрофилов уничтожать поглощенные бактерии резко нарушена. Это приводит к образованию абсцессов и характерных гранулем в очагах скопления макрофагов в печени, легких, селезенке и лимфатических узлах. В основе этого нарушения лежит генетическая недостаточность комплекса адгезивных мембранных гликопротеидов CD11/ CD18 (дефект адгезии лейкоцитов), в который входит рецептор С3 — рецептор опсонизирующего компонента комплемента.
Дефектам системы моноцитов-макрофагов принадлежит значительная роль в патогенезе ряда болезней накопления липидов (сфинголипидозов). При ферментной недостаточности макрофаги не убирают клеточный детрит, что приводит к его накоплению в тканях и снижению сопротивляемости инфекции. Примером таких заболеваний служит болезнь Гоше, при которой нарушена функция фермента глюкоцереброзидазы, в результате макрофаги превращаются в клетки Гоше, содержащие большое количество глюкозил-церамида (глюкозилцереброзида) — компонента мембран погибших клеток. Таких больных можно лечить с помощью инфузий нормального фермента, модифицированного таким образом, что он выставляет остатки маннозы, которые связываются с рецепторами маннозы на поверхности макрофагов.
Цитокин ИЛ-12 стимулирует продукцию ИФН-у Т- и NK-клетками. У больных с наследственной недостаточностью рецептора ИФН-у на макрофагах или рецепторов ИЛ-12 или самого ИЛ-12 в лимфоцитах резко снижена резистентность к нетуберкулезной микобактериальной инфекции (Mycobacterium avium или БЦЖ). Примерно 50% таких больных страдают диссеминированным сальмонеллезом. В настоящее время все эти нарушения носят общее название микобактерицидных дефектов лейкоцитов.
Повышенная восприимчивость к инфекциям позволяет подозревать дефекты функции моноцитов-макрофагов и при многих других клинических состояниях. Например, мононуклеарные фагоциты новорожденных in vitro легче заражаются ВИЧ и вирусом кори, чем клетки взрослого человека. Макрофаги новорожденных, особенно недоношенных, выделяют меньше Г-КСФ и ИЛ-6 в культуральную среду. Это подтверждают данные о низком уровне Г-КСФ в крови и малых запасах гранулоцитов в костном мозге новорожденных, особенно недоношенных. ИФН-у слабее активирует макрофаги новорожденных, что могло бы объяснить бо, льшую подверженность внутриклеточным инфекциям в этом возрасте.
Первоначально гистиоцитами назвали клетки, обнаруживаемые в фиксированных тканевых препаратах, которые считали макрофагами. Однако сейчас известно, что при гистиоцитозе X происходит подобное злокачественному разрастание дендритных клеток Лангерганса. Поэтому название гистиоцитоз клеток Лангерганса точнее отражает это нарушение, так как «гистиоцит» — это лишь гистологический термин, не отражающий специфичности клеток.
Мононуклеары: моноциты и макрофаги
Мононуклеарным фагоцитам (моноцитам и макрофагам) принадлежит важнейшая роль в иммунных реакциях, защите организма от инфекций, а также восстановлении и перестройке тканей. Не бывает человека, у которого отсутствовала бы эта линия клеток, поскольку макрофаги, по-видимому, необходимы для удаления примитивных тканей по мере их замещения новыми в процессе эмбрионального развития.
Моноциты и различные формы тканевых макрофагов составляют систему мононуклеарных фагоцитов. Это именно система, так как все мононуклеары имеют общее происхождение, сходное строение и одинаковые функции (фагоцитоз).
Основная локализация макрофагов в тканях:
• Печень (купферовские клетки).
• Легкие (интерстициальные и альвеолярные макрофаги).
• Соединительная ткань.
• Серозные полости (плевральные и перитонеальные макрофаги).
• Кости (остеокласты).
• Головной мозг (реактивные клетки микроглии).
• Селезенка, лимфатические узлы, костный мозг.
• Стенка кишечника.
• Грудное молоко.
• Плацента.
• Гранулемы (многоядерные гигантские клетки).
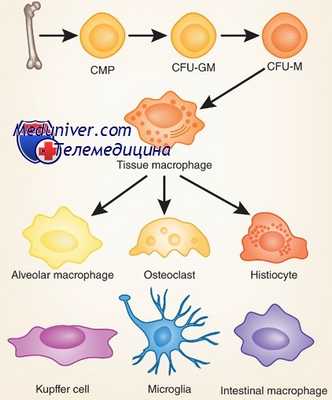
Моноциты — циркулирующие в крови предшественники тканевых макрофагов — развиваются в костном мозге быстрее и остаются в крови дольше нейтрофилов. Первый предшественник моноцита, монобласт, превращается в промоноцит, несколько более крупную клетку с цитоплазматическими гранулами и вдавленным ядром, состоящую из небольших глыбок хроматина, и, наконец, — в полностью развитый моноцит.
Зрелый моноцит по своим размерам больше нейтрофила, и его цитоплазма заполнена гранулами, содержащими гидролитические ферменты. Превращение монобласта в зрелый моноцит крови занимает около 6 сут. Моноциты сохраняют некоторую способность к делению и после попадания в ткани подвергаются дальнейшей дифференцировке; в тканях они могут оставаться в течение нескольких недель и месяцев.
В отсутствие воспаления моноциты, по-видимому, случайным образом попадают в ткани. Оказавшись там, они трансформируются в тканевые макрофаги, морфологические, а иногда и функциональные свойства которых зависят от конкретной ткани. Органоспецифические факторы влияют на дифференцировку моноцитов и определяют их метаболические и структурные особенности. В печени они превращаются в купферовские клетки, которые соединяют синусоиды, разделяющие соседние пластинки гепатоцитов.
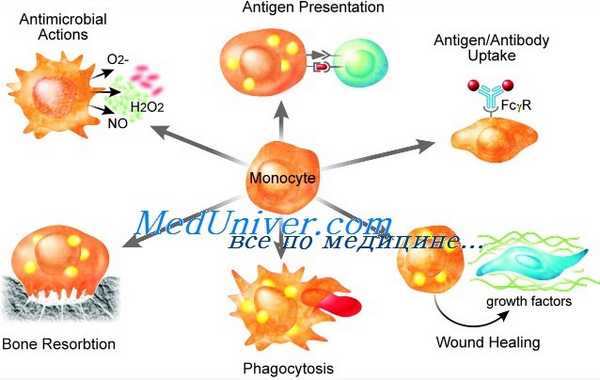
В легких они представлены крупными эллипсоидными альвеолярными макрофагами, в костях — остеокластами. Все макрофаги обладают по крайней мере тремя основными функциями — антигенпредставляющей, фагоцитарной и иммуномодулирующей, связанной с секрецией многих цитокинов. В очагах воспаления моноциты и макрофаги могут сливаться друг с другом, образуя многоядерные гигантские клетки — последняя стадия развития мононуклеарных фагоцитов. Под действием некоторых цитокинов моноциты крови дифференцируются в дендритные клетки, которые особенно эффективно представляют антигены лимфоцитам.
Нарушения функции фагоцитов. Генетические причины недостаточности адгезии лейкоцитов
В защите кожи и слизистых оболочек от чужеродных агентов наиболее важная роль принадлежит нейтрофилам. Фагоциты должны появляться в очаге воспаления уже в первые 2-4 ч после проникновения микробов в ткань. В противном случае может произойти местная и гематогенная диссеминация инфекции.
Оценка состояния иммунитета при подозрении на иммунодефицит, особенно при рецидивирующих или необычных бактериальных инфекциях, свидетельствующих о нарушении функции фагоцитов, крайне трудна. Сложность дифференциальной диагностики обусловлена сходством клинических проявлений дефектов нейтрофилов, антителообразования и комплемента. Нарушение фагоцитарной функции у больного с рецидивирующими или необычными инфекциями следует предполагать в случае нормальных результатов первичного иммунологического исследования. Наследственные нарушения фагоцитов встречаются редко, но выяснение их молекулярных механизмов вносит неоценимый вклад в понимание нормальной функции нейтрофилов.
Хемотаксис, миграция клеток в очаги воспаления, включает несколько этапов. Исследования нарушенного in vitro хемотаксиса нейтрофилов у детей с различными заболеваниями не позволяют установить, являются ли рецидивирующие инфекции следствием нарушения хемотаксиса или обусловлены осложнениями основного заболевания. Синдром гиперпродукции IgE характеризуется снижением подвижности нейтрофилов на фоне высокого уровня IgE, что приводит к развитию хронического дерматита и рецидивирующим синуситам и пневмониям. Для детей с этим синдромом характерны грубые черты лица, задержка прорезывания молочных зубов и повышение частоты переломов.
Генетические причины недостаточности адгезии лейкоцитов
Недостаточность адгезии лейкоцитов-1 и -2 (НАЛ-1 и НАЛ-2) — редкая аутосомно-рецессивная патология. НАЛ-1 встречается с частотой около 1:10 000 000 и характеризуется повторными бактериальными и грибковыми инфекциями, а также ослаблением воспалительных реакций, несмотря на выраженный нейтрофильный лейкоцитоз.
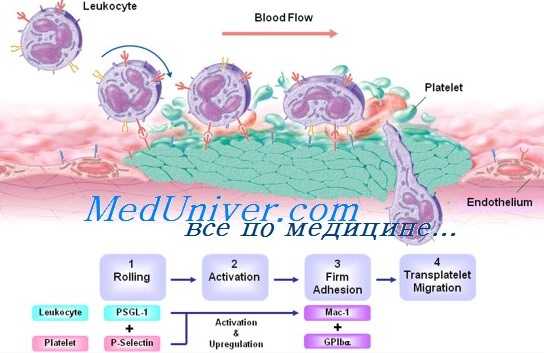
В основе недостаточности адгезии лейкоцитов-1 лежат мутации гена, расположенного на хромосоме 21 (участок q22.3) и кодирующего CD18 — b2-субъединицу лейкоцитарных интегринов с молекулярной массой 95 кДа. Нормальные нейтрофилы экспрессируют на мембране три гетеродимерные молекулы адгезии, носящие названия LFA-1 (CDlla/CD18), Мас-1 (CDllb/CD18; она же CR3, или рецептор iC3b) и р150,95 (CD11C/CD18). Эти три трансмембранные молекулы состоят из уникальных а1-субъединиц с молекулярной массой соответственно 185, 190 и 150 кДа, кодируемых генами на хромосоме 16, и общей Р2-субъединицы.
Эти лейкоцитарные интегрины обеспечивают прочную адгезию нейтрофилов на поверхности эндотелиальных клеток, извлекая нейтрофилы из циркуляции, и адгезию на микроорганизмах, покрытых iC3b. В результате происходит фагоцитоз микробов и активируется НАДФ-зависимая оксидаза.
Мутации гена CD 18 нарушают синтез мРНК или изменяют структуру синтезируемого пептида, нарушая его посттрансляционный процессинг или полностью лишая нейтрофилы комплекса CD11/ CD18. Полимеры CDllа1-субъединиц нестабильны, и дефицит трех таких субъединиц на нейтрофилах лежит в основе НАЛ-1. При некоторых мутациях генов CD11/CD18 сборка и функциональная активность интегриновых молекул в той или иной степени сохраняются, заболевание у детей проявляется не в самой тяжелой форме. При полном же отсутствии b2-интегринов нейтрофилы не попадаю т в очаги воспаления вне легких, поскольку не обазуют прочных связей с эндотелием. Неспособность лишенных комплекса CD11/CD18 нейтрофилов проникать сквозь эндотелий обусловлена связыванием b2-интегринов с внутриклеточными молекулами адгезии ICAM-1 и ICAM-2, которые экспрессируются эндотелиальными клетками при воспалении.
Нейтрофилы, проникшие в легочный очаг воспаления независимым от CD11/CD18 путем, не «узнают» микроорганизмы, покрытые опсонизирующим фрагментом комплемента iC3b. Этот важнейший стабильный опсонин образуется при расщеплении С3b его инактиватором. В норме связывание с iC3b активирует другие функции нейтрофилов — дегрануляцию и окислительный обмен, поэтому при НАЛ-1 резко нарушаются и эти функции. В результате у больных возрастает предрасположенность к тяжелым и повторным бактериальным инфекциям.
В отсутствие комплекса CD11/CD18 моноциты не связываются с фибриногеном, что снижает их роль в заживлении ран.
При недостаточности адгезии лейкоцитов-2 (имеющей общие клинические проявления с НАЛ-1) интегрины CD11/CD18 нормальны. НАЛ-2 характеризуется неврологическими нарушениями, дефектами строения черепа и лица и фенотипом эритроцитов Bombay. В основе НАЛ-2 лежит дефект специфического транспортера ГДФ-L-фукозы в аппарате Гольджи, и фукоза не включается в гликопротеиды клеточной поверхности. В результате меняются углеводные маркеры эритроцитов, определяющие группы крови, и нарушается адгезия нейтрофилов. Нейтрофилы больных с НАЛ-2 лишены углеводной структуры сиалил-Lex, необходимой для их адгезии к активированным эндотелиальным клеткам. Поэтому такие нейтрофилы не «приклеиваются» к стенкам воспаленных венул, не активируются и не покрывают эндотелий.
1 ГБОУ ВПО «Саратовский государственный медицинский университет им. В.И. Разумовского Минздрава России»
1. Аллергология и иммунология, клинические рекомендации для педиатров / Под ред. А.А. Баранова и Р.М. Хаитова. – М.: М-Студио. – 248 с.
2. Гематология / Рукавицын О.А., Павлов А.Д., Морщакова Е.Ф. и др. Под ред. О.А. Рукавицына. – Изд–во СПб.: ООО «Д.П.», 2007. – 912 с.
3. Гематологический атлас. С. Луговская, М.Е. Почтар. 3-е издание. – Москва – Тверь. ООО «Изд-во Триада», 2011. – 368 с.
4. Драпник Г.Н. Клиническая иммунология и аллергология. – М. ООО «Медицинское информационное агентство», – 2003. – 604 с.
5. Зайчик А.Ш. Механизмы развития болезней и синдромов // А.Ш. Зайчик, Л.П. Чурилов. – СПб.: ЭЛБИ, 2002. – Т. 3. – 507 с.
6. Нормальная физиология: учебник [Н.А. Агаджанян, Н.А. Барабаш, А.Ф. Белов и др.] / Под ред. проф. В.М. Смирнова. – 3-е изд. – М.: Издательский центр «Академия», 2010. – 480 с.
8. Типовые реакции иммунной системы на действие антигенов–аллергенов / Под общей ред. проф. Чесноковой Н.П. – Изд–во Саратов. мед. ун-та. Саратов, 2014. – 154 с.
9. Физиология человека / В.Ф. Киричук, О.Н. Антипова, Н.Е. Бабиченко, В.М. Головченко, Е.В. Понукалина, И.В. Смышляева, Л.К. Токаева / Под ред В.Ф. Киричука. – 2-е изд. – Изд-во Саратовского медицинского университета. – 2009. – 343 с.
12. Abbas A.K. Diseases of immunity / Robbins and Cotran pathologic basis of disease. – 7th ed. / Editet by V. Kumar, A.K. Abbas, N. Fausto. – Philadelphia, Pennsylvania. Elserier, 2005. – P. 193–267.
Антигенперерабатывающие и антигенпрезентирующие клетки
Мононуклеарная система фагоцитов включает в себя промоноциты костного мозга и их предшественников, моноциты крови и тканевые макрофаги.
Дифференцировка моноцитов из монобластов происходит в костном мозге в течение 5 дней, после чего они сразу выходят в кровоток, не формируя, в отличие от гранулоцитов, костномозговой резерв. Небольшая часть моноцитов трансформируется в макрофаги костного мозга.
В крови человека имеются маргинальный пул моноцитов, примыкающий к сосудистой стенке, и циркулирующий пул.
Непринимающий участие в циркуляции маргинальный пул в 3,5 раза больше, чем пул циркулирующих моноцитов.
В периферической крови моноциты составляют от 1 до 10 % всех лейкоцитов, что соответствует абсолютному количеству, равному 80–600 клеткам в 1 мм3 у взрослых. Моноциты циркулируют в крови от 1,5 до 4,5 суток, а затем покидают ее и эмигрируют в ткани.
Тканевой пул моноцитов в 25 раз превышает внутрисосудистый пул. В тканях происходит трансформация моноцитов в тканевые макрофаги. Сроки жизни тканевых макрофагов составляют 60 дней и более. Наибольшее количество макрофагов содержится в печени (56,4 %) , в легких (14,9 %) , селезенке (15 %) , перитонеальной полости (7,6 %). Тканевым макрофагам отводится ведущая роль в переработке антигена, образовании высокоиммуногенных фракций антигена, индукции иммунного ответа.
Антигенперерабатывающие клетки, или профессиональные фагоциты (А–клетки), включают в себя фиксированные макрофаги печени, костного мозга, селезенки, лимфатических узлов, центральной нервной системы, а также остеокласты, альвеолярные и перитонеальные макрофаги, макрофаги плевральной и перикардиальной областей, эпителиоидные и гигантские многоядерные клетки очагов воспаления.
Основными функциями антигенперерабатывающих клеток являются фагоцитоз и уничтожение различных объектов, к числу которых относятся микроорганизмы, иммунные комплексы, опухолевые клетки, вирусинфицированные клетки, а также поврежденные, дегенерирующие в процессе апоптоза клетки.
Фагоцитоз, обеспечиваемый антигенперерабатывающими клетками, осуществляется в виде классических стадий: приближения фагоцита к фагоцитируемому объекту, аттракции, поглощения объекта фагоцитом, умерщвления (киллинга) жизнеспособных объектов, переваривания нежизнеспособных объектов.
Процессы киллинга во всех антигенперерабатывающих клетках обеспечиваются при участии кислородзависимых и кислороднезависимых бактерицидных систем. Кислородзависимые системы обеспечиваются миелопероксидазой, продуктами дыхательного взрыва, возникающего при активации фагоцитов: Н2О2, супероксидным анион-радикалом, гидроксильным радикалом, синглетным кислородом, галогенами.
Кислороднезависимые системы включают лизоцим, лактоферрин, щелочную фосфатазу, катионные белки, кислую среду фагосом.
При утрате жизнеспособности патогенных агентов антигенперерабатывающие клетки обеспечивают их переваривание за счет выделения в фагосому содержимого лизосом. В процессе слияния фагосомы и лизосомы формируется фаголизосома, где проявляют разрушающее действие различные гидролитические ферменты: протеазы, амилазы, липазы, фосфолипазы, эластазы, коллагеназы, ДНК-азы, РНК-азы, глюкозидазы и др.
Общими свойствами профессиональных фагоцитов, или антигенперерабатывающих и представляющих клеток, являются секреция биологически активных соединений на фоне антигенной стимуляции, а также представление антигенов лимфоцитам.
К профессиональным антигенпредставляющим клеткам, помимо моноцитов и А–клеток, относят клетки Лангерганса, дентритные клетки – ДК, интердигитирующие клетки тимуса, фолликулярные дендритные клетки зародышевых центров лимфатических узлов, которые несут конституциональные антигены MHC.
Касаясь локализации антигенпредставляющих клеток, следует отметить, что клетки Лангерганса локализованы в супрабазальном слое эпидермиса, составляя до 2 % всех эпидермальных клеток, а также в эпителии слизистой полости рта, пищевода, легких, влагалища, шейки матки, конъюнктивы. В небольшом количестве клетки Лангерганса выявляются в тимусе, лимфатических узлах, селезенке.
Клетки Лангерганса являются основными клетками, регулирующими интенсивность иммунного ответа в коже. Они относятся к линии дендритных клеток в связи с их способностью образовывать длинные цитоплазматические отростки, посредством которых происходит контакт с другими клетками.
Другой разновидностью антигенпредставляющих клеток являются фолликулярные дендритные клетки, локализующиеся в зародышевых центрах и первичных лимфоидных фолликулах лимфоузлов, а также селезенке.
Интердигитирующие клетки, а также клетки Лангерганса располагаются в паракортикальных зонах лимфоузлов и соответствующих Т-зависимых зонах селезенки, миндалин, мозговом веществе тимуса. В небольшом количестве они содержатся практически во всех органах и тканях.
ДК вторичных лимфоидных органов представлены несколькими субпопуляциями, отличающимися по степени экспрессии СД18. Различают незрелые ДК, а также зрелые ДК: ДК1 и ДК2, несущие различные хемокины и обеспечивающие, соответственно, дифференцировку Th0 в Th1 и Th2. Костномозговые ДК способны вызвать как Th1, так и Th2.ответы.
К числу непрофессиональных антигенпредставляющих клеток могут быть отнесены также В-лимфоциты, эндотелий сосудов, а также полиморфноядерные лейкоциты, кератиноциты, эозинофилы, тучные клетки, которые несут только индуцированные молекулы MHC.
Самыми эффективными антигенпредставляющими клетками являются дендритные клетки, способные представить антиген в первичном иммунном ответе. Источником происхождения дендритных клеток являются стволовая кроветворная клетка и, возможно, общий для Т- и В-лимфоцитов предшественник. Дендритные клетки обеспечивают индукцию иммунного ответа на экзогенные и эндогенные антигены.
Дендритные клетки первыми связывают антигенные вещества, проникая через барьер кожи, возможно, и слизистых; прочно фиксируют антиген на своей поверхности; обеспечивают неглубокий эндоцитоз и частичное ферментативное расщепление антигена.
Сконцентрировав антиген на клеточной мембране, дендритные клетки поступают в циркуляцию, затем распространяются в лимфатические узлы для представления и распознавания антигена лимфоцитами.
За короткий промежуток времени эмиграции дендритных клеток в лимфоидные органы на их мембране в высокой концентрации экспрессируются молекулы МНС-II или МНС-I.
Профессиональный фагоцит- макрофаг способен эффективно присоединять комплекс антиген-антитело за счет наличия специализированных рецепторов к Fс-фрагменту иммуноглобулинов. Фрагменты расщепления антигена из поглощенного комплекса макрофаг экспонирует на клеточной мембране в комплексе с молекулами МНС –IМНС-II, т.е. как и классические дендритные антигенпредставляющие клетки.
Следует отметить, что Т-лимфоциты способны лишь к «двойному» распознаванию пептидных антигенов только при условии их укомплектованности на поверхности клеточной мембраны антигенпредставляющих клеток с собственными молекулами клеточной мембраны, называемыми молекулами главного комплекса гистосовместимости (МНС I или II класса). За это открытие ученые P. Doherty и R. Zinkernagel, 1996 г., были удостоены Нобелевской премии по физиологии и медицине.
В-лимфоциты в роли антигенпредставляющих клеток способны уловить иммуноглобулиновым рецептором мембраны низкие дозы растворимых антигенов, особенно при повторной антигенной стимуляции.
Эндотелиальные клетки могут выполнять антигенпредставляющую функцию в зоне инфекционного воспаления, т.е. в месте проникновения антигена-аллергена.
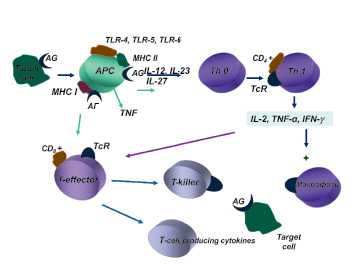
Схема участия моноцитарно-макрофагальной системы крови и тканей в механизмах индукции иммунного ответа на корпускулярные антигены-аллергены
Основными антигенпредставляющими клетками являются дендритные клетки Лангерганса, фолликулярные дендритные клетки зародышевых центров лимфатических узлов, интердигитирующие клетки тимуса.
Касаясь значимости клеток мононуклеарной фагоцитирующей системы в развитии межклеточного взаимодействия на фоне антигенной стимуляции, необходимо отметить не только их фагоцитарную и антигенпредставляющую функции, но и способность к продукции комплекса биологически активных соединений – монокинов.
Монокины – гетерогенная группа соединений с различной биологической активностью. К числу монокинов относятся следующие группы веществ:
Медиаторы воспаления и иммуномодуляции (интерлейкин 1, фактор некроза опухоли, интерферон, лизоцим, фактор активации нейтрофилов, компоненты системы комплемента С1, С2, С3, С5, а также интерлейкины – 3, 6, 8, 10, 12, 15).
Факторы свертывающей системы крови, активаторы и ингибиторы фибринолиза (активатор плазминогена, ингибиторы плазминогена и плазмина, V, VII, IX, Х плазменные факторы свертываемости крови).
Факторы роста, в частности, различные колониестимулирующие факторы, активизирующие гемопоэз в костном мозге, фактор роста фибробластов.
Моноциты и тканевые макрофаги являются ведущими клетками иммунного ответа организма, обеспечивая переработку антигенов и их презентацию (особенно при вторичном иммунном ответе) Т-хелперам. Подобная презентация необходима для запуска иммунного ответа на многие Т-зависимые антигены.
Связь между Т-хелперами и макрофагами обеспечивается при участии адгезивных молекул, синтез которых, в свою очередь, зависит от интенсивности продукции макрофагами ИЛ-I,ИЛ-6,ФНО (рисунок).
Резюмируя вышеизложенное, следует заключить, что моноциты периферической крови, трансформируясь в тканевые макрофаги по мере эмиграции за пределы сосудистого русла, обеспечивают многогранные функции, включающие не только фагоцитоз и элиминацию клеток, несущих генетически чужеродную информацию, но и индукцию иммунного ответа со стороны Т- и В-систем лимфоцитов, а также развитие синдрома системного воспалительного ответа за счет активации синтеза цитокинов с полимодальным локальным и системным действием.
Читайте также:
