Нежелательные интраоперационные и сосудистые осложнения при лечении по NCI
Добавил пользователь Владимир З. Обновлено: 29.01.2026
Заведующая онкологическим отделением в клинике Ихилов.
Как пройти дистанционное лечение рака в Израиле во время эпидемии коронавируса?
В 2020 – м году, 11 марта, COVID-19 был объявлен как глобальная пандемия. Вирус поражает человеческие органы напрямую путем инфицирования либо воздействием на иммунную систему. Чаще всего, главным осложнением коронавирусной инфекции является вирусная пневмония. Она влечет за собой острую недостаточность дыхания, при которой требуется кислородная терапия и респираторная поддержка.
Понятие коронавирусной инфекции
Коронавирусная инфекция представляет собой тяжелое острое респираторное заболевание. Может проходить как в легкой форме, так и в тяжелой. Главными и наиболее частыми симптомами данного вируса выступают:
- Высокая температура тела.
- Кашель (сухой)
- Тошнота.
- Расстройство стула (диарея).
- Тяжесть дыхания (одышка).
- Утрата вкуса и обоняния.
- Всевозможные болевые ощущения (ломота в мышцах и суставах).
- Конъюнктивит.
- Обсыпание на теле (крапивница, различные шишки).
- Быстрая утомляемость.
Главным защитным способом избежания от попадания инфекции являются маски. Но они должны использоваться с соблюдением другого перечня мер: поддержание необходимой дистанции, отказ от нахождения в замкнутом пространстве, где большое скопление людей, частое и обильное мытье рук, поддержание основных правил респираторной гигиены.
Последствия после болезни COVID-19
Легкие
Самое известное и частое последствие коронавирусной инфекции на легкие – это одышка. Главное воздействие этой болезни осуществляется на легкие. Для их восстановления после болезни не обходимо проводить длительную терапию.
Наблюдается изменение в этом органе у человека даже после выздоровления. Такое последствие реально определить с помощью процедуры под названием – томография. Для пациентов необходим дополнительно кислород. Его они получают в центрах реабилитации либо дома, путем аренды кислородного концентратора.
Сердечно – сосудистая система
COVID-19 способен поразить сердечно – сосудистую систему. Это может быть большое артериальное давление, появление тромбов, неправильная работа сердца (аритмия), воспаление миокарда. Больше всего рискуют получить такие осложнения те люди, у которых наблюдаются хронические заболевания сердечно – сосудистой системы. Причины появления таких осложнений:
- Поражение сосудов и сердца вирусом SARS-CoV-2.
- Поражения, произошедшие благодаря воспалениям в ответ на коронавирусную инфекцию.
- Сбои в работе сердца и сосудов. Это из-за недостачи магния и калия в организме человека.
- Отрицательное воздействие на человеческий организм и его сердечно – сосудистую систему препаратов, которые использовались при лечении коронавируса.
Поражение сосудов и сердца вирусом SARS-CoV-2
Данный вид вируса, как и любой другой, имеет способность осуществлять размножение исключительно в клетке. Для этого находятся рецепторы и к ним происходит прикрепление вируса. Именно через эти рецепторы коронавирусная инфекция поражает сердечно – сосудистую систему.
Пораженные вирусом легкие тоже воздействуют на работу сердца и сосудов в человеческом организме. Из – за нарушения дыхательной функции начинает становиться выше частота сокращений сердца. Это проявляется в том, что сердце за одну минуту прокачивает большое количество крови. Происходит высокое потоотделение и обезвоживание организма, из – за чего теряются магний и калий, которые требуются для сохранения нормального ритма сердца. В результате коронавируса могут наблюдаться такие осложнения:
- миокардит (воспаление в мышце сердца),
- перикардит и эндокардит (поражаются сердечные оболочки),
- аритмии (нарушается регулярность и частота ритма сердца),
- образуются тромбы,
- синдром Кавасаки (системный васкулит – поражаются мелкие и средние артерии).
Заболевания внутренних органов
Последствиями коронавирусной инфекции, которые влияют на внутренние органы человека являются:
- Понижение защитной функции организма (иммунитет).
- Мочевыделительная система ( происходят воспалительные процессы).
- Половая система (идет сбой в работе).
- Заболевания эндокринологии.
- Различные аллергические реакции.
Больше всего поражаются те органы, которые подвержены хроническим заболеваниям. Может происходить обострение тех болезней, которые ранее не проявляли себя и не беспокоили человека. Людям, переболевшим коронавирусом следует обращаться к врачу почаще и осмотрительно относиться к своему состоянию здоровья.
Центральная нервная система
Коронавирусная инфекция способна попадать и в центральную нервную систему. Ей поражаются нейроны и вспомогательные клетки. Главными проявлениями неврологии после коронавируса являются:
- Частые боли головы. Могут быть как постоянные боли, так и мигрень – возникает приступами, периодами.
- Неправильная терморегуляция. Температура тела у одних людей держится – 37; 37, 5 градусов, а у других – меньше 36 – ти градусов.
- Озноб. Очень часто чувствуется холод, мышечная дрожь.
- Нарушение зрения. Человек может опасаться света, появление различных пятен перед глазами.
- Расстраивается чувствительность (парестезия). Это характеризуется жжением, покалываниями на теле, ползанием по коже мурашек.
- Нарушается вкус и запах. Это может продолжаться в течение пары месяцев.
Кровеносная система
Наиболее известными и тяжелыми осложнениями после Ковид – 19 являются тромбозы, разрывы аневризм (выпячивается сосудистая стенка и истончается). Сосуды, которые повреждены вирусом, восстанавливаются очень долго. Все процессы, осуществляющиеся в человеческом организме, дают высокую нагрузку всей кровеносной системе.
Из – за повреждения сосудов начинают формироваться тромбы. Происходит их рост и циркуляция в крови, а человек не имеет представления, что у него тромб. Эти тромбы способны блокировать сердечные артерии и головной мозг. В результате коронавируса может быть инсульт или инфаркт. При таких симптомах, как:
- Одышка, возникающая внезапно и без всяких причин.
- Грудная боль.
- Кашель с кровью.
- Хрипы в груди.
- Состояние обморока, головокружение и холодный пот.
- Резко учащается пульс в спокойном состоянии.
Если обнаружен крупный тромб, то прописывают препараты (статины, тромболитики). Необходимо обратиться за квалифицированной помощью к врачу. Он назначит восстановительные методы. К ним относятся:
- Анализ крови на D – димер и общий анализ крови.
- Липидограмма и коагулограмма.
- Электрокардиограмма.
- Ангиография.
- Доплеография коронарных сосудов.
- Постоянный контроль артериального давления.
Желудочно – кишечный тракт
Последствиями Ковид – 19 часто является неправильная работа пищеварительной системы. Это включает в себя:
- Перистальтика кишечника снижается. Происходит медленное прохождение пищи по желудочно – кишечному тракту.
- Нарушается стул. Могут быть как запоры, так и диарея.
- Ухудшается аппетит.
В результате сочетания этих симптомов может изменяться состав правильной кишечной микрофлоры. Если состояние уже запущено, то это может стимулировать понижение иммунитета, анемии и различным аллергическим реакциям.
Печень
Последствия коронавирусной инфекции для печени проявляются в том, что может произойти обострение таких хронических заболеваний как: панкреатит, холецистит. Лечение Ковида -19 антибиотиками, гормональными и противовирусными средствами влияют на печень и оказывают на нее огромную нагрузку. В результате могут развиваться гепатит от применения лекарств, диарея, дисбактериоз. Также проявляются боли в правом боку, могут быть и обострения.
Восстанавливаться после коронавирусной инфекции следует под контролем врача. Не стоит употреблять жирную и острую пищу, так как печень требует покоя после перенесенной болезни.
Суставы
Боли в суставах начинаются у многих людей, которые переболели коронавирусом. Причинами таких болей являются:
- Влияние токсинов, появляющихся при гибели тех клеток, которые поражены вирусом. В итоге происходит выделение многих веществ, которые влекут за собой воспалительный процесс. С кровью они попадают в весь организм и это способствует воспалительному процессу в суставах, мышцах и других органах.
- Аутоимунные процессы. Вырабатываются антитела, которые уничтожают частицы вируса. Благодаря этому и наступает выздоровление. Огромная роль отводится скорому распознаванию и устранению собственных клеток, зараженных инфекцией.
Возможны следующие осложнения:
- Миозит. Воспаляется ткань мышцы, что приводит к ее разрушению.
- Кардиальные осложнения. Происходит их развитие в случае поражения мышцы сердца либо сосудистых стенок.
- Энцефалопатия. Поражается центральная нервная система. Повреждаются мелкие сосуды.
- Ревматоидный артрит. Начинается тогда, когда антитела оказывают свое влияние на суставной хрящ или суставные оболочки.
- Во избежание этих патологий следует обратиться к врачу, постоянно находиться у него под наблюдением и вовремя вести лечение суставов.
Преимущество лечения в Израиле
В клинике Ихилов в Израиле действует отделение по лечению последствий коронавирусной инфекции. Для того, чтобы попасть на прием, необходимо заполнить форму ниже или позвонить по любому из перечисленных телефонов.
Данная клиника с довольно отличной и высокой репутацией. В отделении по лечению COVID-19 в Израиле пациентам предоставляют стационар, проводят диагностику и предотвращение, профилактику вирусных заболеваний. Всем пациентам предоставляется помощь в виде консультаций. Работает круглые сутки экспресс-лаборатория, которая оснащена современными диагностическими и питательными средами для выявления инфекции.
В отделении действуют палаты с боксами для инфекционных болезней. При сложном течении болезни оказывается специализированная помощь в отделении реанимации интенсивной терапии.
Основные преимущества лечения в данной клинике:
- Получение современной и высокотехнологичной помощи.
- Качественное обслуживание пациентов.
- Удобные и комфортные условия.
- Эффективность назначенного лечения.
- Точный диагноз.
- Возможность выбрать для себя врача для лечения.
- Стоимость лечения умеренная.
- Особый подход к каждому пациенту.
После коронавирусной инфекцией, необходимо пройти полный реабилитационный курс. Для этого следует выполнять все предписания и рекомендации лечащего врача, контролировать артериальное давление и пульс. Регулярно выполнять гимнастические упражнения для дыхания, либо их комплекс для поддержания своего организма в нужной форме. Следует отказаться от табачных изделий и спиртных напитков, так как они ведут к росту тромбов. Следить за правильностью питания, принимать витамины, предписанные врачом. Совершать прогулки почаще и подольше находиться на свежем воздухе. К нагрузкам приступать постепенно.
В случае проявления каких – либо осложнений, немедленно стоит обратиться к своему лечащему врачу.
Нежелательные интраоперационные и сосудистые осложнения при лечении по NCI
Операции из минидоступа при хирургическом лечении заболеваний аортобедренного сегмента используются с 90-х годов XX века как альтернатива открытым реконструктивным операциям с применением тотальной «мечевидно-лонной» лапаротомии [2, 4].
Преимущества миниинвазивных методик заключаются в их медицинской и экономической эффективности. Первое подразумевает снижение количества осложнений и летальности, улучшение косметического эффекта и повышение комфортности лечения для больного, второе - уменьшение затрат, обусловленное прежде всего сокращением сроков госпитализации и длительности пребывания в палате интенсивной терапии, а также потребности в медикаментах и др. В настоящее время эти преимущества минилапаротомии в хирургии инфраренальной аорты можно считать доказанными [1, 3, 5].
Однако при оценке любой миниинвазивной методики необходимо принимать во внимание еще и следующие факторы:
1) методика не должна изменять стандартной технологии проведения операции, ее патогенетической сущности;
2) миниинвазивная модификация операции должна быть воспроизводима в абсолютном большинстве наблюдений. При необходимости конверсия доступа должна быть легко и безопасно выполнимой;
3) методика должна быть безопасной. Частота интраоперационных осложнений не должна увеличиваться, а при их возникновении они должны эффективно устраняться.
Целью настоящей работы явился анализ интраоперационных проблем и осложнений, частоты и причин конверсии доступа при реконструктивных операциях по поводу заболеваний аортобедренного сегмента с применением минилапаротомии.
Материал и методы
Проанализированы непосредственные результаты 269 реконструкций инфраренальной аорты с применением трансперитонеального минидоступа. Все операции были выполнены в период с 2002 по 2008 г. в отделении сосудистой хирургии республиканской клинической больницы Минздрава республики Татарстан.
Возраст больных варьировал от 29 до 83 лет (в среднем 58,3±0,57 года). 238 больным операции произведены по поводу синдрома Лериша, 30 - по поводу аневризмы инфраренальной аорты (в 17 наблюдениях - в сочетании с окклюзирующим процессом), у 1 больного имелась посттравматическая окклюзия общей подвздошной артерии. Было произведено 229 бифуркационных реконструкций, 35 унилатеральных, в 5 наблюдениях выполнено линейное протезирование инфраренальной аорты.
Длина лапаротомии варьировала от 5 до 10 см. При выполнении реконструкции использовали базовый набор «Мини-ассистент», выпускаемый серийно фирмой ЛИГА-7 (Екатеринбург), в конструкцию которого по мере отработки методики были внесены изменения.
Для сравнительного анализа частоты интраоперационных проблем и осложнений проанализированы также протоколы 162 операций, выполненных по поводу заболеваний аортобедренного сегмента (145 - окклюзирующие заболевания, 9 - аневризма инфраренальной аорты, 8 - аневризма+окклюзия) в период с 2000 по 2002 г. с применением стандартной лапаротомии.
Результаты и обсуждение
Опыт операций с применением срединной минилапаротомии показал выполнимость манипуляции в абсолютном большинстве наблюдений. В случае технических затруднений доступ может быть легко расширен путем дополнительного рассечения брюшной стенки по белой линии живота. К этой мере мы были вынуждены прибегнуть в 19 наблюдениях. Ни у одного больного длина лапаротомии не превысила 15-20 см, т.е. не достигла протяженности мечевидно-лонной.
Поскольку в начале анализируемого периода происходило освоение методики, совершенствование оперативной техники и инструментальной базы, определение противопоказаний к реконструкции аорты из минидоступа, представлялось целесообразным проанализировать причины конверсий доступа раздельно в двух временных периодах - 2002-2004 гг. (период освоения методики) и 2005-2008 гг. В I периоде было оперировано 115 больных, во II периоде - 154 больных.
Исходы операций в I периоде
Эксплорацию бедренных артерий в паховой области выполняли по обычной методике. Особое внимание уделяли тщательной препаровке тканей под паховой связкой для подготовки забрюшинного туннеля. Отходящие от наружной подвздошной артерии в lacuna vasorum эпигастральные и огибающие подвздошную кость артерии, как и эпигастральные вены, проходящие в поперечном направлении относительно артерии, могут быть легко повреждены при проведении бранши протеза. В некоторых наблюдениях мы превентивно лигировали эти сосуды.
Срединная лапаротомия - разрез брюшной стенки выше и на уровне пупка длиной 5-10 см. Протяженность лапаротомии определялась антропометрическими параметрами больного и индивидуальными предпочтениями оперирующего хирурга. Основной целью этого этапа операции является доступ в левый брыжеечный синус, через который в дальнейшем производится эксплорация аорты. В противном случае существует риск доступа к аорте через брыжейку тонкой кишки. На этом этапе мы столкнулись со сложностями в 8 наблюдениях.
Избыточная масса 3 больных (индекс массы тела 35,1; 34,7; 34,3) затрудняла манипуляции в ране из-за увеличения ее глубины. Во всех этих наблюдениях мы были вынуждены увеличить длину разреза передней брюшной стенки.
В 4 наблюдениях мы столкнулись с выраженным спаечным процессом, затрудняющим ориентацию в брюшной полости. У 2 больных доступ был расширен.
В одном наблюдении после лапаротомии была выявлена резко отечная и утолщенная брыжейка тонкой кишки. Для выяснения причины этого состояния лапаротомия была расширена и выполнена полная ревизия брюшной полости. Патологических изменений не обнаружено. Гистологическое исследование лимфатических узлов брыжейки выявило лишь отек стромы. В раннем послеоперационном периоде осложнений не было. При наблюдении в течение 12 мес также не выявлено клинически значимых заболеваний.
Таким образом, на этапе лапаротомии конверсия доступа понадобилась в 6 наблюдениях. В 2 наблюдениях сложности были преодолены без конверсии.
Эксплорация брюшной аорты. Целью этого этапа является выделение брюшной аорты и обеспечение надежного проксимального и дистального клампинга. Опыт показывает, что из минидоступа может быть выделен весь подлежащий реконструкции сегмент инфраренальной аорты - от бифуркации до левой почечной вены.
Большие размеры аневризмы аорты с распространением ее на подвздошные артерии затрудняли визуализацию проксимальной шейки и надежный дистальный клампинг. Это явилось причиной конверсии доступа в 2 наблюдениях.
У 2 больных выделение аорты затруднял выраженный рубцовый перипроцесс, в 1 наблюдении доступ был расширен.
Повреждение нижней полой вены в наших наблюдениях не встречалось, но у 2 больных были повреждены поясничные сосуды (в 1 - артерия, в 1 - вена). В одном наблюдении лигирование артерии было выполнено без расширения доступа, в другом гемостаз был достигнут после конверсии.
Формирование проксимального анастомоза и пуск кровотока. Выраженное кровотечение через швы анастомоза возникло у одного больного с кальцинозом аорты после декальцинации. Гемостаз был достигнут после повторного пережатия аорты и наложения дополнительных швов на прокладках. Доступ у этого больного был расширен.
Формирование забрюшинного туннеля и проведение протеза в бедренную рану. В условиях минилапаротомии эта манипуляция затруднена в связи с тем, что часто невозможно ввести руку в операционную рану для формирования забрюшинного канала со стороны брюшной полости. Поэтому формирование канала вслепую, только с помощью туннелизатора может вызвать такие осложнения, как разрыв заднего листка брюшины в малом тазу и повреждение артерий и вен в области формируемого туннеля.
Повреждение вен в lacuna vasorum произошло у 2 больных. В одном наблюдении гемостаз был достигнут со стороны паховой раны (лигирование ветви наружной подвздошной вены), в другом потребовалось расширение лапаротомии вниз для наложения пристеночного шва наружной подвздошной вены.
Разрыв брюшины в малом тазу произошел в 2 наблюдениях. Частичное интраабдоминальное расположение протеза было выявлено только на заключительном этапе операции после пуска кровотока. Для перитонизации шунта потребовалась конверсия доступа вниз у обоих больных.
На основании этих данных были выделены две основные группы проблем, возникающих в процессе реконструкции инфраренальной аорты из минидоступа: 1) анатомические; 2) технические (ятрогенные, собственно осложнения).
К первой группе относятся проблемы, связанные с антропометрическими параметрами (избыточная масса), анамнестическими данными (спаечный процесс после перенесенных вмешательств, сопутствующие заболевания, затрудняющие ориентацию в топографоанатомических отношениях), с характеристикой самого патологического процесса (большой размер аневризмы, кальциноз, перипроцесс). Ко второй группе относятся состояния, связанные с повреждениями анатомических структур в процессе операции, т.е. интраоперационные осложнения (кровотечение, разрыв заднего листка брюшины и др.).
Таким образом, в I периоде (периоде освоения методики) интраоперационные проблемы возникли в 19 наблюдениях (16,5% на 115 операций), из них осложнения в 7 (6,1%). В 14 наблюдениях сделана конверсия доступа, ее частота составила 12,2% (14 операций), из них частота конверсий доступа вследствие развития осложнений - 4,3% (5).
На основании анализа данных I периода нами был принят ряд тактических и технологических решений. Относительным противопоказанием к минилапаротомии считали избыточную массу. У мужчин показания к минилапаротомии были ограничены индексом массы тела более 35. У женщин данный фактор мы не всегда расцениваем как противопоказание, так как более рыхлое строение подкожной жировой клетчатки и апоневроза часто допускает создание адекватного минидоступа. При ожидаемом спаечном процессе (обширные травматичные операции в анамнезе) вопрос решался в пользу забрюшинного доступа (в том числе миниинвазивного).
Большой размер аневризмы (более 8 см в диаметре и 15 см в длину) и ее распространение на подвздошные артерии затрудняют манипуляции в ране и надежный дистальный клампинг, особенно при необходимости формирования дистальных анастомозов на уровне подвздошных артерий.
Были внесены изменения в инструментальную базу:

1) туннелизатор снабжен атравматической оливой (рис. 1), Рисунок 1. Туннелизатор. а - общий вид; б - стандартная рабочая часть (ЛИГА-7, Екатеринбург); в - усовершенствованный вариант с атравматической оливой. что снижает вероятность повреждения сосудов при формировании забрюшинного туннеля;

2) изменена конфигурация лопаток ранорасширителя - применены расширяющие площадки-насадки, что улучшает удержание петель кишечника и брыжейки, особенно при ожирении (рис. 2, а, б, в); Рисунок 2. Инструменты, используемые при минидоступе. а - стандартная лопатка кольцевого ретрактора «Мини-ассистент»; б - лопатка ретрактора со съемной площадкой-насадкой; в - площадки-насадки разных размеров; г - трехшарнирные инструменты (иглодержатель и пинцет).
3) применены удлиненные, «трехшарнирные» инструменты (рис. 2, г), облегчающие дистанционные манипуляции в глубине раны, что снижает нагрузку на пальцы и кисть хирурга;
4) для превентивного клипирования поясничных артерий и сосудов в области lacuna vasorum использован облегченный клипатор из комплекта для эндоскопической диссекции перфорантных вен.
Проведена также коррекция оперативной техники:
1) аорту стремились выделять максимально высоко вплоть до левой почечной вены, при этом предпочтение отдавали кросс-клампингу. Это позволяло пережимать аорту и формировать проксимальный анастомоз в зоне наименьших изменений аорты при надежном контроле проксимального гемостаза;
2) иногда выполняли превентивное клипирование поясничных артерий, особенно при операциях по поводу аневризм с целью снижения риска их повреждения и кровотечения из аневризматического мешка;
3) формирование забрюшинных каналов для протеза выполняли до этапа формирования проксимального анастомоза, поскольку после имплантации протеза объем раны значительно уменьшался, что затрудняло создание туннеля со стороны брюшной полости.
Исходы операций во II периоде
Во II анализируемом периоде (2005-2008) операции производили с учетом приведенных выше принципов. Всего было предпринято 154 попытки выполнения реконструкции аортобедренного сегмента с конверсией доступа в 5 (3,2%) наблюдениях, т.е. выполнено 149 аортобедренных реконструкций через минилапаротомию.
Избыточная масса стала причиной конверсии у одного больного, как и большие размеры аневризмы. Спаечный процесс наблюдался у 3 больных (1 конверсия), рубцовый процесс вокруг аорты - у 2 (конверсий доступа не было). В одном наблюдении мы столкнулись с анатомической аномалией - низким горизонтальным расположением корня брыжейки, изменяющим анатомию брыжеечных синусов. Конверсии доступа не потребовалось.
Кровотечение вследствие повреждения поясничных сосудов встретилось в двух наблюдениях, из швов проксимального анастомоза - в одном. Во всех наблюдениях гемостаз был достигнут через минидоступ.
В одном наблюдении возникли сложности с пережатием аорты из-за выраженного кальциноза. Надежный клампинг был достигнут после наложения второго зажима. Это потребовало расширения лапаротомии.
На этапе формирования забрюшинного канала для протеза ветви подвздошной вены были повреждены в 2 наблюдениях, для их устранения конверсия доступа не понадобилась. Повреждение заднего листка брюшины возникло в одном наблюдении, что потребовало расширения доступа вниз для перитонизации протеза.
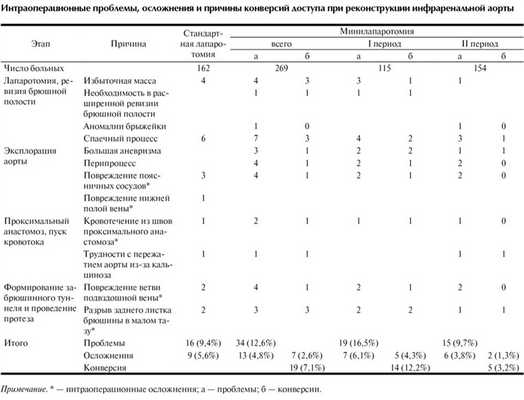
Необходимым условием для выполнения мининвазивного вмешательства является его достаточная безопасность по сравнению с традиционной методикой. Анализ протоколов 162 операций, произведенных через стандартную лапаротомию, показал, что частота возникновения интраоперационных проблем и осложнений при минилапаротомии была не выше, чем при стандартной (см. таблицу). Интраоперационные проблемы при стандартной лапаротомии возникли в 9,4% наблюдений, при минилапаротомии - в 12,6% (p=0,505), осложнения - соответственно в 5,6 и 4,8% наблюдений (p=0,930).
Таким образом, реконструкция инфраренальной аорты из минилапаротомного доступа выполнима у большинства больных, хотя и имеет ряд относительных противопоказаний, связанных прежде всего с анатомическими, антропометрическими и анамнестическими факторами (избыточная масса больного, большие размеры аневризмы, распространение аневризмы на подвздошные артерии, наличие спаечного процесса). Частота конверсии доступа, по нашим данным, составила 7,1%, по мере накопления опыта она снизилась до 3,2% (р=0,017). При этом общепринятая технология проведения реконструкции не нарушалась. Немаловажно, что в случае необходимости конверсия осуществляется довольно легко - путем дополнительного рассечения тканей брюшной стенки по белой линии живота.
Частота интраоперационных осложнений при использовании минидоступа не увеличивается по сравнению с реконструкцией, производимой через стандартный доступ (соответственно 4,8 и 5,6%; р=0,930). При возникновении осложнений в большинстве наблюдений они могут быть устранены из минидоступа.
Сосудистые осложнения после коронавируса

Новая коронавирусная болезнь, вызванная штаммами SARS-СоV-2, тесно коррелирует с различными осложнениями со стороны системы кровообращения. При этом уязвимы не только пациенты с хроническими кардиоваскулярными патологиями, но и люди, ранее не имевшие проблем со здоровьем. Почему же страдают сосуды после ковида, с чем связаны критерии высокого риска и как их можно минимизировать?
Рассказывает специалист РЦ «Лаборатория движения»
Дата публикации: 28 Октября 2021 года
Дата проверки: 30 Ноября 2021 года
Содержание статьи
Причины сердечно-сосудистой патологии после коронавируса
Существует несколько потенциальных эффектов коронавируса, вызывающих патологические изменения в сердце и сосудах:
- для проникновения в клетку хозяина возбудитель связывается с поверхностной молекулой мембранного белка 2 (АПФ2), регулирующего сердечно-сосудистую функцию
- гиперактивация иммунной системы (цитокиновый шторм) приводит к повреждению мышечных клеток сердца, нестабильности и разрыву атеросклеротических бляшек, и, как следствие, острому тромбозу и сосудистой непроходимости
- из-за поражения легких развивается гипоксемия, из-за недостатка кислорода в крови накапливаются метаболиты и другие специфические продукты жизнедеятельности клеток, вызывающие существенную нагрузку на кровеносную систему
Сосудистые осложнения при коронавирусе чаще встречаются у пациентов с хроническими соматическими заболеваниями. Существует гипотеза, что прием гиполипидемических препаратов (статинов) увеличивает поглощение холестерина, тем самым облегчая инвазию вируса в стенку сосуда. Кроме того, некоторые лекарственные средства, использующиеся в борьбе с COVID-19, обладают кардиотоксическим эффектом. Негативные последствия у ранее здоровых людей связывают с нарушением гемостаза, внутрисосудистым свертыванием и формированием кровяных сгустков.
Наиболее распространенные кардиоваскулярные осложнения после коронавируса
У пациентов, перенесших коронавирусную болезнь, существует риск развития следующих сердечно-сосудистых нарушений:
- артериальная гипертензия
- васкулит (воспаление сосудов)
- ИБС (ишемия)
- миокардит,
- перикардит
- аритмии
- инсульт
- инфаркт
- сердечная недостаточность
- кардиогенный шок
Характерно то, что осложнения на сосуды после коронавируса чаще встречаются у пациентов с тяжелой пневмонией, нуждающихся в интенсивной терапии и искусственной вентиляции легких.
Диагностика и оценка риска кардиоваскулярных расстройств
Комплекс диагностических мероприятий, направленных на выявление нарушений со стороны системы кровообращения, включает:
- ЭКГ
- ЭхоКГ
- контроль уровня лабораторных маркеров миокардиального стресса
- УЗИ легких
- КТ сердца
- МРТ (при подозрении на тромбоз левого желудочка)
- нагрузочные тесты
Для оценки риска отдаленных сердечно-сосудистых осложнений после коронавируса выздоровевшим рекомендуется длительное диспансерное наблюдение.
Как восстановить сосуды после коронавируса
Чтобы ускорить регенерацию поврежденных тканей, стабилизировать артериальное давление и восстановить функциональность сердца и сосудов, применяется специальный комплекс реабилитационных мероприятий:
- медикаментозная коррекция
- ЛФК (поэтапные программы физических тренировок)
- диетотерапия
- дозированная ходьба на свежем воздухе
- аппаратная физиотерапия
- массаж
Обязательным условием восстановления является отказ от вредных привычек, ограничение приема соли, коррекция веса и поддержание оптимальной массы тела.
Приложение А1. Методология разработки клинических рекомендаций
2. Студенты медицинских вузов, ординаторы, аспиранты.
Базы для разработки методических рекомендаций
Порядок оказания медицинской помощи взрослому населению по профилю «анестезиология и реаниматология», утвержденному приказом Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. №919н.
При разработке методических рекомендаций использовались материалы
Cochrane Reviews, рекомендации World Federation of Societies of Anaesthesiologists, Федерации анестезиологов и реаниматологов России, Association of Anaesthetists of Great Britain and Ireland, European Society of Anaesthesiology.
Методы, использованные для сбора доказательств:
Поиск в электронных базах данных. Клинические рекомендации основаны на публикациях (PubMed/MEDLINE, SCOPUS, EMBASE), в том числе метаанализах, рандомизированных контролируемых исследованиях (РКИ), международных и национальных рекомендациях с учетом следующих принципов:
1. Использовать в качестве доказательной базы рекомендаций адекватно выполненные достоверные исследования;
2. Наиболее приоритетными считать данные РКИ и метаанализов таких исследований, но также использовать результаты эмпирических исследований надлежащего научного качества и мнения экспертов;
3. Указывать класс рекомендаций и уровень доказательности по основным вопросам диагностики и лечения (табл. 1 и 2), что позволяет на стандартизованной основе оценивать состояние научного знания в той или иной области медицины.
Таблица П1. Шкала оценки УДД для диагностических вмешательств
Иерархия дизайнов клинических исследований по убыванию уровня достоверности доказательств от 1 до 5
Систематические обзоры исследований с контролем референсным методом
Отдельные исследования с контролем референсным методом
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода
Несравнительные исследования, описание клинического случая
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица П2. Шкала определения УУР для диагностических вмешательств УУР
Однозначная (сильная) рекомендация (все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
Неоднозначная (условная) рекомендация (не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
Низкая (слабая) рекомендация — отсутствие доказательств надлежащего качества (все исследования имеют низкое методологическое качество, и их выводы по интересующим исходам не являются согласованными)
Таблица П3. Шкала определения УДД для лечебных, реабилитационных, профилактических вмешательств
Систематический обзор РКИ с применением метаанализа
Отдельные РКИ и систематические обзоры исследований любого дизайна (помимо РКИ) с применением метаанализа
Нерандомизированные сравнительные исследования, в том чисде когортные исследования
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай—контроль»
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица П4. Шкала определения УУР для лечебных, реабилитационных, профилактических, вмешательств
4. Представлять конкретные алгоритмы действия для простого и быстрого использования в практической деятельности.
Рекомендации являются результатом согласованного мнения экспертов, выработанного на основании анализа опубликованных исследований в этой области [4, 7, 8]. Данные рекомендации не могут описать всего многообразия клинических форм основного и сопутствующих заболеваний и клинических ситуаций и призваны помочь выбрать врачу наиболее оптимальную стратегию и тактику периоперационного ведения больных с патологией клапанного аппарата сердца. Критическая оценка диагностических и лечебных процедур в последнее время включает определение соотношения риск—польза.
Индикаторы доброкачественной практики (Good Practice Points — GPPs)
Рекомендуемая доброкачественная практика базируется на клиническом опыте членов рабочей группы по разработке рекомендаций.
Экономический анализ
Анализ стоимости не проводился, и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций
— Внешняя экспертная оценка;
— Внутренняя экспертная оценка.
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, прежде всего, то, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания. Получены комментарии со стороны врачей анестезиологов-реаниматологов в отношении доходчивости изложения и оценки важности рекомендаций как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультация и экспертная оценка
Проект рекомендаций был рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Порядок обновления методических рекомендаций
Клинические рекомендации обновляются каждые 3 года.
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, а риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Приложение А2. Связанные документы
1. Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
2. Порядок оказания медицинской помощи взрослому населению по профилю «анестезиология и реаниматология», утвержденному приказом Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. №919н.
3. Приказ Министерства здравоохранения и социального развития Российской Федерации от 17 декабря 2015 г. №1024н «О классификации и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы».
Приложение Б. Алгоритмы ведения пациентов
1. Алгоритм ведения пациента с сопутствующей ХСН перед плановой операцией.

Приложение В. Информация для пациента
У Вас диагностирована хроническая сердечная недостаточность, которая может проявляться одышкой при физической нагрузке и в покое, отеками ног, увеличением живота, затруднением дыхания в горизонтальном положении и необходимостью спать в положении полусидя.
Необходимо рассказать анестезиологу о перенесенных инфарктах миокарда, условиях возникновения болей в груди (при какой нагрузке возникают, как долго продолжаются, отчего проходят), одышки, отеков, повышенном артериальном давлении, наличии нарушений ритма сердца (ощущения «перебоев в работе сердца», возникновении приступов мерцательной аритмии или других аритмий), обмороках, предоставить все выписки и электрокардиограммы.
Вы также должны сообщить анестезиологу обо всех принимаемых Вами препаратах и их дозах, так как кардиальная терапия может повлиять на течение анестезии и исход операции. Особенно важно обратить внимание на прием таких препаратов, как аспирин, клопидогрель, тикагрелор, варфарин, ривароксабан, дабигатран, апиксабан. Несвоевременная отмена или неоправданное прекращение приема препаратов может привести к кровотечениям и тромбозам во время и после оперативного вмешательства.
Обязательно сообщите о перенесенных вмешательствах на сердце и сосудах (ангиопластика и стентирование коронарных артерий, аортокоронарное или маммарокоронарное шунтирование, протезирование клапанов, установка кардиостимулятора, кардиовертебро-дефибриллятора).
Сопутствующие заболевания, такие как сахарный диабет, болезни почек, анемия, гипертоническая болезнь, язвенная болезнь желудка и двенадцатиперстной кишки могут также оказать влияние на тактику анестезиолога и результат оперативного лечения, поэтому необходимо сообщить врачу обо всех имеющихся у Вас диагнозах.
Важное значение имеет также наличие у Вас факторов риска сердечно-сосудистых заболеваний: курения, ожирения, повышенного уровня холестерина и липопротеидов низкой плотности, злоупотребления алкоголем, а также сердечно-сосудистых заболеваний у ближайших родственников.
Поздние осложнения чрескожных коронарных вмешательств
По данным Всемирной организации здравоохранения, сердечно-сосудистые заболевания занимают первое место в мире в структуре причин смертности. В настоящее время стандартом интервенционного лечения пациентов с атеросклеротическим поражением коронарных артерий является чрескожное коронарное вмешательство (ЧКВ). Внедрение в клиническую практику стентов второго поколения с лекарственным покрытием (СЛП) позволило увеличить эффективность и безопасность ЧКВ за счет уменьшения выраженности воспалительных изменений, а также увеличения скорости заживления и эндотелизации артерии в месте имплантации стента. Однако техника и технология вмешательства сами по себе препятствуют полному восстановлению структуры и функции сосудов и сопряжены с риском отсроченного нарушения функции стента. У пациентов, перенесших ЧКВ с имплантацией СЛП, сохраняется риск поздних осложнений стентирования (тромбоза стента, рестеноза, неоатеросклероза и кровотечения), информация о которых представлена в настоящем обзоре. Важную роль в патогенезе острого коронарного синдрома после стентирования, а также в рецидивировании клинических симптомов после ЧКВ играет неоатеросклероз. Расширенная коронарная визуализация и длительная двойная антитромбоцитарная терапия, возможно, будут иметь фундаментальное значение для дальнейшего понимания и лечения этого процесса.
Ключевые слова: ишемическая болезнь сердца, чрескожное коронарное вмешательство, стент с лекарственным покрытием, рестеноз коронарных артерий, тромбоз стента, кровотечение.
Для цитирования: Шумаков Д.В., Шехян Г.Г., Зыбин Д.И. и др. Поздние осложнения чрескожных коронарных вмешательств. РМЖ. 2020;10:25-28.
Late complications of percutaneous coronary interventions
D.V. Shumakov, G.G. Shekhyan, D.I. Zybin, A.A. Yalymov, E.V. Stepina, M.A. Popov
Moscow Regional Clinical Research Institute named after M.F. Vladimirsky, Moscow
According to the World Health Organization, cardiovascular diseases occupy first place in the world as the causes of fatal outcomes. At present, percutaneous coronary intervention (PCI) is the standard treatment regimen of patients with atherosclerotic lesions of the coronary arteries. The introduction of second-drug-eluting stents (SDES) into clinical practice has increased the efficacy and safety of PCI by reducing the severity of inflammatory changes, as well as increasing the rate of regeneration and endothelization of the artery at the stent implantation site. However, the technique and technology of intervention itself prevent the complete regeneration of vascular structure and function and are associated with the risk of late stent dysfunction. Patients who have undergone PCI with SDES implantation remain at risk of late stenting complications (stent thrombosis, restenosis, neoa therosclerosis and bleeding), which are described in this review. Neoatherosclerosis plays an important role in the pathogenesis of acute coronary syndrome after stenting, as well as the recurrence of clinical symptoms after PCI. Advanced cardiac imaging and long-term dual antiplatelet therapy may be of fundamental importance for further understanding and treatment of this pathological process.
Keywords: coronary heart disease, percutaneous coronary intervention, drug-eluting stents, restenosis, stent thrombosis, bleeding.
For citation: Shumakov D.V., Shekhyan G.G., Zybin D.I. et al. Late complications of percutaneous coronary interventions. RMJ. 2020;10:25–28.
Введение
По данным Всемирной организации здравоохранения, сердечно-сосудистые заболевания занимают первое место в мире в структуре причин смертности [1]. В Российской Федерации ишемическая болезнь сердца (ИБС) встречается у 13,5% населения [2], при этом 44,9% случаев смерти от всех причин у женщин и 55,4% у мужчин приходится именно на пациентов с ИБС (14% у лиц трудоспособного возраста) [3]. В настоящее время в лечении ИБС одно из ведущих мест занимает чрескожное коронарное вмешательство (ЧКВ) с имплантацией стента, которое ежегодно выполняется не менее чем у 5 млн пациентов во всем мире [4]. Внедрение в повседневную клиническую практику стентов с лекарственным покрытием (СЛП) второго поколения, которые в значительной степени заменили голометаллические стенты (ГМС), способствовало уменьшению выраженности воспалительных изменений, а также увеличению скорости заживления и эндотелизации артерии в месте имплантации стента [5]. Как следствие, при использовании СЛП наблюдалось снижение частоты осложнений, связанных со стентированием, что способствовало расширению показаний к ЧКВ. Однако проблема безопасности вмешательства остается актуальной. Настоящий обзор посвящен наиболее часто встречающимся поздним осложнениям стентирования: тромбоз стента (ТС), рестеноз, неоатеросклероз и кровотечение.
Тромбоз стента
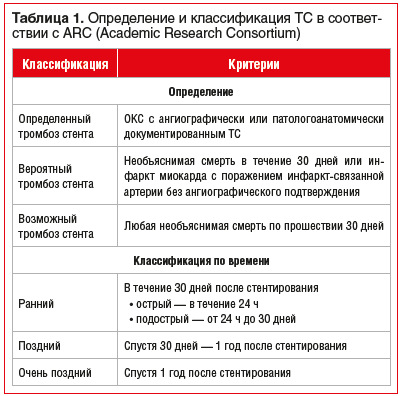
Под ТС подразумевается его тромботическая окклюзия [6]. ТС относится к большим осложнениям ЧКВ и ассоциирован с высоким риском заболеваемости и смертности. В отличие от рестеноза, на фоне которого могут возникать симптомы, характерные для стабильной стенокардии, ТС является острым процессом, который обычно манифестирует в виде острого коронарного синдрома (ОКС). Определение и классификация ТС представлены в таблице 1 [7].
По данным ранних публикаций [8, 9], ТС после ЧКВ отмечался в 16% случаев, при этом показатель 30-дневной смертности составлял 15–30%. По крайней мере отчасти, подобные результаты были обусловлены низкоэффективными схемами профилактики ТС (препараты ацетилсалициловой кислоты, дипиридамол, декстран). С совершенствованием методов стентирования и внедрением двойной антитромбоцитарной терапии (ДАТ) в клиническую практику наблюдалось выраженное снижение частоты ТС до 0,7% в течение 1 года и 0,2–0,6% в течение последующего наблюдения [10–12]. Распространенность ТС при плановом ЧКВ составляет 0,3–0,5% и увеличивается до 3,4% при ОКС. Не получено статистически значимых различий в отношении частоты ТС при использовании ГМС и СЛП. Однако для ГМС по сравнению с СЛП характерно более раннее развитие тромбоза (первые 30 дней с момента вмешательства по сравнению с 3 мес. и более) [13].
В крупных рандомизированных исследованиях и регистрах были идентифицированы факторы, ассоциированные с ТС. Так, в исследовании CHAMPION-PHOENIX инфаркт миокарда с подъемом и без подъема сегмента ST на момент поступления, ангиографические характеристики тромботических поражений и длина стента являлись независимыми предикторами острого ТС [14]. В исследовании ACUITY была установлена ассоциация между сахарным диабетом (СД), почечной недостаточностью, количеством баллов по шкале Duke Jeopardy score, минимальным диаметром просвета стента, назначением тиенопиридинов в предоперационном периоде, исходным уровнем гемоглобина, протяженностью поражений коронарных артерий и ранним ТС [15]. В субанализе HORIZONS-AMI при использовании внутрисосудистого ультразвукового исследования (ВСУЗИ) были идентифицированы следующие предикторы ТС: площадь поперечного сечения менее 5 мм, некорректное позиционирование стента, пролапс или протрузия атеросклеротической бляшки, краевая диссекция, резидуальный стеноз и бифуркационное стентирование [16]. В исследовании Triton-TIMI 38 инфаркт миокарда с подъемом сегмента ST был ассоциирован с более высоким риском ТС, который снижался на 50% при использовании некоторых антитромбоцитарных препаратов [17].
В настоящее время особое внимание уделяется позднему и очень позднему ТС. Если при развитии острого и подострого ТС основную роль, по-видимому, играют анатомические особенности коронарного русла, а также техники и технологии стентирования, то механизм отсроченных тромботических явлений представляется более сложным [18, 19]. В исследованиях идентифицированы следующие факторы риска позднего и очень позднего ТС: СД, ОКС во время исходной процедуры, почечная недостаточность, пожилой возраст, снижение фракции выброса левого желудочка, сердечно-сосудистые осложнения в течение 30 дней после исходной процедуры. Особенности ангиопластики (малый размер сосуда, бифуркационное стентирование, многососудистое поражение, наличие кальцификаций и окклюзий, использование длинных стентов), скорее всего, ассоциированы с поздним ТС как для ГМС, так и для СЛП. Риск ТС увеличивается при нарушениях, связанных с ДАТ: несоблюдение режима приема препаратов, субоптимальная дозировка, лекарственные взаимодействия, коморбидный фон, генетический полиморфизм. К позднему ТС также могут приводить неоатеросклероз (НА) в стенте и поздние реакции гиперчувствительности.
Рестеноз
Применение коронарных стентов позволило улучшить прогноз при ЧКВ по сравнению с изолированной баллонной ангиопластикой, которая сопровождалась как механическими осложнениями (окклюзия, диссекция и т. д.), так и высокой частотой рестенозов (до 40–50%). К концу 1990-х гг. до 70% ЧКВ выполнялись с имплантацией ГМС [20]. Несмотря на совершенствование технологий вмешательства и медикаментозной терапии, риск рестеноза после имплантации ГМС оставался достаточно высоким и составлял около 20%, и внедрение в клиническую практику СЛП позволило дополнительно снизить частоту рестенозов [21, 22].
Одним из наиболее важных предикторов рестенозов является СД (табл. 2). Так, у пациентов с СД, перенесших имплантацию ГМС, риск развития рестеноза увеличивается на 30–50% [23]. При этом применение СЛП у больных с СД также не позволяет полностью предотвратить данное осложнение. Механизм формирования рестеноза при СД, вероятно, является комплексным и включает в себя как системные (например, вариабельность воспалительного ответа), так и анатомические (например, стентирование сосудов малого диаметра; протяженность и диффузный характер поражений) факторы [24]. Также на распространенность рестенозов независимо влияют диаметр сосуда и протяженность поражения [22]. Кроме того, при длине стента свыше 35 мм (по сравнению с длиной менее 20 мм) наблюдалось практически двукратное увеличение частоты рестеноза. Немаловажную роль играет минимальный диаметр просвета стента [25].
Неоатеросклероз
НА называют процесс трансформации нормального слоя интимы в атерогенную неоинтиму внутри стента. Процесс опосредован накоплением липидных макрофагов и в некоторых случаях сопровождается кальцификацией в области стентирования [26]. В отличие от атеросклероза в нативных коронарных артериях, прогрессирующего в течение десятилетий, формирование неоинтимы после ЧКВ происходит в течение нескольких месяцев — нескольких лет [27].
НА в стенте проявляется инфильтрацией и апоптозом макрофагов и последующим образованием некротического ядра [28]. Точная причина высокой скорости процесса в настоящее время не установлена, однако предложено несколько механизмов, в т. ч. неполное эндотелиальное покрытие, приводящее к эндотелиальной дисфункции. На фоне данного процесса, преимущественно после имплантации СЛП, нарушается формирование клеточных соединений, снижаются экспрессия антитромботических молекул и продукция оксида азота. Кроме того, при НА имеет место проникновение липопротеинов высокой плотности и протеогликанов в субэндотелиальное пространство [29].
Для выявления механизмов недостаточности стента можно использовать ВСУЗИ или OКT [32]. Однако разрешение ОКТ (10–20 мкм) по сравнению с разрешением ВСУЗИ (80–120 мкм) делает его предпочтительным методом интракоронарной визуализации для оценки неоинтимальной ткани в стентированном сегменте.
Многоцентровой анализ показал, что среди пациентов, которым были установлены СЛП первого и второго поколения, распространенность НА, определяемого с помощью OКT, составила 27,4% (58/212) [33]. Первое поколение СЛП по сравнению со стентами второго поколения показало более высокую скорость развития НА (45,5% против 10,8%; p<0,001). Разницы между типами стентов установлено не было. Кроме того, пациенты с НА имели более высокий риск развития ОКС (19% против 3,9%; р=0,001). Многофакторный анализ показал, что хроническая болезнь почек, уровень липопротеинов низкой плотности выше 70 мг/дл и длительность наблюдения с момента установки стента были независимыми предикторами развития НА.
Таким образом, не вызывает сомнений, что НА является распространенным осложнением ЧКВ с имплантацией СЛП. Широкое внедрение внутрикоронарной визуализации, особенно ОКТ, неизбежно будет способствовать повышению осведомленности и более глубокому пониманию данного процесса. Следует подчеркнуть, что НА не является доброкачественным процессом и может приводить к очень позднему ТС.
Кровотечение
Кровотечения после ЧКВ являются значимой причиной общей и сердечно-сосудистой смертности [36]. После острой кровопотери повышается риск развития ТС, вероятно, за счет образования незрелых крупных тромбоцитов с большей реактивностью [37]. По данным регистра [38], частота больших кровотечений после ЧКВ составляет 1,7%, при этом до 50% случаев связаны с сосудистым доступом. В остальных случаях наиболее распространенной локализацией являются органы желудочно-кишечного тракта. Внедрение радиального доступа в клиническую практику способствовало значительному снижению распространенности больших кровотечений в послеоперационном периоде [39].
В настоящее время предложено несколько инструментов оценки риска кровотечений, полученных в регистрах и клинических исследованиях ОКС и ЧКВ. Шкала CRUSADE (Can Rapid risk stratification of Unstable angina patients Suppress ADverse out comes with Early implementation of the ACC/AHA guidelines) была разработана на когорте из 71 277 пациентов с ОКС без подъема сегмента ST и прошла валидацию на 17 857 больных [40]. При оценке риска больших кровотечений во время пребывания в стационаре используются исходные характеристики (женский пол, анамнез СД, облитерирующего атеросклероза артерий нижних конечностей, инсульта), клинические (частота сердечных сокращений, систолическое артериальное давление, признаки правожелудочковой сердечной недостаточности) и лабораторные (гематокрит, расчетное значение клиренса креатинина) параметры на момент поступления. Однако для данной модели характерна умеренная точность (с-статистика 0,68 и 0,73 для консервативного лечения и инвазивного лечения соответственно).
Шкала ACUITY (Acute Catheterization and Urgent Intervention Triage strategY) была разработана на когорте из 17 421 пациента с ОКС с подъемом и без подъема сегмента ST, включенных в исследования ACUITY и HORIZONS-AMI [41]. По результатам анализа были выявлены независимые предикторы кровотечений (женский пол, пожилой возраст, увеличение сывороточной концентрации креатинина, концентрация лейкоцитов, анемия и инфаркт миокарда с подъемом или без подъема сегмента ST, применение низкомолекулярных гепаринов и ингибиторов гликопротеина IIb/IIIa). Модель позволила прогнозировать риск больших кровотечений, не связанных с аортокоронарным шунтированием, в течение 30 дней и смертности в течение 1 года наблюдения. Следует отметить, что представленная шкала не была валидирована на независимой когорте больных. Кроме того, для нее характерна умеренная точность (с-статистика 0,74). Изменение практики инвазивных вмешательств (например, внедрение радиального доступа), снижение дозировки низкомолекулярных гепаринов, снижение частоты использования ингибиторов GPIIb/IIIa и применение более эффективных ингибиторов рецепторов аденозиндифосфата тромбоцитов P2Y12 (ингибиторы P2Y12) потенциально могут модифицировать расчетную величину риска. Таким образом, вероятность ишемических событий и геморрагических осложнений следует оценивать индивидуально в каждом конкретном случае. Однако важно подчеркнуть, что одни и те же факторы могут быть ассоциированы с риском и тромбоза, и кровотечений.
Достижение баланса между тромботическими событиями и геморрагическими осложнениями у пациентов, получающих длительную ДАТ, вызывает определенные затруднения. Имплантация СЛП второго поколения и назначение ДАТ в течение 6 мес. представляется достаточным для предотвращения большинства случаев ТС. Внедрение шкал PRECISE-DAPT и DAPT может индивидуализировать решения относительно длительности ДАТ.
Заключение
За последние 40 лет произошли значительные изменения в области интервенционной ангиологии у пациентов с ОКС, которые позволили повысить эффективность и безопасность ЧКВ. Внедрение в клиническую практику СЛП первого поколения значительно снизило частоту рестеноза при увеличении риска позднего ТС. Использование СЛП второго поколения сопровождалось уменьшением частоты данного осложнения, однако техника и технология стентирования сами по себе препятствуют полному восстановлению структуры и функции сосудов с соответствующим риском отсроченного нарушения функции стента. В данной ситуации следует отметить роль НА как фактора риска ОКС и позднего рецидивирования симптомов у пациентов, перенесших ЧКВ. Расширенная коронарная визуализация и длительная ДАТ, возможно, будут иметь фундаментальное значение для дальнейшего понимания и лечения этого процесса.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Читайте также:
- Классификация лейкодистрофий по поражению клеток, нарушению метаболизма
- Лучевые признаки аневризмы межпредсердной перегородки сердца плода
- КТ, МРТ при шванноме симпатического ствола
- Возбудители эмпиемы плевры. Пункционный метод лечения эмпиемы плевры
- Морфология аллергической тугоухости. Аллергический средний отит
