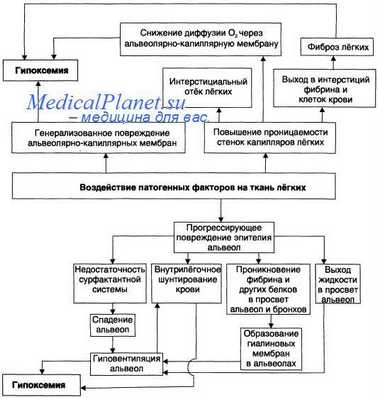
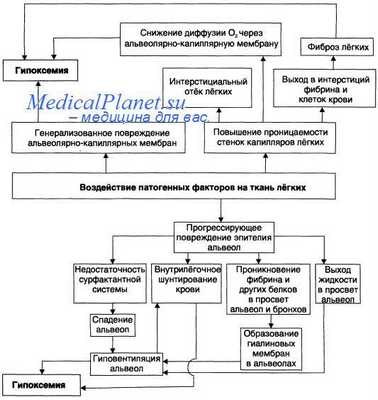
Порочные круги респираторного дистресс-синдрома.
Добавил пользователь Morpheus Обновлено: 30.01.2026
Патогенез респираторного дистресс-синдрома.
Из приведенного выше перечня заболеваний и патологических состояний, сопровождающихся РДС, можно сделать вывод о полиэтиологичности этого осложнения, тем не менее патогенетические механизмы являются общими для всех видов РДС. Они заключаются в развитии токсического интерстициального, а затем pi альвеолярного отека легких вследствие нарушения проницаемости клеточных мембран на почве эндотоксемрш.
Чтобы убедиться в этом, во ВНИИ пульмонологии МЗ СССР бьши проведены исследования токсичности крови у больных с острой пневмонией с использованием теста "времени выживания простейших". В качестве последних бьши рюпользованы тетрахршены. Если в крови здоровых людей (а также и животных) это время ввыживания составляет около 20 минут, то, в зависимости от тяжести состояния больных с острой пневмонией, это время сокращалось до 10, 5 и даже 2 мршут. Однако такое возрастание токсичности крови могло быть только одним из последствий острой пневмонии и не иметь самостоятельного значения в дальнейшем развитии пораженрш легких, которое могло происходить просто от прогрессирования основного патологического процесса в этом же органе.
Первые же наши эксперименты на кроликах с интратрахеальным введением культуры патогенных (выделенных от реальных больных) пневмококков дали достаточно удивительные результаты - уже через 5-10 мин из крови и внутренних органов (печень, почки, селезенка) стал высеваться данный возбудитель, а токсичность крови нарастала до такого же уровня, как и у больных с острой пневмонией. По всей вероятности такая же бактериемия имеет место и у больных, и лишь раннее начато антибактериальной терапии не дает возможности выявлять этот феномен чаще, чем у 30% из них.
При гистологргческом исследовании легких этих животных выявлялась картина интерстициального и альвеолярного отека на фоне воспаления - расширение межальвеолярных перегородок с инфильтрацией интерстиция лимфоидными клетками; в альвеолах находилась жидкость, богатая белком. Масса легких возрастала на 32%.
При воспроизведении аналогичного уровня эндотоксемии внутривенным введением живой или убитой культуры пневмококков также наблюдались проявления отека легких, подобные вышеописанным, но несколько меньшего масштаба. Масса легких возрастала на 25%.
Патогенез респираторного дистресс синдрома взрослых (РДСВ)
Интересно, что как при интратрахеальном, так и внутривенном введении возбудителя наблюдалась картина отека и нарастания объема внесосудистой жидкости также и в печени, почках, селезенке.
В экспериментах на собаках проводилась торакотомия и прижизненная контактная биомикроскопия легких. Уже через 15 мин после внутривенного введения как живой, так и убитой культуры пневмококков, на поверхности легких отмечалось расширение межальвеолярных перегородок с накоплением пенистой жидкости в просвете альвеол. К 30-й минуте изменения в легких нарастали и достигали максимума к 180-й минуте.
После внутривенного введения лиофилизата средних молекул на поверхности легких собак при контактной биомикроскопии также можно было отметить быстрое развитие интерстициального и альвеолярного отека легких. При электронной микроскопии отмечалось развитие деструктивных процессов в альвеоло-капиллярной мембране, начинающееся со стороны эндотелия капилляров. Аналогичные результаты были получены и на модели изолированных перфузируемых легких собак.
Подобная картина острых поражений легких на почве нарушенной проницаемости эндотелия сосудов обнаружена и при добавлении эндотоксинов (липополисахарид) грамотрицательных бактеррш и экзотоксина Escherichia coli. Причем именно липополисахаридам грамотрицательных энтеробактерий и выделяемым ими цитокинам (TNF-a) принадлежит ведущая роль в развитии септического шока, сопровождающегося рефрактерной гипотензией с нарушением тканевой перфузии и последующей мультиорганной дисфункцией.
Проведенные эксперименты показали, что в развитии поражений респираторной паренхимы легких, возникающих на фоне острой пневмонии, ведущее значение имеет не столько распространение первичного патологического процесса по воздухоносным путям, а эндотоксемия вследствие выхода в циркуляцию как живых микробов, так и продуктов воспаления, приводящих к нарушению проницаемости клеточных мембран эндотелия с выходом в интерстиций не только жидкости, но и белка. Об этом свидетельствовала значительная гипопротеинемия при развитии эндотоксемии - общий белок у экспериментальных животных снижался в течение часа с 67,0 до 51,9 г/л, главным образом за счет альбуминов (альбумино-глобулиновый коэффициент снижался с 1,3 до 0,7). Эти наблюдения подтверждают, что наблюдаемая у больных гипопротеинемия, достигающая уровня белка 40 г/л, также является следствием ухода белков в интерстиций через более порозные мембраны эндотелия капилляров. Это коррелирует с нарастанием концентрации белка в лимфе, также приближающейся к уровню 40 г/л, вместо обычных 20 г/л.
Таким образом, у больных с острой пневмонией развивается двоякий тип поражения легких - первичный, зависящий от распространения возбудителей по дыхательным путям, и вторичный, возникающий вследствие проникновения микробов и продуктов воспаления из первичного очага в кровь с развитием токсемии. При этом опасность для легочной паренхимы грозит уже не со стороны эпителия дыхательных путей, а со стороны крови через эндотелий сосудов.
Характер токсемии также многокомпонентный. Помимо собственно бактериальных токсинов (для пневмококка это гиалуронидаза, нейроаминидаза), живых и погибших микробных тел в кровь поступают продукты тканевого распада, медиаторы воспаления, целый комплекс биологически активных веществ (БАВ) - продукты калликреин-кининового каскада, гистамин, серотонин, продукты перекисного окисления липидов, протеолиза pi нарушенного метаболизма тканей (среднемолекулярные олигопептиды), распада лейкоцитов (лизосомальные энзимы).
При электронно-микроскопическом исследовании в микрососудах легких удавалось обнаружить подтверждения описанного ранее синдрома краевого стояния лейкоцитов, когда наблюдали лейкоцит в стадии распада, адгезированный к эндотелию, с лизосомальными тельцами, фиксированными к эндотелию вне лейкоцита и со значительной перифокальной зоной деструкции сосудистой стенки.
Все виды этих токсичных субстанций нарушают проницаемость клеточных мембран, причем не только легких, но и практически всех остальных внутренних органов и тканевых структур с нарушением их функционального состояния и развитием синдрома полиорганной недостаточности. И хотя чаще всего это состояние характеризуется как РДС по наиболее манифестирующим признакам дыхательной недостаточности и рентгенологических проявлений, а нарушения остальных органов внешне не столь бросаются в глаза, тем не менее трудно представить себе изолированный РДС при нормальной работе остальных органов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Респираторный дистресс-синдром
Респираторный дистресс-синдром взрослых (РДСВ) – крайне тяжелое проявление дыхательной недостаточности, сопровождающееся развитием некардиогенного отека легких, нарушений внешнего дыхания и гипоксии. Несмотря на многообразие факторов, приводящих к РДВС, в его основе лежат повреждения легочных структур, вызывающие несостоятельность транспортировки кислорода в легкие. Другими названиями респираторного дистресс-синдрома являются «шоковое», «влажное», «травматическое» легкое.
МКБ-10
Общие сведения
Резкое снижение оксигенации и вентиляции организма вызывает кислородную недостаточность сердца и головного мозга и развитие угрожающих для жизни состояний. При РДСВ летальность в случае несвоевременно или неадекватно оказанной помощи достигает 60-70%.
Причины РДСВ
Механизмом, запускающим развитие респираторного дистресс-синдрома, служит эмболизация мелких сосудов легких микросгустками крови, частичками поврежденных тканей, каплями жира на фоне образующихся в тканях токсичных биологически активных веществ — кининов, простагландинов и др. Микроэмболизация легочных сосудов развивается в результате прямого или опосредованного воздействия на капиллярно-альвеолярную мембрану легочных ацинусов различного рода повреждающих факторов.
Прямое повреждающее воздействие оказывает аспирация крови, рвотных масс и воды, вдыхание дыма и токсических веществ, контузия легких, перелом ребер, разрыв диафрагмы, передозировка наркотических средств. Опосредованное, непрямое повреждение капиллярно-альвеолярных мембран вызывает активация и агрегация форменных элементов крови при бактериальных и вирусных пневмониях, сепсисе, ожогах, сочетанных травмах и травматическом шоке, сопровождающихся массивной кровопотерей, панкреатите, аутоиммунных процессах, электротравме, эклампсии и т. д.
Патогенез
Повышение проницаемости мембраны для белка и жидкости вызывает отек интерстициальной и альвеолярной тканей, снижение растяжимости и газообменной функции легких. Эти процессы приводят к развитию гипоксемии, гиперкапнии и острой дыхательной недостаточности. Респираторный дистресс-синдром может развиваться на протяжении нескольких часов или суток от момента воздействия повреждающего фактора. В течении РДСВ выделяют три патоморфологические фазы РДСВ:
- Острая фаза (до 2-5 суток) – интерстициальный и альвеолярный отек легких, поражение капилляров легких и эпителия альвеол, развитие микроателектазов. В случае благоприятного течения респираторного дистресс-синдрома спустя несколько дней острота явлений стихает, транссудат рассасывается; в противном случае возможен переход в подострое либо хроническое течение.
- Подострая фаза – развитие бронхоальвеолярного и интерстициального воспаления.
- Хроническая фаза – соответствует развитию фиброзирующего альвеолита. Происходит утолщение и уплощение капиллярно-альвеолярных мембран, разрастание в них соединительной ткани, формирование микротромбозов и запустевание сосудистого русла. Исходом хронической фазы респираторного дистресс-синдрома служит развитие легочной гипертензии и хронической дыхательной недостаточности. Выраженный альвеолярный фиброз может возникнуть уже спустя 2-3 недели.
Симптомы РДСВ
Развитие респираторного дистресс-синдрома взрослых характеризуется последовательной сменой стадий, отражающих патологические изменения в легких и типичную картину остро нарастающей дыхательной недостаточности.
- I (стадия повреждения) – первые 6 часов со времени воздействия стрессового фактора. Жалобы, как правило, отсутствуют, клинико-рентгенологические изменения не определяются.
- II (стадия мнимого благополучия) – от 6 до 12 часов со времени воздействия стрессового фактора. Развиваются нарастающая одышка, цианоз, тахикардия, тахипноэ (учащение дыхания более 20 в мин.), беспокойство пациента, кашель с пенистой мокротой и прожилками крови. Одышка и цианоз не купируются кислородными ингаляциями, содержание кислорода в крови неуклонно падает. Аускультативно в легких – хрипы, крепитация; рентгенологические признаки соответствуют диффузному интерстициальному отеку.
- III (стадия дыхательной недостаточности) – спустя 12-24 часа после воздействия стрессового фактора. Клокочущее дыхание с выделением пенистой розовой мокроты, нарастающая гипоксемия и гиперкапния, поверхностное дыхание, увеличение центрального венозного и снижение артериального давления. По всей поверхности легких выслушиваются влажные, множественные хрипы различного калибра. На рентгенограммах определяется слияние очаговых теней. В этой стадии происходит образование гиалиновых мембран, заполнение альвеол фибрином, экссудатом, распадающимися кровяными тельцами, поражение эндотелия капилляров с образованием кровоизлияний и микроателектазов.
- IV (терминальная стадия) - метаболический ацидоз, гипоксемия и гиперкапния не устраняются предельно большими объемами интенсивной терапии и ИВЛ. Ложноположительная рентгенологическая динамика (появление очагов просветлений) вызвана разрастанием соединительной ткани, замещающей паренхиму легких. В этом терминальном периоде респираторного дистресс-синдрома развивается полиорганная недостаточность, характеризующаяся:
- артериальной гипотонией, выраженной тахикардией, фибрилляцией предсердий, желудочковой тахикардией;
- гипербилирубинемией, гиперферментемией, гипоальбуминемией, гипохолестеринемией;
- ДВС-синдромом, лейкопенией, тромбоцитопенией ;
- повышением мочевины и креатинина, олигурией;
- желудочно-кишечными и легочными кровотечениями;
- угнетением сознания, комой.
Осложнения
В ходе купирования респираторного дистресс-синдрома возможны осложнения в виде баротравм легких, бактериальных пневмоний, развития ДВС-синдрома, левожелудочковой сердечной недостаточности. Проявлениями баротравмы, развивающейся вследствие проведения аппаратной вентиляции легких, служат подкожная эмфизема, пневмоторакс, пневмомедиастинум. Повышенный риск развития баротравм у пациентов с респираторным дистресс-синдромом обусловлен перерастяжением альвеол при снижении эластичности легочной ткани.
Острая левожелудочковая недостаточность (или кардиогенный отек легких) при РДСВ обусловлена застоем кровообращения в малом круге. ДВС-синдром (синдром диссеминированного внутрисосудистого свертывания) развивается при сепсисе, панкреонекрозе и других повреждающих факторах и выражается в полиорганном поражении различных систем.
Диагностика
Респираторный дистресс-синдром является критическим состоянием и требует экстренной оценки состояния пациента. Ранними объективными проявлениями РДСВ служат нарастающие одышка, тахикардия и цианоз. Аускультативная картина легких изменяется соответственно стадиям респираторного дистресс-синдрома: от жесткого «амфорического» дыхания к клокочущим влажным хрипам и симптому «немого» («молчащего») легкого в терминальной стадии.
Характерным показателем газового состава крови при РДСВ является РаО2 ниже 50 мм рт. ст. (гипоксемия), несмотря на проводимую оксигенотерапию (при FiО2 более >60%.), нарастание гиперкапнии. У пациентов с РДСВ выраженная дыхательная недостаточность и гипоксемия сохраняются даже при ингаляциях высококонцентрированной кислородной смеси.
Биохимические показатели венозной крови характеризуются гипоальбуминемией, повышением свертывающих факторов, нарастанием трансаминаз и билирубина. При рентгенографии легких на периферии выявляются диффузные множественные тени (симптом "снежной бури"), снижение прозрачности легочной ткани, плевральный выпот обычно отсутствует.
Показатели функции внешнего дыхания свидетельствуют об уменьшении всех дыхательных объемов и статического растяжения легочной ткани менее 5 мл/мм вод. ст. Измерение давления в легочной артерии катетером Суона–Ганца показывает его «заклинивание» на уровне менее 15 мм рт.ст. Респираторный дистресс-синдром следует отличать от кардиогенного отека легких, пневмонии, ТЭЛА.
Лечение респираторного дистресс-синдрома
Лечение респираторного дистресс-синдрома осуществляется в условиях отделения интенсивной терапии и реанимации. Мероприятия по купированию РДСВ включают:
- устранение стрессового повреждающего фактора;
- коррекцию гипоксемии и острой дыхательной недостаточности;
- лечение полиорганных нарушений.
На первом этапе лечения респираторного дистресс-синдрома устраняются прямые повреждающие факторы легких, назначается массивная антибактериальная терапия при бактериальных пневмониях, сепсисе, осуществляется соответствующее лечение ожогов и травм. Для устранения гипоксии проводится подбор адекватного режима кислородотерапии с динамическим контролем газов крови (с поддержанием РО2 не менее 60 мм рт.ст.). Подача кислорода может осуществляться чрез маску или носовой катетер, при неэффективной оксигенации показана ИВЛ (при ЧД 30 в минуту).
Для профилактики развития ДВС-синдрома назначаются ацетилсалициловая кислота, дипиридамол и реополиглюкин, гепарин. Несмотря на интерстициальный и альвеолярный отек, проводится инфузионная терапия для улучшения питания органов, нормализации диуреза и поддержания уровня АД. Эффективность лечения респираторного дистресс-синдрома зависит от его своевременности: оно успешно лишь на ранних стадиях данного состояния до наступления необратимых поражений легочной ткани.
Прогноз и профилактика
Летальность в III стадии респираторного дистресс-синдрома составляет около 80%, в терминальной стадии, соответствующей полиорганной недостаточности, обычно все пациенты погибают. При благоприятном исходе после купирования РДСВ функция легких может практически полностью восстановиться, однако чаще требуется длительная поддерживающая терапия.
Специфические профилактические мероприятия респираторного дистресс-синдрома отсутствуют. Следует остерегаться воздействия стрессовых повреждающих факторов, ведущих к развитию РДСВ.
2. Острый респираторный дистресс-синдром в педиатрической практике/ Александрович Ю.С., Пшениснов К.В.// Вестник интенсивной терапии. – 2014 - No3.
4. Классификация острого респираторного дистресс-синдрома/ Мороз В.В., Голубев А. М. .// Общая реаниматология. – 2012 - №4(4).
Синдром дыхательных расстройств
Синдром дыхательных расстройств - патологическое состояние новорожденных, возникающее в первые часы и сутки после рождения вследствие морфофункциональной незрелости легочной ткани и дефицита сурфактанта. Синдром дыхательных расстройств характеризуется дыхательной недостаточностью различной степени выраженности (тахипноэ, цианозом, втяжением уступчивых мест грудной клетки, участием вспомогательной мускулатуры в акте дыхания), признаками угнетения ЦНС и нарушения кровообращения. Синдром дыхательных расстройств диагностируется на основании клинических и рентгенологических данных, оценке показателей зрелости сурфактанта. Лечение синдрома дыхательных расстройств включает оксигенотерапию, инфузионную терапию, антибиотикотерапию, эндотрахеальную инстилляцию сурфактанта.
Синдром дыхательных расстройств (СДР) – патология раннего неонатального периода, обусловленная структурно-функциональной незрелостью легких и связанным с ней нарушением образования сурфактанта. В зарубежной неонатологии и педиатрии термин «синдром дыхательных расстройств» тождественен понятиям «респираторный дистресс-синдром», «болезнь гиалиновых мембран», «пневмопатии». Синдром дыхательных расстройств развивается примерно у 20% недоношенных (у детей, рожденных ранее 27 недель гестации, – в 82-88% случаев) и 1-2% доношенных новорожденных. Среди причин перинатальной смертности на долю синдрома дыхательных расстройств приходится, по различным данным, от 35 до 75%, что указывает на актуальность и во многом еще нерешенность проблемы выхаживания детей с СДР.
Причины синдрома дыхательных расстройств
Как уже указывалось, патогенез синдрома дыхательных расстройств у новорожденных связан с незрелостью легочной ткани и обусловленной этим недостаточностью антиателектатического фактора - сурфактанта, его неполноценностью, ингибированием или повышенным разрушением.
Сурфактант представляет собой поверхностно-активный липопротеиновый слой, покрывающий альвеолярные клетки и уменьшающий поверхностное натяжение легких, т. е. предупреждающий спадение стенок альвеол. Сурфактант начинает синтезироваться альвеолоцитами с 25-26 недели внутриутробного развития плода, однако его наиболее активное образование происходит с 32-34 недели гестации. Под действием многих факторов, в числе которых гормональная регуляция глюкокортикоидами (кортизолом), катехоламинами (адреналином и норадреналином), эстрогенами, гормонами щитовидной железы, созревание системы сурфактанта завершается к 35-36-й неделе гестации.
Поэтому, чем ниже гестационный возраст новорожденного, тем меньше у него количество сурфактанта в легких. В свою очередь, это приводит к спадению стенок альвеол на выдохе, ателектазу, резкому снижению площади газообмена в легких, развитию гипоксемии, гиперкапнии и респираторного ацидоза. Нарушение альвеолокапиллярной проницаемости приводит к пропотеванию плазмы из капилляров и последующему выпадению гиалиноподобных веществ на поверхность бронхиол и альвеол, что еще в большей степени снижает синтез сурфактанта и способствует развитию ателектазов легких (болезнь гиалиновых мембран). Ацидоз и легочная гипертензия поддерживают сохранение фетальных коммуникаций (открытого овального окна и артериального протока) – это также усугубляет гипоксию, приводит к развитию ДВС-синдрома, отечно-геморрагического синдрома, дальнейшему нарушению образованию сурфактанта.
Риск развития синдрома дыхательных расстройств повышается при недоношенности, морфо-функциональной незрелости по отношению к гестационному возрасту, внутриутробных инфекциях, гипоксии плода и асфиксии новорожденного, ВПС, пороках развития легких, внутричерепных родовых травмах, многоплодии, аспирации мекония и околоплодных вод, врожденном гипотиреозе и др. Материнскими факторами риска развития синдрома дыхательных расстройств у новорожденного могут служить сахарный диабет, анемия, родовое кровотечение, родоразрешение с помощью кесарева сечения.
Классификация синдрома дыхательных расстройств
На основании этиологического принципа различают синдром дыхательных расстройств гипоксического, инфекционного, инфекционно-гипоксического, эндотоксического, генетического (при генетически обусловленной патологии сурфактанта) генеза.
На основании развивающихся патологических сдвигов выделяют 3 степени тяжести синдрома дыхательных расстройств.
- I (легкая степень) – возникает у относительно зрелых детей, имеющих при рождении состояние средней тяжести. Симптоматика развивается только при функциональных нагрузках: кормлении, пеленании, проведении манипуляций. ЧД менее 72 в мин.; газовый состав крови не изменен. Состояние новорожденного нормализуется в течение 3-4 дней.
- II (средне-тяжелая степень) – ребенок рождается в тяжелом состоянии, которое нередко требует проведения реанимационных мероприятий. Признаки синдрома дыхательных расстройств развиваются в течение 1-2 часов после рождения и сохраняются до 10 суток. Необходимость в дотации кислорода обычно отпадает на 7-8 сутки жизни. На фоне синдрома дыхательных расстройств у каждого второго ребенка возникает пневмония.
- III (тяжелая степень) – обычно возникает у незрелых и глубоко недоношенных детей. Признаки синдрома дыхательных расстройств (гипоксия, апноэ, арефлексия, цианоз, резкое угнетение ЦНС, нарушение терморегуляции) возникают с момента рождения. Со стороны сердечно-сосудистой системы отмечается тахикардия или брадикардия, артериальная гипотония, признаки гипоксии миокарда на ЭКГ. Велика вероятность летального исхода.
Симптомы синдрома дыхательных расстройств
Клинические проявления синдрома дыхательных расстройств обычно развиваются на 1-2 сутки жизни новорожденного. Появляется и интенсивно нарастает тахипноэ (ЧД до 60–80 в минуту) с участием в дыхательном акте вспомогательной мускулатуры, втяжением мечевидного отростка грудины и межреберий, раздуванием крыльев носа. Характерны экспираторные шумы («хрюкающий выдох»), обусловленные спазмом голосовой щели, приступы апноэ, синюшность кожных покровов (сначала периоральный и акроцианоз, затем – общий цианоз), пенистые выделения изо рта часто с примесью крови.
У новорожденных с синдромом дыхательных расстройств отмечаются признаки угнетения ЦНС, обусловленные гипоксией, нарастание отека мозга, склонность к внутрижелудочковым кровоизлияниям. ДВС-синдром может проявляться кровоточивостью из мест инъекций, легочным кровотечением и т. д. При тяжелой форме синдрома дыхательных расстройств стремительно развивается острая сердечная недостаточность с гепатомегалией, периферическими отеками.
Другими осложнениями синдрома дыхательных расстройств могут являться пневмонии, пневмоторакс, эмфизема легких, отек легких, ретинопатия недоношенных, некротический энтероколит, почечная недостаточность, сепсис и др. В исходе синдрома дыхательных расстройств у ребенка может отмечаться выздоровление, гиперреактивность бронхов, перинатальная энцефалопатия, нарушения иммунитета, ХНЗЛ (буллезная болезнь, пневмосклероз и др.).
Диагностика синдрома дыхательных расстройств
В клинической практике для оценки степени тяжести синдрома дыхательных расстройств используется шкала И. Сильвермана, где в баллах (от 0 до 2-х) оцениваются следующие критерии: экскурсия грудной клетки, втяжение межреберий на вдохе, западение грудины, раздувание ноздрей, опускание подбородка на вдохе, экспираторные шумы. Суммарная оценка ниже 5 баллов свидетельствует о легкой степени синдрома дыхательных расстройств; выше 5 – средней, 6—9 баллов — о тяжелой и от 10 баллов – о крайне тяжелой степени СДР.
В диагностике синдрома дыхательных расстройств решающее значение отводится рентгенографии легких. Рентгенологическая картина изменяется в различные патогенетические фазы. При рассеянных ателектазах выявляется мозаичная картина, обусловленная чередованием участков снижения пневматизации и вздутия легочной ткани. Для болезни гиалиновых мембран характерны «воздушная бронхограмма», ретикулярно-надозная сетка. В стадии отечно-геморрагического синдрома определяется нечеткость, размытость легочного рисунка, массивные ателектазы, определяющие картину «белого легкого».
Для оценки степени зрелости легочной ткани и системы сурфактанта при синдроме дыхательных расстройств применяется тест, определяющий отношение лецитина к сфингомиелину в околоплодных водах, трахеальном или желудочном аспирате; «пенный» тест с добавлением этанола в анализируемую биологическую жидкость и др. Возможно использование этих же тестов при проведении инвазивной пренатальной диагностики - амниоцентеза, осуществляемого после 32 недели гестации.
Состояние ребенка, обусловленное синдромом дыхательных расстройств, следует отличать от врожденной пневмонии, пороков дыхательной системы, атрезии хоан, ВПС, родовой травмы, врожденной диафрагмальной грыжи и др. В рамках дифференциальной диагностики выполняется нейросонография, рентгенография позвоночника, люмбальная пункция, ЭКГ, ЭхоКГ и пр.
Лечение синдрома дыхательных расстройств
Ведение ребенка с синдромом дыхательных расстройств осуществляется неонатологом, детским анестезиологом-реаниматологом с привлечением в случае необходимости детского невролога, детского пульмонолога, детского кардиолога и др.
Ребенок с синдромом дыхательных расстройств нуждается в непрерывном контроле ЧС, ЧД, газового состав крови, КОС; мониторинге показателей общего и биохимического анализа крови, коагулограммы, ЭКГ. Для поддержания оптимальной температуры тела ребенок помещается в кувез, где ему обеспечивается максимальный покой, ИВЛ или ингаляции увлажненного кислорода через носовой катетер, парентеральное питание. Ребенку периодически выполняется трахеальная аспирация, вибрационный и перкуторный массаж грудной клетки.
При синдроме дыхательных расстройств проводится инфузионная терапия раствором глюкозы, гидрокарбоната натрия; трансфузии альбумина и свежезамороженной плазмы; антибиотикотерапия, витаминотерапия, диуретическая терапия. Важным слагаемым профилактики и лечения синдрома дыхательных расстройств является эндотрахеальная инстилляция препаратов сурфактанта.
Прогноз и профилактика синдрома дыхательных расстройств
Последствия синдрома дыхательных расстройств определяются сроком родов, тяжестью дыхательной недостаточности, присоединившимися осложнениями, адекватностью проведения реанимационных и лечебных мероприятий.
В плане профилактики синдрома дыхательных расстройств наиболее важным представляется предупреждение преждевременных родов. В случае угрозы преждевременных родов необходимо проведение терапии, направленной на стимуляцию созревание легочной ткани у плода (дексаметазон, бетаметазон, тироксин, эуфиллин). Недоношенным детям необходимо проводить раннюю (в первые часы после рождения) заместительную терапию сурфактантом.
В дальнейшем дети, перенесшие синдром дыхательных расстройств, кроме участкового педиатра, должны наблюдаться детским неврологом, детским пульмонологом, детским офтальмологом.
Порочные круги респираторного дистресс-синдрома.
Более того, появляется ряд порочных кругов, когда токсический отек легких и гипоксемия стимулируют гипоксические нарушения проницаемости мембран; поражение почек способствует дополнительной задержке жидкости в организме (стимулируется отек) и шлаков (нарастает токсемия); поражение печени с подавлением ее детоксикационной функции также углубляет токсемию; токсическая миокардиопатия усугубляет органные нарушения микроциркуляции; токсическая энцефалопатия ведет и к мозговым расстройствам, а освобождающиеся нейропептиды стимулируют нейрогенный отек легких. Именно такая "суммация" поражений при полиорганной недостаточности и определяет крайне высокую летальность - до 80%. Этот синдром полиорганной недостаточности отражает биологическую катастрофу, вид биологического суицида, возникающую при широком круге клинических ситуаций.
Поражения эндотелия легочных капилляров, помимо развития интерстициального отека, приводят также к нарушениям микроциркуляции и микротромбозам, что ведет к появлению очагов ишемического поражения легочной паренхимы и последующим деструкциям. Альвеолярный отек прекращает доступ кислорода к интерстицию, что при наличии местной ишемии и анаэробной микрофлоры ведет к гангрене легкого.
Интерстициальный и альвеолярный токсический отек легких блокирует газообмен на уровне альвеол вследствие расширения аэрогематического барьера (альвеоло-капиллярной мембраны). Это приводит к тяжелой и труднокорригируемой паренхиматозной дыхательной недостаточности, являющейся ведущим фактором танатогенеза.
Примерно такой же механизм развития респираторного дистресс-синдрома при септическом и ожоговом шоке, других видах эндотоксемии. При травматическом шоке существенный вклад на общем фоне эндотоксемии имеет жировая эмболия. Однако при этом имеется в виду не столько факт попадания в циркуляцию свободного жира из зон тканевой деструкции (что, конечно, имеет место), сколько нарушение суспензионного состояния липидов и формирование жировых глобул уже в сосудистом русле. Это активизирует липазу и в результате липолиза резко возрастает концентрация свободных жирных кислот и лизофосфатидов, обладающих выраженной мембранотропной активностью.
При тяжелых травмах и, главным образом, при синдроме раздавливания, продолжительной ишемизации тканей и развитии аутолиза формируются чрезвычайно токсичные продукты тканевого распада, миоглобин и свободный гемоглобин (вследствие гемолиза), которые в наибольшей степени оказывают повреждающее воздействие на пути своего выведения - на паренхиму и функцию почек, что часто вызывает потребность в гемодиализе.
Токсичные продукты, циркулирующие в крови, оказывают повреждающее воздействие не только на эндотелий стенки сосудов, но и на ингредиенты самой крови, главным образом, на ее клетки. Нарушения проницаемости, механических и электростатических свойств мембран эритроцитов способствуют их агрегированию (сладжу) и еще большим расстройствам реологии крови и микроциркуляции. Возбуждение мембран лейкоцитов способствует возрастанию их адгезивных свойств и задержке в микрососудах (синдром краевого стояния лейкоцитов). Активация тромбоцитов также способствует повышению их адгезивности, возникновению микроагрегатов, которые становятся как бы ядрами для последующего формирования каскада реакций ДВС-синдрома, стимулирующего и микротромбозы и кровотечения.
Таким образом, респираторный дистресс-синдром является вторичным токсическим поражением респираторной паренхимы, возникающим при заболеваниях не только легких, но и при целом ряде других патологических состояний, имеющих общие патогенетические механизмы. Главным из них является токсическое нарушение проницаемости клеточных мембран.
Специальные исследования, проведенные еще в 1970-е годы, выявили нарушение активности сурфактанта при развитии шоковых легких. Сур-фактант, уменьшая поверхностное натяжение в альвеолах и обеспечивая тем самым их стабильность на выдохе, снижает и гидростатическое давление в легочных капиллярах, предотвращая транссудацию жидкости из них. Таким образом, отсутствие сурфактанта приводит как к ателектазу, так и к отеку легких. Главным действующим началом сурфактанта является фосфолишщ дипальмитил-фосфатадил холин, но существуют и белковые его компоненты, т.е. сурфактант представляет собой липо-протеид, синтез которого происходит в альвеолоцитах II типа.
Существует несколько попыток объяснить снижение активности сурфактанта. В частности, считается, что жидкость и белок, поступающие в альвеолу при отеке, дезорганизуют слой сурфактанта, смывают его. Однако возможна и прямая ингибиция сурфактанта под воздействием каких-то токсичных субстанций, среди которых выделяются свободные жирные кислоты. Гистохимические исследования показали, что уже через 2 часа после начата геморрагического шока наступают изменения поверхностно-активной пленки альвеол, ее фрагментация.
ТОРС – это воспалительная патология легочной ткани вирусной этиологии. Характеризуется нарастающей тяжелой дыхательной недостаточностью вследствие респираторного дистресс-синдрома. Клиническая картина также включает в себя лихорадку, сухой кашель, выраженную одышку. Диагностика осуществляется с помощью молекулярно-генетических методов (выявление возбудителя) и серологических исследований (поиск антител). Лечение заболевания преимущественно патогенетическое и симптоматическое, этиотропного препарата с доказанной вирулицидной эффективностью в настоящее время не разработано.
Причины ТОРС
Характеристика воздудителя
Возбудитель инфекции – РНК-содержащий коронавирус SARS–CoV. Представляет собой сферический микроорганизм с шиповидными выростами, тропизмом к клеткам альвеол, печени, кишечника, также почек, сердца, глаза. Резервуар инфекции в дикой природе – летучие мыши, источник – больной или бессимптомный носитель. Основной путь передачи – воздушно-капельный, также передача вируса может осуществляться контактным и гораздо реже ‒ фекально-оральным путем.
Факторы риска
Основные факторы риска: возраст старше 65 лет, иммунные дефициты, связанные с ВИЧ-инфекцией, онкологическими болезнями, приемом системных кортикостероидов. К уязвимой группе относят лиц с заболеваниями легких, сердечно-сосудистой системы, сахарным диабетом, ожирением. Высока вероятность заболевания у медицинских работников, лиц, осуществляющих уход за больными дома.
При попадании на слизистую рото- и носоглотки коронавирусы колонизируют эпителий. Они имеют различные механизмы связи с рецепторами. Так, с эпителиальными клетками взаимодействие происходит посредством аминопептидазы. Ведущая роль в механизме связывания с рецепторами клеток человека принадлежит гликопротеину шиповидных отростков. Вышедшие вирионы способны вновь сорбироваться на поверхности клеток, вызывая их слияние и стимулируя иммунный ответ хозяина.
Основными клетками-мишенями являются клетки альвеолярного эпителия, макрофаги. Коронавирусы, обладая способностью к индукции апоптоза, вызывают некроз пораженных тканей. Индуцирование слияния клеток оказывает сильное воздействие на их проницаемость, приводит к нарушению водно-солевого баланса и транспорта белков. В этих условиях развивается недостаточность сурфактанта, возникают симптомы легочного дистресс-синдрома.
Симптомы ТОРС
Первые симптомы тяжелого острого респираторного синдрома возникают после инкубационного периода, который составляет 5 дней (от 2 до 10 суток). Обычно пациенты предъявляют жалобы на гриппоподобный синдром: лихорадку более 38,5°C, ознобы, головную боль. Отмечается выраженная слабость, боли в мышцах, снижение работоспособности. К концу первой недели болезни или к началу второй появляется сухой мучительный кашель, который при коронавирусной инфекции обычно беспокоит больных по ночам.
Наиболее грозным проявлением ТОРС является одышка. Пациенты отмечают нарастающее чувство нехватки воздуха, особенно в ночные часы, при разговоре или натуживании, затруднение, как вдоха, так и выдоха. Позднее больные вынуждены принимать позу с опорой на руки, дыхание становится хриплым, шумным, кожа приобретает багрово-синюшный оттенок. Параллельно могут возникать першение, сухость в горле, симптомы диареи.
Диагностика коронавирусной инфекции, её лечение осуществляется совместно врачами-инфекционистами, пульмонологами, реаниматологами. Другие медицинские специалисты привлекаются по показаниям. Важен сбор эпидемиологического анамнеза, включая данные о путешествиях в эндемичные районы, семейных, рабочих контактах больного. Основные клинические, инструментальные и лабораторные методы диагностики ТОРС:
- Физикальное обследование. Объективно у больных определяются симптомы дыхательной недостаточности – одышка, вынужденное положение, синюшный оттенок кожи. Наблюдается непродуктивный кашель и повышение температуры тела. При аускультации легких – ослабление дыхания, мелкопузырчатые хрипы, притупление перкуторного звука. Сатурация у пациентов при пульсоксиметрии снижается до 90-70%.
- Лабораторные исследования. Специфических изменений нет. Общеклинический анализ крови обычно выявляет лимфопению, тромбоцитопению, ускорение СОЭ. При присоединении бактериальных осложнений развивается лейкоцитоз. В биохимических исследованиях наблюдается увеличение активности СРБ, ЛДГ, трансаминаз. Возможно удлинение АЧТВ, гипонатриемия, гипокалиемия, также гипокальциемия, гипомагниемия.
- Выявление инфекционных агентов. Верификация диагноза происходит с помощью метода ПЦР (RT PCR SARS-CoV). Материалом для выделения коронавируса служит мазок из носоглотки, мокрота, плазма крови, в период выздоровления – фекалии. Серологическое исследование (ИФА) проводится в парных сыворотках не ранее 4-х суток болезни, возможны перекрестные реакции с коронавирусами других видов.
- Инструментальные методы. Рекомендуется проведение КТ органов грудной клетки. Уже на 3-4 сутки болезни возникают типичные проявления ТОРС: сначала периферические односторонние, затем двусторонние множественные сливные инфильтраты в виде «матового стекла». На поздних сроках инфекции может обнаруживаться пневмоторакс, пневмомедиастинум, субплевральный фиброз. Необходимо динамическое КТ-исследование у инфицированных.
Дифференциальная диагностика
Схожие клинические симптомы наблюдаются при гриппе, респираторно-синцитиальной вирусной патологии, MERS, что требует их лабораторной верификации. Необходимо дифференцировать ТОРС с пневмониями, вызванными Haemophilus influenzae, Mycoplasma pneumoniae, Chlamydia species, реже Legionella species, Сoxiella burnetii, пневмококком. Дифференциальный диагноз проводится с ХОБЛ, бронхоэктатической болезнью, анафилаксией.
Лечение ТОРС
Симптомы SARS, выявляемые у пациента, являются показанием к госпитализации, за исключением легких случаев, когда допускается амбулаторное лечение с соблюдением правил самоизоляции, обязательным медицинским контролем состояния. Стационары должны быть оборудованы палатами интенсивной терапии, реанимационными отделениями. Специфической диеты нет, питьевой режим вне противопоказаний не ограничивается.
Консервативная терапия
Стандартизированное лечение ТОРС отсутствует. Предпочтительна симптоматическая терапия: жаропонижающие, препараты сурфактанта, дезинтоксикационные и иные средства. Использование системных кортикостероидов увеличивает риск внутрибольничных инфекций ‒ диссеминированных грибковых заболеваний, нарушений обмена веществ, остеонекроза. Данные препараты, назначаемые на ранних стадиях ТОРС, могут пролонгировать виремию.
Вирус ТОРС склонен к нозокомиальному распространению, поэтому использование небулайзеров, спейсеров и кислородотерапии через назальные катетеры либо маску должно быть запрещено или строго ограничено. При нарастании дыхательной недостаточности, респираторных симптомов дистресс-синдрома пациент переводится на ИВЛ. По показаниям применяется ЭКМО.
Экспериментальное лечение
Лечение с использованием рибавирина не доказало своей эффективности при ретроспективном исследовании. Применение высоких доз препарата приводило к задокументированному снижению гемоглобина у 59% пациентов, среди 36% больных регистрировался гемолиз, были отмечены гепатотоксичные, кардиотоксичные эффекты. Сочетание с лопинавиром/ритонавиром снижало частоту интубаций, а также общую смертность до 2,3%.
Лопинавир, бустированный ритонавиром, является препаратом для терапии ВИЧ-инфекции. Лечение с введением данного средства при ТОРС показало снижение вирусной нагрузки коронавируса, позволяло уменьшить дозу метилпреднизолона. Ингибирующим эффектом на возбудителя также обладал интерферон альфакон-1, однако исследование проводилось всего на 9 пациентах, сопровождалось приемом кортикостероидов и не было контролируемым.
Лечение при помощи пассивной иммунизации с помощью плазмы выздоровевших больных использовалось на небольшом числе пациентов, однако имело эффект в виде значительного снижения смертности по сравнению с плацебо либо отсутствием терапии. Наилучшие результаты получены в группе инфицированных ТОРС, которым вводили плазму не позднее 14-го дня болезни. Также предлагалась концепция человеческих моноклональных антител.
Прогноз при своевременном выявлении, отсутствии соматической декомпенсированной патологии благоприятный. Летальность ТОРС составляет около 4%, варьирует от 0 до 40% в зависимости от исходного состояния заболевшего. Специфическая профилактика (вакцина) находится в стадии разработки. Неспецифические меры: использование масок заболевшими, частое мытье рук с мылом, кашлевой этикет, в медицинских учреждениях – строгое соблюдение санитарных норм.
2. SARS (Severe Acute Respiratory Syndrome), или ТОРС (тяжелый острый респираторный синдром)/ Н. В. Астафьева, Е. Г. Белова// Лечащий врач. – 2003- № 9.
4. Immune responses in COVID-19 and potential vaccines: Lessons learned from SARS and MERS epidemic/ E. Prompetchara, Ch. Ketloy, T. Palaga// Asian Pacific Journal of Allergy and Immunology. - 2020.
Читайте также:
- КТ при абсцессе жевательного пространства
- Концентрация аденозина при алкоголизме. Алкогольный стаж и чувствительность к алкоголю
- Генерализованное тревожное расстройство - синонимы, диагностика, лечение
- Нервы полости носа и околоносовых пазух (иннервация)
- Нефрогенный несахарный диабет. Регуляция осмолярности внеклеточной жидкости
