Промоторы опухолевого роста.
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Генотоксические канцерогены. Негенотоксические канцерогены. Цитохром Р-450 в коже.
Как видно из изложенного выше, существуют два типа канцерогенов: канцерогены-инициаторы и канцерогены-промоторы. Это разделение соответствует классификации канцерогенов на генотоксические и эпигенетические.
Генотоксические канцерогены, включая ПАУ, которые имеют наибольшее значение для канцерогенеза кожи, подвергаются метаболической активации с образованием конечных алкилирующих метаболитов, являющихся короткоживушими, весьма реактивными соединениями, вызывающими саркомы на месте введения. Так называемые канцерогены прямого действия (например, бета-пропиолактон) образуют алкилирующие метаболиты в результате спонтанного распада в воде. В результате взаимодействия алкилирующих метаболитов с ДНК происходит образование аддуктов, из них наиболее изучены iV-7-метилгуанин и 0-6-метилгуанин (МГ). Первый из них образуется чаще, но сравнительно быстро удаляется из ДНКпри репарации. Что касается 0-6-МГ, то эффективность индукции опухолей в определенных органах коррелирует с высоким содержанием или персистенцией именно этого аддукта.
Негенотоксические канцерогены называют также канцерогенами промоторного типа. Для них характерны следующие особенности; 1) неэффективность однократного воздействия и неспособность служить инициаторами двухстадийного канцерогенеза; 2) необходимость больших доз и длительного беспрерывного воздействия; 3) остановка канцерогенеза при прекращении воздействия.
Предполагаемые механизмы канцерогенного действия негенотоксических канцерогенов: а) промоция спонтанной инициации; б) цитогоксичность со стойкой клеточной пролиферацией; в) оксидативный стресс; г) образование комплекса канцероген-рецептор; д) торможение апоптоза; е) нарушение межклеточных щелевых контактов.
Цитохром Р-450 в коже
Как говорилось выше, большая часть действующих на кожу канцерогенов окружающей среды (в том числе ПАУ) является в действительности про- или преканцерогенами и нуждаются в метаболической активации. Последняя осуществляется при помощи ферментной системы монооксигеназ, главными представителями которой являются изоферменты цптохрома Р-450. Основным органом, где локализуются эти изоферменты, является печень, но цитохром Р-450 обнаруживается и в других органах. Он найден и в коже различных млекопитающих, включая человека. Максимальная концентрация его имеется в высокодифференцированных клетках шиповатого слоя, минимальная — в базальном слое.
Клетки-мишени эпидермиса содержат энзимы, способные метаболизировать и детоксифицировать ПАУ и другие канцерогены. Энзимами, катализирующими первую (оксидатив-ную. или окислительную) фазу являются монооксигеназы (цитохром Р-450), пероксидазы (циклооксигеназы) и гидролазы (эпоксидгидролазы). Система эпидермальныхгидроксилаз (aryl hydrocarbon hydroxylase — АНН) в коже мышей отличается высокой активностью и индуцибельностью различными ПАУ. Наивысшая активность ее в норме обнаружена в эпидермисе и — в меньшей степени — в верхних слоях дермы.
Глкюкуронилтрансферазы, сульфотрансферазы, глютатион-5-трансферазы катализируют вторую фазу (конъюгации) взаимодействия канцерогена с эпидермисом. Метаболизм канцерогенов связан также с действием энзимов, участвующих в биосинтезе простагландинов и метаболизме арахидоновой кислоты.
Таким образом, метаболизм канцерогенов в эпителиоцитах кожи мыщи и человека имеет сходство и различия. Сходство выражается в способности гех и других образовывать мутагенные метаболиты. Различия заключаются, во-первых, в большей индивидуальной вариабельности реакций эпителиоцитов человека, во-вторых, в глюкуронизации реакции конъюгации у мыщей, не имеющей значения у эпителиоцитов человека.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Промоторы опухолевого роста.
В течение определенного времени считалось, что ТФА (12-0-тетрадеканоилфорбол-13-аце-тат) не нуждается в метаболической активации для реализации своего промоторного эффекта в мышиной коже. В действительности ТФА метаболизируется с образованием моноэфиров и спирта — форбола. Механизмы этого метаболизма остаются неясными. Было показано, что тканевая эстераза способна быстро метаболизировать ТФА.
Но этот фермент присутствует в коже хомячков, которые резистентны к двухстадийному канцерогенезу, и практически отсутствует в коже мышей, высоко чувствительных к нему.
Известны значительные видовые и линейные различия в чувствительности к двухстадийному канцерогенезу. Крысы и хомячки практически резистентны к нему, и длительное нанесение ТФА на их кожу не вызывает развития стойкой гиперплазии. Среди мыщей имеются большие различия в степени гиперплазии, вызываемой ТФА, и чувствительности к двухстадийному канцерогенезу. Линия мыщей SENCAR считается наиболее чувствительной: степень гиперплазии и чувствительность к инициации — промоции (количество папиллом на мышь) при сравнении с другими линиями оценивались как 5+, а у мыщей менее чувствительной линии C57BL/6 — 1+ и +/— соответственно. Предполагали, что различия чувствительности мыщей к промоторному действию ТФА объясняются генетическими особенностями его метаболизма. Сравнение метаболитов ТФАдвухлиний мыщей, отличающихся по степени указанных выше показателей, не обнаружило заметных различий. Основным метаболитом ТФА у обеих линий был форбол-13-ацетат или форбол-12-тетрадеканоат. Таким образом, линейные различия в двухстадий-ном канцерогенезе не могут быть объяснены генетическими различиями в метаболизме ТФА.
ТФА является чуть ли не единственным широко используемым в лабораториях промотором, хотя обнаружено более 20 новых промоторов, по структуре отличающихся от ТФА. Они разделены на 2 группы в зависимости от их способностии связываться с форболовыми рецепторами в коже мышей: 1) промоторытипа ТФА и 2) промоторы других типов (нефорболовые промоторы).
Промоторы форболового типа, действующие через форболовые рецепторы, практически идентичны протеинкиназе С. Ее активация вызывает фосфорилирование некоторых пептидов, которые служат сигналами для клеток и в конечном счете вызывают образование опухолей. Промоторы этого типа положительны в тесте на раздражение уха мышей, индуцируют орнитиндекарбоксилазу (ОДК), вызывают клеточную адгезию (HL-60), индуцируют в коже мышей активность гистидиндекарбоксилазы (ГДК) и продукцию простагландина Е2.
К этому типу промоторов относят два основных класса соединений — телеоцидины и аплизиатоксины. Телеоцидины, выделенные из Streptomyces mediocidicus и относящиеся к ин-дольным алкалоидам, представлены несколькими изомерами с разным молекулярным весом и обладают промоторной активностью в 2-3 раза меньшей, чем ТФА (А папилломы на мышь у телеоцидина по сравнению с 11 у ТФА). Аплизиатоксины были найдены в сине-зеленых водорослях в морской воде, вызвавшей зуд у нескольких сот купальщиков в 1968 г. на Окинаве и в 1980 г. на Гавайских островах. По своей промоторной активности они несколько слабее, чем наиболее потентные телеоцидины — дигидротелеоцидин В и телеоцидин.
Промоторы нефорболового типа — представлены 5 соединениями: палитоксином, гапсигаргином, окадаиковой кислотой, динофизиотоксином-1 и стауроспорином. Ихпромотор-ная активностьь слабее, чем у форболовых промоторов, но все они вызывают раздражение кожи мышей и стимулируют продукцию простагландина Е2. Окадаиковая кислота обладает сильной промоторной активностью; подозревают, что она имеет специфический рецептор, т.е. иной механизм действия, чем у других промоторов. Она вызывает и другие эффекты промоторов (индукцию ОДК и ГДК, но не клеточную адгезию), палитоксин не вызывает этих эффектов. Два соединения этой группы стимулируют образование радикалов.
Таким образом, оба типа промоторов обладают общими свойствами (помимо чисто промоторной активности): дают положительный тест на раздражение уха мыши, вызывают продукцию простагландина Е2, стимуляцию метаболизма арахидоновой кислоты.
1. Определение опухоли
Опухоль, новообразование, бластома (от греч. blasto — росток) — пат. процесс, характеризуемый безудержным размножением клеток, при этом нарушения роста и дифференцировки клеток обусловлены изменениями их генетического аппарата.
Основные свойства:
автономный, или бесконтрольный, рост.
атипизм клетки (структуры, обмена, функции, антигенной структуры, размножения и дифференцировки): Анаплазия — дедифференцировка клеток, приобретение ими эмбриональных свойств. Но! Вместе с тем опухолевые клетки имеют достаточно высокую ультраструктурную организацию и тенденцию к специфической дифференцировке. «Катаплазия» приобретение опухолевой клеткой особых свойств.
Опухоль возникает в любой ткани, любом органе.
2. Молекулярно-генетические механизмы канцерогенеза. Роль протоонкогенов, генов-супрессоров опухолевого роста, генов, регулирующих апоптоз, и генов-репараторов.
Молекулярные механизмы канцерогенеза.
Мишени канцерогенных агентов:
протоонкогены, регуляторы пролиферации и дифференцировки клеток;
гены - супрессоры опухолей (антионкогены), ингибирующие пролиферацию клеток
гены, участвующие в апоптозе клеток;
гены, отвечающие за репарацию ДНК;
Канцерогенез — длительный процесс накопления генетических повреждений.
I этап— инициация (трансформация) — приобретение исходно норм. клеткой способности беспредельно размножаться: является результатом стойких изменений в геноме клетки, т. е. мутации одного из генов, регулирующих клеточное размножение.
Инициирующие факторы: канцерогены, вызывающие повреждения ДНК.
На сегодня установлено, что в ДНК норм.клеток имеется участок гомологичный по нуклеотидному составу онкогену вирусов. В норм. клетках клеточный аналог вирусного онкогена неактивен и назван протоонкогеном. В опухолевых клетках он активен и называется клеточным онкогеном.
Механизмы активации протоонкогенов:
1) Включение (вставка) промотора. Промотор — это участок ДНК, с которым связывается РНК-полимераза, инициируя транскрипцию онкогена. Проявлению активирующего действия промотора способствует его расположение рядом с протоонкогеном (в непосредственной близости). В роли промоторов для протоонкогенов могут выступать ДНК-копии определенных участков онкорнавирусов, а также транспозоны («прыгающие гены»),
2) Амплификация, т. е. увеличение числа копий протоонкогенов, которые в норме обладают небольшой активностью. В итоге общая активность протоонкогенов значительно возрастает -> опухолевой трансформации клетки;
3) Транслокация протоонкогенов. Установлено, что перемещение протоонкогена в локус с функционирующим промотором превращает его в клеточный онкоген;
4) Мутации протоонкогенов. Введение в геном клетки хотя бы одной копии клеточного онкогена (мутация) сопровождается активацией протоонкогенов.
Вслед за превращением протоонкогенов в активные клеточные онкогены начинается экспрессия активных клеточных онкогенов. Она проявляется в увеличении синтеза онкобелков или в синтезе структурно измененных онкобелков. Затем начинается превращение (трансформация) нормальной клетки в опухолевую клетку благодаря следующим механизмам. Онкобелки:
соединяются с рецепторами факторов роста и образуют комплексы, постоянно генерирующие сигналы к делению клеток;
повышают чувствительность рецепторов к факторам роста или понижают чувствительность к ингибиторам роста;
сами могут действовать как факторы роста.
II этап – промоция, или активация пролиферации опухолевых клеток.
1. ─ Дополнительное воздействие факторов, усиливающих клеточную пролиферацию (промоторные факторы) -> амплификация онкогенов -> включение митогенных сигналов и митотического деления клеток.
─ Активация все новых протоонкогенов и реализация эффектов клеточных онкогенов.
2. Опухолевые клетки, находившиеся в латентном состоянии, начинают интенсивно размножаться -> бессмертный опухолевый моноклон.
Суть: стимуляция клеточного деления -> создание критической массы инициированных клеток, что обуславливает их высвобождение из-под тканевого контроля и формирование опухолевой популяции.
Факторы промоции – химические вещества (форболэстер, эстрогены и др.), которые сами не вызывают повреждения и не являются канцерогенами, но их постоянное воздействие на инициированные клетки приводит к пролиферации последних. В качестве промоторных факторов функционируют половые гормоны. Например, гиперэстрогенизация женского организма способствует формированию рака молочной железы из «дремлющих» опухолевых клеток.
III этап – прогрессия – стойкое качественное изменение свойств опухоли.
В основе: деление моноклона на субклоны из-за мутационной изменчивости опухолевых клеток в направлении все большей агрессивности и злокачественности: приобретения способности к деструктивному росту, инвазивности, образованию метастазов и приспособляемости к меняющимся условиям существования.
Прогрессия опухоли касается и первичных, и вторичных признаков. Первичным признаком опухоли является нерегулируемый рост, а остальные свойства – скорость роста, инвазивность опухоли, метастазирование, системное действие на организм опухоленосителя, структурно-функциональный атипизм – вторичные, которые возникают и изменяются в ходе прогрессии.
Способствует снижению антибластомной резистентности и противоопухолевого иммунитета: иммунодепрессия, ослабление «кейлонного надзора» за опухолью, эндокринный дисбаланс, гормонально-метаболические нарушения и др.
Роль генов-протекторов, или генов-супрессоров (антионкогенов)
Контролирующих синтез ингибиторов роста, подавляющих активность онкогена и соответственно размножение клеток и стимулирующих их дифференцировку.
Мутация или делеция антионкогена обусловливает опухолевую трансформацию клетки и развитие опухоли. Наследуемость дефекта гена-супрессора по аутосомнодоминантному типу объясняет наследственную предрасположенность к развитию злокачественных новообразований.
Инактивация антионкогенов, вызванная их мутациями, приводит к неконтролируемому росту.
Пример антионкогена: В клетках опухоли отсутствовал или в результате мутации был функционально неактивен ген Rb-1. Кодируемый этим геном белок (р 110) прерывает клеточный цикл опухолевых клеток, связывает вирусные промоторы роста и останавливает митотическое деление, предотвращая опухолевую трансформацию клеток сетчатки глаза. Выделенный ген был перенесен в безудержно размножающиеся клетки культуры ретинобластомы, после чего опухолевые клетки стали вырабатывать белок р 110, блокирующий действие онкогена. В результате, опухолевые клетки превращались в нормальные, старели и погибали.
Роль генов, регулирующих апоптоз
Пример: Мутация антионкогена р53 блокирует апоптоз и приводит к накоплению неограниченно делящихся клеток с различными генетическими повреждениями, что характерно для клеток опухолей. В опухолях с инактированнным р53 индуцированные повреждения ДНК не приводят к апоптозу, и такие опухоли резистентны к химио- и лучевой терапии.
Таким образом, опухолевый рост – результат дисбаланса между процессами пролиферации клеток и апоптоза. Снижение способности к апоптозу осуществляется с помощью следующих механизмов:
гиперэкспрессии онкогена bcl (ингибитора апоптоза)
мутации (делеции) гена-супрессора р53 (индуктора апоптоза),
нарушений эффекторных механизмов и путей передачи проапоптотических сигналов (например, блокирование рецепторов ретиноевой кислоты – одного из мощных индукторов апоптоза);
уменьшение количества Fas-рецепторов на поверхности клетки или нарушение связывания этих рецепторов со своими лигандами (Fas-L), выделяющимися цитотоксическими Т-лимфоцитами и NK-клетками и являющимися «фактором смерти», индуцирующим апоптоз в клетках мишенях.
Клеточные онкогены — промоторы опухолевого роста
Представление о канцерогенезе в настоящее время связывают с возможностью канцерогенных агентов вызывать повреждения генома клеток, вызывающие активацию клеточных онкогенов и/или инактивацию антионкогенов. Связь канцерогенеза с этими генами не случайна, так как именно они участвуют в регуляции клеточного цикла, контролируют пролиферацию и дифференцировку клеток.
В 1976 г. у птиц, а в 1978 г. у млекопитающих был обнаружен участок ДНК, гомологичный вирусным онкогенам. В активном состоянии такие участки называют клеточными онкогенами, в неактивном — протоонкогенами.
Протоонкогены — нормальные гены клеток. В зрелых тканях они, как правило, неактивны. Активация протоонкогенов и превращение их в клеточные онкогены происходят при опухолевом росте, а также в ходе эмбриогенеза. Активация ряда клеточных онкогенов возможна при пролиферации и дифференцировке клеток в очагах репаративной регенерации.
Клеточные онкогены кодируют синтез белков, называемых онкобелками (онкопротеинами). Многие известные онкопротеины участвуют в передаче сигналов от клеточной мембраны к определённым генам клеток. Это значит, что большинство факторов роста и других цитокинов в той или иной степени могут взаимодействовать с онкобелками.
По функциональной активности и структурному сходству с элементами сигнальной митогенетической цепочки все онкобелки (рис. 7-2) делят на онкобелки — гомологи факторов роста (c-sis, int-r, k-fgt и др.), онкобелки — гомологи рецепторов к факторам роста (c-erb B, c-erb A и др.), онкобелки, связанные с работой рецепторов, аналоги G-белка (c-ras), протеинкиназные белки (c-src, c-fps, c-fes, c-abl, c-met), онкобелки, передающие ростовые сигналы на ДНК (c-fos, c-jun, c-myc и др.).
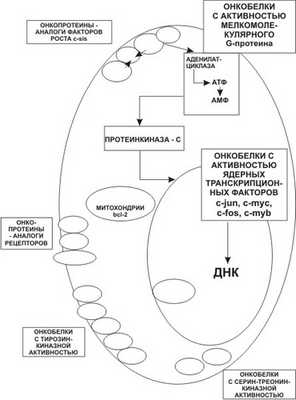
Рис. 7-2. Распределение онкопротеинов в клетке.
Для того чтобы стимулировать пролиферацию клеток, необходимо превращение протоонкогенов в клеточные онкогены. Основные механизмы активации протоонкогенов:
инсерционная активация — активация под действием встроенных в геном генов (вирусных);
активация при транслокации участка хромосомы с встроенным в него протоонкогеном;
активация путём амплификации (умножения копий) протоонкогена;
активация при точечных мутациях протоонкогенов (рис. 7-3).
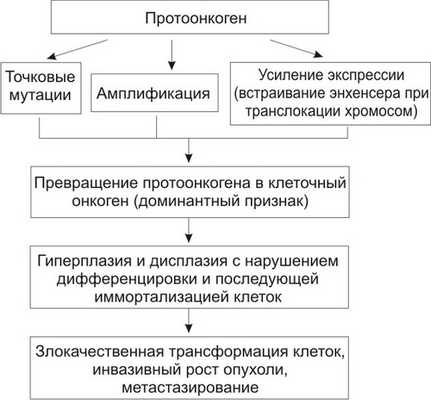
Рис. 7-3. Механизмы активации протоонкогенов.
Инсерционная активация происходит при участии РНК-, реже ДНК-вирусов. Они могут встраиваться в геном клетки и своими генами модулировать активность близлежащих клеточных генов, в том числе, протоонкогенов. Ретровирусы могут быть носителями вирусного онкогена или играть роль активаторов онкогенов (эннсеров).
Транслокация участков хромосом в клетках может приводить к контакту протоонкогенов с сильными эннсерами, например, при лимфоме Беркитта и хроническом миелолейкозе.
● Лимфома Беркитта. Наблюдают реципрокную транслокацию участков хромосом 8 и 14. В результате происходит транслокация участка хромосомы 8q24, содержащего c-myc, на участок хромосомы 14-14q32, в зону действия гена тяжёлых цепей иммуноглобулина. В 10% случаев возможен другой вариант реципрокной транслокации с встраиванием участка 8q24, несущего c-myc, в хромосому 2, вблизи генов лёгких цепей иммуноглобулина. Активные гены иммуноглобулина выступают в роли эннсеров по отношению к клеточному онкогену c-myc.
● Хронический миелоидный лейкоз человека. Характерен специфический генетический дефект — филадельфийская хромосома (результат реципрокной транслокации между хромосомами 9 и 22). Участок хромосомы 9, несущий протоонкоген с-abl, оказывается на фрагменте хромосомы 22. Там формируется новый ген-гибрид c-abl-bcr, его белок обладает тирозиназной активностью.
Амплификация клеточного онкогена проявляется в увеличении числа его копий и может захватывать как отдельные гены, так и целые участки хромосом. При этом возможно появление добавочных мелких хромосом. Амплификация описана для c-myc и с-ras при раке лёгкого, мочевого пузыря, толстой кишки, поджелудочной железы. Амплификация N-myc найдена при нейробластоме в 38% случаев и коррелирует с плохим прогнозом для пациентов. Амплификация c-neu, чей онкобелок гомологичен рецепторам к фактору роста эпидермиса, — неблагоприятный прогностический критерий при раке молочных желёз. Накопление в клетках карциномы онкопротеина c-neu приводит к усиленному связыванию факторов роста, синтезируемых самими опухолевыми клетками (ТФР-α), что стимулирует рост опухоли по аутокринному механизму.
Активация транскрипции клеточных протоонкогенов
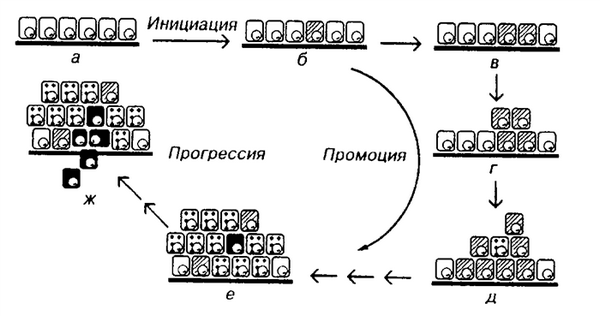
а - нормальные эпителиальные клетки ; б - появление (инициация) одной клетки; в, г, д - развитие (промоция) атипической пролиферации; е - приобретение злокачественных свойств (Ca in situ); ж - прорыв (инвазия) базальной мембраны, способность к прогрессии и метастазированию. (По В.Г. Черенкову, 1999)
Канцерогенез – стадийный многоступенчатый процесс, основу которого составляют нелетальные повреждения генома клеток (мутации), накопление этих мутаций и их проявления на уровне приобретения какого-либо фенотипа. У злокачественных опухолей этот фенотип включает в себя: избыточный рост, инвазию, способность к метастазированию.
Генетическая концепция канцерогенеза подразумевает, что популяция опухолевых клеток – результат размножения, идущего от одной клетки – родоначальницы клона, претерпевающего опухолевую трансформацию.
Основными мишенями генетического воздействия при опухолевой трансформации являются 3 класса регуляторных генов: протоонкогены, антионкогены и гены, контролирующие апоптоз. Мутантные аллели протонкогенов расцениваются как доминантные: они трансформируют клетки, несмотря на наличие их нормальных копий. В противоположность этому мутантные аллели генов-онкосупрессоров являются рецессивными и проявляются только в гомозиготном состоянии. Гены, контролирующие апоптоз, могут выступать и как анти-онкогены и как протоонкогены.
Выделяют 3 стадии канцерогенеза: инициацию, промоцию и прогрессию.
Инициация – начальная опухолевая трансформация генома клеток под действием канцерогена. Стойкое, необратимое изменение ДНК (мутация), которое имеет генетическую память. Инициация – начало канцерогенеза даже при однократном воздействии инициатора. Инициированная клетка становится потенциально способной к неограниченному делению, но требует для проявления этой способности ряда дополнительных условий для продвижения и поддержания опухолевого процесса. Эти условия обеспечиваются в стадию промоции. Инициирующими факторами являются различные канцерогены, вызывающие повреждение ДНК.
Переход из стадии инициации в стадию промоции происходит в результате воздействия экзо- и эндогенных факторов, которые могут как способствовать, так и препятствовать этому процессу.
Канцерогенез. Промоция
Промоция – стадия реализация опухолевого фенотипа обусловлена влиянием различных факторов – промоторов, не обладающих способностью вызывать повреждения ДНК, не являющихся канцерогенами. Действие промоторов на инициированные клетки стимулирует их деление, обеспечивая наработку «критической массы» опухолевых клеток, повышающей их устойчивость и автономность роста. Ряд промоторов - форболовые эфиры (TPA) и их производные - агонисты протеинкиназы С (ПКС). При участии РКС осуществляется мобилизация многих внутриклеточных систем, позволяющих клетке избежать апоптоз и гибель от апоптоза и различных неблагоприятных воздействий.
В отличие от инициаторов действие промоторов не затрагивает ДНК и поэтому обратимо. Для них существует пороговый уровень действия, поэтому субпороговые или раздельные дозы с большими паузами между ними не дают завершающего канцерогенного эффекта.
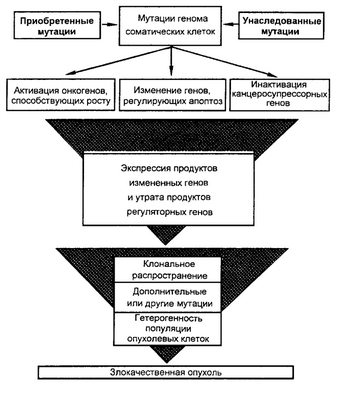
Патогенез злокачественных новообразований (М.А. Пальцев, Н.М. Аничков, 2001)
Канцерогенез с раздельным участием инициаторов и промоторов реализуется при действии неполных канцерогенов, канцерогенов в низких дозах (ДМБА) или некоторых онкогенных вирусов (Эпштейн-Барра).
Полные канцерогены (нитрозамины), ионизирующее излучение сами обладают как нициирующим, так и промоцирующим действием.
Читайте также:
- Отравление препаратами висмута (Pepto-Bismol) и его побочные эффекты
- Показания для резекции поджелудочной железы с панкреатоеюностомией по Фрею
- Особенности периодонта. Степени деформации периодонта
- Примеры эпителиомы (аденомы) пигментного эпителия сетчатки из поствоспалительного рубца
- Латерализация внутренней сонной артерии (лат-ВСА) - лучевая диагностика
