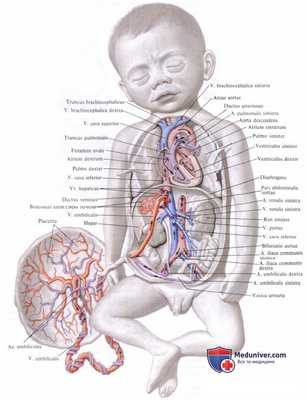
Пупочные вены эмбриона. Первичные лимфатические мешки плода
Добавил пользователь Валентин П. Обновлено: 21.01.2026
Пупочные вены эмбриона. Первичные лимфатические мешки плода
С момента своего образования пупочные (аллантоидные) вены включены в латеральные стенки тела по всей длине, начиная от брюшного стебелька и кончая венозным синусом. С увеличением своего объема печень срастается с латеральной стенкой тела. В месте этого срастания развиваются сосуды, связывающие пупочные вены со сплетением сосудов в печени. После образования этих сосудов кровь из пупочных вен все более и более стремится проходить по ним в печень, а старые сосуды, ведущие в венозный синус, постепенно дегенерируют.
Правая пупочная вена перестает проводить кровь в печень, и вся плацентарная кровь проходит по левой пупочной вене.
Интересно отметить, что, несмотря на то, что правая пупочная вена перестает играть роль сквозного сосуда, часть ее сохраняется и отводит кровь из стенки тела. Движение крови здесь приобретает обратное направление, и в результате кровь поступает в левую пупочную вену.
Покидая печень, венозный проток соединяется с печеночными венами (корни желточно-брыжеечных вен), которые отводят кровь из сети синусоидов печени. В этом же месте с печеночными венами и венозным протоком соединяется и полая вена. Таким образом, кровь, идущая из нижних системных вен, из воротной вены и из плаценты, вступает в сердце вместе. Эмбриологически этот большой сосудистый ствол представляет собой сросшиеся проксимальные части прежних желточно-брыжеечных вен, расширившихся под действием плацентарной крови, поступающей из венозного протока, и крови, идущей из полой вены.
У взрослого человека он рассматривается как часть полой вены, так как с прекращением плацентарного кровообращения при рождении здесь проходит главным образом кровь из полой вены.
Первичные лимфатические мешки плода
Первые признаки формирования лимфатической системы у эмбриона появляются на шестой неделе развития. У эмбрионов длиной примерно 10 мм обычно можно различить парные (правый и левый) яремные лимфатические мешки. Эти мешки образуются из небольших выстланных эндотелием сосудов, которые вначале являлись частью первичного сосудистого сплетения на шейных уровнях развивающихся передних и кардинальных вен. Некоторые из этих мелких сосудов теряют связь с главной веной и временно превращаются в слепые мешки, лежащие рядом с венами. В это время они, по-видимому, содержат кровяные тельца, которые вновь выходят в ток крови, когда эти первичные лимфатические мешки вторично оказываются связанными с венозной системой.
Хотя период восстановления связи с венозной системой очень варьирует, яремные лимфатические мешки обычно открываются в передние кардинальные вены к концу шестой или в начале седьмой недели (эмбрионы длиной 12—14 мм).
В течение седьмой недели яремные лимфатические мешки значительно увеличиваются путем расширения самих первоначальных мешков, а также в результате их слияния с соседними эндотелиальными синусами. Несколько позднее появляются другие лимфатические мешки в подмышечных и паховых областях, расположенные вдоль дорзальной стенки тела (в связи с непарной веной и развивающейся нижней полой веной) и около основания брыжеек. Наиболее развитые из этих мешков удобнее всего называть, исходя из их будущего положения.
Так, в подмышечной области находится подключичный лимфатический мешок. Цепь мелких мешков, расположенных вдоль дорзальной стенки тела, составляет зачаток главного продольного лимфатического сосуда, называемого грудным протоком (ductus thoracicus). Забрюшинно в поясничной области находится большой срединный мешок, из которого образуется цистерна (cisterna chyli).
В тесной связи с цистерной, но вентральнее ее, развивается забрюшинный лимфатический мешок. Из этого мешка в брыжейки растут лимфатические канальцы. С развитием этих сосудов они обеспечивают отток лимфы из желудочно-кишечного тракта, за исключением области прямой кишки. В связи с забрюшинным мешком образуется также сплетение сосудов, отводящих лимфу из почечных и генитальных областей.
Дорзальнее забрюшинного мешка в виде каудального продолжения cisternae chyli образуются парные подвздошные мешки. У этих первичных мешков имеются подвздошно-поясничные (илио-люмбарные) расширения на уровне почек и подвздошно-паховые (илио-ингвинальные) расширения примерно на уровне бифуркации аорты. Сплетения лимфатических сосудов, образующихся в дорзальной стенке тела между почками, составляют ретроренальную лимфатическую систему взрослого человека. Подвздошно-паховые мешки распространяются по ходу подвздошных сосудов в конечности.
От подвздошно-паховых мешков отходят также медиальные отростки, которые отводят лимфу от прямой кишки и промежности. Кроме того, здесь имеются сосуды, которые образуют анастомозы с забрюшинными сосудами, расположенными в области почек и внутренних половых органов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Вены верхней конечности эмбриона. Развитие нижней полой вены плода
Вены верхней конечности вначале представляют собой лишь часть общего поверхностного венозного сплетения шеи и грудной клетки, кровь из которых отводится по кардинальным венам. На свободном крае развивающейся почки конечности вскоре появляется краевая вена, преаксиальная и постаксиальная части которой называются соответственно v. cephalica и v. basilica.
Отведение крови из верхней конечности и грудной клетки позднее осуществляется подключичной веной — постепенно увеличивающимся сосудом, связывающим v. basilica с передней кардинальной веной. В развивающуюся подключичную вену впадает самая большая вена грудной клетки — v. thoraco-epigastrica, которая у взрослого человека сохраняется в качестве v. thoracalis lateralis.
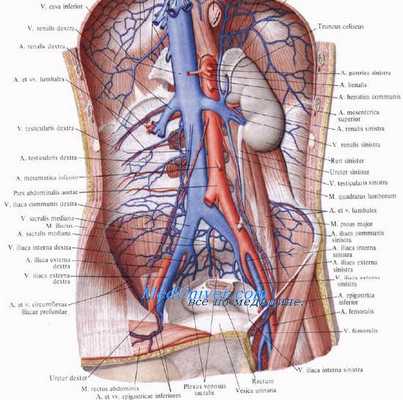
Система нижней полой вены. Системные вены в нижней части тела изменяются значительно более радикально, чем в верхней. Одновременно с мезонефросами дегенерируют и задние кардинальные вены. Нижняя полая вена, которая заменяет кардинальные вены, — это сложный сосуд, постепенно формирующийся в результате расширения и удлинения вначале небольших местных сосудов в связи с дегенерацией задних кардинальных вен.
Появление субкардинальных вен приводит к отклонению посткардинального кровотока. Образуются они вдоль вентромедиальных поверхностей мезонефросов и проходят параллельно посткардинальным венам немного вентральнее их. В районе средних частей мезонефросов они сообщаются друг с другом при помощи мелких сосудов, которые вскоре срастаются, образуя интерсубкардинальный анастомоз.
С увеличением своих размеров этот анастомоз вместе с объединенными таким образом субкардинальными венами образует большой медиальный венозный синус, называемый субкардинальным синусом. После образования этого синуса мелкие сосуды, связывающие суб- и посткардинальные вены, направляются большей частью в медиальном направлении в задние кардинальные вены.
Головной конец мезонефроса расположен рядом с печенью. Складка ткани задней стенки тела, расположенная справа от первичной дорзальной брыжейки, рано создает своего рода мостик между этими двумя органами. Эта складка называется plica cavae брыжейки. В ней, как и в любом месте растущего тела, проходит большое количество мелких сосудов.
В печени этот новый путь крови вначале проходит по извилистым мелким сосудам, вступая в конце концов в венозный синус (sinus venosus) вместе с кровью из желточно-брыжеечных вен. С увеличением объема проходящей по этому пути крови в печени постепенно образуется большой сосуд. Этот новый сосуд постепенно смещается к поверхности и в конце концов превращается в большую вену, расположенную в углублении на дорзальной стороне печени.
Эта вена составляет печеночную часть нижней полой вены. Из субкардинального синуса наиболее прямой путь к этому новому сосуду проходит через правую субкардинальную вену. Таким образом, уже у шестинедельных эмбрионов образование нижней полой вены начинается формированием ее предпочечной части, состоящей ис субкардинального синуса, части правой субкардинальной вены и новых сосудов, проходящих через брыжейку и через печень.
Притоки нижней полой вены эмбриона. Легочные вены и воротная вена плода
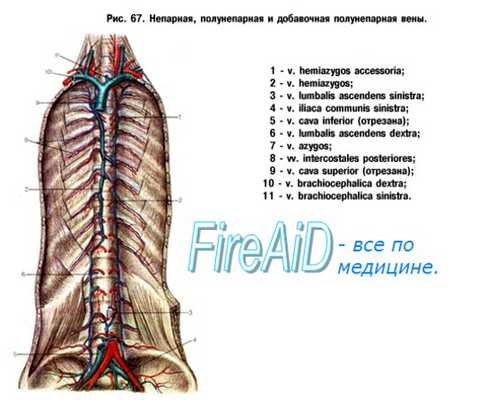
Ниже уровня субкардинального синуса, который находится на будущем уровне почек, в формирование нижней полой вены включаются другие группы вен. Эти вены называются супракардинальными. Появляются они позднее, чем субкардинальные вены, в виде парных сосудов, отводящих кровь от дорзальной стенки тела. На уровне средней части мезонефроса супракардинальные вены соединяются с субкардинальным синусом точно так же, как это произошло с посткардинальными венами на более ранних этапах развития.
Краниальнее синуса части супракардинальных вен сохраняются в виде группы непарных вен (vv. azygos), кровь из которых отводится в редуцированную проксимальную часть правой посткардинальной вены. Каудальнее анастомоза с субкардинальным синусом супракардинальные вены становятся главным путем, по которому кровь отводится из вен таза и ног. С образованием анастомоза, связывающего правую и левую подвздошные вены (vv. iliacae), кровь все в большем объеме проходит по правой супракарпинальной вене, которая постепенно расширяется и составляет постренальную часть нижней полой вены.
Прохождение части полой вены, расположенной у взрослого человека каудальнее уровня почек, в более дорзальной по отношению к аорте положении ясно указывает на ее образование из лежащей ближе к дорзальной стороне тела правой супракардинальной вены, а не из расположенной ближе к вентральной стороне правой посткардинальной вены, как думали раньше. Направление левой вены надпочечника и левой гонадной вены отражает их образование из частей левой субкардинальной вены.
Окончательная судьба левой общей кардинальной вены (проток Кювье) зависит от такого изменения в направлении системных вен, в результате которого все они впадают в правую половину сердца.
В то время как прежде левая общая кардинальная вена переносила в сердце половину всей крови, проходящей по системным венам, теперь она утрачивает почти все впадающие в нее сосуды. Тем не менее проксимальная часть левого кардинального сосуда продолжает функционировать.
Загнутый вокруг сердца при движении венозного синуса вправо левый проток Кювье располагается в атриовентрикулярной бороздке рядом с дорзальной стенкой тела. В процессе роста сердечная мышца нуждается в усиленном кровоснабжении, обеспечивающем ее метаболизм. Мелкие вены, отводящие кровь из мышцы сердца, находят себе путь в этот удобно расположенный большой сосуд. Таким образом, даже тогда, когда периферическая часть левого протока Кювье запустевает, его проксимальная часть сохраняется в виде коронарного синуса, в который впадают вены стенки сердца.
Филогенетически легкие — это относительно молодые структуры. Поэтому не удивительно, что легочные вены образуются не путем превращения старых сосудов, а совершенно самостоятельно, в качестве сосудов, которые отводят кровь из различных веточек, проходящих в легочных почках, и собираются в общий ствол, впадающий в левое предсердие сзади. При росте сердца этот сосуд постепенно включается в стенку предсердия до тех пор, пока четыре его первоначальных ветви не будут впадать непосредственно в левое предсердие в виде главных легочных вен взрослого человека.
В случае неполного включения первичной общей лагочной вены легочные вены, идущие из правого и левого легких, впадают в левое предсердие вместе, а не как обычно — в виде парных сосудов.
Первичное кровоснабжение желудочно-кишечного тракта осуществляется серией вентральных сегментарных артерий, которые разветвляются в стенках первичной кишки и желточного мешка и в конце концов превращаются в чревную, верхнюю и нижнюю брыжеечные артерии. Отток венозной крови из первичной кишки происходит вначале через желточные вены желточного мешка, которые объединяются в главные парные желточно-брыжеечные вены (vv. omphalomesentericae) и впадают сзади в венозный синус. При достижении сердца эти вены проходят вдоль краев переднего кишечного входа и, таким образом, прилегают к развивающейся печени.
Растущие тяжи печеночной ткани разделяют проксимальную часть желточно-брыжеечных вен на сеть мелких сосудов, разветвляющихся в ткани печени. Однако корни этих вен сохраняются и отводят кровь из этого сплетения. Дистальнее печени первоначальные вены также на некоторое время сохраняются и несут кровь из желточного мешка и кишечника к печени. С исчезновением желточного мешка и ростом кишечника желточная часть этих вен исчезает, но брыжеечные ветви остаются и становятся более развитыми в соответствии с увеличением длины и сложности кишечного тракта. Первоначальные желточно-брыжеечные стволы, в которые собираются эти вены, превращаются в непарную воротную вену в результате образования поперечных анастомозов и последующего запустевания одного из сосудов.
Отношения воротной вены и кишечника, которые наблюдаются у взрослого, связаны с исчезновением первоначального левого сосуда краниальнее среднего анастомоза и первоначального правого сосуда каудальнее его.
Лимфатическое русло (ЛР) служит дополнительным к венам дренажем большинства органов, образуется путем выключения из кровотока коллатеральной части эмбрионального венозного русла. Закладка ЛР начинается с его экстраорганной части: в первичные вены с эндотелиальными стенками при их расширении в плотном окружении интенсивно растущих органов инвагинируют артерии с наружной оболочкой и разделяют периферическую часть вен на боковые карманы. Расширение вен приводит к сужению и перерыву сообщен ий центральных каналов вен с их боковыми карманами, отделению лимфатических щелей с эндо-телиальной выстилкой. Карманы принимают притоки, они выходят из разных органов. Часть притоков под давлением артерий неравномерно расширяется и фрагментируется на дополнительные лимфатические щели. Щели сливаются в лимфатические мешки и стволы, их притоки выходят из стенок органов. Падение давления в закладке ЛР приводит к полному разделению лимфатических и кровеносных капилляров. Лимфатические капилляры с более тонкой стенкой отводят тканевую жидкость и крупнодисперсные частицы, не попавшие в кровеносное русло. Плацента устроена как жабры и сосудистая система раков: хориальные ворсинки погружены в лакуны эндометрия с материнской кровью, находящиеся между маточными сосудами. Пупочные вены несут из межворсинчатых лакун в тело зародыша кислород и питательные вещества. Плацента организует дренаж зародыша в маточные сосуды через лакуны. Иначе говоря, в ЛР плаценты нет необходимости. Учитывая механику закладки ЛР, она «противопоказана» плаценте, поскольку могла бы послужить причиной гибели или возникновению различных пороков развития зародыша: расчленение пупочных вен привело к бы к застою артериальной крови и нарушению кровоснабжения зародыша, начиная с печени - центра его кроветворения. Врожденная непроходимость тонкой кишки внутреннего типа возникает в результате нарушения целостности слизистой (Politzer G., 1931) и кровоснабжения (Barnard C.N., 1956). В эмбриогенезе эти процессы обусловлены спирализацией кишечной трубки и скручиванием брыжейки, что приводит к деформации брыжеечных вен. В норме критическая ситуация разрешается закладкой ЛР (Петренко В.М., 1987). Цель данного исследования - показать, каким образом предотвращаются деформация пупочных сосудов и закладка ЛР плаценты. Строение пупочного канатика и его сосудов изучено на серийных гистологических срезах зародышей человека 4-9 нед, окрашенных гематоксилином и эозином, смесью Маллори, толуи-диновым и альциановым синими.
Причины этого явления разнообразны. Пупочные артерии, как и артерии в теле зародыша, рано приобретают адвентициальную оболочку, которая препятствует их расчленению. В окружении пупочной вены нет органов и плотных структур, интенсивный рост и давление которых приводил бы к ее деформации и закладке лимфатических мешков. Прилежащие к пупочной вене пупочные артерии не образуют множественных ветвей, которые пересекали бы расширяющуюся вену. По форме пупочный канатик сопоставим с пупочной кишечной петлей. Интенсивный рост в длину ее тонкокишечного (нисходящего) колена в условиях плотного окружения в брюшной полости и узкой полости пупочного канатика сопровождается спи-рализацией тонкой кишки и скручиванием ее истончающейся брыжейки, что приводит к: 1) вытяжению из основания пупочного канатика грыжевого мешка с петлями подвздошной кишки; 2) множественной деформации брыжеечных вен и закладке брыжеечного ЛР. Толстый пупочный канатик эмбриона явно отстает от пупочной кишечной петли по темпам роста в длину и не спи-рализуется. Упругий вартонов студень увеличивает резистентность пупочного канатика и его сосудов к внешнему давлению (физиологической пупочной грыжи) и предохраняет пупочные сосуды от деформации. У плодов пупочный канатик сильно удлиняется и спирализуется, но стенки пупочной вены уже включают наружную и среднюю оболочки.
Заключение. Пупочная вена, потенциальный источник лимфатических щелей и ЛР плаценты, не подвергается значимой деформации и перестройке в эмбриогенезе. Необычный морфогенез сосудистого русла плаценты без образования ЛР представляет собой частный случай в сложном развитии сердечно-сосудистой системы млекопитающих, который однако только подтверждает адекватность строения и функционирования сосудистого русла его топографии, строению и функциям обслуживаемых органов.
Лимфатическая система с момента закладки является частью единой сердечно-сосудистой системы и образуется в эмбриогенезе путем выключения части первичных вен и их притоков с эндотелиальными стенками из кровотока. Неравномерный рост первичного лимфатического русла с эндотелиальными стенками, в т.ч. путем его частичной магистрализации и редукции, лежит в основе морфогенеза вариабельной дефинитивной лимфатической системы у плодов в прямой связи с закладкой лимфатических узлов.
Введение
Проблема механики развития лимфатической системы (ЛСи) интересная и сложная, с большой и неоднозначной историей [3,4]. В последнее время появились спекулятивные публикации о строении и развитии грудного протока (ГП), основанные на работах сотрудников нашей кафедры [5], в т.ч. о морфогенезе дефинитивной ЛСи путем магистрализации лимфатических сплетений. Термин «магистрализация» давно применяется разными авторами при описании развития сосудистого русла, в т.ч. и лимфатического [6].. Суть самого «открытия» также давно описана [2]: «Прежде чем разовьются сосуды, отличающиеся качественной определенностью и специфическими свойствами, в теле зародыша всеми тканевыми закладками завладевает диффузная капиллярная сеть. Приводящие и отводящие сосуды выделяются из первичного сплетения по гемодинамическим законам. Более крупные кровеносные сосуды эмбриона - это действительно преобразованные первичные сосудистые трубки. Наряду с прогрессивным ростом их наблюдается редукция части протокапилляров. Принимая во внимание новоообразование капилляров как факт, все же надо признать, что складывание основных кровеносных путей в теле зародыша происходит на основе первичного капиллярного сплетения». Все начинается с разрушения венозных сплетений, на месте которых возникают первичные лимфатические структуры (мешки, в том числе ретроаортальный - цистерна ГП). Мезенхима внедряется в лимфатические мешки и они превращаются в лимфатические сплетения. Затем из мезенхимы инвагинаций формируются закладки лимфатических узлов (ЛУ) и происходит магистрализация лимфатических сплетений с оформлением дефинитивной ЛСи. «В реалиях сегодняшнего дня, когда концепция запрограммированной клеточной гибели получила всемирное признание. нет смысла обсуждать идею непосредственного превращения вен в лимфатические каналы, а венозных эндотелиоцитов в лимфатические» [7]. С 80-х гг. прошлого столетия В.Э.Шуркус стремится компилировать основные положения венозной и мезенхимной концепций происхождения лимфатических сосудов: полость множества разрушающихся вен становится полостью лимфатических закладок, а их эндотелий образуется позднее из уплощающихся мезенхимных клеток. Но такое просто невозможно: 1) на стадии закладки ЛСи (эмбрионы 6-8 нед) мезенхима уже превратилась в разные ткани; 2) без эндотелия полость вен спалась бы, ее заполнила бы соединительная ткань - настоящая катастрофа! Зачем так «мудрить», грубо нарушая биогенетический закон? (В эволюции лимфатическое русло образуется у рыб путем выключения из кровотока части вен). Очень трудно увидеть и показать на фотографии эндотелий первичных вен и лимфатических путей эмбриона - он имеет очень маленькую толщину и находится в окружении плотной мезенхимы, которая маскирует его. И В.Э.Шуркус «элегантно» вышел из сложного положения: концепция апоптоза (современная преформистская концепция развития) приобщена для прикрытия «третьего пути». Когда не могут объяснить механику развития чего-либо, вспоминают о потусторонних силах либо все сваливают на наследственность. Гипотезы о механике закладки ЛСи (F..Sabin, O..Kampmeier и др.) я подробно разобрал ранее [3,4]. В этой статье я остановлюсь на менее освещенной в литературе проблеме становления дефинитивных вариантов строения ЛСи.
Состояние вопроса
Заключение
Парный ГП образуется у эмбрионов человека 7-8 нед путем выключения из кровотока части первичных вен с эндотелиальными стенками [3,4]. У плодов ГП становится зигзагообразным: сохраняются нижняя часть правого ГП и верхняя часть левого ГП, между ними расширяется анастомоз на индивидуально разных уровнях, что зависит от индивидуальных особенностей органогенеза. ГП плода становится непарным на всем или большем протяжении путем неравномерного роста эмбриональной бимагистральной системы ГП в связи с асимметричным морфогенезом правых и левых ЛУ, в первую очередь поясничных и шейных. ЛУ, «перекачивая» часть периферической лимфы в вены, снимают часть функциональной нагрузки с ГП и других лимфатических коллекторов. В результате они отстают в росте, относительно уменьшаются, исчезают или превращаются в ЛУ и связанные с ними лимфатические сосуды. На примере ГП хорошо видно, что в основе морфогенеза дефинитивной ЛСи, возникновения индивидуальных вариантов ее строения у плодов лежит неравномерный рост первичного лимфатического русла с эндотелиальными стенками, в т.ч. путем его частичной (локальной) магистрализации и редукции, в прямой связи с закладкой ЛУ, которые вытесняют лимфатические мешки.
Читайте также:
- Лечение и профилактика врожденного сифилиса у новорожденного
- Показания для операции при переломе лопатки
- Дифференциальный диагноз дерматопатического лимфаденита. Потница и ее причины
- Суставы, кости при гемофилии - лучевая диагностика
- Глазное яблоко на рентгенограммах. Рентгенография глаза при воспалении
