Санация очагов инфекции при сепсисе и септическом шоке - рекомендации
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Клиническая больница №1
ФГБУ ДПО «Центральная государственная медицинская академия» УД Президента РФ, Москва, Россия
Центральная клиническая больница с поликлиникой Управления делами Президента РФ, Москва
Современные возможности лечения сепсиса на основе сорбционных методик (обзор литературы)
Сепсис и септический шок (СШ) остаются важной проблемой медицины, поскольку являются одной из наиболее частых причин смерти в отделении интенсивной терапии. Согласно данным литературы, внутрибольничная летальность от сепсиса колеблется в пределах 14—41%. Сепсис запускает каскад клеточных и иммунологических реакций, главную роль в которых играют эндотоксин (ЭТ) и провоспалительные цитокины. Массированный выброс ЭТ и провоспалительных цитокинов приводит к тканевому и капиллярному повреждению, вызывая нарушение микроциркуляции, генерализованную вазодилатацию, что в итоге приводит к циркуляторную и тканевую гипоксию и полиорганную недостаточность (ПОН) с высокой летальностью. В настоящее время методом, который может снизить летальность больных с сепсисом/СШ, является сорбция ЭТ. Цель обзора — обобщение результатов применения экстракорпоральной сорбции ЭТ и цитокинов как одного из методов терапии сепсиса/СШ. В обзоре представлены данные зарубежных и отечественных авторов о результатах применения сорбционных методик у больных сепсисом/СШ. Анализ мировой литературы показал, что на сегодняшний день наиболее эффективным и широко используемым в клинической практике является картридж с иммобилизированным полимиксином В. Часть сорбентов находится в стадии клинических исследований и накопления полученных результатов. Перспективным и многообещающим является использование сорбентов, способных элиминировать цитокины, участвующие в развитии ПОН. Таким образом, представленные данные литературы показывают, что в настоящее время сорбция ЭТ и цитокинов является методом, позволяющим улучшить результаты лечения больных сепсисом/СШ.
Повышенное внимание к сепсису и септическому шоку (СШ) со стороны клиницистов и специалистов по лабораторной диагностике обусловлено следующими причинами: увеличением числа случаев, высоким уровнем летальности и сложностями при установлении диагноза.
Согласно данным литературы, в США ежегодно диагностируется 650—750 случаев сепсиса на 100 тыс. населения, СШ развивается в 58% случаев [1]. Число больных сепсисом в Европе варьирует от 79 в Словакии до 295 случаев на 100 тыс. населения в Нидерландах [2—5].
Прогноз при сепсисе зачастую непредсказуем, летальность даже в ведущих клиниках развитых стран достигает 40%, а при СШ — 80—90% [6].
Необходимо констатировать, что внутрибольничная летальность при сепсисе остается на высоком уровне, несмотря на современные возможности медицины. По данным международного многоцентрового исследования Sepsis Occurrence In Acutely ill Patients (SOAP) (представлены результаты 198 европейских медицинских центров), средняя внутрибольничная летальность составила 24,1% (от 14% в Швейцарии до 41% в Португалии) [7]. Результаты другого многоцентрового исследования — Promoting Global Research Excellence in Severe Sepsis (PROGRESS) показали, что внутрибольничная летальность достигает 49,6% [8].
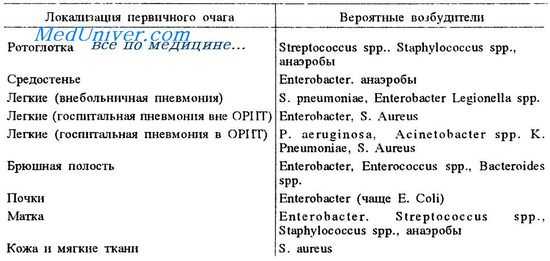
По данным Европейского эпидемиологического проспективного исследования SOAP, первичный очаг при сепсисе в 68% случаев локализуется в легких, в 22% — в брюшной полости [3]. Имеются определенные особенности развития источника первичного очага инфекции в зависимости от региона мира. В частности, в странах Западной Европы и Северной Америке в качестве источника преобладают легкие и брюшная полость. В странах Восточной Европы, включая 8 центров из России, очагами первичной инфекции были легкие и мочевыводящие пути [9].
Представление о патогенезе сепсиса и методах его лечения за последние 30 лет неоднократно менялись. В 2016 г. были приняты новые консенсусные дефиниции сепсиса (Сепсис-3) и СШ, авторами которых являлись эксперты Society of Critical Care Medicine (SCCM) и Europan Society Intensive Care Medicine (ESICM) [10]. В них сепсис определяется как угрожающая жизни дисфункция, причина которой — дис-регуляторный ответ на инфекцию. Новые дефиниции позволяют раньше выявлять больных с сепсисом и начинать лечение в кратчайшие сроки [6, 10, 11].
При формировании сепсиса в ответ на инфекцию активируется множество биологических систем: кининовая, комплемента, коагуляции, метаболизма, а также клетки периферической крови — нейтрофилы, эозинофилы, моноциты, макрофаги. Одновременно происходит выброс большого количества медиаторов, что образно рассматривается как «метаболическая анархия» [12]. Полиорганная недостаточность (ПОН) — клиническое проявление метаболического хаоса, возникающего при дисциркуляторном ответе организма больного на инфекцию.
При сепсисе и СШ важная роль в возникновении ПОН отводится эндотоксину (ЭТ) грамотрицательных бактерий, который выявляется приблизительно у 80% больных [13]. Высокий уровень ЭТ в крови больных сепсисом коррелирует с высоким риском летального исхода. Повышенный уровень ЭТ регистрируется при бактериологически подтвержденной грамотрицательной инфекции, однако имеются сведения, что уровень ЭТ увеличивается при грамположительной флоре, грибковой инфекции, а также при СШ, когда источник инфекции не установлен микробиологическими методами. В настоящее время известно, что желудочно-кишечный тракт является резервуаром Э.Т. Поэтому нарушение перфузии и барьерной функции слизистой оболочки желудочно-кишечного тракта приводит к транслокации ЭТ и манифестации сепсиса [13, 14].
ЭТ представляет собой облигатный липополисахарид бактериальной стенки грамотрицательных бактерий. Структура Э.Т. включает длинную цепь жирных кислот (липид А) и полисахаридное ядро. К сердцевине ядра прикреплена вариабельная углеводная цепочка (О-антиген), которая уникальна для каждой бактерии и определяет ее серотип. В результате разрушения бактериальной стенки грамотрицательной бактерии происходит высвобождение Э.Т. Поступление Э.Т. в кровь вызывает активацию различных биологически активных систем. Кроме того, ЭТ, взаимодействуя с макрофагами, усиливает продукцию свободных кислородных радикалов, что приводит к инициации диссеминированного внутрисосудистого свертывания крови. Высокую чувствительность к ЭТ имеют почки, легкие и сердечно-сосудистая система [15, 16].
Удаляя ЭТ из крови больных сепсисом и СШ, можно уменьшить выраженность ПОН, а следовательно, снизить летальность. Для реализации этой идеи были разработаны специальные методы.
Метод сорбции заключается в способности притягивать растворенные вещества к сорбенту. Сорбенты обладают высокой адсорбционной емкостью, что делает их идеальными для применения у больных с сепсисом и С.Ш. Сорбенты могут применяться как самостоятельно, так и в комбинации с другими широко известными экстракорпоральными методами лечения (ЭМЛ).
В настоящее время в клинической практике применяются следующие сорбенты: картридж с иммобилизированным полимиксином В (ПМ-В) («Toraymyxin 20R», Япония), LPS Adsorber («Alteco Medical AB», Швеция), MATISSE-Fresenius system («Fresenius SE» Германия), Токсипак (НПФ «ПОКАРД», Россия).
Наиболее изученным и широко используемым у больных с сепсисом и СШ является картридж с иммобилизированным ПМ-В. ПМ-В представляет собой катионный полипептидный антибиотик с высокой активностью по отношению к грамотрицательным бактериям и аффинной способностью к Э.Т. Внутривенное применение ПМ-В ограничено из-за его высокой нефро- и нейротоксичности. Возможность фиксации ПМ-В на полистиреновом волокне картриджа позволяет удалять ЭТ без риска развития побочных эффектов. Картридж с ПМ-В был разработан и разрешен к клиническому применению в Японии в 1993 г. В 1998 г. применение ПМ-В одобрено в Европе.
Таким образом, наибольший опыт использования препарата накоплен в Японии, где на протяжении 17 лет методика картриджа с ПМ-В включена в комплексное лечение СШ, вызванного грамотрицательными бактериями. Имеется лабораторное подтверждение эффективности картриджа с ПМ-В как компонента ЭМЛ: после процедуры в крови больных снижалась концентрация ЭТ, цитокинов, фактора некроза опухоли (ФНО) и интерлейкина-6 (ИЛ-6) [17].
В России также имеется большой опыт применения ПМ-В у больных, находящихся в критических состояниях. Первые публикации, посвященные сепсису и СШ, появились в 2008 г. [21, 22].
LPS Adsorber состоит из серии пористых полиэтиленовых пластин, покрытых пептидом, специфичным к Э.Т. Этот адсорбент предназначен для сорб-ции ЭТ из крови. В настоящее время в мировой литературе встречается мало публикаций, посвященных применению LPS Adsorber у больных сепсисом. В отечественной литературе представлены результаты использования LPS Adsorber при лечении больных сепсисом и СШ [24]. Авторы указывают, что включение адсорбента в комплексную терапию приводит к снижению концентрации ЭТ, медиаторов воспаления и клиническому улучшению течения заболевания, которое проявляется восстановлением респираторных и гемодинамических показателей.
Сравнительный анализ эффективности ПМ-В и LPS Adsorber у больных с грамотрицательным сепсисом не выявил существенных различий в исходе заболевания [25, 26].
MATISSE-Fresenius system — система для сорбции ЭТ, основанная на способности альбумина сыворотки крови ковалентно связываться с макропористыми шариками акрилового полимера. Результаты рандомизированного исследования [27] не обнаружили какого-либо значимого эффекта в сравнении со стандартной терапией у больных сепсисом.
Другой подход к лечению сепсиса связан с элиминацией цитокинов. Доказано, что цитокины играют важную роль в патогенезе сепсиса, СШ и ПОН. У большинства больных сепсисом выявляется устойчивое повышение в крови уровня цитокинов. Цитокины синтезируются макрофагами и представляют собой пептиды с множественными паракринными и дистанционными эффектами. Они отвечают за эффекторные и регуляторные функции при иммунном ответе [16]. В результате дисбаланса между провоспалительными и противовоспалительными цитокинами первые начинают преобладать. Данное явление получило название «цитокиновый шторм». Цитокинам отводится ведущая роль в развертывании медиаторного механизма сепсиса. При сепсисе имеет место неотрегулированная экспрессия различных цитокинов. Считается, что избыточное высвобождение провоспалительных цитокинов, к которым относятся ИЛ-1, ИЛ-6, ИЛ-8 и ФНО, оказывает прямое цитотоксическое действие и вызывает эффект «иммунопаралича». Повреждающее действие цитокинов усиливается повышенной продукцией радикалов кислорода, супероксид анионов и оксида азота. В результате быстрый и массированный выброс цитокинов и биологически активных веществ приводит к тканевому и капиллярному повреждению, вызывая нарушение микроциркуляции, генерализованную вазодилатацию, что в конечном итоге определяет развитие ПОН [33, 34].
Проводятся исследования [35, 36], посвященные применению экстракорпоральных устройств, способных элиминировать цитокины за счет их сорб-ции. Одно из наиболее известных устройств — система CytoSorb («Cytosorbents Inc.», США), предназначенная для удаления цитокинов из крови больных сепсисом. В структуру системы CytoSorb входит высокотехнологичный гранулированный полимер, позволяющий адсорбировать молекулы от 8 до 55 кДа. Система CytoSorb может использоваться самостоятельно, в комбинации с методиками заместительной терапии, а также в контуре аппарата искусственного кровообращения.
Отчеты о применении системы CytoSorb указывают на хороший клиренс цитокинов и улучшение гемодинамики у больных сепсисом и ПОН [37—39]. K. Kogelmann и соавт. [37] в 2017 г. представили результаты применения CytoSorb у 26 больных с хирургическим и терапевтическим сепсисом и С.Ш. Использование CytoSorb, особенно в первые часы от момента постановки диагноза СШ, сопровождалось быстрой стабилизацией гемодинамики, летальность составила 69% при ожидаемой (расчетной) — 92%. В настоящее время опубликованы данные двух работ по изучению эффективности CytoSorb у больных СШ: пилотного рандомизированного контролируемого исследования [40] и проспективного одноцентрового исследования [41]. Согласно их результатам, применение CytoSorb сопровождается гемодинамической и метаболической стабилизацией у больных СШ, одновременно сообщается о снижении концентрации прокальцитонина и эндотелина-1.
Сорбент CTR-001 («Kaneka Corp.», Япония) представляет собой пористые целлюлозные шарики, на которых ковалентно иммобилизован гидрофобный компонент с гексадецил-алкиновой цепочкой. Исследования, проведенные in vitro [36, 42], продемонстрировали способность сорбента CTR-001 элиминировать ЭТ и цитокины, такие как ФНО и ИЛ-6.
Сорбент CYT-860 («Toray Industries Inc.», Япония) был получен путем химической модификации полистирола на основе конъюгированного волокна — армированного полипропилена, изначально разработанного для адсорбции Э.Т. Согласно отчету Y. Kobe и соавт. [42] о лечении 7 больных, сорбент CYT-860 показал способность снижать концентрацию цитокинов и улучшать общее состояние пациентов.
Безусловно, большинство описанных методик находится на начальных стадиях изучения и их клиническую эффективность еще предстоит оценить в рандомизированных исследованиях.
Проводя обзор литературы, посвященный сорбционным методикам лечения больных сепсисом и СШ, необходимо отметить такой экстракорпоральный метод детоксикации, как сочетанная плазмофильтрация и адсорбция (СПФА) («Bellco», Италия). Этот метод можно отнести к гибридной технологии, поскольку он предусматривает использование плазменного фильтра, предназначенного для отделения плазмы от крови и сорбента. Компонентом сорбента является синтетический сшитый дивинилбензолом стирольный полимер, способный удалять медиаторы воспаления.
До сих пор нет однозначного мнения по поводу эффективности СПФА у больных сепсисом и С.Ш. Ряд авторов указывают, что СПФА эффективно снижает концентрацию медиаторов воспаления и оказывает стабилизирующее действие на гемодинамику у больных сепсисом и СШ. В работах, представленных А.В. Ватазиным и соавт. [46] и А.М. Фоминым и А.А. Зацепиной [47], отмечается, что на фоне СПФА наблюдаются повышение среднего артериального давления, улучшение газообмена в легких и снижение потребности в вазопрессорной поддержке у больных сепсисом.
В 2014 г. S. Livigni и соавт. [48] опубликовали работу по изучению эффективности СПФА у больных СШ. В 18 отделениях интенсивной терапии Италии изучали влияние СПФА на 90-дневную и стационарную летальность. Как показали результаты исследования, смертность в группе СПФА не отличалась от контрольной группы. Кроме того, авторы отметили частое тромбирование экстракорпорального контура и высокую стоимость методики, что затрудняет проведение СПФА в полном объеме.
В 2017 г. международное сообщество Current Surviving Sepsis Campaign (Компания за выживание при сепсисе) опубликовало очередной релиз рекомендаций по лечению сепсиса и СШ [49]. Акцент в них был сделан на раннюю диагностику и лечение, поскольку сепсис легче лечить на начальных стадиях, чем бороться с манифестированной ПОН.
Вместе с тем необходимо признать, что кардинального прорыва в терапии сепсиса не наступило. Основа успешного результата заключается в ранней диагностике сепсиса (шкалы sepsis-related organ failure assessment (SOFA) и quick-SOFA) и начале терапевтических мероприятий до перевода в ОРИТ. Важная роль отводится мультидисциплинарному подходу. Стартовая терапия подразумевает внутривенное введение кристаллоидных растворов, назначение при необходимости вазопрессоров, проведение искусственной вентиляции легких, определение уровня лактата в крови, идентификацию возбудителя инфекции, эффективную антибактериальную терапию, санацию очага инфекции.
Отношение к ЭМЛ в этих рекомендациях не определено и остается на усмотрение лечащего врача. Во многом это связано с ошибками, допущенными в предыдущих рекомендациях (2008 г.), когда недостаточно проверенные методики оказывались не-эффективными. Безусловно, необходимы дальнейшие исследования, разработка новых сорбционных методик, которые позволят определить вид ЭМЛ, подходящий для тех или иных состояний. Хотя, на взгляд авторов настоящей статьи, единый универсальный подход к лечению сепсиса и СШ выработать невозможно, так как уже сейчас очевидно, что превалирование того или иного компонента ПОН диктует применение различных методов детоксикации.
Авторы подтверждают, что статья или ее части ранее не были опубликованы.
Санация очагов инфекции при сепсисе и септическом шоке - рекомендации
Очень важным компонентом лечения больных сепсисом является адекватная санация источника инфекции, особенно в том случае, если генерализованная инфекция является основной причиной развития критического состояния. Иногда комплексный подход к лечению таких пациентов может приводить к быстрому улучшению их состояния. Высокую эффективность лечения могут отражать следующие признаки:
• снижение интенсивности клинических проявлений сепсиса и генерализованного воспаления;
• эрадикация бактерий;
• доказательства снижения степени метаболических нарушений, связанных с инфекцией, нормальное течение раневого процесса с формированием грануляционной ткани или эпителизацией;
• рентгенологические признаки разрешения воспалительных очагов;
• приостановка или обратное развитие признаков органной дисфункции;
• выздоровление пациентов.
Оценка эффективности санации очагов инфекции может способствовать изменению тактики лечения, как то: необходимости проведения повторных операций для удаления некротических тканей, поиска доказательств жизнеспособности органов, например кишечника.
Меры по санации очага инфекции желательно предпринимать тогда, когда состояние пациента является относительно стабильным. Однако при развитии септического шока у пациентов с инфарктом кишечника или клостридиальной инфекцией мягких тканей трудно рассчитывать на улучшение состояния без агрессивного хирургического лечения.
Некротические инфекции мягких тканей. Результаты классических и современных исследований указывают на то, что ранняя агрессивная хирургическая тактика по иссечению некротических тканей резко снижает летальность. Так, в одном из крупных исследований было показано, что радикальное иссечение некротических тканей приводило к снижению летальности с 38 до 4 %. Кроме того, важное значение имеют сроки операции: проведение вмешательства в первые 24 ч позволило вдвое снизить летальность по сравнению с операцией, проведенной в более поздние сроки.
Чрескожное дренирование абсцессов брюшной полости. Имеются исследования, указывающие на то, что эффективность чрескожного и лапаротомического дренирования абсцессов брюшной полости одинаковая. Однако чрескожное дренирование как временная мера контроля очага инфекции особенно актуальна у больных тяжелым сепсисом и с септическим шоком, так как в меньшей степени нарушает физиологические и гемодинамические показатели.
Инфекций дыхательных путей. Инфекции дыхательных путей, особенно нозокомиальные, являются фактором риска летального исхода у тяжелых, в том числе гематологических, больных. Контаминация дыхательных путей нозокомиальной резистентной флорой требует применения в стартовом режиме антибактериальных препаратов, обладающих высокой активностью в отношении нозокомиальной флоры. Решение о применении антибактериальной терапии должно иметь под собой доказательства наличия инфекции.
Типичные клинико-лабораторные признаки пневмонии встречаются только у 1/3 тяжелых больных, поэтому в последние годы для повышения надежности диагностики и контроля эффективности лечения нозокомиальной пневмонии, особенно у реанимационных больных, стали применять методы «инвазивной» диагностики. В основе этих методов лежит бронхоскопия с применением различных устройств (защищенные щетки, защищенные катетеры) и способов (бронхоальвеолярный лаваж — БАЛ) для забора материала из трахеи и бронхов на количественное микробиологическое исследование. Высев из жидкости, полученной при бронхоальвеолярном лаваже, микроорганизмов в количестве более 105 КОЕ/мл (колониеобразующих единиц в мл) является подтверждением нозокомиальной пневмонии.
Назначение антибиотиков и снижение концентрации бактерий в последующих посевах жидкости, полученной при проведении БАЛ, считается признаком эффективности антимикробной терапии и адекватного контроля очага инфекции в легких. Необходимо указать, что даже эффективная антибактериальная терапия не обеспечивает «стерилизации» трахеобронхиального дерева у пациентов, которым проведена интубация трахеи и осуществляется искусственная вентиляция легких. В этих случаях снижение количества бактерий до 102 КОЕ/мл при исчезновении признаков дыхательной недостаточности указывает на возможность прекращения антибактериальной терапии. Аналогичный количественный критерий отмены антибактериальной терапии у пациентов без интубации трахеи отсутствует.
Таким образом, меры, направленные на санацию источника инфекции, могут быть разнообразными и выбираются с учетом потенциальной эффективности, своевременности и безопасности для пациента. При развитии септического шока радикальность методов контроля очага инфекции должна быть сопоставима с тяжестью состояния пациента. Оценку эффективности санации очага инфекции проводят на основании клинических и лабораторных тестов, динамики показателей, характеризующих генерализованное воспаление, органную дисфункцию и состояние предполагаемого очага инфекции.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Антибактериальная терапия септического шока - выбор эффективного антибиотика
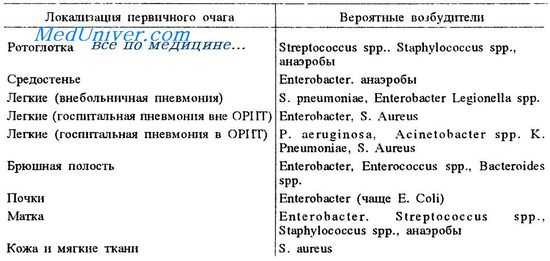
Адекватной антимикробной терапией септического шока считается та, хотя бы один компонент которой оказался активным в отношении возбудителя, выделенного из предполагаемого источника инфекции. Ретроспективные исследования применения адекватной антимикробной терапии в отношении ангиогенных инфекций, вызванных грамотрицательной флорой, указывают на снижение летальности пациентов в сравнении с теми, по отношению к которым по разным причинам применялась неадекватная антибактериальная терапия. В таблице представлены результаты анализа эффективности адекватной и неадекватной терапии в лечении больных сепсисом с различным прогнозом исхода заболевания. Прогноз заболевания определялся с помощью оценки тяжести состояния и наличия сопутствующей патологии.
Необходимо отметить, что аналогичные данные о влиянии адекватной и неадекватной антибактериальной терапии на летальность больных сепсисом, вызванным грамположительной флорой, весьма ограничены, тем не менее в отдельных исследованиях были выявлены различия в эффективности адекватной и неадекватной антибактериальной терапии.
В отношении адекватной терапии кандидемии (одной из форм инвазивного кандидоза) также имеются ограниченные данные, указывающие на важность проведения адекватной антигрибковой терапии. К 30-м суткам лечения летальность пациентов, получавших адекватную противогрибковую терапию (37 %), была достоверно ниже летальности пациентов, не получавших адекватной терапии (76 %). В отношении влияния на летальность раннего назначения противогрибковой терапии (раньше или позже 3 сут после диагностики инфекции) имеются противоречивые данные, не позволяющие сделать однозначного заключения.
Таким образом, адекватная антибактериальная терапия больных сепсисом, вызванным грамотрицательной, грамположительной флорой и кандидами, является фактором, достоверно снижающим летальность и предупреждающим развитие септического шока.
Эффективность адекватной и неадекватной антимикробной терапии больных сепсисом и септическим шоком
Сравнение монотерапии и комбинированной антимикробной терапии септического шока
Важной проблемой антибактериальной терапии сепсиса и септического шока является выявление преимуществ комбинированной терапии перед применением одного препарата. Преимущества комбинированной терапии обычно сводятся к трем основным аргументам:
1) комбинация препаратов обладает более широким спектром антимикробной активности по сравнению с одним препаратом. Этот аргумент становится особенно актуальным при проведении эмпирической терапии полимикробных инфекций, например, у больных абдоминальным сепсисом;
2) при применении 2 или более препаратов можно рассчитывать не только на аддитивный, но и на синергический эффект препаратов. Теоретически при применении синергических комбинаций может быть снижена доза препаратов, обладающих серьезными побочными эффектами;
3) комбинированная терапия приводит к снижению развития резистентности флоры и вероятности возникновения суперинфекции.
Сравнительные исследования лечения цефалоспоринами 3-й генерации и комбинацией полусинтетических бета-лактамов и аминогликозидов
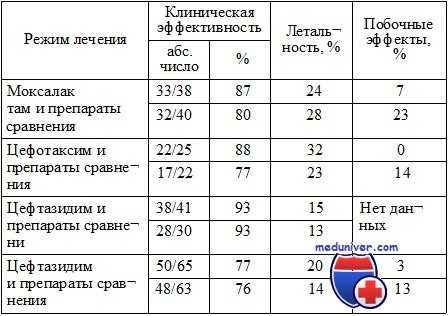
* Препаратами сравнения были комбинации полусинтетических бета-лактамных антибиотиков или цефалоспоринов 1-й генерации с аминогликозидами.
Впервые преимущества комбинированной терапии перед монотерапией были выявлены в 60—70 годах XX в. Эти преимущества заключались в более низкой летальности больных сепсисом при применении синергических комбинаций по сравнению с несинергическими. Появление новых препаратов более широкого спектра действия привело к тому, что эффективность комбинированной антибактериальной терапии оказалась равной эффективности одного современного препарата. Необходимо отметить, что дизайн этих исследований не удовлетворял современным требованиям, предъявляемым к исследованиям с доказательностью высокого уровня достоверности. В 70—90-е годы аналогичные данные были получены в отношении комбинации различных аминогликозидов и цефалоспорина 3-й генерации.
Некоторые исследователи пытались применять одновременно 2, 3 и более антибиотиков, однако экспансия не привела к повышению эффективности лечения и сопровождалась возрастанием токсических эффектов. Внедрение в клиническую практику антибиотиков, обладающих широким и ультрашироким спектром активности (цефалоспоринов 3—4-й генераций, карбапенемов) в отношении важнейших возбудителей тяжелых инфекций, снизило актуальность применения комбинированной терапии и показало высокую эффективность монотерапии современными препаратами.
Равная эффективность монотерапии цефалоспоринами 3—4-й генераций по сравнению с комбинацией полусинтетических бета-лактамных антибиотиков с одним из аминогликозидов была доказана при проведении четырех проспективных рандомизированных исследований. Результаты исследований, представленные в таблице, указывают на примерно равную клиническую эффективность, отсутствие различий в летальности и снижение количества побочных эффектов при применении монотерапии цефалоспоринами по сравнению с комбинированной терапией.
Сравнительные исследования карбапенемов и комбинации бета-лактамных антибиотиков и аминогликозидов
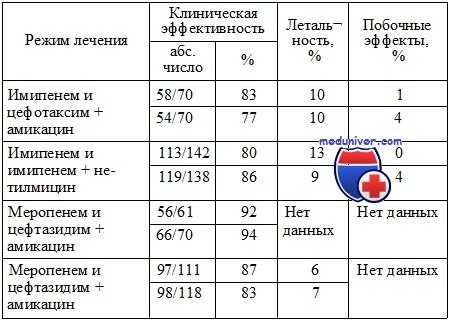
Равная эффективность и безопасность монотерапии карбапенемами по сравнению с комбинацией бета-лактамных антибиотиков и аминогликозидов была доказана при проведении четырех проспективных рандомизированных исследований.
Таким образом, синергические комбинации бета-лактамных полусинтетических антибиотиков в комбинации с аминогликозидами, по-видимому, обладают равной эффективностью с монотерапией современными бета-лактамными антибиотиками (цефалоспоринами 3—4-й генерации, карбапенемами). Тем не менее важная роль комбинированной терапии показана в лечении инфекций, вызванных высокорезистентной нозокомиальной флорой, в частности грамположительной, так как большинство бета-лактамных антибиотиков в этой ситуации оказываются неэффективными. Несмотря на это, проблема роста резистентности флоры не может быть решена исключительно применением комбинированной антибактериальной терапии.
Эмпирическая терапия септического шока противогрибковыми препаратами
С 80-х годов XX в. отмечается значительный рост заболеваемости грибковыми инфекциями, причем наиболее актуальными стали инфекции, вызванные грибами рода кандида. При инвазивных грибковых инфекциях, сопровождающихся фунгемией, доля возбудителей рода кандид достигает 45 %, однако до настоящего времени остается непонятным, как интерпретировать выделения грибов из нестерильных локусов — как подтверждение инфекции или как колонизацию. Это связано с тем, что клинические признаки кандидоза не обладают высокой специфичностью, а обычные культуральные методы, антигенные и биохимические маркеры не обладают высокой чувствительностью. С учетом того, что грибы в этиологической структуре сепсиса составляют не более 5 %, рутинное применение противогрибковых препаратов считается нерациональным.
Все сказанное выше относится к пациентам без иммунологических нарушений. Выделение возбудителей рода кандид из крови или из нормально стерильных сред у пациентов с иммуносупрессией следует трактовать как инвазивный кандидоз, требующий немедленного начала антибактериальной терапии.
Септический шок - эпидемиология, смертность
Тяжелый сепсис и септический шок являются актуальной проблемой современной медицины вследствие увеличения количества больных, высокой летальности и возрастания социально-экономических проблем, связанных с лечением и реабилитацией таких пациентов.
Септический шок является жизнеугрожающим состоянием, наиболее тяжелой стадией или формой развития генерализованной инфекции (сепсиса), характеризующейся наличием неконтролируемого инфекционного процесса, реактивного генерализованного воспаления, полиорганной дисфункции/недостаточности и артериальной гипотензии.
До настоящего времени в научной литературе можно встретить несколько терминов, приближающихся по своему значению к термину «септический шок», — это «бактериальный шок», «бактериемический шок», «эндотоксический шок», «эндотоксиновый шок», «инфекционно-токсический шок».
Многообразие сходных названий исторически связано с субъективными факторами: разработкой проблемы сепсиса и септического шока в различных областях медицинской науки, отсутствием до недавнего времени единой классификации сепсиса и объективными факторами — наличием существенных патогенетических различий механизмов развития сепсиса при ряде нозологических форм, недостаточной научной разработкой проблемы септического шока в целом.
Важным шагом к унификации представлений о сепсисе и септическом шоке стали материалы Согласительной конференции Американского торакального общества и Общества специалистов по интенсивной терапии (ACCP/SCCM) в 1991 г., предложившей использовать термин «септический шок» в качестве варианта течения сепсиса. Эта точка зрения нашла поддержку у большинства специалистов и в настоящее время считается общепризнанной.
На этой же конференции были даны определения других стадий инфекции: бактериемии, сепсиса, тяжелого сепсиса, септического шока и синдрома полиорганной дисфункции (СПД). Разработка этих определений открыла новые перспективы как для развития фундаментальных и прикладных научных исследований в области тяжелых инфекций, так и для клинической практики, заложив основу систематической разработки рекомендаций по диагностике и лечению.
Возбудители сепсиса

Эпидемиология септического шока
Септический шок как синдром, стадия или форма заболевания пока не включен в Международную классификацию болезней, поэтому ориентировочные эпидемиологические данные были получены при проведении нескольких многоцентровых проспективных рандомизированных контролируемых исследований с целью оценки эффективности лекарственных препаратов у больных сепсисом. Обнаружено, что пациенты с септическим шоком составляют 58 % от всех больных с тяжелым сепсисом. Математическое моделирование позволило примерно определить количество пациентов с септическим шоком в США — 435 580 человек в год.
Другим источником информации могут быть данные, полученные в ходе международного многоцентрового эпидемиологического исследования 14 364 пациентов в 28 отделениях реанимации и интенсивной терапии (ОРИТ): пациенты с септическим шоком составили 6,3 % от всех больных ОРИТ, причем в 63,2 % случаев септического шока был осложнением нозокомиальных инфекций (НИ). Согласно отечественным данным, доля больных с септическим шоком составила только 26,1 % среди всех пациентов с тяжелым сепсисом.
При включении критериев сепсиса, тяжелого сепсиса и септического шока в программу регистрации пациентов ОРИТ хирургического профиля было обнаружено, что среди 25,9 % пациентов с сепсисом доля больных септическим шоком составила 4,1 %.
Близкие данные по количеству больных септическим шоком приведены в исследованиях многих авторов — 2—4 %, однако имеются данные и о более высоких показателях —7—18 %, что может свидетельствовать о значительной разнородности исследованных групп пациентов.
Летальность в группе больных с септическим шоком. Причиной летальных исходов больных сепсисом и септическим шоком является органная недостаточность, причем комбинация недостаточности нескольких органов увеличивает вероятность летального исхода. В нескольких исследованиях произведена оценка летальности в группе пациентов с септическим шоком по сравнению с больными сепсисом и тяжелым сепсисом. Летальность в группе больных с септическим шоком составила от 46 до 82 %, что в 1,5—2,5 раза превосходило летальность больных тяжелым сепсисом.
Септический шок ( Инфекционно-токсический шок )
Септический шок – это тяжелое патологическое состояние, возникающее при массивном поступлении в кровь бактериальных эндотоксинов. Сопровождается тканевой гипоперфузией, критическим снижением артериального давления и симптомами полиорганной недостаточности. Диагноз ставится на основании общей клинической картины, сочетающей в себе признаки поражения легких, сердечно-сосудистой системы (ССС), печени и почек, централизации кровообращения. Лечение: массивная антибиотикотерапия, инфузия коллоидных и кристаллоидных растворов, поддержание деятельности ССС за счёт введения вазопрессоров, коррекция респираторных нарушений путем ИВЛ.
МКБ-10
Общие сведения
Септический шок (СШ) также называют инфекционно-токсическим (ИТШ). Как самостоятельная нозологическая единица патология впервые была описана в XIX веке, однако полноценное изучение с разработкой специфических противошоковых мер началось не более 25 лет назад. Может возникать при любом инфекционном процессе. Наиболее часто встречается у пациентов хирургических отделений, при менингококковой септицемии, брюшном тифе, сальмонеллезе и чуме. Распространен в странах, где диагностируется наибольшее количество бактериальных и паразитарных заболеваний (Африка, Афганистан, Индонезия). Ежегодно от ИТШ погибает более 500 тысяч человек по всему миру.
Причины
В абсолютном большинстве случаев патология развивается на фоне ослабления иммунных реакций. Это происходит у пациентов, страдающих хроническими тяжелыми заболеваниями, а также у людей пожилого возраста. В силу физиологических особенностей сепсис чаще диагностируется у мужчин. Список самых распространенных заболеваний, при которых могут возникать явления ИТШ, включает в себя:
- Очаги гнойной инфекции. Признаки системной воспалительной реакции и связанных с ней нарушений в работе внутренних органов отмечаются при наличии объемных абсцессов или флегмоны мягких тканей. Риск генерализованного токсического ответа повышается при длительном течении болезни, отсутствии адекватной антибактериальной терапии и возрасте пациента старше 60 лет.
- Длительное пребывание в ОРИТ. Госпитализация в отделение реанимации и интенсивной терапии всегда сопряжена с риском возникновения сепсиса и инфекционного шока. Это обусловлено постоянным контактом с резистентной к антибактериальным препаратам микрофлорой, ослаблением защитных сил организма в результате тяжёлой болезни, наличием множественных ворот инфекции: катетеров, желудочных зондов, дренажных трубок.
- Раны. Нарушения целостности кожных покровов, в том числе возникшие во время операции, существенно повышают риски инфицирования высококонтагиозной флорой. ИТШ начинается у больных с загрязненными ранами, не получивших своевременной помощи. Травматизация тканей в ходе оперативного вмешательства становится причиной генерализованной инфекции только при несоблюдении правил асептики и антисептики. В большинстве случаев септический шок возникает у пациентов, перенесших манипуляции на желудке и поджелудочной железе. Еще одна распространенная причина – разлитой перитонит.
- Приём иммунодепрессантов. Лекарственные средства, угнетающие иммунитет (меркаптопурин, кризанол), используются для подавления реакции отторжения после трансплантации органов. В меньшей степени уровень собственной защиты снижается при употреблении химиотерапевтических средств – цитостатиков, предназначенных для лечения онкологических заболеваний (доксорубицина, фторурацила).
- СПИД.ВИЧ-инфекция в стадии СПИДа приводит к развитию нетипичного сепсиса, спровоцированного не бактериальный культурой, а грибком рода Candida. Клинические проявления болезни характеризуется малой степенью выраженности. Отсутствие адекватного иммунного ответа позволяет патогенной флоре свободно размножаться.
Возбудитель сепсиса – грамположительные (стрептококки, стафилококки, энтерококки) и грамотрицательные (Enterobacter cloacae, Clostridium pneumoniae) бактерии. Во многих случаях культуры нечувствительны к антибиотикам, что затрудняет лечение пациентов. Септический шок вирусного происхождения в настоящее время вызывает споры специалистов. Одни представители научного мира утверждают, что вирусы неспособны стать причиной патологии, другие – что внеклеточная форма жизни может спровоцировать системную воспалительную реакцию, являющуюся патогенетической основой ИТШ.
Патогенез
В основе симптомов лежит неконтролируемое распространение медиаторов воспаления из патологического очага. При этом происходит активация макрофагов, лимфоцитов и нейтрофилов. Возникает синдром системного воспалительного ответа. На фоне этого снижается периферический сосудистый тонус, объем циркулирующей крови падает за счет повышения проницаемости сосудов и застоя жидкости в микроциркуляторном русле. Дальнейшие изменения обусловлены резким уменьшением перфузии. Недостаточное кровоснабжение становится причиной гипоксии, ишемии внутренних органов и нарушения их функции. Наиболее чувствителен головной мозг. Кроме того, ухудшается функциональная активность легких, почек и печени.
Помимо СВР в формировании септического шока важную роль играет эндогенная интоксикация. В связи со снижением работоспособности экскреторных систем в крови накапливаются продукты нормального обмена веществ: креатинин, мочевина, лактат, гуанин и пируват. Во внутренних средах повышается концентрация промежуточных результатов окисления липидов (скатол, альдегиды, кетоны) и бактериальных эндотоксинов. Всё это вызывает тяжелые изменения гомеостаза, расстройства кислотно-щелочного баланса, нарушения в работе рецепторных систем.
Классификация
Шоковое состояние классифицируется по патогенетическому и клиническому принципу. Патогенетически болезнь может быть «теплой» и «холодной». Тёплый шок характеризуется увеличением сердечного выброса на фоне снижения общего сосудистого тонуса, эндогенной гиперкатехоламинемией и расширением внутрикожных сосудов. Явления органной недостаточности выражены умеренно. Холодная разновидность проявляется снижением сердечного выброса, резким ослаблением тканевой перфузии, централизацией кровообращения и тяжелой ПОН. По клиническому течению септический шок подразделяется на следующие разновидности:
Симптомы септического шока
90% случаев СШ сопровождается дыхательной недостаточностью различной степени тяжести. Пациенты с декомпенсированным и терминальным течением болезни нуждаются в аппаратной респираторной поддержке. Печень и селезенка увеличены, уплотнены, их функция нарушена. Может отмечаться атония кишечника, метеоризм, стул с примесью слизи, крови и гноя. На поздних стадиях возникают симптомы диссеминированного внутрисосудистого свертывания: петехиальная сыпь, внутреннее и наружное кровотечения.
Осложнения
Септический шок приводит к ряду тяжелых осложнений. Наиболее распространённым из них считается полиорганная недостаточность, при которой нарушается функция двух и более систем. В первую очередь страдает ЦНС, легкие, почки и сердце. Несколько реже встречается поражение печени, кишечника и селезенки. Летальность среди пациентов с ПОН достигает 60%. Часть из них погибает на 3-5 сутки после выведения из критического состояния. Это обусловлено органическими изменениями во внутренних структурах.
Еще одним распространенным последствием ИТШ являются кровотечения. При формировании внутримозговых гематом у пациента развивается клиника острого геморрагического инсульта. Скопление экстравазата в других органах может приводить к их сдавлению. Уменьшение объема крови в сосудистом русле потенцирует более значимое снижение артериального давления. ДВС на фоне инфекционно-токсического шока становится причиной гибели пациента в 40-45% случаев. Вторичное поражение органов, спровоцированное микротромбозами, возникающими на начальном этапе формирования коагулопатии, отмечается практически у 100% больных.
Диагностика
Диагноз устанавливается врачом анестезиологом-реаниматологом. Предположение строится на клинических данных, однако с точностью определить имеющееся состояние можно только при наличии результатов аппаратного и лабораторного исследований. При подозрении на септический шок все анализы делаются в экстренном режиме, «по cito». Реанимационные мероприятия следует начинать, не дожидаясь окончания работы вспомогательных служб. Комплексное обследование, необходимое для определения и подтверждения ИТШ, включает в себя:
- Осмотр и физикальное исследование. Реализуется непосредственно лечащим врачом. Специалист обнаруживает характерные клинические признаки шокового состояния. Для этого проводится тонометрия, визуальная оценка цвета кожных покровов, особенностей дыхательных движений, подсчет пульса и ЧДД, аускультация сердца и легких. При подозрении на наличие осложнений необходима оценка неврологического статуса на предмет симптоматики кровоизлияния в мозг.
- Аппаратное исследование. Имеет вспомогательное значение. Пациенту показан контроль состояния с использованием анестезиологического монитора. На экран устройства выводится информация о величине артериального давления, частоте сердечных сокращений, степени насыщения крови кислородом (при легочной недостаточности SpO2<90%) и коронарном ритме. На фоне нарушений дыхания и токсического поражения миокарда может отмечаться тахикардия, аритмия и блокады внутрисердечной проводимости.
- Лабораторное исследование. Позволяет выявить имеющиеся нарушения гомеостаза, сбои в работе внутренних органов. У пациентов с шоком септического происхождения обнаруживается повышенный уровень креатинина (> 0,177 ммоль/л), билирубина (>34,2 мкмоль/л), лактата (>2 ммоль/л). О нарушении коагуляции свидетельствует тромбоцитопения (
Лечение септического шока
Пациентам показана интенсивная терапия. Лечение проводят в отделениях ОРИТ с использованием методов аппаратной и медикаментозной поддержки. Лечащий врач – реаниматолог. Может потребоваться консультация инфекциониста, кардиолога, гастроэнтеролога и других специалистов. Требуется перевод больного на искусственную вентиляцию лёгких, круглосуточное наблюдение среднего медицинского персонала, парентеральное кормление. Смеси и продукты, предназначенные для введения в желудок, не используются. Все методы воздействия условно делятся на патогенетические и симптоматические:
- Патогенетическое лечение. При подозрении на наличие сепсиса больному назначают антибиотики. Схема должна включать в себя 2-3 препарата различных групп, обладающих широким спектром действия. Подбор медикамента на начальном этапе проводят эмпирическим путем, в соответствии с предполагаемой чувствительностью возбудителя. Одновременно с этим производят забор крови на стерильность и восприимчивость к антибиотикам. Результат анализа готовится в течение 10 дней. Если к этому времени подобрать эффективную лекарственную схему не удалось, следует использовать данные исследования.
- Симптоматическое лечение. Подбирается с учетом имеющейся клинической картины. Обычно больные получают массивную инфузионную терапию, глюкокортикостероиды, инотропные средства, антиагреганты или гемостатики (в зависимости от состояния свертывающей системы крови). При тяжелом течении болезни используют препараты крови: свежезамороженную плазму, альбумин, иммуноглобулины. Если пациент находится в сознании, показано введение анальгетических и седативных лекарств.
Прогноз и профилактика
Септический шок имеет неблагоприятный прогноз для жизни. При субкомпенсированном течении погибает около 40% больных. Декомпенсированная и терминальная разновидности оканчиваются гибелью 60% пациентов. При отсутствии своевременной медицинской помощи смертность достигает 95-100%. Часть больных умирает через несколько дней после устранения патологического состояния. Профилактика ИТШ заключается в своевременном купировании очагов инфекции, грамотном подборе антибиотикотерапии у хирургических больных, соблюдении антисептических требований в отделениях, занимающихся инвазивным манипуляциями, поддержке адекватного иммунного статуса у представителей ВИЧ-инфицированной прослойки населения.
2. Тактика ведения пациентов с сепсисом и септическим шоком в многопрофильном стационаре/ Сапичева Ю.Ю., Лихванцев В.В. – 2015.
Читайте также:
