Строение и функции клатриновых везикул в эндоцитозе
Добавил пользователь Алексей Ф. Обновлено: 20.01.2026
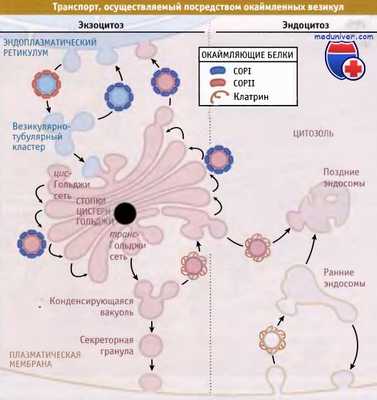
происходит в специализированных участках плазматической мембраны. Это так называемые окаймленные ямки. Они называются так потому, что со стороны цитоплазмы плазматическая мембрана покрыта, одета, тонким(около 20 нм) волокнистым слоем, который на ультратонких срезах как бы окаймляет, покрывает небольшие впячивания, ямки . Эти ямки есть почти у всех клеток животных, они занимают около 2% клеточной поверхности. Окаймляющий слой состоит в основном из белка клатрина, ассоциированного с рядом дополнительных белков. В покрытых клатриновой оболочкой (окаймленных) ямках рецепторные белки мембраны вытесняют все остальные; таким образом ямки действуют как приспособления для накопления и сортировки молекул Этим механизмом достигается и значительная экономия в ходе процесса эндоцитоза: для поглощения определенного количества молекул лиганда требуется значительно меньше пузырьков, чем было бы в случае диффузного распределения комплексов рецептор-лиганд.
Три молекулы клатрина вместе с тремя молекулами низкомолекулярного белка образуют структуру трискелиона, напоминающего трехлучевую свастику.
Клатриновый трискелионы на внутренней поверхности ямок плазматической мембраны образуют рыхлую сеть, состоящую из пяти- и шестиугольников, в целом напоминающую корзинку. Клатриновый слой одевает весь периметр отделяющихся первичных эндоцитозных вакуолей, окаймленных пузырьков.
Клатрин относится к одному из видов т.н. “одевающих” белков. Эти белки связываются с интегральными белками- рецепторами со стороны цитоплазмы и образуют одевающий слой по периметру возникающей пиносомы, первичного эндосомного пузырька - “окаймленного” пузырька. в отделении первичной эндосомы участвуют также белки - динамины, которые полимеризуются вокруг шейки отделяющегося пузырька.
После того как окаймленный пузырек отделится о плазмолеммы и начнет переноситься вглубь цитоплазмы клатриновый слой распадается, диссоциирует, мембрана эндосом (пиносом) приобретает обычный вид. После потери клатринового слоя эндосомы начинают сливаться друг с другом. Было найдено, что мембраны окаймленных ямок содержат сравнительно мало холестерина, что может определять снижение жесткости мембран и способствовать образованию пузырьков. Биологический смысл появления клатриновой “шубы” по периферии пузырьков, возможно, заключается в том, что он обеспечивает сцепление окаймленных пузырьков с элементами цитоскелета и последующий их транспорт в клетке, и препятствует их слиянию друг с другом.
44)Эндосомы
Эндосомы - мембранные пузырьки с постепенно закисляющимся содержимым, которые обеспечивают перенос макромолекул с поверхности клетки в лизосомы и их частичный или полный гидролиз на стадиях, предшествующих лизосомальному уровню деградации. В связи с указанными свойствами совокупность эндосом в настоящее время считают не просто механизмом транспорта веществ в клетке (как полагали ранее), а частью системы их переваривания ("внутриклеточного пищеварительного тракта"), в которую входят также лизосомы.
Большинство эндосом, образующихся в результате эндоцитоза из плазматической мембраны, транспортируются внутрь клетки, где сливаются с существующими эндосомами либо закисляются за счёт активности протонной АТФазы (H-АТФаза). В процессе созревания эндосома проходит несколько последовательных стадий, постепенно превращаясь в лизосому.
Различают три типа эндосом: ранние, или первичные, эндосомы(Первичные эндосомы содержат в основном захваченные в жидкой среде чужеродные молекулы и не содержат гидролитических ферментов. эндосомы могут сливаться друг с другом при этом увеличиваясь в размере. Они затем сливаются с первичными лизосомами (см. ниже), которые вводят в полость эндосом ферменты, гидролизующие различные биополимеры. Действие этих лизосомных гидролаз и вызывает внутриклеточное пищеварение - распад
полимеров до мономеров), поздние эндосомы (или мультивезикулярные тельца) и рециркулирующие эндосомы. Они различаются по своей морфологии. После того, как везикулы теряют оболочку, они сливаются с ранними эндосомами, которые в свою очередь в процессе созревания превращаются в поздние липосомы перед тем, как слиться с лизосомами.
Слияние поздних эндосом с лизосомами приводит первоначально к образованию гибридной структуры с промежуточными характеристиками.Так, например, лизосомы обладают большей плотностью, чем эндосомы, в то время как такие гибридные структуры имеют промежуточную плотность.
Ранняя эндосома — в нее поступают эндоцитозные (пиноцитозные) пузырьки. Из ранней эндосомы рецепторы, отдавшие (из-за пониженного рН) свой груз, возвращаются на наружную мембрану.
Поздняя эндосома — в нее из ранней эндосомы поступают пузырьки с материалом, поглощенном при пиноцитозе, и пузырьки из аппарата Гольджи с гидролазами. Рецепторы маннозо-6-фосфата возвращаются из поздней эндосомы в аппарат Гольджи.
45) .Эндоплазматическая сеть (ретикулум).
В световом микроскопе в фибрибластах после фиксации и окраски видно, что периферия клеток (эктоплазма) окрашивается слабо, в то время как центральная часть клеток (эндоплазма) хорошо воспринимает красители. Так К.Портер в 1945 году увидел в электронном микроскопе, что зона эндоплазмы заполнена большим числом мелких вакуолей и каналов, соединяющихся друг с другом и образующих что-то наподобие рыхлой сети (ретикулум). Было видно, что стопки этих вакуолей и канальцев ограничены тонкими мембранами. Так был обнаружен эндоплазматический ретикулум, или эндоплазматическая сеть. Позднее, в 50-х гг., при использовании метода ультратонких срезов удалось выяснить структуру этого образования и обнаружить его неоднородность. Самым же главным оказалось, что эндоплазматический ретикулум (ЭР) встречается практически у всех эукариот.
Подобный электронно-микроскопический анализ позволил выделить два типа ЭР: гранулярный (шероховатый) и гладкий.
Строение и функции клатриновых везикул в эндоцитозе
Механизм ретроградного транспорта белков COPI везикулами
Подобно тому как COPII-окаймленные везикулы участвуют в транспорте вновь синтезированных нативных белков из ЭПР в аппарат Гольджи, COPI-окаймленные везикулы осуществляют ретроградный транспорт белков из аппарата Гольджи в ЭПР. COPI-везикулы играют важную роль в возвращении белков снова в ЭПР. Наряду с этим они, вероятно, принимают участие в рециклировании таких важных компонентов везикул, как белки SNARE. Эти белки возвращаются из аппарата Гольджи назад, в ЭПР, а также мигрируют из транс-участка аппарата Гольджи на цис-сторону. Имеются данные о том, что COPI-везикулы могут принимать участие в антероградных транспортных процессах в диктиосоме Гольджи, хотя их роль при этом точно не известна.
Наиболее убедительные данные о роли COPI-везикул в ретроградном транспорте были получены в генетических экспериментах на дрожжах. Для инициации процесса конъюгации дрожжей фактор а должен связаться со своим рецептором на плазматической мембране. С использованием генетического подхода был сконструирован рецептор а фактора, который в цитолазматическом участке содержал сигнал возвращения с двумя остатками лизина. Этот рецептор не экспрессировался на поверхности клетки, и дрожжи с таким мутантным рецептором не обладали способностью к конъюгации. Были обнаружены супрессорные мутации, которые восстанавливали способность клеток к конъюгации.
Оказалось, что эти мутации происходят в генах, кодирующих компоненты белков окаймления COPI. Тем самым подтвердилась роль COPI везикул в возврате в ЭПР белков, обладающих соответствующим сигналом с двумя остатками лизина.
Для образования COPI везикул необходима сборка ГТФазы и белков окаймления на донорской мембране. Процесс сборки происходит таким же образом, как и для COPII везикул, но с использованием других белков. В случае везикул COPI на первом этапе сборки происходит ассоциация с мембраной ГТФазы, представляющей собой фактор АДФ-рибозилирова-ния (ARF). ARF охарактеризован менее подробно, чем его аналог в ЭПР, Sar1p, играющий аналогичную роль в сборке окаймляющих белков COPII. Впервые ARF был идентифицирован как кофактор, необходимый для гибели клетки при действии на нее холерного токсина.
ARF, связанный с ГДФ, представляет собой растворимый белок цитоплазмы. Как и другие небольшие ГТФазы, ARF активируется при связывании с ГТФ-ГДФ-обменивающим фактором (GEF). Комплекс ARF-GEF находится на мембранах аппарата Гольджи и специфическим образом воздействует на ARF, вызывая отщепление ГДФ и связывание ГТФ. При связывании ГТФ наступают конформационные изменения, в результате которых на N-конце молекулы ARF обнажается остаток миристиновой кислоты. Этот остаток способствует скреплению комплекса ARF-ГТФ с мембранами аппарата Гольджи.
Комплекс является специфической мишенью для брефелдина А, фармакологического препарата, блокирующего сборку белков окаймления COPI и приводящего к разрушению аппарата Гольджи и массовому переходу его мембран в ЭПР.
Образование комплекса ARF-ГТФ приводит к мобилизации в мембране комплексов белков окаймления COPI, известных под названием коатомеров. Каждый коатомер представляет собой ассоциат, состоящий из семи белков, которые обозначаются следующим образом: а-, b-, b'-, у-, δ-, ε- и ζ-COP. Активации мембранных комплексов способствует присутстствие отрицательно заряженных мембранных липидов, которые с ними связываются. Связывание коатомеров с мембраной способствует ее деформации при образовании везикул. Таким образом, коатомеры играют в образовании везикул COPI такую же роль, как и Sec23/24 и Sec 13/31 в образовании везикул COPII.
Белки окаймления COPI прямо или опосредованно связываются с белками, возвращающимися в ЭПР. Ддя мембранных белков типа I, у-субъединица коатомера непосредственно связывается с возвратной последовательностью, содержащей два лизиновых остатка и расположенной со стороны цитоплазматической части. Белки окаймления COPI также связываются опосредованно с рецептором KDEL, вероятно за счет ARF-ГТФаза активирующего белка (ARF-GAP). Это приводит к возврату в ЭПР KDEL-содержащих растворимых белков. Комплекс ARF-GAP также стимулирует гидролиз ГТФ, связанного с ARF, что вызывает отщепление белков окаймления.
Как показано на рисунке ниже, процесс возврата белков начинается, как только при слиянии везикул COPII, отпочковавшихся от ЭПР, сформировались везикулярнотубулярные кластеры (VTCs). Возврат продолжается по мере движения VTCs в цис-Гольджи вдоль микротрубочек. Возврат также происходит из CGN и, в меньшей степени, из более отдаленных участков аппарата Гольджи.
Некоторые токсины, например холерный токсин, используют механизм возврата белков из дистальных компартментов аппарата Гольджи. Токсин продуцируется холерным вибрионом Vibrio cholera. Он попадает в клетку путем эндоцитоза и из ЭПР транспортируется в цитоплазму, вероятнее всего по ретротранслокационному механизму. На С-терминальном конце одной из субъединиц молекулы холерного токсина находится последовательность KDEL. Попавший в клетку токсин транспортируется из эндосом в транс-Гольджи-сеть, где связывается с дистальным KDEL-рецептором и по механизму ретроградного транспорта поступает в ЭПР.
До того как COPI везикулы сольются с ЭПР, они должны освободиться от белков окаймления с тем, чтобы липидный бислой транспортной везикулы мог тесно контактировать с реципиентной мембраной. Если заблокировать процесс освобождения от белков окаймления, то слияния везикулы с мембраной не происходит Механизм отщепления белков окаймления исследован недостаточно, однако предполагается, что диссоциация коатомера и везикулы инициируется ARF-GAP. По-видимому, ARF-GAP стимулирует гидролиз ГТФ под действием ARF, что ведет к высвобождению из мембраны ARF-ГДФ и коатомера. В заключении комплекса ARF-GAP в везикулу может участвовать рецептор KDEL. После освобождения от белков окаймления везикулы сливаются с ЭПР при участии белков SNARE.
Модель, описывающая участие окаймляющих белков и молекул карго в сборке COPI везикул.
На схеме представлено возвращение молекул карго (трансмембранный белок типа I и KDEL рецептор) в эндоплазматический ретикулум. Три основных типа покрытий, характерных для процесса везикулярного транспорта,
представляют собой COPI, COPII и клатриновое окаймление.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
• COPII везикулы представляют собой единственный тип транспортных везикул, которые происходят из эндоплазматического ретикулума
• Для сборки COPII окаймляющих белков на экспортных сайтах в эндоплазматическом ретикулуме необходима ГТФаза и структурные белки
• Сигналы для экспорта мембранных белков эндоплазматического ретикулума обычно находятся в их цитоплазматическом участке
• После отшнуровывания COPII везикулы образуют кластеры, сливаются и мигрируют по микротрубочкам в цис-участок аппарата Гольджи
В ЭПР происходит синтез и структурирование секреторных и других белков, предназначенных для различных компартментов экзо- и эндоцитоза. Белок выходит из ЭПР после того, как сформировалась его нативная структура, а в случае белковых комплексов, состоящих из субъединиц, только после их окончательной сборки. Белки, предназначенные на экспорт, собираются на сайтах ЭПР, в которых образуются везикулы, транспортирующие вновь синтезированные белки в аппарат Гольджи.
(В секреторных клетках экспортные сайты ЭПР определяются как сайты, в которых происходит интенсивный процесс отшнуровывания везикул, которые называются «переходные элементы».)
Транспортные везикулы называются везикулы COPII (англ, coat protein — белок окаймления, СОР). Они представляют собой единственный путь везикулярного экспорта материалов из ЭПР. Компоненты COPII способствуют выпячиванию мембраны, необходимому для образования везикулы, и могут взаимодействовать специфически с некоторыми трансмембранными карго-белками для их отбора на экспорт. Основные закономерности образования везикул COPII такие же, как и для других окаймленных везикул.
Процесс образования везикулы COPII представлен на рисунке ниже. Образование везикулы начинается с последовательного отбора растворимых цитозольных компонентов COPII, Sar1p, Sec23/Sec24 и See13/31. Sar1p представляет собой небольшую ГТФазу, которая находится в цитозоле в неактивной, связанной с ГДФ форме. Она связывается с мембранами ЭПР, взаимодействуя с фактором обмена гуаниловых нуклеотидов, Sec12p (иначе называемый Sar-GEF), который представляет собой интегральный мембранный белок.
See12р активирует Sar1p, обменивая ГДФ на ГТФ.
Связывание Sar1p-ГТФ с мембраной активирует два структурных компонента белкового окаймления, гетеродимеры Sec23/Sec24 и Sec13/Sec31. По форме кристаллическая структура комплекса Sarlp-ГТФ-Sec23/24 напоминает галстук-бабочку и хорошо подходит к искривленной поверхности везикулы COPII. Поэтому полимеризацией этих комплексов с Sec13/31 можно объяснить деформацию и отпочковывание везикулы. Sec24 связывается с белком карго, заключенным в везикулу COPI. Наличие большого количества молекул карго, способных включиться в везикулу, можно объяснить присутствием множественных перекрывающихся сайтов связывания.
Три основных типа покрытий, характерных для процесса везикулярного транспорта,
представляют собой COPI, COPII и клатриновое окаймление.
Sec23 связывается непосредственно с Sar1p и стимулирует гидролиз связанного ГТФ при образовании везикулы или сразу после этого. Поэтому Sec23 действует как белок, активирующий ГТФазу (GAP), раздевающий везикулу и высвобождающий субъединицы окаймляющих белков для следующих циклов образования новой везикулы.
Большинство белков карго включаются в везикулы COPII либо за счет неизбирательного потока, либо используя сигналы сортировки. По механизму неизбирательного потока включается большинство растворимых секреторных белков, которые синтезируются в секреторных клетках в больших количествах.
Сигналы на экспорт белков из ЭПР обычно представляют собой короткие последовательности аминокислот, расположенные в цитоплазматическом участке молекулы мембранных белков. Из всех сигналов сортировки белков сигналы экспорта из ЭПР охарактеризованы наименее полно. Одним из примеров является последовательность, состоящая преимущественно из дикарбоновых аминокислот, присутствующая, например, в VSV G белке — гликопротеине оболочки вируса везикулярного стоматита, который широко использовался в исследованиях по биогенезу плазматической мембраны.
Наличие экспортного дикарбонового сигнала увеличивает эффективность экспорта белков из ЭПР, поскольку он связывается с компонентом Sec24 окаймляющего комплекса COPII.
Экспорт мутантного VSV G белка, в котором этот сигнал отсутствует, происходит в 2-3 раза медленнее, чем экспорт белка дикого типа.
Другим примером сигнала экспорта из ЭПР служит трансмембранный белок ERGIC-53 (ER, Golgi, белок промежуточного компартмента, с мол. массой 53 кДа). Предполагается, что этот белок переносит растворимые гликопротеины из ЭПР в аппарат Гольджи. Цитоплазматический участок молекулы белка содержит сигнал, представленный двумя остатками фенилаланина, который взаимодействует с компонентом Sec23/24 комплекса COPII. Существование этого сигнала необходимо для того, чтобы ERGIC-53 мог выйти из ЭПР.
Растворимые белки карго также могут использовать сигналы экспорта, однако непосредственно с ними не связываются. Вместо этого они связываются с рецепторами, которые находятся на COPII везикулах. Такой сигнал содержат растворимые белки, которые переносятся ERGIC-53 от ЭПР в аппарат Гольджи. Домен ERGIC-53, расположенный со стороны люмена, связывается с этими белками через богатые маннозой олигосахариды, которые находятся в большинстве гликопротеинов, выходящих из ЭПР. Однако, поскольку ERGIC-53 не связывает все гликопротеиды с повышенным содержанием маннозы, сигнал содержит и другие компоненты.
У больных с дефицитом белка ERGIC-53 развивается повышенная кровоточивость, связанная с пониженным содержанием факторов свертывания крови V и VIII. Или ERGIC-53 способен лишь к ограниченному транспорту других белков, или иные белки каким-то образом компенсируют его отсутствие.
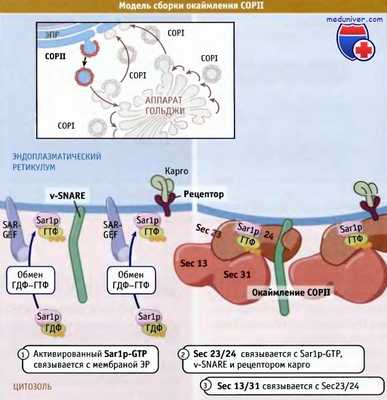
Модель, описывающая последовательность этапов сборки COPII везикул,
с участием белков окаймления и молекул карго (v-SNARE и рецептор карго).
Еще один пример растворимого белка, который экспортируется из ЭПР под действием сигнала, представляет собой а-фактор — гликопротеин, секретируемый дрожжами S. cerevisiae и обеспечивающий их конъюгацию. Недавно идентифицирован белковый рецептор, пронизывающий мембрану, который концентрирует а-фактор в везикулах COPII.
Другой путь включения белков карго в COPII везикулы состоит в использовании белка упаковки, который сам в везикулу не поступает. Например, в плазматической мембране дрожжей содержится пермеаза аминокислот. Новосинтезированные пермеазы транспортируются по экзоцитозному пути к клеточной поверхности. Включение этих пермеаз в COPII везикулы ЭПР требует присутствия упаковочного белка (Shr3p), хотя механизм его действия неизвестен. Так же как и экспортные сигналы, упаковочные белки, по-видимо-му, лишь увеличивают эффективность процессов экспорта из ЭПР, хотя сами по себе не являются для них абсолютно необходимыми.
Компоненты транспортного механизма, такие как белки SNARE, которые обеспечивают причаливание и слияние везикул с мембранами, должны также включаться в везикулы. Каким образом SNARE, которые являются интегральными мембранными белками, включаются в везикулы COPII? Два белка из группы SNARE, участвующие в транспортных процессах из ЭПР в аппарат Гольджи (Betlp и Bos1p), связываются с мембранными формами Sar1p и Sec23/24. Это приводит к активации белка Sec 13/31, что свидетельствует о том, что белки SNARE включаются в механизм на стадии образования везикулы.
Одно из предположений заключается в том, что при образовании везикулы SNARE играют роль затравки и таким образом гарантируют наличие сигналов адресования во всех образующихся везикулах СОРИ. Однако данные, подтверждающие это заманчивое предположение, отсутствуют.
После отшнуровывания от ЭПР везикула COPII мигрирует в аппарат Гольджи, где происходит слияние. Везикулы COPII формируют кластеры и, возможно, сливаются друг с другом в экспортных сайтах ЭПР (образование «везикулярно-тубулярных кластеров» (VTC). Когда везикулы COPII образуются на экспортных сайтах, удаленных от аппарата Гольджи, VTC могут перемещаться до места назначения вдоль микротрубочек. Таким образом, пространственное расположение (близость ЭПР к аппарату Гольджи) и транспорт вдоль микротрубочек сказываются на эффективности, с которой везикулы COPII находят свое окончательное местоположение.
У почкующихся дрожжей ЭПР не обладает отдельными экспортными сайтами, и везикулы COPII могут образовываться в любом месте ЭПР. В отличие от клеток млекопитающих цистерны аппарата Гольджи находятся в цитоплазме, в основном в виде отдельных дисков. Таким образом, в почкующихся дрожжах везикулы COPII могут просто выбирать кратчайшее расстояние между сайтом своего образования в ЭПР и первой ближайшей цистерной.
Белки карго включаются в образующиеся COPII-везикулы по разным механизмам. Сигнал экспорта из ЭПР включает последовательности,
содержащие остатки дикарбоновых аминокислот или два остатка фенилаланина.
• Поэтапная сборка клатриновых трискелионов может представлять собой механический способ преобразования мембран в окаймленные ямки
• Различные адапторные комплексы позволяют отбирать карго для транспорта при связывании как с сигналами сортировки, так и с клатриновыми трискелионами
• ГТФазы из группы динаминов способствуют высвобождению окаймленных везикул из мембраны
• Специальные АТФазы удаляют клатриновое окаймление до начала этапов причаливания и слияния везикул
Эндоцитоз является основным путем, посредством которого в клетку попадают внеклеточные макромолекулы и белки плазматической мембраны. Эндоцитоз и различные его формы представляют собой еще один способ мембранного транспорта, при котором образование транспортных везикул происходит в местах инвагинации плазматической мембраны. По направленности эндоцитоз противоположен общей схеме образования секреторных везикул из мембран ор-ганелл, но в остальном от нее не отличается.
К наиболее изученному механизму эндоцитоза относится протекающий с участием транспортных везикул, покрытых белком клатрином и одним или несколькими адаптерными комплексами, связывающими клатрин с мембраной. Эти адаптеры также участвуют в отборе карго для включения его в образующиеся везикулы, участвующие в эндоцитозе. Клатрин и белки адаптерного комплекса поступают в образующиеся везикулы из цитозоля.
Молекулы карго, находящиеся в клатриновых везикулах, которые образуются на плазматической мембране, часто представляют собой рецепторы внеклеточных лигандов, предназначенные для быстрого проникновения их в клетку. Фактически селективный захват рецепторов клатриновыми везикулами являлся первым примером отбора карго в процессе мембранного транспорта. Клатри-новые везикулы также участвуют в транспортных процессах через транс-Гольджи сеть; эти везикулы имеют другие адаптеры и несут другие белки карго, чем те, которые участвуют в эндоцитозе.
Впервые окаймленные ямки и везикулы были обнаружены при электронно-микроскопическом исследовании ооцитов комаров в начале 1960-х годов. Ооциты захватывают и хранят желточные гранулы, необходимые для дальнейшего эмбриогенеза, и скорость захвата так высока, что большая часть поверхности ооцита содержит ямки, покрытые клатрином.
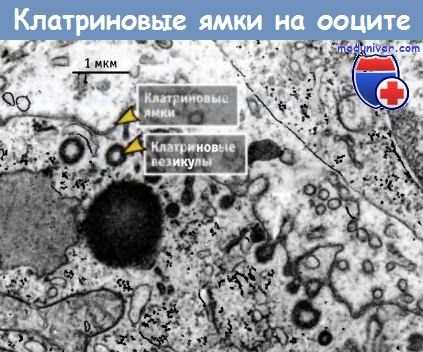
Фотография клатриновых ямок и везикул,
расположенных на поверхности ооцита, сделанная с помощью трансмиссионного электронного микроскопа.
В начале 1970-х годов была выяснена структура окаймляющего слоя. Это было сделано на синапсах нейронов при рециклизации синаптических пузырьков пресинаптических мембран, используя метод замораживания-замещения. Окаймление выглядит в виде переплетенной сети белковых волокон.
Благодаря такой структуре, окаймление получило название клатрин (лат. clatbratus — защищенный решеткой).
Впервые клатриновые везикулы были выделены из ткани головного мозга в 1969 г., и позже был показано, что клатриновое покрытие состоит в основном из двух белков, тяжелой (180 кДа) и легкой (30 кДа) цепей клатрина, представленных в эквимолярном количестве. Исследования в электронном микроскопе показали, что клатриновые белки образуют трехногую фигуру, называемую трискелион. Каждая «нога» трискелиона включает по одной тяжелой и легкой цепи клатрина. Проксимальный участок ноги расположен ближе к вершине трискелиона и представляет собой место присоединения легких цепей. Дистальный участок располагается дальше от вершины и состоит из тяжелой цепи.
Хотя in vivo клатриновое покрытие мембран может собираться с участием других белков, in vitro клатрин обнаруживает замечательную способность к самосборке в решетчатые структуры. При инкубации выделенных трискелионов в среде с определенным значением pH и солевым составом, они спонтанно образуют пустую клатриновую сетку, которая выглядит так же, как и покрытие, окружающее мембрану in vivo. Сборка клатриновых решеток из очищенных препаратов легких и тяжелых цепей показывает, что трискелион образует гексагональные и пентагональные структуры, представленные на рис. 4.36. Эти структуры образуют сетки, которые напоминают покрытие везикул in vivo.
Таким образом, для образования решетчатой структуры необходимо и достаточно наличие тяжелых и легких цепей клатрина. Каждая вершина представляет собой узел одного трискелиона, а каждая сторона Пентагона или гексагона состоит из четырех ног, принадлежащих различным трискелионам.
Электронные микрофотографии структур,
окаймленных клатрином, находящихся на плазматической мембране.
Клатриновые сетки имеют различную кривизну.
На каждой фотографии изображена разная сетка.
Геометрически структура выглядит так, что гексагональные клатриновые решетки являются плоскими, но образование пентагонов вызывает изгиб необходимый для формирования сетки. Однако вся последовательность событий, приводящих к образованию полностью изогнутых и окаймленных ямок, in vivo остается неизвестной. Согласно одной из предложенных моделей, часть гексагонов в плоскости каким-то образом меняет структуру и образует пентагоны, что приводит к возникновению кривизны. Другая модель предполагает, что необходимая кривизна мембраны обеспечивается белками, отличными от клатрина, и эта кривизна «фиксируется» образованием пентагонов.
Для сборки клатриновых сеток источники энергии не требуются. Поэтому предполагают, что при сборке происходит изменение свободной энергии, способствующее инвагинации мембраны и образованию везикулы. Однако в деформации плазматической мембраны до образования окаймленной везикулы ключевую роль также играют адаптерные комплексы.
Клатриновое покрытие непосредственно не взаимодействует с мембраной или с мембранными белками. Как показано на рисунке ниже, различные адапторные комплексы являются посредниками между клатриновыми субъединицами и сигналами сортировки, расположенными в цитоплазматическом участке молекул белков карго. На разных этапах транспорта разные адаптеры выбирают трансмембранные белки.
Для завершения эндоцитоза отпочковывающиеся клатриновые везикулы должны отшнуроваться от плазматической мембраны. Процесс отшнуровки требует энергетических затрат и происходит с участием ГТФазы, называемой динамин, которая была впервые обнаружена в клетках мутанта Drosophila shibire. Эти мухи не способны летать при непермиссивной температуре. В клетках мутанта при непермиссивной температуре окаймленные ямки в синапсах нейронов соединены с длинными перемычками и не отшнурованы от плазматической мембраны.
Такие структуры не обнаруживались при пермиссивной температуре. Эти наблюдения позволили предположить, что фентотип shibire-мутанта обусловлен неспособностью компонентов синаптического пузырька передаваться через плазматическую мембрану, тем самым блокируя передачу нервного импульса. Мутация shibire вызвана дефектом динамина. В присутствии негидролизуемого ГТФ аналога очищенный динамин клеток млекопитающих in vitro образует на плазматической мембране эти длинные перемычки.
Так называемые «воротнички» представляют собой по сравнению с shibire небольшие по размеру структуры, состоящие из динамина, которые располагаются вокруг перемычек нормальных клатриновых ямок. Динамин поступает из цитоплазмы, группируясь вокруг перемычки отпочковывающейся окаймленной везикулы в виде спирали с тем, чтобы помочь отшнуровке клатриновых ямок от плазматической мембраны.
Однако механизм отшнуровки неизвестен. Согласно одному представлению, при гидролизе ГТФ эти спиральные структуры сжимаются, тем самым обеспечивая слияние мембраны, необходимое для высвобождения новых клатриновых пузырьков. Другая модель предполагает, что динамин косвенным образом способствует отшнуровке, по-видимому, привлекая другие молекулы или изменяя конформацию окаймленной ямки в сторону образования везикулы. Какова бы ни была причина, очевидно, что динамин является основным компонентом процесса высвобождения клатриновых везикул из плазматических мембран, и вероятно, также из транс-Гольджи сети.
После отделения от мембраны клатриновые везикулы взаимодействуют с элементами актинового цитоскелета, что способствует продвижению везикул по цитозолю. Вновь образованные везикулы могут служить местами сборки актиновых филаментов, обеспечивающих это продвижение. Хотя еще остается выяснить, насколько такое движение необходимо, очевидно, что многие «дополнительные белки», которые участвуют в образовании клатриновых ямок, в частности динамин, могут нуклеи-ровать сборку актина.
После образования клатриновой везикулы окаймление удаляется с тем, чтобы обеспечить везикуле возможность позиционироваться на следующем компарт-менте, ранней эндосоме. В удалении клатрина участвуют по крайней мере два белка, «раздевающая АТФаза», которая является цитозольным ферментом из группы белков теплового шока, Hsp70, и ауксилин, белок, взаимодействующий с этой АТФазой. Точный механизм удаления окаймления неизвестен, однако, вероятно, он включает в себя дестабилизацию и отделение клатринового слоя после присоединения Hsp70.
Такой механизм согласуется со способностью этих АТФаз, участвующих в качестве шаперонов при синтезе и деградации молекул белка, связываться со структурами высшего порядка и вызывать их дестабилизацию. Определенную роль в отделении окаймления, особенно при высвобождении адапторных комплексов, может играть гидролиз кислых фосфолипидов.
Кпатриновые трискелионы собраны в замкнутые корзиноподобные структуры.
Эти структуры могут образовывать сеть, состоящую из многоугольников пентагонального и гексагонального типа,
и, таким образом, генерируются замкнутые корзиноподобные структуры.
Для простоты на нижнем правом рисунке легкие цепи не показаны. Клатрин связывается с адаптерами,
которые узнают сигнал сортировки, расположенный на цитоплазматическом участке предназначенных для транспорта белков. Электронная микрофотография клатриновых ямок в клетках мутанта дрозофилы, дефектных по динамину.
Мутантные мухи не были способны летать при непермиссивной температуре 30 °С.
Видны канальцы, распространяющиеся от клеточной поверхности и заканчивающиеся клатрин-окаймленными утолщениями.
Эти утолщения не могут отшнуровываться, поскольку динаминовые мутанты не способны нормально функционировать при непермиссивной температуре. Динамин может образовывать спиральные структуры вокруг перетяжки (шейки)
отпочковывающейся везикулы, которые вызывают ее отшнуровку. В удалении клатринового окаймления везикул участвуют два белка: Hsp70 и ауксилин.
Клатрин-зависимый тип эндоцитоза.
зависимый) эндоцитоз (Receptor-mediated endocytosis). Главной особенностью этого типа эндоцитоза является интернализация лиганд-рецепторных комплексов. Одна из функций плазматической мембраны – прием информации в виде молекулярных сигналов извне и ее передача в клетку по строго определенному адресу. Прежде всего, речь идет о передаче регуляторных сигналов, в частности, гормональных, однако в клетку поступает и другая многообразная «молекулярная» информация. В клетке существуют разные механизмы передачи сигналов, обеспечивающие адресную доставку молекулярного сигнала, сортировку сигнальных молекул, и клатрин-зависимый тип эндоцитоза занимает важное место в этих процессах.
Клатрин-зависимый эндоцитоз хорошо визуализируется в электронном микроскопе, благодаря наличию «зубчиков» клатрина на цитоплазматической стороне плазмалеммы, участвующей в эндоцитозе. Клатрин придает эндоцитозным структурам «опушенный» вид.
В процессе клатрин-зависимого эндоцитоза выделяют следующие стадии:
Распознавание белковой молекулы (лиганда) рецептором;
Формирование лиганд-рецепторного комплекса;
Образование «опушенной» ямки (coated pit);
Образование «опушенного» пузырька (coated vesicle);
Отделение опушенного пузырька от плазмалеммы;
Формирование эндоцитозного пузырька;
Перенос лиганд-рецепторного комплекса в раннюю эндосому;
Процессинг лиганд-рецепторного комплекса, сортировка.
Клатрин – фибриллярный белок цитозоля, состоящий из трех ветвей, расположенных под определенным углом друг к другу, и способный к самосборке с формированием корзинковидных структур. Формирование лиганд-рецепторного комплекса на поверхности плазмалеммы является сигналом к полимеризации клатрина, в результате которой происходит искривление плазматической мембраны и формирование «опушенной» ямки и «опушенного» пузырька. После отделения пузырька клатриновая корзинка деполимеризуется, пузырек становится «гладким». Эндоцитозный пузырек мигрирует от плазмалеммы в цитоплазму и сливается с ранней эндосомой. Таким образом, клатриновые пузырьки в процессе эндоцитоза переносят участки плазмалеммы в цитоплазму, где они сливаются с мембраной ранних эндосом. Кроме интернализации макромолекул, в процессе клатрин-зависмого эндоцитоза осуществляется обновление плазматической мембраны.
Клатрин не может сам связываться с мембраной и с лигандами, для этого нужны белки-адаптеры. Известно около 20 форм белков-адаптеров клатрина. Кроме клатрина и белков-адаптеров, в клатрин-зависимом эндоцитозе участвует актин, хотя его роль не всегда очевидна.
Отделение «опушенного» пузырька от мембраны обеспечивается динамином, 100-кДа ГТФазой, имеющей в клетках млекопитающих 3 изоформы (динамин-1, -2 и -3). Динамин-3 наиболее распространен.
Ранняя эндосома – конечная точка транспорта макромолекул и место, где начинает реализовываться их «программа». Ранние эндосомы существуют в клетке, и являются частью эндосомально-лизосомальной системы. Назначение ранних эндосом в клатрин-зависимом эндоцитозе – диссоциация лиганд-рецепторного комплекса и сортировка рецепторов, которая обеспечивается кислым рН. В ранней эндосоме нет гидролаз. Маркеры ранних эндосом:
Early Endosome Associated Protein (EEA-1)
Клатрин-зависимый эндоцитоз обеспечивает проникновение в клетку многих белковых гормонов, используется вирусами. Этот тип эндоцитоза намного лучше изучен, чем все остальные разновидности эндоцитоза, и поэтому создается ложное впечатление, что тот путь обеспечивает основную долю эндоцитируемого материала. На самом деле, в зависимости от типа клеток, примерно половина – клатрин-зависимый эндоцитоз, и половина – клатрин-незвисимый.
Механизмы, регулирующие формирование эндоцитозных пузырьков и интернализацию связавшихся с поверхностью клетки молекул и несвязанных, находящихся в просвете пузырьков, варьируют в зависимости от типа молекулы и типа клеток. Картина усложняется наличием разных путей эндоцитоза в одной клетке и неспецифичностью связывания некоторых молекул. Одним из ключевых является вопрос: захватывает ли уже существующий пузырек молекулы, или их связывание с поверхностью клетки индуцирует формирование пузырька?
В случае клатрин-зависимого эндоцитоза это определяется типом захватываемой молекулы (лиганда). Ряд лигандов индуцирует формирование новых «опушенных» ямок (рецептор фактора роста эпидермиса, различные патогены). Другие лиганды стабилизируют существующие ямки и используют их для интернализации (рецептор трансферрина, рецептор липопротеинов низкой плотности). Первый вариант – конституитивный эндоцитоз, второй – лиганд-индуцированный.
Клатрин-зависимый эндоцитоз – очень эффективный сортировочный механизм, опушенные ямки могут накапливать на порядок больше рецепторов, чем находится на ровной поверхности клетки.
Кавеолы – специальный тип липидных рафтов, являются инвагинациями липидного бислоя плазмалеммы. Они вовлечены в большой набор клеточных процессов, включая передачу сигналов, эндоцитоз, трансцитоз и транспорт холестерола. Кавеолы есть не во всех типах клеток. Так, их много в клетках эндотелия, жировых и мышечных клетках – они могут занимать до 35% клеточной поверхности. В то же время они не обнаружены в нейронах и лимфоцитах. Кавеолы могут располагаться как по всей поверхности клетки, так и на одной из поверхностей (в эпителии), могут образовывать цепочки и кластеры (розетки), везикуло-вакуолярные органеллы. В эндотелии кавеолы могут образовывать каналы, проходящие через клетку.
Существуют две формы кавеол: мелкие и глубокие.
Формирование кавеол обеспечивается белками кавеолинами, которые деформируют фосфолипидный бислой, взаимодействуя с холестеролом. Кавеолин-1 – интегральный белок плазмалеммы с центральным гидрофобным доменом, формирующим петлю. Оба конца, и N, и C выходят в цитоплазму, т.е., кавеолин-1 имеет топологию шпильки (hairpin). Кавеолин-1 – основной формообразующий белок кавеол, он формирует «скелет» кавеолы вместе с другими формами кавеолина. «Скелет» определяет форму кавеол, размеры и многие их свойства. Недавно открытые белки кавины формируют наружный периферический слой, имеют форму крупных гетероолигомерных комплексов, покрывающих изогнутую мембрану кавеолы. Полагают, что кавины стабилизируют «скелет» кавеолы, обеспечивают изгиб мембраны, участвуют в почковании кавеолы.
Генетический анализ показал высокую консервативность кавеолинов. На мышах показано, что нарушение экспрессии кавеолина-1 связано с развитием рака, диабета, сосудистых и урогенитальных аномалий, болезней глаз, легких, мышечной дистрофии и кардиомиопатии.
Кавеолы стабильны и долго существуют в мембране, а кавеолины – исключительно долгоживущие белки. В отличие от «клатриновых» пузырьков, кавеолы не сбрасывают свое кавеолиновое «покрытие» при отшнуровке и попадании в цитоплазму.
Кавеолы имеют четкую спиральную исчерченность на цитозольной стороне, в отличие от зубчиков клатрина на поверхности «опушенных» пузырьков. Остальные типы пузырьков имеют гладкую поверхность и этим отличаются от кавеол и «опушенных» пузырьков.
Факт, что липидные рафты могут формироваться в мембранах цитоплазматических структур, в частности, в АГ, предполагает возможный механизм биогенеза кавеол. Синтез кавеолина происходит на мембранах ЭПР, молекулы закрепляются «крючком» через внутренний листок мембраны ЭПР. Вскоре после синтеза мономеры кавеолина олигомеризуются в гептамеры, которые фосфорилируются, чтобы предупредить преждевременную сборку. Фосфорилированные олигомеры переносятся посредством COPII-пузырьков в АГ, где дефосфорилируются. Гипотетически холестерол встраивается в участки мембраны, в которые встроен кавеолин, и тогда эти участки, содержащие гептамеры кавеолина и холестреол, изгибают мембрану и формируют фрагмент рафта кавеол. Именно асимметрично встроенный в мембрану кавеолин обеспечивает создание изгибающего момента и задает в конечном счете форму кавеол. Т.е., липидные рафты, обогащенные кавеолином, образуются на мембранах АГ, затем транспортируются к плазмалемме, где они сливаются, накапливаются и формируют кавеолу «привычной» формы. Перенос кавеолинового «скелета» к плазмалемме происходит путем специального пузырькового транспортного пути.
Кавеолин-зависимый эндоцитоз
Гипотеза о существовании клатрин-независимого эндоцитоза появилась лишь в начале 1990-х, до этого времени всё прекрасно объяснялось клатрин-зависимым эндоцитозом. Предположение о связи кавеол с эндоцитозом появилось после открытия связи динамина с кавеолами – уже было известно, что динамин обеспечивает «отшнуровку» «опушенного» пузырька при клатрин-зависимом эндоцитозе. Соответственно, динамин может «отшнуровывать» и кавеолу. Постепенно накопились разные данные о существовании эндоцитоза посредством кавеол.
Обычно кавеолы – стационарные структуры плазмалеммы, их интернализация не происходит даже при сильных воздействиях специфических лигандов. Это не исключает возможность воздействия на кавеолы какими-то путями, однако их надо показать.
Отшнуровка кавеол и их перемещение считаются установленным механизмом, хотя детальных картинок не опубликовано. Вместе с тем, считается, что есть и механизм «kiss-and-run», когда «бегающая» кавеола получает «что-то» и переносит из стационарной.
Кавеосомы, ранее считавшиеся «специальными эндосомами» для кавеолин-зависимого эндоцитоза, оказались глубокими инвагинациями плазмалеммы с кавеолами. Это было показано ЭМ с использованием метки рутениевым красным. Мембраны этих структур содержат много кавеолинов, что дает основание полагать, что они образуются при гиперэкспрессии кавеолина, или его мутантных форм. Опубликованы также данные, что кавеосомы являются частью эндосомо-лизосомальных структур. Предлагается термин «кавеосома» впредь не использовать.
Полагают, что из кавеол лиганды попадают в раннюю эндосому, однако точный механизм этого процесса не установлен. Очевидно, что имеет место пузырьковый транспорт.
Кавеолы и их кластеры обеспечивают эндоцитоз ряда белков и многих патогенов, включая вирусы, бактерии, грибы, прионы.
Клатрин- и кавеолин-независимый (рафт-зависимый эндоцитоз)
По мере накопления знаний о механизмах эндоцитоза становилось очевидно, что существуют четко различающиеся варианты эндоцитоза, помимо клатрин- и кавеолин-зависимого, обеспечивающие интернализацию микродоменов плазмалеммы.
Клатрин- и кавеолин-независимый, GPI-связанный эндоцитоз.
Эндоцитоз этого типа также обеспечивает интернализацию микродоменов, и протекает в клетках при блокировании клатрин-зависимого и кавеолин-1 зависимого эндоцитоза. Этот вариант эндоцитоза зависит от наличия холестерола, т.е., представляет собой разновидность эндоцитоза, зависящую от определенной композиции липидов в мембране (рафт-зависимый эндоцитоз). Показано, что данная разновидность эндоцитоза, в частности, обеспечивает интернализацию внеклеточной жидкости, вируса SV40, холерного токсина, некоторых сфинголипидов, рецепторов интерлейкина-2, гормона роста, эндотелина и многих других белков. Все эти белки связываются с плазматической мембраной посредством трансмембранных белков, имеющих гликозилфосфатидилинозитоловый якорь (glycosylphosphatidylinositol anchor) - GPI-linked proteins. Эти заякоренные связывающие белки локализуются в детергент-устойчивых областях плазмалеммы и не содержатся в области клатриновых пузырьков и кавеол. Лиганды, интернализуемые путем данного эндоцитоза, также попадают в эндосому, однако динамика этого процесса отличается от таковой при других типах эндоцитоза.
Морфологически этот вариант эндоцитоза выглядит как интернализация трубочек или кольцеобразных структур.
Механизмы всех вариантов этого типа эндоцитоза точно не установлены, постоянно появляются новые данные. Некоторые авторы различают типы эндоцитоза по участию в них динамина.
Эндоцитоз рецептора интерлейкина 2β - морфологически – везикулы, но обсуждается и вариант трубочек. Интернализация не только рецептора интерлейкина 2β, но и ряда других рецепторов цитокинов.
Arf6 –зависимый эндоцитоз. Морфология: везикулы и/или трубочки. Интернализация белков главного комплекса гистосовместимости класса 1, CD59, карбоксипептидазы Е.
ARF6 - ADP-ribosylation factor 6 (фактор 6 рибозилоирования) – фактор рибозилирования АДФ семейства ГТФ-связывающих белков (a member of the ADP ribosylation factor family of GTP-binding proteins).
ARF6 имеет в клетке много функций, связанных с трафиком мембран и трансмембранных белков.
Читайте также:
- Кохлео-вестибулярные стрептомициновые нарушения. Стрептомициновая интоксикация уха
- Признаки сочетания грибка ногтей и псориаза
- Рецепторы гормонов. Количество и чувствительность рецепторов гормонов
- Проявления лихорадки Эбола. Диагностика тропических лихорадок
- Лучевая диагностика очавого сливного фиброза печени
