Введение в заболевания почечных канальцев
Добавил пользователь Валентин П. Обновлено: 21.01.2026
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Почечная недостаточность: причины появления, симптомы, диагностика и способы лечения.
Определение
Почечная недостаточность — состояние, при котором одна или обе почки не могут в полном объеме выполнять свои функции. Это происходит в результате какого-либо заболевания, когда почки перестают полноценно фильтровать кровь. Вещества, которые должны выводиться из организма, попадают обратно в кровоток. Нарушение функций почек может быть связано с уменьшением кровотока через них и резким снижением снабжения кислородом.
Основная функция почек – выделительная, то есть очищение организма от шлаков и токсинов, при этом почки отвечают за максимальную сохранность полезных веществ.
Почки принимают участие в фосфорно-кальциевом обмене и формировании костной ткани путем выработки кальцитриола (активной формы витамина D), поэтому у детей почечная недостаточность негативно влияет на рост костей и их аномальное развитие, а у взрослых может вызывать хрупкость.
Почки регулируют артериальное давление, поэтому почечная недостаточность приводит к его повышению.
Почки участвуют в образовании красных кровяных телец крови – эритроцитов. При почечной недостаточности снижается количество эритроцитов, развивается анемия.
Почки осуществляют регуляцию количества воды и солей – поддержание водно-солевого баланса.
Причины появления почечной недостаточности
Существует множество причин развития почечной недостаточности. Одни приводят к быстрому ухудшению функции почек, чаще всего ишемического или токсического генеза (острое повреждение почек, или острая почечная недостаточность). Другие - к постепенному ухудшению функции почек (хронической болезни почек, или хронической почечной недостаточности). Помимо неспособности почечной ткани фильтровать из крови метаболические продукты жизнедеятельности организма (в частности, креатинин и азот мочевины), снижается способность почек контролировать количество и распределение воды в организме (баланс жидкости) и уровень электролитов в крови.
Острое повреждение почек представляет собой внезапное снижение их функции в течение нескольких дней или недель, вызывающее накопление азотистых соединений в крови (азотемию).
Причины почечной недостаточности при острой форме заболевания:
- острые нарушения почечной гемодинамики (коллапс, шок);
- интоксикации различного генеза (лекарственные, укусы насекомых и змей, бытовые яды);
- острое инфекционное поражение почки;
- острые воспалительные заболевания почек (пиелонефрит, острый гломерулонефрит);
- травма почки или другого органа с большой потерей крови;
- непроходимость мочевыводящих путей;
- удаление почки.
- почечные заболевания — хронический пиелонефрит и гломерулонефрит;
- болезни обмена веществ: амилоидоз, подагра, сахарный диабет;
- врожденные почечные заболевания: сужения почечных артерий, недоразвитие почек, поликистоз;
- ревматические заболевания: геморрагические васкулиты, склеродермия, системная красная волчанка;
- серьезные нарушения работы сердечно-сосудистой системы: артериальная гипертония и болезни, приводящие к значительным изменениям в почечном кровотоке (сердечная недостаточность, нарушение ритма);
- заболевания, которые становятся причиной проблем с оттоком мочи.
Хотя снижение функции почек возможно в любом возрасте, хроническая почечная недостаточность и острое повреждение почек чаще возникают у пожилых людей. Многие заболевания, вызывающие ухудшение функции почек, поддаются лечению, в результате которого функция почек восстанавливается. Благодаря доступности диализа и трансплантации почки почечная недостаточность стала не смертельным, а управляемым заболеванием.
Классификация заболевания
В Международную классификацию болезней (МКБ) 10 были внесены изменения, касающиеся замены устаревшего термина «хроническая почечная недостаточность» на термин «хроническая болезнь почек» (код N18).
Современная классификация основана на двух показателях — скорости клубочковой фильтрации и признаках почечного повреждения (протеинурии, альбуминурии). В зависимости от их сочетания выделяют пять стадий хронической болезни почек.
Непосредственными причинами острой почечной недостаточности (код N17) являются низкая объемная скорость кровотока, острая деструкция клубочка с потерей приносящих и выносящих артерий и клубочковых капилляров, повреждение канальцев нефронов или нарушение оттока мочи от почки из-за обструкции. В зависимости от этого различают три формы острой почечной недостаточности:
- преренальную (70%),
- паренхиматозную (25%),
- обструктивную (5%).
У почечной недостаточности есть следующие основные признаки:
- уменьшение количества выделяемой мочи, расстройство мочеиспускания (олигоурия, дизурия);
- отеки;
- общая заторможенность, сонливость;
- тошнота, рвота, снижение аппетита;
- тахикардия, повышение артериального давления;
- вздутие живота, жидкий стул.
Часто доминирующими симптомами острой почечной недостаточности являются проявления основного заболевания или симптомы, вызванные хирургическими осложнениями операции, которая привела к нарушению функции почек.
Для хронической почечной недостаточности характерно малосимптомное начало заболевания. На этом этапе больные часто не предъявляют жалоб, в крайнем случае, говорят о повышенной утомляемости при умеренной физической нагрузке, а также о сухости во рту и слабости, проявляющейся ближе к вечеру. Далее обращают на себя внимание бледная кожа и дряблые мышцы, которые утрачивают тонус. Исходя из результатов биохимического анализа крови, больным часто сообщают о наличии белка в моче и незначительных сдвигах в электролитном составе крови.
Выраженность симптомов зависит от стадии хронической болезни почек. Заболевание имеет волнообразное течение: состояние пациента то улучшается, то снова ухудшается.
Чрезвычайно опасной является терминальная стадия хронической болезни почек, когда у пациента нарушаются эмоциональные реакции (апатия резко переходит в возбуждение, нарушается ночной сон, появляются признаки заторможенности). Появляется аммиачный запах изо рта, отеки, лицо приобретает одутловатость, желтоватую окраску, на коже видны следы расчесов, волосы становятся тусклыми, ломкими, усиливается дистрофия. Нарастают симптомы уремической интоксикации: асцит, плеврит, перикардит, уремическая кома. Нередко возникает тяжелая артериальная гипертензия.
Диагностика почечной недостаточности
Для диагностики почечной недостаточности назначают следующие обследования:
- общий (клинический) анализ крови;
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий.
Метод определения Определение физико-химических параметров выполняется на автоматическом анализаторе методом «сухой химии». Аппаратная микроскоп.
Метод определения клубочковой фильтрации (эффективного почечного кровотока). Клиренс эндогенного креатинина относится к геморенальным проб�.
Комплексное ультразвуковое сканирование органов мочевыделительной системы, позволяющее обнаружить патологию на ранних стадиях развития.
Исследование, позволяющее получить данные о состоянии органов малого таза, выявить патологические изменения и опухоли.
Метод оценки состояния мочевыделительной системы с помощью компьютерной томографии.
К каким врачам обращаться
При обнаружении признаков заболевания следует обратиться к врачу-урологу или нефрологу. Лечение детей зависит от стадии заболевания и тяжести симптомов. Легкие формы заболевания контролирует врач-педиатр . В более тяжелых случаях потребуется помощь детского нефролога.
Лечение почечной недостаточности
Современная медицина может компенсировать последствия хронической почечной недостаточности, позволяя людям жить активной жизнью, несмотря на то, что жизненно важный орган больше не выполняет свои функции. Однако до сих пор нет возможности полностью вылечить это заболевание.
Основная цель всех врачебных манипуляций – устранение причины, вызывающей данное патологическое состояние. Для этого в повседневной медицинской практике используют привычные способы устранения интоксикации, гемолиза, обезвоживания и шока.
При острой почечной недостаточности больного необходимо срочно поместить в стационар, где лечение должно вестись по двум направлениям: устранение причин, вызвавших почечную недостаточность (например, большой кровопотери), и восстановление функций почек.
Лечение хронической почечной недостаточности направлено на замедление прогрессирования заболевания и коррекцию осложнений. В консервативной терапии используют препараты, улучшающие микроциркуляцию, обладающие нефропротективным действием. Для коррекции водно-электролитных нарушений, анемии индивидуально подбирается диета, режим инфузионной и трансфузионной терапии, препараты рекомбинантного эритропоэтина. Обычно необходимо назначение витамина D для улучшения костного обмена, а также солей кальция, которые связывают избыток фосфатов в крови. При почечной недостаточности на фоне сахарного диабета нужно постоянно следить за уровнем сахара, соблюдать строгую диету. При проблемах с давлением необходимо регулировать его уровень. Для стимуляции выделения мочи применяют диуретики.
Основными способами лечения почечной недостаточности повсеместно признаны диализ и трансплантация почки. Наиболее полное замещение почечной функции происходит в результате успешной трансплантации почки, а диализ замещает ее лишь частично. Во время гемодиализа происходит удаление из организма токсических продуктов обмена веществ для уменьшения биохимических аномалий, нормализации нарушений водного, электролитного баланса и кислотно-щелочного равновесия. Очищение крови производится путем снижения концентрации в ней вредных веществ.
Осложнения острой почечной недостаточности представляют угрозу жизни и здоровью пациента. Патология сопровождается сепсисом, солевой и водной сверхнагрузкой, изменениями в крови, нарушениями в мочевыводящих путях, сердечно-сосудистой и дыхательной системах.
Тяжелая форма патологии дополняется развитием уремического гастроэнтероколита, сопровождающегося кровотечением.
У пациентов с хронической формой заболевания могут развиваться различные осложнения, которые отражают нарушение эндокринной или экзокринной функции почек, - анемия, нарушение метаболизма костной ткани, ацидоз, повышенный риск развития сердечно-сосудистых заболеваний и заболевание периферических артерий.
Профилактика почечной недостаточности
Профилактика почечной недостаточности основывается на предотвращении причин, которые вызывают данную патологию. Особенно важно вовремя начать борьбу с такими заболеваниями как пиелонефрит, мочекаменная болезнь, гломерулонефрит.
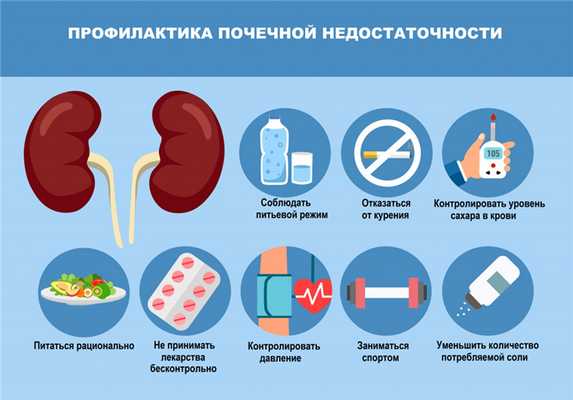
Важным направлением профилактики и лечения почечной недостаточности является коррекция образа жизни и характера питания с целью наиболее полного воздействия на модифицируемые факторы риска развития и прогрессирования заболевания:
- коррекция массы тела при ожирении за счет изменения калорийности рациона, достаточной физической активности и ограничения поваренной соли в пище;
- ограничение потребления алкоголя и исключение курения;
- санация хронических очагов инфекции;
- предупреждение лекарственной нефротоксичности – широкое информирование пациентов о вреде самолечения, отказ от бесконтрольного приема анальгетиков, антибиотиков, пищевых добавок и др.
- Клинические рекомендации. Хроническая болезнь почек (ХБП). Ассоциация нефрологов, 2021. – 233 с.
- Клинические рекомендации. Острое повреждение почек (ОПП). Ассоциация нефрологов, Научное общество нефрологов России, Ассоциация анестезиологов-реаниматологов России, Национальное общество специалистов в области гемафереза и экстракорпоральной гемокорреции, 2020. – 142 с.
- Kidney Disease: Improving Global Outcomes (KDIGO), KDIGO clinical practice guideline for the evaluation and management of chronic kidney disease, Kidney Int Suppl (2013); 3: 1-150.
Гломерулонефрит
Гломерулонефрит: причины появления, симптомы, диагностика и способы лечения.
Гломерулонефрит, который еще называют клубочковым нефритом, - двустороннее аутоиммунное воспалительное заболевание почек с преобладающим поражением почечных клубочков и включением в патологический процесс почечных канальцев, интерстициальной ткани и сосудов. Протекает остро или хронически (с повторными обострениями и ремиссиями), имеет прогрессивный характер и отличается постепенной, но неуклонной гибелью клубочков и сморщиванием почек.
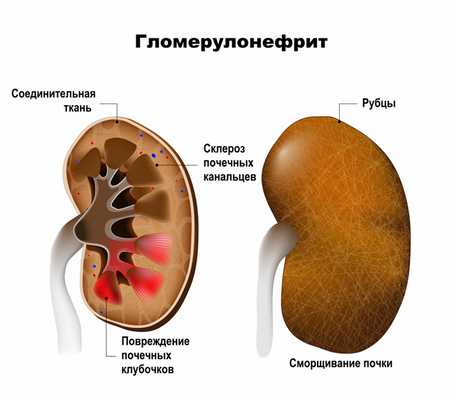
Обычно у человека две почки, которые напоминают по форме фасоль и прилегают к задней брюшной стенке под ребрами. В каждой из них находится около миллиона маленьких фильтров, которые называются клубочками, или гломерулами, играющими основную роль в фильтрации крови. Их поражение сопровождается задержкой в организме продуктов обмена, жидкости, солей и токсинов, что нередко приводит к возникновению тяжелой артериальной гипертензии и перегрузки жидкостью. При повреждении почечных клубочков, состоящих из множества кровеносных капилляров, в мочу попадают элементы крови, которые в норме должны в ней отсутствовать. По мере прогрессирования болезни развивается склероз почечных канальцев (нефросклероз).
Больные гломерулонефритом находятся в группе риска развития хронической болезни почек и почечной недостаточности.
Причины появления гломерулонефрита
Гломерулонефрит может быть первичным, возникающим вследствие непосредственного морфологического разрушения почек, или вторичным, вызываемым широким спектром заболеваний, которые помимо почек могут поражать и другие органы.
Многие ученые считают основной причиной развития гломерулонефрита инфекционные заболевания: бактериальные (туберкулез, сифилис, стрептококковые, стафилококковые (группы А) и пневмококковые инфекции), грибковые, паразитарные и вирусные инфекции (вызванные вирусами гепатита В и С, простого герпеса, Эпштейна-Барр, цитомегаловирусом, ВИЧ).
Нередкая причина гломерулонефрита – наличие у пациента системных заболеваний (ревматоидного артрита, системной красной волчанки, васкулита, амилоидоза).
Гломерулонефрит может развиться на фоне некоторых онкологических заболеваний (множественной миеломы, рака легких, хронического лимфоцитарного лейкоза).
К другим причинам клубочкового нефрита относят наследственный фактор, воздействие токсинов, поствакцинальные осложнения.
Острый гломерулонефрит чаще развивается у детей 3–7 лет или взрослых 20–40 лет. Мужчины болеют в 2–3 раза чаще, чем женщины.
Клиническая классификация гломерулонефрита.
- Острый гломерулонефрит:
- с развернутой клинической картиной (циклическая форма),
- со стертыми клиническими проявлениями (латентная, ациклическая форма).
- Хронический гломерулонефрит:
- изолированный мочевой синдром (латентный нефрит),
- гипертоническая форма,
- гематурическая форма,
- нефротически-гипертоническая форма (смешанная форма),
- нефротический синдром.
- Быстропрогрессирующий (подострый).
- ремиссия;
- активная стадия (увеличение в 5-10 раз гематурии, протеинурии, нарастание артериального давления и отеков, появление нефротического синдрома или острой почечной недостаточности).
- выраженное недомогание, общая слабость, быстрая утомляемость, тошнота, потеря аппетита, рвота и другие симптомы интоксикации;
- повышение температуры тела до высоких значений;
- боль в поясничной области;
- боль в животе и суставах;
- выраженные отеки на лице, особенно периорбитальные;
- повышение артериального давления;
- олигурия (резкое снижение объема выделяемой мочи);
- потемнение мочи в результате гематурии (примеси крови в моче);
- нарушения со стороны центральной нервной системы.
- Первый (классический). При врожденных состояниях кислотно-щелочное равновесие изменяют мутации генов ATP6V1B1, ATP6V0A4 S1C4A, что инициирует дистальный почечный тубулярный ацидоз (синдром или болезнь Батлера-Олбрайта). Вторичная форма становится результатом приема лекарств, трансплантации почек и некоторых заболеваний (серповидноклеточной анемии, системной красной волчанки, синдрома Шегрена). Медуллярная губчатая почка, цирроз и хроническая обструктивная уропатия также рассматриваются как потенциальные триггеры.
- Второй (проксимальный). Проксимальный почечный канальцевый ацидоз сопровождает синдром Фанкони, нефропатию на фоне множественной миеломы, как осложнение развивается при длительном приеме ацетазоламида, сульфонамидов, ифосфамида, тетрациклина. Реже имеет другую этиологию: дефицит витамина Д, хроническую гипокальциемию с вторичным гиперпаратиреозом, ряд наследственных патологий: непереносимость фруктозы, окулоцереброренальный синдром, цистиноз.
- Четвертый (обобщенный, генерализованный). Почечный тубулярный ацидоз обусловлен дефицитом альдостерона или нарушением его взаимодействия с рецепторами. Как первопричину нарушения рассматривают прием калийсохраняющих диуретиков, циклоспорина, гепарина, других препаратов. Из нефрологических заболеваний тубулопатию провоцируют ХБП, хронический интерстициальный нефрит, ВИЧ-инфекция с поражением почек, в урологии – все ситуации, связанные с обструкцией мочевыводящих путей. Тубулярный почечный ацидоз (IV) вызывает аутоиммунная дисфункция (СКВ), серповидноклеточная анемия, диабет.
- Первый (тубулярный классический, дистальный). Заболевание вызвано уменьшением выработки молекул водорода дистальными канальцами, повышением экскреции HCO3- . Часто сопровождается нефрокальцинозом, камнеобразованием. Выделяют врожденный (аутосомно-доминантный, аутосомно-рецессивный с тугоухостью, аутосомно-рецессивный без нарушения слуха) и приобретенный варианты.
- Второй (тубулярный проксимальный). Возникает из-за патологии проксимального отдела почечных трубок. Ацидемия менее выражена из-за сохранности дистальных интеркалированных клеток, вырабатывающих кислоту. Основной особенностью синдрома является деминерализация костной ткани (остеомаляция, рахит) из-за истощения фосфатного обмена. Различают аутосомно-рецессивный, аутосомно-доминантный, спорадический (транзиторный детский и персистирующий взрослый) почечный ацидоз.
- Третий (тубулярный ювенильный). Представляет собой сочетание классического и второго типа почечной ацидемии. Аутосомно-рецессивная патология, связанная с генетической мутацией. Регистрируется крайне редко. Тубулопатию поддерживает унаследованный дефицит углекислой ангидразы 2.
- Четвертый (тубулярный гиперкалиемический). Вызван дефицитом или резистентностью к альдостерону. Сопутствующая гиперкалиемия приводит к патологическим процессам в миокарде. Почечная функция не нарушена или страдает незначительно. Состояние встречается преимущественно у взрослых, в большинстве наблюдений имеет вторичный характер.
- Увеличение осмолярности в почечных канальцах. Йодсодержащие контрастные соединения хорошо фильтруется нефронами и не подвергается реабсорбции, из-за чего моча становится более концентрированной. Повышение вязкости оказывает прямое повреждающее воздействие на эпителиоциты канальцев.
- Нарушение почечной гемодинамики. Контраст-индуцированное расширение и последующее спазмирование ренальных артерий влияет на интенсивность кровотока в микрососудистом русле. После временного прилива крови интенсивность ренального кровоснабжения резко падает, в тканях возникает ишемия.
- Высвобождение активных форм кислорода. После восстановления адекватного кровотока в ишемизированных тканях развивается реперфузионный «кислородный парадокс». Из-за резкой активации перекисного окисления липидов образуются свободные радикалы кислорода, которые токсически влияют на клеточные мембраны.
- Воспалительная реакция. В ответ на введение йодсодержащего препарата в различных органах, в том числе почках, происходит контраст-опосредованная активация комплемента и выброс цитокинов. В результате токсические повреждения паренхимы могут усугубиться действием медиаторов воспаления.
- Тубулярная обструкция. Преципитация внутриканальцевых белков, индуцированная рентгеноконтрастным веществом, нарушает внутрипочечный пассаж мочи. Вследствие обструкции канальцев нарушается реабсорбция мочи, а опосредованное влияние на нефроны ухудшает процессы фильтрации.
- Определение содержания сывороточного креатинина. При контраст-индуцированной почечной дисфункции его концентрация по сравнению с исходными данными в течение 24-48 часов после процедуры возрастает на 25% или 26,5 мкмоль/л и больше. Пик уровня креатинина в сыворотке достигается на 2-5 сутки, после чего в течение 7-10 дней показатель постепенно снижается. У некоторых пациентов СК остается повышенным на протяжении 3 недель.
- Анализ концентрации калия в крови. Характерный лабораторный симптом контраст-индуцированной нефропатии — гиперкалиемия. Повышение показателя более 5,1 ммоль/л служит маркером токсического повреждения канальцев. Зачастую гиперкалиемия сочетается со снижением pH крови менее 7,2 (при исследовании кислотно-основного состояния), признаками гемолиза, падением содержания тромбоцитов, повышением концентрации билирубина.
- Инфузионная ощелачивающая терапия. Для коррекции тканевых и системных эффектов метаболического ацидоза, гиперкалиемии внутривенно вводят препараты кальция, глюкозу с инсулином, бикарбонат натрия. Инфузионную терапию дополняют пероральным приемом или ректальным введением хелатных форм кальция под контролем уровня калия через каждые 2-4 часа.
- Заместительная почечная терапия. При значительном снижении диуреза, нарастании лабораторных и клинических признаков почечной недостаточности рассматривается перевод пациента на ЗПТ. С учетом состояния больного и технических возможностей лечебного учреждения назначают гемодиализ, гемофильтрацию, гемодиафильтрацию, перитонеальный диализ.
- Официнальные лекарственные средства. Ренальная дисфункция возникает при приеме антибактериальных препаратов (пенициллинов, цефалоспоринов, аминогликозидов, тетрациклинов, фторхинолонов, сульфаниламидов, противотуберкулезных средств), анальгетиков, НПВС, диуретиков, барбитуратов, цитостатиков, блокаторов H2-гистаминовых рецепторов, ингибиторов АПФ, фенотиазинов и др. При использовании рентгеновского контраста возможно развитие контраст-индуцированной нефропатии.
- Вакцины и сыворотки. До 23% случаев лекарственной нефрологической патологии вызвано введением противостолбнячной, противокоревой, антистафилоккоковой сывороток, АДС, АДС-М, АКДС, гоновакцины. Риск поствакцинальных или сывороточных нефропатий возрастает при проведении иммунизации или введении готовых антител пациентам с отягощенным аллергологическим анамнезом, гиперчувствительностью к компонентам иммунопрепарата.
- Парамедицинские препараты. По данным наблюдений, до 80% населения использует средства нетрадиционной медицины. При этом зачастую недоучитываются вазоконстрикторный, цитопатический, кристаллурический, дисметаболический эффекты лекарственных растений. Как сообщает FDA, до 32% аюрведических препаратов содержат ртуть, мышьяк, свинец, аристолохиевую кислоту, признанную одной из вероятных причин балканской эндемической нефропатии, другие нефротоксичные ингредиенты.
- Острый некроз канальцев. Представлен симптоматикой острой почечной недостаточности. Связан с повреждением канальцевого эпителия, нарушением реабсорбции, вторичным ухудшением фильтрации. Выявляется у 5-20% больных, принимающих аминогликозидные препараты. Возможен при назначении цефалоспоринов, хинина, ампициллина, введении рентгеновского контраста.
- Острый кортикальный некроз. Сопровождается клиникой ОПН. Является вторичным состоянием. Развивается на фоне системных изменений, возникших при приеме лекарственных средств. Чаще всего становится результатом анафилактического шока, вызванного иммунизацией при наличии противопоказаний или индивидуальной гиперчувствительностью к фармпрепаратам.
- Острый интерстициальный нефрит. При тяжелом течении характерна симптоматика ОПН, свидетельствующая о вторичном повреждении гломерул, при стертом преобладает клиника тубулопатии с полиурией. До 72% острых форм интерстициального нефрита имеют лекарственный генез, осложняют прием антибиотиков, сульфаниламидов, ингибиторов протонной помпы, НПВС.
- Хронический интерстициальный нефрит. Длительное время протекает бессимптомно, у половины пациентов диагностируется на стадии ХПН. Преобладает разрастание межуточной ткани, некроз сосочков, атрофия эпителия канальцев. Провоцируется приемом анальгетиков (анальгетическая нефропатия), ингибиторов кальциневрина, препаратов лития, фитосредств с аристохолиевой кислотой.
- Острый лекарственный гломерулонефрит. Проявляется нефритическим синдромом. Морфологически при гломерулонефрите превалирует поражение базальных мембран клубочков циркулирующими иммунными комплексами (мембранозный гломерулонефрит). Возникает вследствие дозонезависимой аллергической реакции на прием НПВС, препаратов золота, антибиотиков, диуретиков, противовирусных средств.
- Хронический гломерулонефрит. Характеризуется выраженным нефротическим синдромом, реже изолированным мочевым синдромом вследствие прогрессирующего аутоиммунного разрушения гломерулярного аппарата, склероза ренальной паренхимы, ХПН. Хронический гломерулонефрит зачастую является исходом острых форм лекарственного нефрита. Развивается при терапии солями ртути, анестетиками.
- Электролитно-гемодинамические расстройства. Преобладают экстраренальные нарушения (повышение АД, водно-электролитный дисбаланс). При кратковременном поступлении лекарственных средств нефропатия обычно обратима. Как правило, ее формирование обусловлено изменением почечной гемодинамики за счет ингибирования синтеза простагландинов при лечении индометацином.
- Общий анализ мочи. При разных вариантах патологического состояния в материале может определяться снижение или значительное повышение относительной плотности, эритроциты, лейкоциты, цилиндры, кристаллы солей. Для оценки реабсорбционной функции канальцев исследование часто дополняют пробой Зимницкого.
- Биохимический анализ крови. О снижении фильтрационной функции свидетельствует повышение уровней креатинина, мочевой кислоты, мочевины, изменение содержания калия, кальция, натрия, фосфора. Дисбаланс ионов возможен при нарушении их реабсорбции. При протеинурии возникает гипо- и диспротеинемия.
- Нефрологический комплекс. Определение работоспособности органа базируется на данных о содержании креатинина, мочевины, мочевой кислоты, макроэлементов. Показательным является появление в моче белка, глюкозы, микроальбумина. В качестве дополнительного метода рекомендована геморенальная проба Реберга, тест Сулковича.
- Сонография. УЗИ почек выявляет увеличение или уменьшение размеров органа, диффузные и очаговые изменения в паренхиме и мозговом веществе. Ультразвуковое сканирование дополняют УЗДГ, позволяющим оценить ренальный кровоток, при необходимости — томографией (МРТ, КТ).
- Внутривенная урография. По данным о выведении контрастного вещества оцениваются особенности кровоснабжения почек и их функциональная активность. Экскреторная урография может быть дополнена нефросцинтиграфией. Из-за возможного усугубления симптоматики обследование пациентов с ОПН проводится ограниченно.
- Пункционная биопсия почек. Гистологическое исследование биоматериала дает возможность наиболее точно оценить состояние гломерул, канальцев, интерстициальной ткани, капилляров, артериол. Результаты биопсии почек являются особо ценными для выбора врачебной тактики у больных с хроническими медикаментозными нефропатиями.
- Кортикостероиды. Глюкокортикоидная терапия средними и высокими дозами оправдана при иммунном патогенезе нефропатии, осуществляется для быстрого купирования аутоиммунных и аллергических реакций. Иммуносупрессорный эффект включает уменьшение отека интерстиция, подавление функций макрофагов, ограничение лейкоцитарной миграции в воспаленных тканях, угнетение синтеза медиаторов воспаления и антител. Глюкокортикостероиды эффективно стабилизируют клеточные и лизосомальные мембраны.
- Симптоматические средства. Почечная дисфункция сопровождается возникновением органных и системных расстройств, требующих экстренной коррекции. Для восстановления водно-электролитного баланса, гемодинамики, микроциркуляции, тканевой перфузии применяется инфузионная терапия с введением коллоидных, кристаллоидных растворов, антиагрегантов, антикоагулянтов. При нарушении ренин-ангиотензиновой регуляции обычно требуется прием антигипертензивных препаратов.
- Заместительная почечная терапия. Экстраренальное очищение крови назначается для предупреждения тяжелых уремических осложнений при выраженной функциональной недостаточности. Гемодиализ, перитонеальный диализ, гемофильтрация, гемодиафильтрация могут проводиться в интермиттирующем режиме до восстановления почечных функций или постоянно при тяжелой ХПН. При хроническом течении медикаментозной нефропатии может потребоваться трансплантация почки.
Хронический гломерулонефрит, как правило, вызывает только очень слабые или едва заметные симптомы. Происходит потеря белка с мочой, за счет чего нарастают отеки. Во многих случаях наблюдается повышение артериального давления. Заболевание чаще выявляют по результатам планового анализа мочи при обнаружении в ней белка и клеток крови.
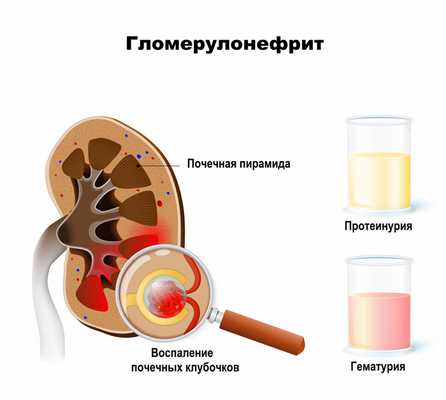
Диагностика гломерулонефрита
Диагноз ставится на основании анализов крови и мочи, иногда на основании визуализирующих методов обследования и/или биопсии почек.
- общий анализ мочи – наличие эритроцитов, белка, уменьшение относительной плотности мочи говорит об ухудшении функции почек;
Почечный тубулярный ацидоз ( Ацидоз почечных канальцев , Почечный канальцевый ацидоз )
Почечный тубулярный ацидоз – это разновидность тубулопатии, которая сопровождается дисбалансом электролитов из-за сбоя экскреции ионов водорода (I), нарушением обратного всасывания бикарбонатов (II), аномальной продукцией альдостерона или взаимодействия с ним (IV). Тип III встречается казуистически редко. Течение может быть бессимптомным или с проявлениями электролитных расстройств: слабостью, тошнотой, костными деформациями. Диагностика почечной ацидемии базируется на измерениях рН мочи и электролитов, данных генетических анализов, УЗИ. Лечение предполагает восстановление кислотно-щелочного баланса: ощелачивающие средства, устранение гипо- гиперкалиемии и пр.
МКБ-10
N25.8 Другие нарушения, обусловленные дисфункцией почечных канальцев. Почечно-канальцевый ацидоз БДУ.
Общие сведения
Почечный канальцевый ацидоз (RTA, тубулярный, трубчатый, ацидоз почечных канальцев) определяется нефрологами как синдром, при котором нарушается выведение ионов водорода или реабсорбция фильтрованного бикарбоната, что приводит к хроническому метаболическому нарушению гомеостаза с гипохлоремией. Наиболее распространенным вариантом является генерализованный тип заболевания, второе место занимает поражение дистальных канальцев нефронов, форма с патологией проксимальных канальцев встречается реже. Точный уровень заболеваемости отследить сложно, поскольку латентные формы часто не распознаются. Наследственные почечные тубулопатии встречаются реже приобретенных.
Причины
Основная причина патологии – утрата способности почек подкислять мочу. Существует множество состояний, которые вызывают ацидоз почечных канальцев, при одних заболеваниях поражаются дистальные отделы, при других – проксимальные, иногда патология носит сочетанный характер или вызывается рядом нарушений, связанных с альдостероном. Характерными причинами для каждого типа являются:
К утяжеляющим факторам относят диарею, отравление солями тяжелых металлов, оперативные вмешательства на органах ЖКТ с установлением дренажей, которые выводят основания вместе с жидким содержимым или секретом (например, поджелудочной железы). Длительная диарея и увеличение объема стула приводят к дополнительной потере бикарбонатов. Прием некоторых лекарственных препаратов – кальция хлорида, магния сульфата, холестирамина нарушают гомеостаз, в сочетании с почечной патологией усугубляют состояние.
Патогенез
При первом типе имеет место сбой секреции или всасывания ионов водорода в дистальных канальцах, что вызывает высокую кислотность крови с гиперхлоремией. При этом нарушается способность почек поддерживать нормальный градиент концентрации водородных ионов между кровью и тубулярной жидкостью. Гипотетически это может быть связано с уменьшением активности клеток, секретирующих ионы водорода, дефектом энергетического механизма, дефицитом систем транспортировки, патологическими изменениями А и Р-клеток нефрона, ответственных за выработку Н+. Гиперкальциурия, сниженная экскреция цитратов приводит к нефролитиазу.
При II типе присутствует дисфункция проксимальных трубочек с нарушением процессов реабсорбции бикарбонатов, НСО3-, но ацидогенетическая функция дистальных структур нефрона остается сохранной. Патогенез проксимального тубулярного ацидоза объясняют дефицитом или полным отсутствием карбоангидразы И-(С), снижением активности карбоангидразы 1-(В) крови и/или митохондриальной НСО3-АТФ-азы в мембранах эпителия проксимальных канальцев. Механизмы развития остеомаляции и остеопении (в том числе, рахита у детей) включают гиперкальциурию, гиперфосфатурию, дисметаболизм витамина Д.
Тип IV инициирует дефицит альдостерона или невосприимчивость к нему дистальных канальцев. Характерен дисбаланс электролитов: натрия, калия, хлора и гидрокарбоната. Гипокалиемия способствует уменьшению секреции аммиака, приводя к метаболической ацидемии. Это расстройство – наиболее распространенный вариант почечной дистальной тубулопатии – имеет вторичный или спорадический характер по отношению к нарушению оси ренин-альдостерон-ренальной системы.
Классификация
Симптомы
Симптомы вариативны, связаны с причинными факторами. При первичном генетически обусловленном дистальном почечном тубулярном ацидозе до появления развернутых клинических проявлений у детей обнаруживается бледность кожных покровов, мышечная гипотония, полиурия и, как следствие, полидипсия. В ряде случаев наследственную патологию сопровождает тугоухость, глазные аномалии. Температура тела незначительно повышена, есть склонность к запорам. Иногда единственным симптомом становится отставание в физическом развитии от сверстников.
В тяжелых случаях без лечения примерно по достижении 2-летнего возраста происходит деформация костей скелета. К 3-4 годам, если патология не диагностирована, и ребенок не получает лечения, прогрессирует задержка роста и интеллектуальных способностей. Кости нижних конечностей Х-образно искривляются, грудная клетка приобретает бочкообразную форму, голова выглядит непропорционально большой. Патологические переломы, костные боли, снижение мышечного тонуса свидетельствуют о прогрессировании патологического процесса.
Реакциями со стороны нервной системы при длительно существующих обменных нарушениях являются раздражительность, агрессивность. Типично раннее наступление пубертата. На фоне развившегося нефрокальциноза присоединяются рецидивирующие инфекции мочевыводящих путей, которые проявляются резями при учащенном мочеиспускании, поясничными болями, повышением температуры. Нефролитиаз и самостоятельное отхождение конкрементов сопровождаются почечной коликой, тошнотой, рвотой.
Проксимальный тип тубулярного почечного ацидоза имеет схожую симптоматику, но рахитоподобные изменения развиваются раньше, а нефрокальциноз выявляется значительно реже. Для второго варианта тубулопатии характерно более тяжелое течение, без лечения патология может прогрессировать до ацидемической комы. Типичен эксикоз (обезвоживание) с обмороками, резким цианозом, одышкой. Изменению подвергается волосяной покров: волосы колючие, жесткие, при соответствующей терапии становятся мягче. Иногда патологическое состояние проходит самостоятельно без какого-либо лечения к 3-10 годам.
У взрослых электролитные расстройства протекают бессимптомно или порождают более мягкую симптоматику. Гипокалиемия вызывает мышечную слабость, снижение рефлексов, параличи. Проявления со стороны опорно-двигательного аппарата включают остеомаляцию, боли. Подобные признаки более типичны для проксимального почечного ацидоза, но могут определяться и при дисфункции дистальных канальцев. Четвертый тип чаще бессимптомный, диагностируется при выявлении незначительной ацидемии. Существует риск нарушений сердечного ритма, особенно если состояние сопровождается выраженной гиперкалиемией.
Осложнения
Без надлежащего лечения хроническая кислотность крови осложняется задержкой роста, нефролитиазом, переломами. У пациентов наблюдают рецидивирующий пиелонефрит, нефрокальциноз, постепенную утрату почечной функции вплоть до терминальной стадии ХПН. Основным последствием дистальной тубулопатии является гипокалиемия, которая сопровождается аритмией, нередко становящейся причиной летального исхода. У детей отсутствие терапии ведет к тяжелым деформациям костей, задержке психического развития. Выраженная гиперкалиемия (IV) осложняется перепадами АД, бронхоспазмом, кишечными коликами.
Диагностика
Ведущая роль в диагностике принадлежит лабораторным анализам. Инструментальные исследования назначаются для определения основной патологии при вторичном почечном тубулярном ацидозе. При наличии в роду наследственных заболеваний необходима консультация генетика, при признаках обструктивной нефропатии требуется осмотр уролога. У детей с наследственными формами, сопровождающимися врожденной глухотой, в обследовании принимает участие сурдолог. Алгоритм диагностики индивидуален, результаты анализов и инструментальных методов вариативны.
Инструментальная диагностика включает УЗИ почек и мочевого пузыря, КТ и МРТ для исключения обструктивных уропатий, нефролитиаза. При тубулярном ацидозе (I) на сонограммах всегда определяется патология почек, для проксимального типа она нехарактерна. На рентгенограммах у детей визуализируются рахитические изменения скелета, поражение трубчатых костей голеней, кистей. Минеральную плотность костной ткани определяют с помощью денситометрии. Деминерализация костей без явного рахита или остеомаляции сопутствует 1 и 4 типам, витамин Д-ассоциированный рахит, остеомаляция характерны для 2 варианта.
Дифференциальную диагностику проводят между возможными типами нарушения кислотно-щелочного равновесия, почечными патологиями иного генеза. Синдром Фанкони имеет схожие проявления с проксимальным и дистальным тубулярным ацидозом. Генетически обусловленные формы дистального почечного ацидоза различают с псевдогипоальдостеронизмом, первичной гипероксалатурией, нефрокальцинозом иного генеза. Иногда требуется дифференциация с почечной недостаточностью, сахарным диабетом, салицилатной нефропатией.
Лечение почечного тубулярного ацидоза
Лечение направлено на коррекцию дисбаланса электролитов (калия, кальция, фосфатов), предотвращение осложнений, коррелирует с типом патологии. Операции выполняют только для исправления тяжелых деформаций костей. Основным мероприятием остается назначение ощелачивающей терапии, без лечения при тубулярном почечном ацидозе у детей замедляется рост, страдает умственное развитие. Щелочные агенты помогают достичь относительно нормальной концентрации бикарбонатов плазмы, скорректировать нарушения.
Медикаментозная терапия
Лечение классического почечного тубулярного ацидоза необходимо для поддержки роста у детей, ликвидации костных изменений, профилактики накопления интерстициальной тканью кальция. Назначают бикарбонат натрия, калия-натрия гидроген цитрат. При остеопатии используют активные метаболиты витамина Д3, что требует осторожности из-за риска развития гиперкальциурии. Терапия проксимального варианта включает пероральное введение цитрата калия. При резистентности в схему добавляют гидрохлортиазид. При ювенильном варианте применяют цитрат натрия или цитрат калия. Дозы подбирают индивидуально.
Основное лечение четвертого варианта направлено на восполнение или замещение альдостерона. Пациентам рекомендуют исключить из питания продукты, богатые калием. Дополнительно вводят NaCl на фоне мониторинга К крови, альдостерона, ренина плазмы. Необходимо прекратить прием лекарств, поддерживающих гиперкалиемию, осуществлять лечение основной патологии (ЗГТ минералокортикоидами). Назначают диуретики (фуросемид, гидрохлортиазид). При отсутствии ответа на лечение используют флудрокортизон, бикарбонат натрия для компенсации ацидемии и усиления экскреции К.
Прогноз и профилактика
Своевременно начатое лечение улучшает исход для всех случаев. При дистальной тубулопатии прием препаратов до присоединения нефрокальциноза благоприятно влияет на прогноз. Проксимальная транзиторная форма с возрастом может купироваться самостоятельно, но подщелачивающая терапия обеспечивает нормальный рост и препятствует деминерализации, рахиту, у взрослых лечение предотвращает развитие остеомаляции. Прогноз почечного ацидоза (IV) определяется тяжестью основного заболевания. За пациентами наблюдают, контролируют электролиты крови каждые 12 недель, проводят УЗИ почек 1 раз в 6 месяцев.
Меры профилактики для врожденной патологии отсутствуют, при отягощенном семейном анамнезе показана консультация генетика. Важно своевременное лечение урологических и нефрологических заболеваний, которые могут приводить к тяжелым формам тубулопатий. Особого наблюдения требуют пациенты с почечным канальцевым ацидозом на фоне уремии (почечная недостаточность с нарушением скорости клубочковой фильтрации, высоким уровнем креатинина, мочевины). Больные, получающие адекватное лечение, обычно не имеют выраженных симптомов, многие из них могут вести нормальную жизнь.
1. Федеральные клинические рекомендации по оказанию медицинской помощи детям с тубулопатиями/ Баранов А.А. – 2015.
2. Ренальный тубулярный ацидоз (обзор литературы)/ Вашурина Т.В., Сергеева Т.В.// Нефрология и диализ – 2003 - №2.
Контраст-индуцированная нефропатия
Контраст-индуцированная нефропатия — это острая почечная дисфункция, которая возникает в течение 1-3 суток после введения рентгеноконтрастного препарата, приводит к повышению уровня сывороточного креатинина минимум на 26,5 мкмоль/л (25%) и более в сравнении с исходным уровнем. Обычно протекает бессимптомно. В тяжелых случаях проявляется олигурией, почечными отеками, слабостью, сонливостью, потерей аппетита, тошнотой. Диагностируется на основании данных о динамике концентрации креатинина и калия в сыворотке крови, результатов общего анализа мочи, биохимии крови, почечных проб. Для лечения вводят инфузионные ощелачивающие препараты, проводят почечнозамещающую терапию.
N14.1 Нефропатия, вызванная другими лекарственными средствами, медикаментами или биологически активными веществами
Контраст-индуцированный вариант нефропатии у пациентов с нормальной функцией почек встречается не более чем в 0,5-5% случаев проведения исследований с применением йодсодержащих рентгеноконтрастных средств. Вероятность развития расстройства существенно возрастает при наличии факторов риска. Так, по результатам клинических наблюдений в области современной урологии, после проведения КТ различных органов, периферической и кардиальной ангиографии почечная дисфункция той или иной степени проявлялась у 50-90% пациентов с диабетическим поражением почечной паренхимы.
С учетом роста популярности компьютерной томографии и других современных методов рентгеновских исследований повышается актуальность своевременного выявления факторов риска и профилактики острой почечной дисфункции, которая возможна при использовании контрастных средств на основе йода.
Причины нефропатии
Острое ятрогенное поражение почек связано с введением йодсодержащего рентгеноконтрастного вещества. Наибольшую нефротоксичность проявляют высокоосмолярные препараты с высокой плотностью и концентрацией йода. Специалисты в сфере нефрологии выделяют пять ключевых факторов, обуславливающих токсическое повреждение различных элементов почечной ткани при введении контраста:
Вероятность возникновения контраст-индуцированной нефропатии возрастает у пациентов, длительно страдающих пиелонефритом, гломерулонефритом, амилоидозом, подагрической нефропатией, поликистозом и другими хроническими болезнями почек, ХПН, перенесших трансплантацию почки. В группу риска входят больные с тяжелой сопутствующей патологией — артериальной гипертензией, сахарным диабетом 2-го типа, циррозом печени, кардиологическими заболеваниями с застойной сердечной недостаточностью, снижением фракции выброса левого желудочка до 35% и менее, множественной миеломой.
Предрасполагающими факторами также считаются возраст более 75 лет, протеинурия, содержание сывороточного креатинина выше 1,5 мг/дл, прием диуретиков, ингибиторов АПФ, нефротоксичных лекарственных средств (НПВС, аминогликозидов, сульфаниламидов, иммуносупрессоров, солей лития, противоопухолевых препаратов). Расстройство чаще развивается при наличии патологических состояний, усугубляющих тканевую гипоксию, — стойкой гипотензии, анемии, кровопотери, дегидратации, острого инфаркта миокарда, кардиогенного шока. Установлена прямая зависимость между вероятностью возникновения индуцированной нефропатии и объемом вводимого контраста.
Механизм контраст-индуцированной ренальной дисфункции основан на сочетанном проявлении ишемических и токсических эффектов. Пусковым моментом в развитии патологического процесса становится локальное нарушение гемодинамики. Под влиянием рентгеноконтрастных соединений активируются ангиотензин II, вазопрессин, дофамин 1, аденозин, эндотелин, вызывающие ренальную вазоконстрикцию. Одновременно уменьшается активность простагландинов и окиси азота, обладающих вазодилатирующим эффектом. В результате продолжительного спазма артерий и артериол в мозговом слое, наиболее восприимчивом к действию гипоксии, возникает ишемия.
Высокая вязкость рентгеновского контраста потенцирует агрегацию эритроцитов и замедление почечного кровотока, усугубляющего ишемию и снижающего скорость клубочковой фильтрации. Нарастанию медуллярной гипоксии также способствует компенсаторное шунтирование крови в корковый слой. Вследствие прямого токсического действия контрастного вещества на почечные эпителиоциты происходит вакуолизация клеток, повреждаются клеточные мембраны, возникает митохондриальная дисфункция, что в конечном итоге приводит к интерстициальному воспалению, некрозу тканей, апоптозу с нарушением почечных функций.
Симптомы нефропатии
Патология развивается в течение первых суток после внутрисосудистого введения рентгеноконтрастных веществ. У большинства пациентов нефропатия протекает без клинических проявлений, с изменением лабораторных показателей биохимических анализов крови и мочи. Тяжелый вариант течения расстройства проявляется симптомами, характерными для острой почечной недостаточности (ОПН): уменьшением суточного количества мочи вплоть до полного прекращения ее выделения, отеками на лице. При контраст-индуцированном поражении почек также могут возникать нарушения общего состояния — сонливость, слабость, тошнота, потеря аппетита.
При прогрессировании состояния наблюдается тубулярный некроз, который приводит к уменьшению фильтрационной способности органа. Вследствие функциональной несостоятельности почек у пациентов, страдающих контраст-индуцированным вариантом нефропатии, могут возникнуть клинические признаки нарушений водно-электролитного состава крови. Чаще всего развивается гиперкалиемия, которая проявляется мышечной слабостью, брадикардией, в неблагоприятных случаях — отеком легких, нарушением сердечного ритма вплоть остановка сердца. На фоне расстройства мочевыделения и длительного повышения объема циркулирующей крови может развиваться артериальная гипертензия и застойная сердечная недостаточность.
О вероятном контраст-индуцированном происхождении нефропатии свидетельствует временная связь почечной патологии с проведением контрастного рентгенологического исследования. Диагностический поиск направлен на выявление характерных маркеров расстройства и оценку функциональной состоятельности почек. Наиболее информативными методами диагностики являются:
В общем анализе мочи при контраст-индуцированных ренальных дисфункциях часто выявляются протеинурия, цилиндрурия, эритроцитурия, лейкоцитурия. При тяжелом течении нефропатии отмечаются лабораторные признаки уремии. О расстройстве фильтрационной функции клубочков свидетельствует повышение уровней азота мочевины, мочевой кислоты, изменение сывороточной концентрации кальция, натрия, неорганического фосфора в биохимическом анализе крови с нарушением соответствующих показателей в нефрологическом комплексе. Определяется снижение скорости клубочковой фильтрации креатинина в пробе Реберга.
Инструментальные методы обследования, предполагающие введение рентгеновского контраста, запрещены. Результаты УЗИ почек зачастую неспецифичны. Характерны изменения на ЭКГ, свидетельствующие о нарушении проводимости вследствие гиперкалиемии. По показаниям, кроме врача-нефролога или уролога, пациента консультирует терапевт, кардиолог, пульмонолог, ревматолог, анестезиолог-реаниматолог, токсиколог, онколог, онкогематолог.
Контраст-индуцированную форму нефропатии дифференцируют с почечной атероэмболией, быстропрогрессирующим гломерулонефритом, хроническим пиелонефритом, подагрическим интерстициальным нефритом, ОПН преренального, ренального, постренального происхождения, нефрологической патологией при системных заболеваниях соединительной ткани, амилоидозе, бериллиозе, саркоидозе.
Лечение контраст-индуцированной нефропатии
Тактика ведения пациентов с повреждением почечной паренхимы рентгеноконтрастными веществами аналогична терапевтической схеме при ОПН. Больных с контраст-индуцированной формой нефропатии госпитализируют в урологический стационар или палату интенсивной терапии реаниматологического отделения. Первые сутки показан постельный режим с последующим переводом на общий палатный.
В рационе при достаточной калорийности питания ограничивают прием поваренной соли и жидкости с учетом объема диуреза. При появлении и нарастании почечных отеков уменьшают количество белковых продуктов. Основной целью лечения является коррекция метаболических нарушений. С учетом данных о фильтрующей функции нефронов могут быть рекомендованы:
У пациентов, которые не имеют болезней почек в анамнезе, обычно отмечается нормализация работы органа в течение нескольких дней без какого-либо лечения. В остальных случаях прогноз также обычно благоприятный. Для профилактики контраст-индуцированной нефропатии необходимо ограничить проведение исследований с введением рентгеновского контраста, если для диагностики можно воспользоваться другими методами. При оценке вероятности ренальной дисфункции используют верифицированные шкалы и стратификационные таблицы.
Пациентам из группы риска рекомендовано введение изоосмолярных неионных контрастных веществ в минимальных дозах. С целью улучшения элиминации препаратов проводится предварительная гидратационная терапия с вливанием физиологического раствора до и после процедуры. Для предупреждения развития нефропатии за день до исследования может дополнительно назначаться ацетилцистеин.
2. Клинические рекомендации и по профилактике, диагностике и лечению контраст-индуцированной нефропатии/ Научное общество нефрологов России, Ассоциация нефрологов России. – 2016.
3. Контраст-индуцированная нефропатия: пособие для интервенционного кардиолога/ Бегшоу Ш.М. , Каллетон Б.Ф.// Международный журнал интервенционной кардиоангиологии. – 2006.
4. Contrast-induced nephropathy – prevention and risk reduction/ Norbert H. Lameire// Nephrology Dialysis Transplantation. – 2006 – 21 (Supplement 1).
Лекарственная нефропатия
Лекарственная нефропатия — это острое или хроническое поражение почечных гломерул, канальцев, интерстиция, обусловленное приемом медикаментов. Проявляется полиурией, олигоанурией, никтурией, гематурией, болями в пояснице, астеническим, отечным и гипертензивным синдромами. Диагностируется на основании данных общего и биохимического анализов крови, мочи, УЗИ, УЗДГ, КТ, МРТ почек, экскреторной урографии, нефросцинтиграфии, биопсии почечных тканей. Лечение включает детоксикационную терапию, кортикостероиды, лекарственные инфузии, антикоагулянты, антиагреганты, гипотензивные средства, ЗПТ. При стойкой хронической дисфункции требуется трансплантация почки.
По наблюдениям отечественных и зарубежных специалистов-урологов, в последние годы возрастает частота лекарственных поражений почек, проявляющихся различными вариантами острых и хронических нефропатий. В первую очередь это связано с расширением арсенала медикаментозных средств, применяемых в терапии различных заболеваний, и потенциальной нефротоксичностью большинства препаратов. У 10-11% пациентов с болезнями почек, требующими проведения заместительной терапии, нефрологическая патология связана именно с приемом медикаментов.
В группу повышенного риска входят больные старшей возрастной группы, которые длительно получают поддерживающее комбинированное лечение по поводу хронических соматических заболеваний и подвергаются диагностическим процедурам с применением нефротоксичных лекарственных препаратов. Их доля в числе нефрологических пациентов достигает 66%.
Лекарственная нефропатия с употреблением фармацевтических и парамедицинских препаратов, обладающих нефротоксическим действием. Обычно предпосылками к развитию поражения почек становятся неконтролируемый прием медикаментов без учета противопоказаний (самолечение), побочные эффекты при необоснованном назначении или неправильном комбинировании лекарственных средств, наследственная предрасположенность, наличие сопутствующей патологии (сахарного диабета, гипертонической болезни, нефрологических заболеваний и пр .). Повреждение почечной ткани могут вызывать:
Основой развития лекарственной нефропатии служит сочетание нескольких патогенетических механизмов. Часть медикаментов оказывает прямое повреждающее воздействие, приводящее к первичному повреждению клеток проксимальных канальцев, реабсорбирующих нефротоксичное химическое соединение. Канальцевый эпителий также может разрушаться при преципитации кристаллов на фоне употребления сульфаниламидных препаратов, обструкции миоглобином при рабдомиолизе вследствие приема статинов, ингибиторов моноаминоксидазы, производных фенотиазина, некоторых анестетиков.
Возникающая канальцевая дисфункция провоцирует вторичное нарушение фильтрационной способности. Самостоятельным или усугубляющим деструкцию фактором становятся ишемические изменения тканей, вызванные анафилактическим шоком, тромботической микроангиопатией, ингибированием простагландинов и ренин-ангиотензиновой системы с последующим сосудистым спазмом.
Отдельным звеном патогенеза является повреждение гломерулярных и канальцевых базальных мембран иммунными комплексами, в состав которых в качестве антигена входит принимаемое лекарственное средство или его метаболиты. Гломерулопатия и тубулопатия могут развиться как при осаждении циркулирующих в крови иммунных комплексов, так и при реакции антител на химические вещества, связавшиеся со структурными почечными элементами.
При иммунном механизме возникновения нефропатии ведущей является гиперергическая реакция с нарушением ренальной микроциркуляции, выделением гистамина и других медиаторов воспаления. Длительная ишемия тканей в сочетании с альтерацией клеточных элементов потенцирует коллагеногенез и склероз тканей с замещением функциональных элементов соединительнотканными волокнами.
В отечественной урологии принята систематизация клинических форм лекарственных нефропатий на основе патоморфологических изменений почечных тканей с учетом динамики развития заболевания и этиопатогенетических факторов. Такой подход обеспечивает наиболее точное прогнозирование возможных осложнений и исхода, позволяет подобрать оптимальную схему ведения пациента. Выделяют семь основных клинических вариантов медикаментозной нефропатии:
Более редкими формами медикаментозных нефропатий являются расстройства, вызванные выпадением отдельных ренальных функций. Заболевания этой группы представлены преимущественно дисметаболическими нарушениями вследствие тубулопатий — приобретенными вариантами синдрома Фанкони, несахарного почечного диабета, калийпенической почки.
Симптомы лекарственной нефропатии
Клиническая картина полиморфна и зависит от особенностей патогенеза заболевания. Острые формы обычно развиваются в течение 1-3 недель после начала приема НПВС, антибиотиков, сульфаниламидов, диуретиков, других нефротоксичных препаратов. Острые нефропатии характеризуется интенсивной болью в пояснице, увеличением или резким ограничением суточного количества мочи вплоть до полной задержки. Часть пациентов отмечает наличие крови в моче. Возможны общие симптомы, обусловленные интоксикацией организма азотистыми соединениями: повышение температуры тела, головные боли, слабость, сонливость, бледность кожи и слизистых, тахикардия, жажда, сухость во рту, кожный зуд.
В клинической картине хронических нефропатий превалирует картина нарастающей почечной недостаточности. Характерны утренние отеки лица, которые в последующем распространяются на другие части тела. Часто отмечается полиурия и преобладание ночного диуреза. У некоторых больных развивается стойкая, терапевтически резистентная артериальная гипертензия. При возникновении сопутствующей анемии пациенты жалуются на быструю утомляемость, слабость, головокружения. Кожные покровы и видимые слизистые становятся бледными. Возможно сочетание почечной симптоматики с признаками лекарственных поражений других органов: диспепсией, мышечно-скелетными болями, рецидивирующим стоматитом, нарушением менструальной функции.
Острое токсическое действие медикаментов на клетки клубочков и почечных канальцев приводит к резкому снижению фильтрации с развитием клиники ОПН, которая в 50-70% случаев становится причиной летального исхода. При прогрессировании лекарственной нефропатии происходит гибель большинства нефронов, вследствие чего без лечения у пациента через 3-4 года болезни развивается хроническая почечная недостаточность. Патологические колебания показателей водно-электролитного обмена, возникающие при снижении процессов фильтрации и реабсорбции мочи, могут провоцировать появление или усугубление кардиальной патологии (аритмии, ишемической болезни сердца), нарушение кальциевого обмена с последующим остеопорозом.
При возникновении острой почечной дисфункции, связанной по времени с приемом потенциально нефротоксичных лекарственных средств, постановка диагноза медикаментозной нефропатии обычно не представляет сложностей. Более тщательный диагностический поиск требуется при постепенном нарастании почечной симптоматики у пациента, длительное время принимающего определенный фармацевтический препарат. Для диагностики лекарственных нефропатий рекомендованы лабораторно-инструментальные методы, позволяющие оценить морфологическую структуру и функциональную способность почек:
В общем анализе крови возможно умеренное ускорение СОЭ, повышение уровня эозинофилов, снижение содержания эритроцитов и гемоглобина. Дифференциальная диагностика проводится с острым и злокачественным гломерулонефритом, нефропатией при подагре, волчанке, аутоиммунных васкулитах, мочекаменной болезнью, туберкулезом почек, идиопатическим интерстициальным нефритом. Кроме уролога или нефролога к консультированию пациента может привлекаться анестезиолог-реаниматолог, токсиколог, ревматолог, иммунолог, фтизиатр, инфекционист, онколог.
Лечение лекарственной нефропатии
Врачебная тактика ведения больных с медикаментозной нефрологической патологией учитывает клинико-морфологическую форму и особенности патогенеза заболевания. В любом случае лечение начинается с отмены лекарственного средства, вызвавшего нефропатию. При острых процессах оправданы методы, направленные на элиминацию повреждающего соединения, — прием антидотов (при наличии), промывание желудка, гемосорбция, плазмаферез, ускорение экскреции (назначение сорбентов, слабительных средств). Терапия проводится с учетом фильтрующей и реабсорбционной функций. В зависимости от клинической ситуации могут применяться:
Исход болезни зависит от своевременности лечения и степени повреждения почечной паренхимы. Если при острой нефропатии не происходит необратимых изменений в анатомической структуре органа, прогноз благоприятный. Возникновение массивной деструкции и ОПН при отсутствии адекватной терапии существенно повышает риск летального исхода. У пациентов с хроническими нефрологическими заболеваниями и отягощенным преморбидным фоном зачастую наблюдается стойкое снижение фильтрационных возможностей почек, которое можно несколько замедлить назначением медикаментозной терапии.
Для профилактики лекарственной нефропатии необходима коррекция доз препаратов, которые метаболизируются в почках, в соответствии со значениями клиренса креатинина, отказ от применения нефротоксичных лекарств при наличии факторов риска (пожилой возраст, женский пол, интеркуррентные заболевания, снижение ОЦК), исключение полипрагмазии.
2. Лекарственная нефропатия/ Лозинский Е.Ю., Шмыкова И.И., Лозинская Л.М., Елисеева Е.В.// Тихоокеанский медицинский журнал – 2005 - №2.
4. Лекарственные поражения почек: учебное пособие/ Калимуллина Д.Х. и др. под общ. ред. Бакирова А.Б. – 2016.
Читайте также:
