Закладка сосудов эмбриона. Формирование аллантоиса эмбриона
Добавил пользователь Alex Обновлено: 28.01.2026
Закладка сосудов эмбриона. Формирование аллантоиса эмбриона
В мезодерме аллантоиса (или в мезодерме зародышевого ствола), так же как и у птиц, закладываются сосуды, образующие систему пупочных сосудов, позднее они васкуляризируют весь хорион, особенно ту область, которая участвует в образовании плаценты. Закладки пупочных сосудов являются парными, они вторично соединяются с парными зачатками эмбриональных сосудов, тем самым включаясь в кровеносный круг.
Из первоначальной парной закладки со временем возникает одна пупочная вена (vena umbilicalis), которая вместе с двумя пупочными артериями (arteriae umbilicales) проходит в пуповине.
С разрастанием амниотической оболочки полость амниона постепенно расширяется, а амнион вместе со своей мезодермой, обволакивающей его снаружи, приближается к внутренней поверхности хориона, также выстланной мезодермой. Благодаря этому увеличивается пространство амниотической полости, расширяющейся и в области, которые располагаются под брюшной стенкой эмбриона.
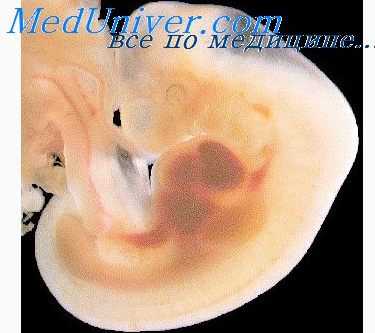
При этом амнион, наподобие вывернутой наизнанку перчатки, своей наружной поверхностью (мезодермой) натягивается на пуповину и, постепенно покрывая ее снаружи, обособляет ее таким образом, что поверхность пуповины оказывается покрытой эктодермой амниона. Одновременно пространство экзоцелома, находящееся между хорионом и амнионом, постепенно уменьшается и полностью исчезает в более поздние стадии развития благодаря тому, что амнион своей наружной мезодермой тесно прилегает к внутреннему мезодермальному слою хориона и сливается с ним; в связи с этим образуется единый амниохорион. При этом также окончательно обособляется и формируется пуповина.
Аллантоис, который, как уже было сказано выше, образуется у человека очень скоро, является всего лишь рудиментарным органом. При описанных процессах он вместе с зародышевым стволом перемещается вентрально, выступая затем из области задней кишки, в которой впоследствии возникает мешкообразное расширение — клоака. Ее змеевидный проток (ductus allantoideus) примыкает к пупочно-кишечному протоку и со временем включается в пуповину, где происходит облитерация (заращение) ее просвета.
В том месте, где змеевидный аллантоис вступает в кишечник, возникает клоака, аналогичная образованию с тем же самым названием, которое развивается и функционирует у птиц. На вентральной стенке каудального конца зародыша энтодермальная стенка этой клоаки без посредничества мезодермы примыкает к поверхностной (кожной) эктодерме эмбриона, обгазуя с ней так называемую клоакальную мембрану, то есть вентральную, брюшную, границу клоакальной полости. Эта мембрана наблюдается уже на очень ранних, основных стадиях развития зародыша, а именно на стадии зародышевого щитка. О ней уже упоминалось в соответствующей главе.
Сосуды, возникшие в области аллантоиса, васкуляризируют мезодерму (мезенхиму) соединившихся пленок хориона и амниона, поскольку они разрастаются в этой мезенхиме и образуют капиллярную сеть. Они представляют собою уже ранее упомянутую систему пупочных сосудов (vasa umbilicalia), которая затем вторично связывается с системой кровообращения эмбриона или же плода.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Аллантоис
К началу 3-й недели эмбрионального развития задняя стенка желточного мешка формирует аллантоис — небольшой вырост, который врастает в амниотическую ножку (тяж впезародышевой мезенхимы, который тянется от зародышевого диска к трофобласту; рис. 8.6). Степка аллантоиса состоит из эпителия (гипобласт) и соединительной ткани (внезародышевая мезенхима). У человека аллантоис остается недоразвитым и играет роль проводника сосудов: вдоль аллантоиса проходят кровеносные сосуды от тела эмбриона к хориону, а значит, к плаценте. На 2-м месяце эмбриогенеза аллантоис атрофируется и превращается в тяж клеток, который вместе с редуцированным желточным мешком входит в состав пупочного канатика (см. рис. 8.5).
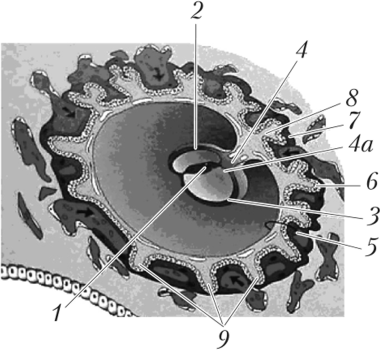
Рис. 8.6. Формирование хориона [ 651 (14-е сутки эмбриогенеза), формирование вторичных ворсинок хориона, амниотической ножки:
1 — зародыш; 2 — амнион; 3 — желточный мешок; 4 — амниотическая ножка; 4а — аллантоис; 5 — хорион; 6 — цитотрофобласт; 7 — симпластотрофо- бласт; 8 — внезародышевая мезодерма; 9 — вторичные ворсинки (эпителий
и соединительная ткань)
Амниотическая оболочка. Пуповина
Амнион формируется с 9—10-х суток эмбриогенеза и представляет собой купол над зародышевым щитком, стенка которого представлена эпителием (эпибласт) и соединительной тканью (внеза- родышевая мезенхима) (см. рис. 8.3).
К концу 2-й недели эмбриогенеза амнион и желточный мешок отодвигаются от быстро растущего трофобласта, но остаются связанными с ним посредством соединительнотканного тяжа — амниотической ножки (рис. 8.6).
К концу 3-й — началу 4-й недели эмбрион приподнимается над желточным мешком, боковые края щитка подворачиваются книзу так, что зародышевая энтодерма, служившая крышей желточного мешка, втягивается в тело зародыша, и формируется зачаток кишки. Эмбрион вдавливается в полость амниона, который формирует складки, окружающие зародыш снизу. Складки амниона сдвигают желточный мешок вплотную к амниотической ножке и окружают эти внезародышевые органы — формируется пупочный канатик (пуповина). Пупочный канатик (см. рис. 8.5) снаружи покрыт эпителием, переходящим с одной стороны в эпидермис кожи плода, а с другой — в эпителий амниотической выстилки. Внутри пупочного канатика находится слизистая соединительная ткань, в которой располагаются остатки желточного мешка, аллантоиса и кровеносные сосуды (две пупочные артерии и одна вена), связывающие плод и плаценту.
Таким образом, па 2-м месяце развития эмбрион оказывается окруженным амниотической оболочкой, основная функция которой — продукция и резорбция амниотической жидкости. По мерс роста эмбриона и увеличения полости амниона наружная соединительнотканная часть его стенки подрастает к соединительной ткани, лежащей под трофобластом, и срастается с ней. Формируется оболочка, изнутри выстланная эпителием амниона, снаружи покрытая эпителием трофобласта с общей соединительной тканью между ними. Это и есть оболочка (в акушерской практике чаще оболочки) плода. Она образует стенку резервуара, заполненного постоянно сменяющейся амниотической жидкостью, в которой находится плод человека. Источники амниотической жидкости: эпителий амниона, продукты диффузии из иптерстиция плаценты, продукты секреции дыхательных путей плода, моча плода (фактически — фильтрат плазмы, не содержащий продуктов метаболизма, так как функцию удаления метаболитов выполняет плацента). Пути удаления амниотической жидкости: резорбция эпителием амниона и заглатывание плодом.
Околоплодные воды — коллоидный раствор сложного биохимического состава, который полностью обновляется за 3 часа. 99 % амниотической жидкости — это вода. В ней находятся органические и неорганические соединения, эпителиальные клетки с поверхности кожи. Значение амниотической жидкости:
Рева И.В. 1, 2 Гармаш А.И. 1 Садовая Я.О. 1 Шиндина А.Д. 1 Индык М.В. 1 Калинин И.О. 1 Шек Л.И. 1 Фургал А.А. 1 Сорокин В.А. 1 Рева Г.В. 1, 2
Для создания фундаментальной платформы по внедрению клеточных технологий в лечение сосудистой патологии необходимо исчерпывающее знание и понимание процессов эмбрионального васкулогенеза и механизмов постнатального ангиогенеза. Противоречивые данные не только по механизмам индукции и ингибирования развития сосудов, но и источников развития эндотелия, противоречия в сроках эмбрионального васкулогенеза, и даже по размерам эмбриона в разные сроки, особенно в самый ранний сразу после имплантации, тормозят развитие не только ангиологии, но и трансплантологии. Клеточные взаимодействия в условиях васкулогенеза изучены в эксперименте на лабораторных животных, а полученные результаты только условно могут быть экстраполированы на человека. На материале эмбриона человека установлено, что васкулогенез в различных органах имеет морфологические отличия, в сердце, печени и нервной трубке кровеносные сосуды отсутствуют, а первичные капилляры идентифицируются в экто- и мезенхиме. Идентификация клеток с рецепторами CD68 и CD163 свидетельствует об их участии в морфо- и васкулогенезе. Полученные данные об особенностях васкулогенеза в различных органах эмбриона человека способствуют пониманию органной специфичности эндотелия.
1. Kupatadze D.D., Nabokov V.V., Malikov S.A., Polozov R.N., Kanina L.Ia., Veselov A.G. Current problems in the reconstructive surgery of the locomotor apparatus in children //Vestn. Khir. Im. I.I. Grek. 1997; 156(2):94-6.
2. Brewster L., Robinson S., Wang R., Griffiths S., Li H., Peister A., Copland I., McDevitt T. Expansion and angiogenic potential of mesenchymal stem cells from patients with critical limbischemia // J. Vasc. Surg. 2017 Mar; 65(3):826-838.e1. DOI: 10.1016/j.jvs.2015.02.061.
3. Banin VV. Role of pericytes in mechanism of vessel neovascularisation in the regenerating connective tissue // Morfologiia. 2004; 125(1):45-50.
5. Liu X., Li Q., Niu X., Hu B., Chen S., Song W., Ding J., Zhang C., Wang Y. Exosomes Secreted from Human-Induced Pluripotent Stem Cell-Derived Mesenchymal Stem Cells Prevent Osteonecrosis of the Femoral Head by Promoting Angiogenesis // Int J Biol Sci. 2017 Feb 6; 13(2):232-244. DOI: 10.7150/ijbs.16951.
6. Tournois C., Pignon B., Sevestre M.A., Al-Rifai R., Creuza V., Poitevin G., Franсois C., Nguyen P. Cell therapy in critical limb ischemia: A comprehensive analysis of two cell therapy products // Cytotherapy. 2017 Feb; 19(2):299-310. DOI: 10.1016/j.jcyt.2016.10.013.
7. Nguyen H.L., Boon L.M., Vikkula M. Vascular Anomalies Caused by Abnormal Signaling within Endothelial Cells: Targets for Novel Therapies // Semin Intervent Radiol. 2017 Sep; 34(3):233-238. DOI: 10.1055/s-0037-1604296.
8. Varazashvili M.N., Mchedlishvili G.I. The hematocrit in the microcirculatory bed of the brain // Fiziol. Zh SSSR Im I.M. Sechenova. 1991 Jun; 77(6):12-9.
9. Mchedlishvili G.I. Disturbances of the normal structuring of the blood flow in the microvessels as the cause of hemorheological disorders // Fiziol. Zh Im I M Sechenova. 1996 Dec; 82(12):41-7.
11. Catani L., Sollazzo D., Bianchi E., Ciciarello M., Antoniani C., Foscoli L., Caraceni P., Giannone F.A., Baldassarre M., Giordano R., Montemurro T., Montelatici E., D’Errico A., Andreone P., Giudice V., Curti A., Manfredini R., Lemoli R.M. Molecular and functional characterization of CD133 + stem/progenitor cells infused in patients with end-stage liver disease reveals their interplay with stromal liver cells // Cytotherapy. 2017 Sep 13. pii: S1465-3249(17)30660-6. DOI: 10.1016/j.jcyt.2017.08.001.
12. Dreyer C.H., Kjaergaard K., Ditzel N., Jоrgensen N.R., Overgaard S., Ding M. Optimizing combination of vascular endothelial growth factor and mesenchymal stem cells on ectopic bone formation in SCID mice // J Biomed Mater Res A. 2017 Sep 6. DOI: 10.1002/jbm.a.36195.
13. Caporali A., Martello A., Miscianinov V., Maselli D., Vono R., Spinetti G. Contribution of pericyte paracrine regulation of the endothelium to angiogenesis // Pharmacol Ther. 2017 Mar; 171:56-64. DOI: 10.1016/j.pharmthera.2016.10.001.
14. Mathiyalagan P., Liang Y., Kim D., Misener S., Thorne T., Kamide C.E., Klyachko E., Losordo D.W., Hajjar R.J., Sahoo S. Angiogenic Mechanisms of Human CD34 + Stem Cell Exosomes in the Repair of Ischemic Hindlimb // Circ Res. 2017 Apr 28; 120(9):1466-1476. DOI: 10.1161/CIRCRESAHA.116.310557.
15. Rigato M., Fadini G.P. Circulating stem/progenitor cells as prognostic biomarkers in macro- and microvascular disease. A narrative review of prospective observational studies.//Curr Med Chem. 2017 Sep 20. DOI: 10.2174/0929867324666170920154020.
17. Wu Q.H., Ma Y., Ruan C.C., Yang Y., Liu X.H., Ge Q., Kong L.R., Zhang J.W., Yan C., Gao P.J. Loss of osteoglycin promotes angiogenesis in limb ischaemia mouse models via modulation of vascular endothelial growth factor and vascular endothelial growth factor receptor 2 signalling pathway // Cardiovasc Res. 2017 Jan; 113(1):70-80. DOI: 10.1093/cvr/cvw220.
20. Guerin C.L., Rossi E., Saubamea B., Cras A., Mignon V., Silvestre J.S., Smadja D.M. Human very Small Embryonic-like Cells Support Vascular Maturation and Therapeutic Revascularization Induced by Endothelial Progenitor Cells // Stem Cell. 2017 Aug; 13(4):552-560. DOI: 10.1007/s12015-017-9731-7.
21. Welt K., Schippel K., Mironov V.A., Mironov A.A., Alimov G.A., Bobrik I.I., Banin V.V., Karaganov J.L. Vascular endothelium (review). I. General morphology. 2A: histogenesis of the vascular endothelium // Gegenbaurs Morphol Jahrb. 1990; 136(2):163-99.
22. Kang J.M., Yoon J.K., Oh S.J., Kim B.S., Kim S.H. Synergistic Therapeutic Effect of Three-Dimensional Stem Cell Clusters and Angiopoietin-1 on Promoting Vascular Regeneration in Ischemic Region // Tissue Eng Part A. 2017 Sep 26. DOI: 10.1089/ten.TEA.2017.0260.
23. Banin V.V., Muller F.S. Effect of hydrogen peroxide on the permeability of the walls of the mesenteric venules for fluorescein // Fiziol Zh SSSR Im I M Sechenova. 1988 Aug; 74(8):1149-57.
24. Calderon G.A., Thai P., Hsu C.W., Grigoryan B., Gibson S.M., Dickinson M.E., Miller J.S. Tubulogenesis of co-cultured human iPS-derived endothelial cells and human mesenchymal stem cells in fibrin and gelatin methacrylate gels // Biomater Sci. 2017 Jul 25; 5(8):1652-1660. DOI: 10.1039/c7bm00223h.
26. Du W., Zhang K., Zhang S., Wang R., Nie Y., Tao H., Han Z., Liang L., Wang D., Liu J., Liu N., Han Z., Kong D., Zhao Q., Li Z. Enhanced proangiogenic potential of mesenchymal stem cell-derived exosomes stimulated by a nitric oxide releasing polymer // Biomaterials. 2017 Jul; 133:70-81. DOI: 10.1016/j.biomaterials.2017.04.030.
28. Bikfalvi A. History and conceptual developments in vascular biology and angiogenesis research: a personal view // Angiogenesis. 2017 Jul 24. DOI: 10.1007/s10456-017-9569-2.
29. Putman D.M., Cooper T.T., Sherman S.E., Seneviratne A.K., Hewitt M., Bell G.I., Hess D.A. Expansion of Umbilical Cord Blood Aldehyde Dehydrogenase Expressing Cells Generates Myeloid Progenitor Cells that Stimulate Limb Revascularization // Stem Cells Transl Med. 2017 Jul; 6(7):1607-1619. DOI: 10.1002/sctm.16-0472.
30. Rossi E., Smadja D., Goyard C., Cras A., Dizier B., Bacha N., Lokajczyk A., Guerin C.L., Gendron N., Planquette B., Mignon V., Bernabеu C., Sanchez O., Smadja D.M. Co-injection of mesenchymal stem cells with endothelial progenitor cells accelerates muscle recovery in hind limb ischemia through an endoglin-dependent mechanism // Thromb Haemost. 2017 Aug 3; 117(10). DOI: 10.1160/TH17-01-0007.
31. Кнорре А.Г. Краткий очерк эмбриологии человека с элементами сравнительной, экспериментальной и патологической эмбриологии. – 1967. – С. 202–209.
32. Robertson D.J. Congenital arteriovenous fistulae of the extremities // J. Cardiovasc Surg (Torino). 1965 Sep-Oct; 5(6):Suppl:237-40.
Врожденные пороки развития сосудов являются причиной приблизительно 20 % смертей в неонатальном периоде, а также занимают значительное место в практике акушерства и гинекологии, медицинской генетике, детской хирургии и ортопедии, патологической анатомии [1]. Аномалии развития артерий и вен, такие как агенезия, аплазия, артериальные и венозные аневризмы, недоразвитие клапанного аппарата вен возникают при нарушении образования сосудистых стволов. По данным Brewster L., Robinson S., Wang R., Griffiths S., Li H., Peister A., Copland I., McDevitt T. (2017) нарушения ангиогенеза, критичные для жизни, наблюдаются среди населения в 1 % случаев [2], а связанные с заболеванием периферических артерий – в 10 % [3–5]. При этом традиционные варианты реваскуляризации возможны только у 50 % пациентов, остальным потребуются методы клеточной терапии, с использованием клеток костного мозга, мезенхимальных стволовых клеток (мск), обладающих большим потенциалом в качестве альтернативы реваскуляризационной терапии [6]. Nguyen H.L., Boon L.M., Vikkula M. (2017) указывают на то, что возникают сосудистые аномалии как следствие неправильного развития и регуляции ангиогенеза [7]. Исследуя ангиогенез, Varazashvili M.N., Mchedlishvili G.I. (1991), Mchedlishvili G.I. (1996) пришли к выводу, что агрегация эритроцитов вызывает нарушения кровотока и ишемию [8–10].
Знания о патофизиологических основах сосудистых аномалий резко возросли за последние 5 лет, дополнив теорию эмбриогенеза сосудистой системы молекулярно-генетическими находками [11]. Нарушения общих внутриклеточных сигнальных путей, часто активирующие мутации, по мнению автoров новых концепций, вызывают эндотелиальную клеточную дисфункцию [12–14]. Mathiyalagan P., Liang Y., Kim D., Misener S., Thorne T., Kamide C.E., Klyachko E., Losordo D.W., Hajjar R.J., Sahoo S. (2017) большую роль отводят СD34+ стволовым клеткам, которые, по их мнению, способны через паракринную секрецию влиять на ангиогенез. Подавляя и одновременно модулируя экспрессию генов, участвующих в ангиогенезе, ответственных за синтез сосудистого эндотелиального фактора роста, ангиопоэтина 1 и ангиопоэтина 2 (ANG1, ANG2), metallopeptidase 9 (MMP9), thrombospondin 1(TSP1), они оказывают терапевтический эффект при ишемии задних конечностей у мыши, что может быть перспективным для экстраполяции в медицинскую практику [15].
Предметом острых дискуссий является вопрос происхождения эндотелия. Rigato M., Fadini G.P. (2017) считают, что циркулирующие прогениторные клетки (circulating progenitor cells, СРС) и эндотелиальные прогениторные клетки (endothelial progenitor cells, ЕРС) являются незрелыми клетками, участвующими в сосудистой регенерации и связанными со многими аспектами макро-и микрососудистых заболеваний [16]. Lu W., Li X. (2017) считают стволовые/прогениторные клетки (VSCs) выполняющими ключевую роль в развитии организма и важным источником всех видов сосудистых клеток, необходимых для создания, поддержания, регенерации и ремоделирования кровеносных сосудов. Авторы выделяют четыре основных типа VSCs, в том числе эндотелиальные прогениторные клетки (Ерс), гладкие мышечные прогениторные клетки (SMPCs), перициты и мезенхимальные стволовые клетки (Мск) [17]. Lin C.S., Lue T.F. (2013) подвергают сомнению роль перицитов, как стволовых, с учётом экспериментальных доказательств их ингибирующих ангиогенез свойств и функционального разнообразия [18]. Мезенхимальные стволовые клетки (мск) существуют в большинстве тканей взрослого человека и располагаются вблизи или внутри кровеносных сосудов. Ibrahim M., Richardson M.K. (2017) свидетельствуют о важности изучения ангиогенеза, так как состояние этого вопроса тормозит развитие трансплантологии, методов репаративной регенерации во всех областях медицины, и на современном этапе имеет недостаточность в изучении на материале человека [19]. Guerin C.L., Rossi E., Saubamea B., Mignon V., Silvestre J.S., Smadja D.M. (2017), подтвердив результаты Банина В.В., Куприянова В.В., Karaganov J.L., Мчедлишвили, Welt с соавторами [20] выдвинули концепцию реваскуляризации критически ишемизированной конечности за счёт выделенных из костного мозга мелких эмбрионально подобных плюрипотентных эндотелиальных прогениторных клеток, способных дифференцироваться в эндотелиоциты с терапевтическим реваскуляризационным потенциалом [21].
Поскольку ангиодисплазии не относятся к казуистическим находкам, существует острая необходимость разработки стратегий консервативного лечения на основе клеточных технологий. Однако, по данным Kang J.M., Yoon J.K., Oh S.J., Kim B.S., Kim S.H. (2017), в клинической практике использование взрослых стволовых клеток имеет ряд ограничений, таких, как низкая выживаемость клетки и низкая терапевтическая эффективность [22]. Несмотря на значительные успехи в изучении ангиогенеза, наличие нескольких противоречивых концепций развития сосудов в теле эмбриона человека (из мезенхимы и целома), а также участия в ангиогенезе циркулирующих ангиобластов, свидетельствуют о том, насколько далека эта проблема от решения. Множество концепций ангиодисплазий учитывают экзо- и эндогенные, молекулярно-генетические, метаболические и другие факторы, которые на современном этапе не получили окончательного подтверждения, а теория эмбриогенеза сосудистой системы требует значительной доработки, поэтому гистогенез эндотелия на современном этапе является одной из важнейших проблем васкуло- и ангиогенеза [23]. Calderon G.A., Thai P., Hsu C.W, Grigoryan B., Gibson S.M., Dickinson M.E., Miller J.S. (2017) подтвердили исследования Banin V.V. [24]. Jeong H.W., Hernfndez-Rodriguez B., Kim J., Kim K.P., Enriquez-Gasca R., Yoon J., Adams S., Scholer H.R., Vaquerizas J.M., Adams R.H. (2017) указывают, что молекулярные механизмы, регулирующие эндотелиальную активность клеток на различных этапах сосудистого роста, ремоделирования, созревания и покоя, остаются неясными [25]. Васкуло- и ангиогенез представляют собой сложные процессы, которые требуют скоординированных изменений в эндотелиальных клетках [26]. Многочисленные гипотезы происхождения эндотелиоцитов трактуют их развитие в связи с теорией трех зародышевых листков [27]. Существенная роль кровеносных сосудов в тканях и органах человека, понимание функциональных свойств и основополагающей молекулярной основы VSC имеет решающее значение для фундаментальных исследований [28]. Современное неудовлетворительное состояние данных по вопросу эмбрионального ангиогенеза определило направление нашего исследования.
Цель исследования – изучить кровеносные сосуды эмбриона человека в эмбриональном периоде.
Материалы и методы исследования
Исследование выполнено с учётом положений Хельсинской декларации (2000) и с разрешением этического комитета ФГАОУ ВО «Дальневосточный федеральный университет». Биоптаты эмбрионов были получены в соответствии с приказом Минздравмедпрома РФ от 29.04.94 № 82 «О порядке проведения патологоанатомических вскрытий» и в соответствии с номенклатурой клинических лабораторных исследований МЗ РФ (приказ 21 февраля 2000 г. № 64). Изучен материал эмбрионов человека 3, 5, 8 недель эмбрионального развития. Распределение материала представлено в табл. 1.
ОЦЕНКА РАЗВИТИЯ ЭМБРИОНА ПРИ ОВОСКОПИИ И ВСКРЫТИИ
Сюда входят: определение интенсивности роста и развития эмбрионов и внезародышевых оболочек (серозная, амнион, аллантоис, желточный мешочек), установление степени использования эмбрионом питательных веществ (главным образом желтка и белка), учет количества инкубационных отходов.
При инкубации яиц одной и той же фермы просмотру подлежат лишь несколько контрольных лотков из партии, заложенной в инкубатор. При инкубации сборной партии яиц овоскопированию следует подвергать лотки с яйцами каждой фермы (не менее 2—3).
При первом просмотре эмбрион еще очень мал, располагается в глубине желтка и поэтому плохо виден. Для лучшего просмотра яйцо слегка поворачивают в руке. При нормальном развитии эмбриона удается видеть его тень и сеть кровеносных сосудов. При отставании в развитии зародыш находится ближе к подскорлупной оболочке и поэтому легко просматривается. Сосудистая сеть желточного мешка недостаточно наполнена кровью. Наличие кровяного кольца на желтке свидетельствует о гибели эмбриона. Если эмбрион при просвечивании яйца не обнаруживается, можно предположить, что либо яйцо было неоплодотворенное, либо произошла гибель эмбриона на ранних стадиях развития.
В некоторых случаях возникает необходимость определить степень развития эмбрионов в первые дни инкубации. Для этого из нескольких лотков инкубируемой партии берут по 2—3 яйца. Ручкой скальпеля разбивают скорлупу в боковой части тупого конца яйца, пинцетом с тонкими концами надбитые части скорлупы снимают вместе с подскорлупной пленкой. Эмбрион вместе с сосудистым полем осторожно вырезают ножницами с тонкими концами и затем шпателем переносят в физиологический раствор поваренной соли. Затем эмбрион переносят на предметное стекло и при малом увеличении микроскопа подсчитывают сомиты, определяют степень развития мозговых пузырей, сердца, кровяных островков и сосудов подлежащего сосудистого поля.
При втором просмотре у эмбрионов при нормальном развитии аллантоис выстилает всю внутреннюю поверхность скорлупы, охва-
тывает белок и замыкается в остром конце яйца. Аналогичное состояние наблюдается при исследовании утиных яиц на 13-е и гусиных на 15-е сутки инкубации. Если эмбрион отстает в развитии, то аллантоис не смыкается в остром конце яйца, иногда не покрывает весь белок, что затрудняет использование последнего. Сосуды аллантоиса недостаточно наполнены кровью.
При третьем просмотре нормально развивающийся эмбрион заполняет все яйцо, тесно прилегает к зародышевым оболочкам, шея эмбриона выпячивается в воздушную камеру, которая достигает значительной величины. Граница воздушной камеры яйца имеет извилистый вид, а острый конец яйца темный. При плохом развитии эмбрион не полностью заполняет яйцо, так как он мал, поэтому в тупом и остром концах яйцо просвечивается.
Особое внимание обращают на наклев и вывод. Наклев должен проходить своевременно, ближе к тупому концу яйца. При неправильном развитии эмбриона наклев скорлупы запаздывает или появляется раньше срока и часто ближе к острому концу яйца. Дружный и своевременный вывод свидетельствует о хорошем развитии эмбрионов, о достаточном использовании ими желтка и белка яйца.
Нарушение режима инкубации или использование биологически неполноценных яиц может явиться причиной запаздывания вывода, который растягивается на более продолжительные сроки (значительная часть яиц содержит погибшие зародыши). Но следует учитывать некоторые факторы, которые могут оказать влияние на время вывода цыплят. Яйца кур мясо-яичного направления инкубируются на 8 ч дольше по сравнению с яйцами кур яичного направления. Имеет значение также возраст птицы. Яйца переярых несушек инкубируются на 6—8 ч дольше, чем яйца молодок.
Принято считать, что при инкубации биологически полноценных яиц начало и конец вывода проходят в срок. Это же дает основание сделать вывод, что в инкубаторе были созданы необходимые условия для развития эмбрионов. Однако самые совершенные режимы не могут обеспечить своевременную выводимость при инкубации биологически неполноценных яиц. Важным признаком правильного развития эмбрионов является потеря массы яйцами. При нормальном инкубационном процессе среднесуточная потеря в массе куриных яиц (с 1-х по 6-е сутки) составляет 0,5—0,6%, утиных — 0,4—0,5, гусиных (до 8 сут.) — 0,3—0,4%. После смыкания аллантоиса потеря массы яиц ускоряется.
В конце инкубации определяют энергию вывода, которая обусловливается характером вывода молодняка птицы. Для этих целей учитывают начало наклева скорлупы, подсчитывают количество яиц с наклевом и время появления выведенных цыплят. Далее подсчитывают количество пустых скорлупок выведенных цыплят через
определенный интервал, примерно через 4—6 ч. При учете пустых скорлупок обращают внимание на их содержимое: состояние сосудистой сети аллантоиса, наличие кровоизлияний, количество белка яйца. При нормальном развитии эмбриона после вывода сосуды аллантоиса должны быть запустевшими и не содержать следов крови, стенка аллантоиса тонкая, бледно-розового цвета, а белок использован полностью. Кристаллы мочевой кислоты должны находиться в минимальном количестве.
Отходы инкубации подразделяют на следующие четыре категории (табл. 13.2):
Первая категория погибших эмбрионов неоднородна, ее можно разделять на группы.
Классификация отходов инкубации
Неоплодотворенные яйца и погибшие эмбрионы в первые 48 ч инкубации
Период инкубации, дней
Яйца, погибшие в первые 2 дня инкубации (до начала кроветворения), отличаются большой подвижностью желтка вследствие его разжижения.
Яйца с погибшим зародышем в период со 2-го по 4-й день имеют малое кровяное кольцо, так как краевые сосуды у них небольшие.
У эмбрионов, погибших в яйцах в период с 4-го по 6-й день инкубации, тело зародыша темное, часто присохшее, а кровяное кольцо большое.
На 19-е сутки инкубации при просмотре эмбрионов оценивают степень подготовленности их к выводу. К первой категории относят яйца, у зародышей которых заметна шея в воздушной камере, а в остром конце яйца еще имеется белок. Вторая категория характеризуется тем, что шея у зародыша не выпячивается и острый конец не просвечивается. У третьей — шея у зародыша выпячивается и острый конец просвечивается. К четвертой категории относятся яйца, в которых зародыш не выпячивает шею в воздушную камеру, виден широкий участок функционирующего аллантоиса с кровеносными сосудами, а острый конец яйца просвечивается, так как белок использован не полностью.
Среднюю категорию на каждый контрольный день характеризует величина К, которую вычисляют по формуле
где AvA2, Ау А4 — число яиц, отнесенных к той или иной категории; 1, 2, 3, 4 — категории развития; п — число просмотренных живых зародышей.
При изучении потерь в массе яиц в процессе инкубации нужно взвесить все яйца контрольного лотка на 6, 11, 19-й дни инкубации. Инкубационные показатели определяют по проценту оплодотворен- ности, выводимости яиц и вывода здоровых цыплят отдельно по партиям.
Оплодотворенность определяют путем подсчета количества живых и погибших эмбрионов при инкубации, а также после вскрытия всех яиц, отнесенных к группе «неоплодотворенные». Яйца, отнесенные к группе «неоплодотворенные», вскрывают для установления истинной неоплодотворенности. Это необходимо делать потому, что часть эмбрионов погибает на ранних стадиях развития (до образования кровяных островков). При просвечивании таких яиц зародышевые диски в них не видны, и оплодотворенные яйца можно отнести к категории неоплодотворенных. Неоплодотворенные яйца отличаются от оплодотворенных тем, что в последних виден бластодиск с хорошо выраженными периферической (темное поле) и центральной (светлое поле) зонами.
Выводимость выражают в процентах от числа оплодотворенных яиц.
Гибель зародышей зависит от многих факторов. Больше задохликов при нарушениях режима инкубации. К гибели зародышей (кровяное кольцо) ведут повышенные температуры в первые дни инкубации. Велика смертность эмбрионов в первые дни инкубации «старых» яиц, хранившихся более 15 сут. с момента их снесения. Продолжительное хранение может вызвать также гибель бластодиска до закладки яиц в инкубатор. В этих случаях яйца принимают за не- оплодотворенные, так как зародыши не развиваются. Это следует учитывать при определении выводимости. Большое количество так называемых неоплодотворенных яиц указывает на то, что яйца «старые».
Повышенная смертность эмбрионов во вторую половину инкубации (с 7-го по 19-й день) свидетельствует о биологической неполноценности инкубационных яиц, которая обусловлена неправильным кормлением и содержанием родительского поголовья. Часто она наблюдается при недостатке в рационе витаминов группы В и при нарушении белкового питания несушек.
По количеству инкубационных отходов не всегда можно определить причину массовой гибели зародышей. Поэтому вскрывают яйца с мертвыми зародышами (см. цв. вкл., рис. 4-8). При этом определяют, на какой стадии развития погибли эмбрионы, характер патолого-анатомических изменений в теле эмбрионов и в провизорных органах (зародышевые оболочки).
Вскрытие яиц осуществляют в тонких резиновых перчатках, так как нередко в яйце с погибшим эмбрионом могут находиться патогенные микроорганизмы.
Инкубационные отходы вскрывают следующим приемом. После удаления надбитых частей скорлупы определяют положение зародыша, затем извлекают его из яйца и осматривают содержимое скорлупы. Особое внимание при этом обращают на состояние зародышевых оболочек. Как известно, под конец инкубации зародышевые оболочки подвергаются инволюции, их сосуды запустевают, околоплодная жидкость полностью исчезает. Обнаружение недостаточной инволюции оболочек и наполненность их сосудов кровью свидетельствуют о неправильном развитии эмбриона, вызванном нередко нарушением режима инкубации. В ряде случаев полнокровность сосудов зародышевых оболочек и утолщение их (отечность) указывают на наличие инфекционных заболеваний. Обращают внимание на степень использования белка. После этого эмбрион осматривают (определяют оперяемость, величину желточного мешка и состояние пуповины), затем вскрывают брюшную полость. Для этого разрезают острыми концами ножниц кожу по средней линии, отворачивают и рассекают обнаженную грудину. Из брюшной полости извлекают очень осторожно втянувшийся желток с желточным мешком, так как стенка желточного мешка очень тонкая и легко разрывается; при этом желток может вылиться в брюшную полость и мешать осмотру внутренних органов. Вынимают внутренние органы пинцетом и ножницами и кладут в чашку Петри. Осматривают серозную оболочку, вскрывают органы и данные записывают в протокол. Учитывая разнообразие патолого-анатомических признаков, желательно вывести процент поражения и провести их оценку.
Для окончательного установления причин гибели зародышей иногда проводят специальные исследования, например вирусологические, бактериологические, микологические.
Вопрос 21. Основные принципы формирования провизорных органов эмбриона человека (амнион, желточный мешок, аллантоис, пуповина, хорион, плацента).
Провизорные органы – органы, образующиеся в эмбриогенезе животных для обеспечения жизненно важных функций ( дыхание , питание , выделение , движение и др. ), которые фукционируют только у зародыша и не сохраняются во взрослом состоянии.
Амнион — временный орган, обеспечивающий водную среду для развития зародыша. В эмбриогенезе человека он появляется на второй стадии гаструляции сначала как небольшой пузырек, дном которого является первичная эктодерма. Стенка пузырька образует внезародышевую эктодерму, которая соединяется с внезародышевой мезодермой, разрастается и окружает зародыш тонкой полупрозрачной амниотической оболочкой.
Амнион быстро увеличивается, и к концу 7-й недели его соединительная ткань входит в контакт с соединительной тканью хориона. При этом эпителий амниона переходит на амниотическую ножку, превращающуюся позднее в пупочный канатик, и в области пупочного кольца смыкается с эпителиальным покровом кожи эмбриона. Основная функция амниотической оболочки — выработка околоплодных вод, обеспечивающих среду для развивающегося организма и предохраняющих его от механического повреждения, а также их всасывание и поддержание необходимой концентрации солей. Амнион выполняет также защитную функцию, предупреждая попадание в плод вредоносных агентов.
Желточный мешок — наиболее древний в эволюции внезародышевый орган, возникший как орган, депонирующий питательные вещества (желток), необходимые для развития зародыша. У человека он образован внезародышевой энтодермой и внезародышевой мезодермой.
Аллантоис представляет собой небольшой пальцевидный отросток в каудальном отделе зародыша, врастающий в амниотическую ножку. Он является Производным желточного мешка и состоит из внезародышевой энтодермы и висцерального листка мезодермы. У человека аллантоис не достигает значительного развития, но его роль в обеспечении питания и дыхания зародыша все же велика, так как по нему к хориону растут сосуды, располагающиеся в пупочном канатике. Это орган газообмена и выделения. По сосудам аллантоиса доставляется кислород, а в аллантоис выделяются продукты обмена веществ зародыша. На 2м месяце аллантоис редуцируется и зарастает.
Пупочный канатик, или пуповина, представляет собой упругий тяж, соединяющий зародыш (плод) с плацентой. Он покрыт амниотической оболочкой, окружающей слизистую соединительную ткань с кровеносными сосудами (две пупочные артерии и одна вена) и рудиментами желточного мешка и аллантоиса.
Хорион, или ворсинчатая оболочка, появляется впервые у млекопитающих, развивается из трофобласта и внезародышевой мезодермы. Первоначально трофобласт представлен слоем клеток, образующих первичные ворсинки. Они выделяют протеолитические ферменты, с помощью которых разрушается слизистая оболочка матки и осуществляется имплантация. На 2-й неделе трофобласт приобретает двуслойное строение в связи с формированием в нем внутреннего клеточного слоя (цитотрофобласт) и симпластического наружного слоя (симпластотрофобласт или синцитиотрофобласт), который является производным клеточного слоя. Появляющаяся в эмбриобласте внезародышевая мезодерма (у человека на 2—3-й неделе развития) подрастает к трофобласту и образует вместе с ним вторичные эпителиомезенхимальные ворсинки. С этого времени трофобласт превращается в хорион, или ворсинчатую оболочку.
В начале 3-й недели в ворсинки хориона врастают кровеносные капилляры и формируются третичные ворсинки. Это совпадает с началом гематотрофного питания зародыша. Дальнейшее развития хориона связано с двумя процессами — разрушением слизистой оболочки матки вследствие протеолитической активности наружного (симпластического) слоя и развитием плаценты.
Читайте также:
