Ангиогенные факторы роста опухоли.
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Морфологическая классификация
В основе традиционных классификаций рака почки лежат особенности морфологии клетки и клеточного ядра. Современные классификации учитывают данные морфологических, цитогенетических и молекулярных исследований и выделяют 5 видов рака почки:
- Светлоклеточный - 60-85%
- Хромофильный (Папиллярный) - 7-14%
- Хромофобный - 4-10%
- Онкоцитарный - 2-5%
- Рак собирательных протоков - 1-2%
О прогностической значимости различных вариантов почечно-клеточного рака будет сказано ниже.
Метастазирование
Говоря о течении метастатической болезни при раке почки, нельзя не упомянуть о случаях спонтанной регрессии и стабилизации. Спонтанная регрессия отмечается у 0,4%-0,8% больных раком почки. Это касается в подавляющем большинстве случаев регрессии легочных метастазов. Стабилизация болезни, определяемая, как отсутствие роста и появления новых метастазов, наблюдается у 20-30% больных. С такой же частотой отмечается стабилизация болезни (отсутствие роста первичной опухоли) у больных раком почки без метастазов. Этот феномен должен учитываться при решении вопроса о хирургическом или системном лечении больных с высоким риском, которые в действительности, могут прожить дольше без всякого лечения.
Классификация рака почки
Почечно-клеточный рак характеризуется весьма вариабельным клиническим течением, что обусловлено генетической гетерогенностью и морфологическим разнообразием данной группы опухолей.
В настоящее время в России, как и во многих странах, используется классификация, предложенная Международным противораковым союзом ((UICC) tumor, node, metastasis (TNM)), подробно освещающая степень распространенности опухолевого процесса с целью определения лечебной тактики.
TNM клиническая классификация почечно-клеточного рака (2002)
Т - первичная опухоль
ТХ - первичная опухоль не может быть оценена
Т0 - нет данных о первичной опухоли
Т1 - опухоль не более 7 см в наибольшем измерении, ограниченная почкой
- T1a - опухоль до 4 см
- T1b - опухоль 4-7 см
Т2 - опухоль более 7 см в наибольшем измерении, ограниченная почкой
Т3 - опухоль распространяется в крупные вены, или инвазирует надпочечник, или окружающие ткани, но не выходит за пределы фасции Герота
- Т3а - опухолевая инвазия надпочечника или паранефральной клетчатки впределах фасции Герота
- Т3b - опухоль распространяется в почечную вену или нижнюю полую вену ниже диафрагмы
- Т3с - опухоль распространяется в нижнюю полую вену выше диафрагмы или инвазирует ее стенку.
Т4 - Опухоль распространяется за пределы фасции Герота

Рисунок 1. Схематическое изображение стадий Т1 и Т2
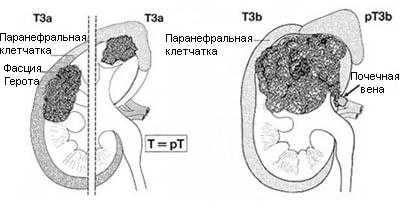
Рисунок 2. Схематическое изображение стадий Т3а и Т3b
N - регионарные лимфатические узлы
NX - регионарные лимфатические узлы не могут быть оценены
N0 - нет метастазов в регионарных лимфатические узлах
N1 - метастаз в одном регионарном лимфатическом узле
N2 - метастазы более чем в одном регионарном лимфатическом узле
М - отдаленные метастазы
МХ - отдаленные метастазы не могут быть оценены
М0 - нет отдаленных метастазов
М1 - отдаленные метастазы
pTNM - патологоанатомическая классификация
pT, pN и pM категории соответствуют T, N и М категориям
G - гистопаталогическая градация
GX - степень дифференцировки не может быть оценена
G1 - высоко дифференцированная опухоль
G2 - умеренно дифференцированная опухоль
G3-4 - низко дифференцированная/недифференцированная опухоль
Группировка по стадиям
Стадия I
Cтадия II
Стадия III
Стадия IV
Факторы прогноза
Клинические факторы
Одним из важнейших направлений современной онкоурологии является выделение факторов, позволяющих составить индивидуальный прогноз и определить оптимальную тактику лечения больных раком почки.
По данным ряда авторов прогностически неблагоприятным являются: тяжелое общее состояние больного, наличие клинических симптомов заболевания на момент установления диагноза, снижение массы тела более чем на 10%. Напротив, возраст, пол и национальность не влияют на прогноз. В ряде исследований продемонстрировано достоверное неблагоприятное влияние на выживаемость увеличения скорости оседания эритроцитов (СОЭ), гаптоглобулина, ферритина, С-реактивного белка, орозомукоида, ?-1-антитрипсина, интерлейкина-6.
У больных диссеминированным почечно-клеточным раком прогностическое значение имеют анемия, гиперкалиемия, гипоальбуминемия и повышение уровня щелочной фосфатазы сыворотки крови.
Показано влияние на исход заболевания таких факторов, как хромогранин А, нейронспецифическая энолаза (NSE), раковый антиген 125 (СА-125), опухоль-ассоциированный ингибитор трипсина (TATI) и эритропоэтин. В настоящее время проводятся исследования, посвященные изучению генетических маркеров в крови и моче, которые могут позволить составить индивидуальный прогноз больных раком почки.
Патоморфологические факторы
Стадия опухолевого процесса (Т), отражающая анатомическую распространенность новообразования, является наиболее значимым фактором прогноза при раке почки. Пациенты с опухолью, ограниченной почкой, имеют лучший прогноз. Инвазия за пределы капсулы Герота (T3a) уменьшает выживаемость на 27%, наличие опухолевого тромбоза почечной и нижней полой вен (T3b-c) - на 40% (таблица 1, рисунок 3).
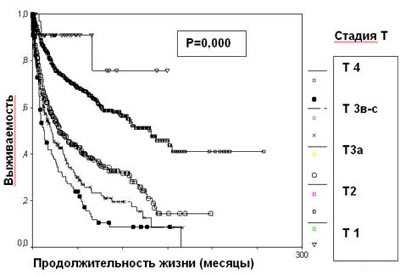
Рисунок 3. Выживаемость 2507 больных раком почки в зависимости от стадии Т
Стадия T
5-летняя выживаемость (%)
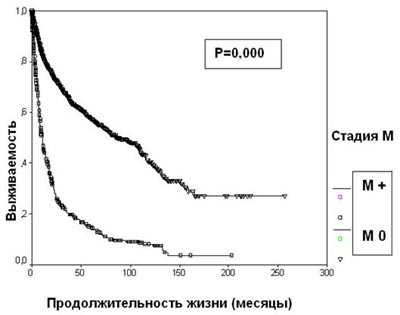
Рисунок 4. Выживаемость 2507 больных раком почки в зависимости от стадии N
Появление отдаленных метастазов резко ухудшает прогноз при раке почки. 5-летняя выживаемость больных диссеминированным раком почки составляет 14,6%, что достоверно меньше, чем в группе пациентов с локализованной опухолью (57,3%) (р=0,0000) (рисунок 5). При наличии отдаленных метастазов стадия Т почечно-клеточного рака прогностического значения не имеет.
Большая продолжительность жизни при диссеминированном почечно-клеточном раке наблюдается при метахронном появлении метастазов и солитарных опухолевых очагах, локализующихся в одном органе. Одним из наиболее важных прогностических факторов является возможность радикального удаления всех определяемых метастазов.
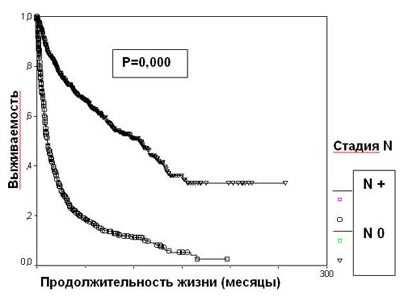
Рисунок 5. Выживаемость 2507 больных раком почки в зависимости от стадии М
Гистопатоморфологические признаки
Большинство современных гистологических классификаций принимает во внимание морфологические признаки клеточного ядра, которые являются независимыми факторами прогноза, занимающими второе место по значимости после стадии заболевания. 5-летняя выживаемость пациентов с опухолями GI составляет 76%, GII - 72%, GIII - 51%, GIV - 35%.
Плоидность ДНК коррелирует с целлюлярной кинетикой почечно-клеточного рака: в диплоидных опухолях отмечается более низкий уровень фракции клеток, находящихся в S-фазе, а также более продолжительное время удвоения опухоли, чем в анеуплоидных клонах, что ассоциировано с благоприятным прогнозом .
На выживаемость больных раком почки влияет митотический индекс. Выявлено, что при наличии менее 1 фигуры митоза на 10 полей зрения при малом увеличении 10-летняя выживаемость составляет 67%, более 1 - 16%.
Генетические факторы
Как было отмечено выше, современные классификации рака почки учитывают не только морфологические, но и цитогенетические особенности опухоли, обуславливающие различное клиническое течение.
Традиционный (не папиллярный) рак составляет 75% всех эпителиальных опухолей почки и характеризуется наличием делеции хромосомы 3р. Только в опухолях данного типа имеет место мутация гена VHL. Данный тип рака почки имеет более высокий метастатический потенциал и отличается худшей выживаемостью по сравнению с папиллярной и хромофобной формами.
При папиллярной форме рака почки обычно выявляется комбинация трисомий по 7,17,3q,8,12,16 и 20 хромосомам, а также утрата Y хромосомы. Папиллярная карцинома часто бывает двухсторонней и мультифокальной, ассоциирована с лучшей выживаемостью, чем традиционный, но худшей, чем хромофобный тип опухоли (рисунок 6).
Для хромофобного рака характерно уменьшение количества хромосом в сочетании с гетерозиготностью по хромосомам 1,2,6,10,13,17,21,X и гипоплоидным содержанием ДНК. Данная форма почечно-клеточного рака имеет низкий метастатический потенциал. Выживаемость больных хромофобными опухолями больше, чем в группе пациентов с папиллярной и традиционной формами рака почки.
Рак собирательных протоков является редкой опухолью, составляющей 1%-2% всех случаев почечно-клеточного рака. Рак собирательных протоков является очень агрессивной опухолью с высоким метастатическим потенциалом.
Таким образом, генетические альтерации детерминируют туморогенез и степень злокачественности опухолевого процесса при различных формах почечно-клеточного рака.
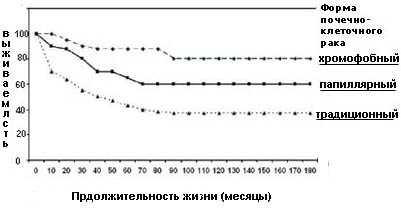
Рисунок 6. Выживаемость больных в зависимости от формы почечно-клеточного рака
Факторы регуляции клеточного цикла
В ряде исследований отмечено прогностическое значение изменений, происходящих в системе регуляции клеточного цикла в процессе развития опухоли. Система регуляции клеточного цикла представлена протеинами, такими как циклины, циклин-зависимые киназы (CDK), CDK-ингибиторы и специфические фосфорилированные и нефосфорилированные субстраты. Белки-регуляторы клеточного цикла являются продуктами экспрессии протоонкогенов. Трансформация протоонкогена в онкоген является одной из ключевых аберраций туморогенеза, приводящей к нарушению регуляции клеточного цикла, обуславливающему повреждение механизмов контроля за клеточным ростом, пролиферацией и апоптозом.
Факторы ангиогенеза
Ангиогенез является важнейшим фактором, определяющим прогрессию опухоли и оказывающим существенное влияние на прогноз больных почечно-клеточным раком. Увеличение новообразования более чем на 1 мм требует появления новых сосудов. Существенную роль в туморогенезе играет сосудистый эндотелиальный фактор роста (VEGF). В настоящее время проводятся исследования, посвященные изучению прогностической роли других факторов (фактора некроза опухоли (TNF-?), основного фактора роста фибробластов (bFGF)) и ингибиторов ангиогенеза (ангиостатина, фактора некроза опухоли (TNF-?)).
Клинические проявления рака почки
Классическая триада симптомов, описываемая ранее при раке почки у 15% больных (боль, макрогематурия и пальпируемая опухоль), в настоящее время встречается редко. В большинстве случаев заболевание протекает бессимптомно.
Клинические проявления возникают в основном при поздних стадиях. Среди местных симптомов наиболее часто отмечаются боль и гематурия. Боли в пояснице и животе возникают при инвазии или компрессии растущей опухолью окружающих структур, а также при почечной колике, обусловленной окклюзией мочеточников сгустками крови. Острая боль может быть следствием кровоизлияния в опухоль или ее разрыва с формированием забрюшинной гематомы. Прощупываемая опухоль - третий местный симптом рака почки, бывает положительным у 12-15% на момент установления диагноза. Появление варикоцеле отмечают до 3.3% больных .
Артериальная гипертензия - непостоянный симптом, (вызываемый сдавлением сегментарных артерий, окклюзией мочеточника, метастазами в головной мозг, формированием артерио-венозных шунтов, или повышенной секрецией опухолью ренина) наблюдается у 15% больных раком почки.
Синдром сдавления нижней полой вены (НПВ) (отеки ног, варикоцеле, расширение подкожных вен живота, тромбоз глубоких вен нижних конечностей, протеинурия) развивается у 50% больных при опухолевом тромбозе НПВ или при компрессии НПВ опухолью и увеличенными лимфатическими узлами.
Рак почки характеризуется большим разнообразием паранеопластических синдромов, наблюдаемых более чем у половины больных. Одной из функций нормальной почечной паренхимы является продукция различных биологически активных веществ (эритропоэтин, ренин, простагландины, простациклины, тромбоксаны, образование активной формы витамина D). Наличие опухоли может приводить к повышенной секреции вышеуказанных субстанций, либо к продукции других гормонов, таких как паратгормон, инсулин, глюкагон, человеческий хорионический гонадотропин. В результате у пациентов может отмечаться артериальная гипертензия, эритроцитоз, гиперкальциемия, гипертермия и др. Появление вышеуказанных симптомов может быть единственным проявлением заболевания и должно настораживать врача в отношении возможного опухолевого поражения почек. После радикального удаления опухоли паранеопластические проявления, как правило, исчезают, но могут возникнуть вновь при развитии местного рецидива или отдаленных метастазов. Таким образом, последние могут быть использованы для мониторинга заболевания.
Редкой формой паранеопластического синдрома является амилоидоз (1.7%). Сохраняющий после нефрэктомии амилоидоз является крайне неблагоприятным фактором прогноза.
До сих пор непонятным остается возникновение в ряде случаев печеночной недостаточности при отсутствии ее метастатического поражения. При этом у больных раком почки отмечается гипоальбуминемия, повышение щелочной фосфатазы, лейкопения, лихорадка, возможно появление очагов некроза печеночной паренхимы (синдром Штафера). Восстановление функции печени после нефрэктомии является благоприятным прогностическим признаком.
Особенное место в клинической картине рака почки занимают симптомы, обусловленные метастазированием, так как более 25% больных имеют отдаленные метастазы на момент установления диагноза. Первым проявлением поражения легких являются кашель и кровохарканье. Костные метастазы могут манифестировать болевым синдромом, развитием патологических переломов, компрессией спинного мозга, появлением пальпируемой опухоли. Поражение головного мозга сопровождается быстрым появлением и нарастанием неврологической симптоматики. Множественные метастазы в печень могут проявляться желтухой.
Такие общие симптомы, как анемия, высокая СОЭ, потеря аппетита, похудание, слабость являются признаками поздних стадий.
Ангиогенные факторы роста опухоли.
ГБОУ ВПО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, ул. Кирочная, 41, Санкт-Петербург, Российская Федерация ,191015;
ГБОУ ВПО «Ростовский государственный медицинский университет» Минздрава России, пер. Нахичеванский, 29, Ростов-на-Дону, Российская Федерация, 344022
ГБОУ ВПО «Ростовский государственный медицинский университет» Минздрава России, пер. Нахичеванский, 29, Ростов-на-Дону, Российская Федерация, 344022
ГБОУ ВПО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава РФ
Васкулоэндотелиальные факторы роста (VEGF): роль и место в патологических процессах
Журнал: Вестник офтальмологии. 2016;132(4): 98‑103
Проведен анализ отечественных и зарубежных источников литературы о семействе сосудистых эндотелиальных факторов роста (VEGF) в различных структурах человеческого организма, их распространенности и участии в патологических процессах . Сделан вывод о необходимости клинического изучения различных видов VEGF.
Изучение молекулярных механизмов управления процессами неоваскуляризации представляет собой одну из наиболее актуальных медико-биологических тем на протяжении более полувека. Сам термин «ангиогенез» был впервые введен британским хирургом Джоном Хантером в 1787 г. В 1971 г. J. Folkman впервые высказал концепцию, что рост опухоли зависит от ангиогенеза. Однако научному обществу потребовалось десятилетие, чтобы признать ее. Впервые эндотелиальный фактор был выделен G. Dvorak в 1983 г. как вещество, способствующее усилению проникновения сосудов в ткани опухоли. Была выдвинута гипотеза о том, что васкулогенез заживающих ран и опухолевой ткани схож и в большей степени зависит от отложения в строме фибрина, чем от прямого влияния факторов ангиогенеза. Обнаружение в ткани опухоли субстанции, влияющей на выход в межклеточное пространство белков плазмы крови и способной к диффузии, подтвердило их предположение. Данное вещество было названо фактором проницаемости сосудов (VPF) [1]. В 1989 г. французским медиком N. Ferrara было доказано влияние на ангиогенез этой субстанции 2. Параллельно были выделены еще два вещества, названные васкулотропином и сосудистым эндотелиальным фактором роста (VEGF). Через некоторое время было выяснено, что VPF и VEGF одно и то же вещество [5].
Представители семейства VEGF взаимодействуют с клеткой через три основных тирозинкиназных рецептора: VEGFR1, VEGFR2, VEGFR3. Также существует два нетирозинкиназных рецептора, усиливающих активационный сигнал, но не передающих его в клетку. Это нейролипин-1 (NRP-1) и нейролипин-2 (NRP-2), при этом NRP-1 является корецептором VEGFR2, а NRP-2 - корецептором VEGFR3 [6,7].
По своей структуре VEGF является гепаринсвязывающим гомодимерным гликопротеидом с молекулярной массой 45 кДа. Семейство факторов VEGF состоит из VEGF А, VEGF В, VEGF С, VEGF D и плацентарного фактора роста, связанного с хромосомой 6р [8]. Многие патологические и физиологические процессы в органах и тканях протекают с участием этих факторов (см. рисунок) [9].
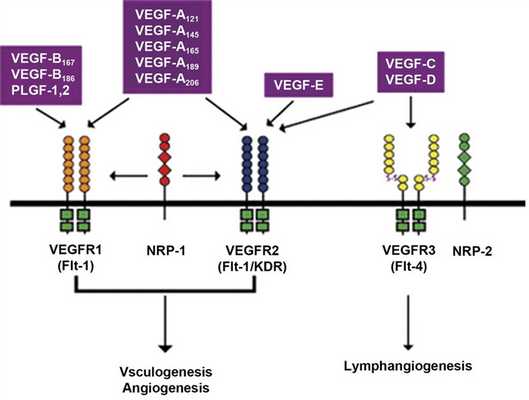
Семейство васкулоэндотелиальных факторов роста и его рецепторы [34].
VEGF А
VEGF, А играет ведущую роль в регуляции ангиогенеза. Синтез этого фактора активируется в условиях гипоксии за счет увеличения периода полураспада матричной мРНК от 3 до 8 раз, а также за счет усиления транскрипции гена. При длительно существующей ишемии происходит накопление как самого фактора, так и мРНК, что доказывает положительную обратную связь между ишемией и синтезом VEGF 13.
Существует несколько основных форм VEGF, А у человека: VEGF 121, VEGF 145, VEGF 148, VEGF 162, VEGF 121, VEGF 165b, VEGF 183, VEGF 189, VEGF 206. VEGF 165 качественно и количественно преобладает над другими изоформами [8, 10, 15]. Он может депонироваться в межклеточном пространстве и обладает способностью к диффузии, но 50-70% фактора находится в связанной форме. Выделяемые в процессе ангиогенеза плазмин и другие протеазы могут отщеплять аминокислотные остатки у VEGF 165 и VEGF 189, давая им способность к диффузии [16].
Ткани глаза могут самостоятельно синтезировать факторы роста. Известна роль VEGF в образовании сосудов у эмбриона [10, 17]. Рецепторы к фактору роста обнаружены на эндотелии и перицитах сосудов сетчатки и хориоидеи, глиальных клетках и пигментном эпителии сетчатки, на клетках эндотелия роговицы [10, 11, 18]. В норме выработка мРНК VEGF выявлена в тканях глаза с максимальной его концентрацией в цилиарном теле, конъюнктиве, пигментном эпителии сетчатки, сосудистой оболочке, хрусталике [18]. Синтез VEGF в сетчатке осуществляется перицитами, эндотелием сосудов, ганглиозными и мюллеровскими клетками сетчатки [19]. Экспериментально доказано, что угнетение синтеза VEGF, А в клетках пигментного эпителия приводит к нарушению формирования хориокапиллярного слоя сосудистой оболочки [20]. В пользу связи между пигментным эпителием сетчатки и хориокапиллярами сосудистой оболочки говорит тот факт, что выработка ростового фактора на базолатеральной поверхности пигментного эпителия в 2-7 раз выше, чем на апикальной [21].
К настоящему времени проведено достаточное количество исследований, подтверждающих влияние VEGF на проницаемость сосудистой стенки. In vitro VEGF при введении в мышечную ткань или кожу усиливает проницаемость посткапиллярных венул и капилляров, вызывая фенестрацию эндотелия путем активации протеинкиназы С. Процесс фосфорилирования при участии этого фермента структурных белков межэндотелиальных плотных соединений окклюдина и zona occluden 1 приводит к образованию «окончатых дефектов». Введение экспериментальным животным ингибитора протеинкиназы С предотвращало данные изменения 24.
Роль VEGF, А в патогенезе диабетической ретинопатии
Интравитреальное введение рекомбинантного VEGF человека вызывает повышение проницаемости сосудов сетчатки, появление отека, микроаневризм, «четкообразности» вен, кровоизлияний, зон капиллярной окклюзии, неоваскуляризации сетчатки и радужки с последующим развитием тракционной отслойки сетчатки и неоваскулярной глаукомы у кроликов и приматов 30. Установлено, что по влиянию на проницаемость сосудистой стенки VEGF в 50 000 раз сильнее гистамина [31].
Затрудненный адгезированными лейкоцитами кровоток являетcя одним из звеньев в патогенезе возникновения ишемических зон. Доказано, что VEGF влияет на лейкостаз в ретинальных сосудах путем повышения синтеза клетками эндотелия молекулы межклеточной адгезии (ICAM-1) 32.
Результаты отдельных исследований свидетельствуют о том, что, возможно, действие VEGF в инициации диабетического поражения сетчатки запускается на самых ранних сроках развития заболевания. Согласно наблюдениям ряда исследователей, у больных сахарным диабетом (СД), но без признаков диабетической ретинопатии (ДР), регистрируют не высокие, а напротив, низкие уровни VEGF во влаге передней камеры по сравнению с аналогичным показателем у пациентов, не страдающих СД [27, 36, 37]. Уровень VEGF во влаге передней камеры коррелирует с его уровнем в стекловидном теле [38]. Снижение активности VEGF не совсем безопасно для жизнедеятельности эндотелиоцитов, перицитов, глиальных клеток и нейронов сетчатки и может привести к усилению апоптоза указанных клеток 41. Клинически усиление апоптоза проявляется образованием ацеллюлярных капилляров, их облитерацией и формированием ишемических зон в сетчатке [42], ранними нейродегенеративными процессами в сетчатке [39, 43]. По мнению же N. Chaturvedi и соавт., а также других исследователей, причиной снижения активности VEGF может быть нарушение активности его рецепторов на поверхности клеток в ответ на недостаточность инсулина или инсулинорезистентность [44, 45]. Возможно, подобный механизм дополняет нарушения, инициированные другими повреждающими механизмами, или, являясь следствием инсулинорезистентности, проявляется даже несколько раньше.
Согласно общепринятым взглядам, повышение VEGF обусловливает повреждение гематоретинального барьера, повышенную проницаемость сосудистой стенки, усиленную пролиферацию эндотелиальных клеток с формированием микроаневризм, а в пролиферативной стадии - рост новообразованных сосудов [3]. Вышеизложенное дает основание полагать, что экспрессия VEGF проходит последовательные фазы в зависимости от стадии основного заболевания: от депрессии в доклинической стадии ДР до выраженной экспрессии при ПДР и ДМО [49, 50].
Одной из характерных особенностей артериогенеза является способность моноцитов мигрировать в нужном направлении по градиенту концентрации VEGF. В результате проведенных исследований можно сказать, что VEGF, А является не только ведущим фактором ангиогенеза, но и критерием прогноза сосудистых катастроф в организме человека.
VEGF B
VEGF B, в отличие от VEGF А, гораздо менее изучен. Известно, что максимальная концентрация фактора присутствует в сетчатке, головном и спинном мозге, гладкой мускулатуре миокарда. Имеет сродство к VEGFR1 и его корецептору NP-1 [51, 52].
Оказывая мощный нейропротекторный эффект, VEGF B блокирует апоптоз ганглиозных клеток сетчатки и головного мозга. Этот эффект используется для выявления новых возможностей лечения таких заболеваний, как болезнь Альцгеймера и острое нарушение мозгового кровообращения 51.
Доказано, что VEGF B не оказывает влияния на проницаемость сосудистой стенки и рост сосудов [57]. Однако, по мнению других ученых, поддерживая жизнеспособность гладкомышечных клеток перицитов, он работает не как «ангиогенный» фактор, а как фактор «выживания», блокируя который, мы опосредовано воздействуем на ангиогенез [58].
VEGF С и D
VEGF С и D вырабатываются в сердце, мышцах, яичнике, тонкой кишке. Они имеют сродство к VEGFR-2 и VEGFR3-рецепторам. Максимальная экспрессия VEGF С в эндотелии лимфатических сосудов позволяет считать ее маркером лимфоангиогенеза, тем самым играя важную роль в онкологических заболеваниях кроветворной системы. Вместе с тем, по мнению некоторых ученых, VEGF С является «сигналом» (маркером) метастазирования опухоли, а соотношение VEGF С/VEGF D служит патологическим маркером поражения лимфатических узлов [59, 60].
Заключение
Несмотря на то, что к настоящему времени накопилось большое количество молекулярно-генетических, иммунологических исследований, посвященных роли семейства VEGF в развитии различных патологических процессов, многие аспекты влияния этих факторов и взаимодействия между собой требуют дальнейшего изучения, что позволит оказывать прецизионное воздействие на любой сложный патологический процесс, сократив до минимума побочные эффекты.
Ангиогенез и ангиогенные факторы роста в регуляции репродуктивной системы у женщин.
Ангиогенез представляет собой образование новых капилляров из уже существующих сосудов. Процессы, включенные в понятие ангиогенез, были подробно изучены и обобщены в ряде обзоров [21, 55] и схематически могут быть представлены в виде следующей последовательности. Ангиогенез начинается с секреции растворимого ангиогенного фактора, воздействующего на близрасположенный кровеносный сосуд и приводящего к изменениям в капиллярной стенке в виде деградации базальной мембраны, митотическому делению эндотелиоцитов, их последующей миграцией в строму и протеолитической деградацией экстрацеллюлярного матрикса. На следующем этапе происходит организация сосудистых эндотелиоцитов в трубчатую структуру и инициализация кровотока во вновь сформированном участке.
Ангиогенез не характерен для неповрежденных тканей организма взрослого человека в физиологических условиях и активизируется при патологическом росте тканей при опухолях, остром или хроническом воспалительном процессе, диабетической ретинопатии. Эндометрий и ткани яичника являются уникальным исключением из этого правила, так как процессы циклического ангиогенеза в них происходят ежемесячно [55].
Регуляция неоваскуляризации представляет собой динамический процесс тонкого взаимодействия ингибиторов и активаторов ангиогенеза. При физиологических условиях ингибиторы ангиогенеза необходимы для контроля над ростом кровеносных сосудов, предотвращая тем самым развитие неоваскуляризации.
Большинство из известных регуляторов ангиогенеза приведены в таблице.
Таблица. Эндогенные регуляторы ангиогенеза (по A. Augustin, 1998, с изм.)
В.А. Бурлев, С.В. Павлович
Научный центр акушерства, гинекологии и перинатологии РАМН, Москва
Формы ангиогенеза
Ангиогенез является критическим во время нормального физиологического развития , но он также встречается у взрослых (в различных формах) при воспалении , заживлении ран , ишемии , а также при патологических состояниях, таких как ревматоидный артрит , гемангиомы и ростовые опухоли . [40 ]
Ангиогенез в физиологическом развитии
Ангиогенез при нормальном физиологическом развитии детей происходит при эмбриогенезе , морфогенезе и заживлении ран.
У взрослых в физиологических условиях ангиогенез представляет собой возникновение ежемесячных (циклических) изменений в матке во время менструального цикла и при заживлении ран.
Ангиогенез при патологических состояниях
Ангиогенез при патологических состояниях может возникнуть в
дегенерация желтого пятна и диабетическая ретинопатия ,
воспалительные изменения при атеросклерозе
псориаз
ревматоидный артрит
рост опухоли и метастазирование
Ангиогенез при воспалительных процессах
Возникновение ангиогенеза у зрелых организмов остается нерешенной проблемой. Недавние исследования показали, что маловероятно, что этот процесс будет значительно способствовать развитию новых кровеносных сосудов, если этот процесс происходит самопроизвольно, в ответ на ишемию или воспаление или в ответ на стимулирующие факторы. Только ишемическая ткань не может быть ключевым стимулом для запуска ангиогенного ответа. Немногие пациенты продемонстрировали такую ;;возможность во время хронической ишемии миокарда, но не большинство пациентов с диффузным множественным сосудистым заболеванием, у которых не развивается тканевая ишемия при отсутствии провокации.
Воспаление и окислительный стресс могут быть гораздо более выраженным раздражителем, [42] [43], и поэтому очень мало ангиогенеза происходит в отсутствие воспаления и окислительного стресса. Это лучше всего демонстрируется тем фактом, что подавление воспалительных реакций, обусловленное генетическими аномалиями, патофизиологическими процессами или лекарственными средствами, может отрицательно влиять на способность тканей вызывать рост новых кровеносных сосудов в них. [44]
Другой важный вопрос: будет ли неишемический миокард реагировать на стимуляцию факторами роста? Значительный объем литературных данных указывает на то, что неишемические ткани реагируют в основном на ангиогенные стимулы. Это может привести, не так часто, к увеличению эндогенного фактора роста или к изменениям во внеклеточном матриксе, в присутствии эндогенных ингибиторов, таких как ангиопоэтин-2 , или к отсутствию экспрессии рецепторов фактора роста и других сигнальных молекул, участвующих в ангиогенной передаче сигналов.
Ангиогенез в опухолях
Опухоль диаметром от 1 до 2 миллиметров путем диффузии получает все вещества, необходимые для ее роста, так что дальнейшая судьба опухоли зависит от развития адекватной неоваскуляризации. Ангиогенез позволяет опухоли неоваскуляризироваться, позволяя ей расти дальше и быстрее, и резко увеличивает метастатический потенциал опухоли, открывая пути проникновения опухолевых клеток в кровообращение и сообщая о появлении симптомов заболевания . Опухоли используют процесс ангиогенеза для обеспечения роста, как показали многие исследования, в том числе проведенные Ferrarai и его коллегами в Genetech, которые показали, что ингибирование ангиогенеза может привести к гибели опухоли, останавливая их рост.
На ранних стадиях роста большинство опухолей человека не вызывают ангиогенез, но остаются небольшими (на месте) в течение длительного времени, пока ангиогенное переключение не заканчивается в состоянии покоя сосудов. [45] Согласно многочисленным исследованиям, ангиогенез в опухолях фактически стимулируется гипоксией, которая возникает, когда опухолевой ткани требуется больше кислорода для дальнейшего роста. В условиях дефицита кислорода (гипоксии) опухоль выделяет молекулы, которые лежат в основе ангиогенного переключения и стимулируют рост кровеносных сосудов, создавая возможность того, что ангиогенные (проангиогенные) факторы (VEGF, IL-8, bFGF и т. Д.) Перевешивают антиангиогенные или ангиогенные ингибиторы, сниженная экспрессия ингибиторов ангиогенеза (фактор тромбоцитов-4, тромбоспондин, ангиостатин и др.). Эти медиаторы ангиогенеза могут генерироваться самими опухолевыми клетками, воспалительными клетками (макрофагами и т. Д.) И другими опухолевыми клетками стромы. [46] Формирование новых кровеносных сосудов начинается в опухолевой ткани на этой стадии развития, которая знаменует переход предракового образования в злокачественную опухоль.
Angiogeneza tumora.jpg
Начало опухолевого ангиогенеза связано с изменениями локального баланса между проангиогенными и антиангиогенными регуляторами. Ангиогенные факторы, секретируемые опухолевыми клетками, в 10000 раз более эффективны для деления эндотелиальных клеток. [b] Затем они мигрируют, разрушая при этом базальную мембрану капилляров и внутриклеточное вещество, благодаря протеазам, которые они выделяют сами или секретируют опухолевыми клетками и макрофагами . Наконец, эндотелиальные клетки создают кровеносные сосуды опухоли, которые более проницаемы, расширены и случайно связаны. На самом деле кровеносные сосуды опухоли представляют собой «входную дверь» для проникновения опухолевых клеток в кровообращение, что также является первым шагом на пути развития метастазов. Исследования показали, что ангиогенез напрямую связан с трансформацией злокачественной опухоли, т.е. чем более выражен ангиогенез, тем злокачественнее опухоль и быстрее метастазируют. [47] [48] [49]
Ангиогенез в лечении
Терапевтическая стимуляция ангиогенеза или проангиогенеза имеет особое биологическое и медицинское значение и может быть полезна для терапевтических целей в:
заживления костно-мышечной ткани (кости, хряща и сухожилий)
заживление ран в хирургии (хирургические раны, ожоги, шрамы)
формирование новых кровеносных сосудов при инфаркте миокарда, ишемической болезни сердца и микроциркуляции
регенерация органов (печени, почек и моторных нейронов)
Современная медицина использует две формы ангиогенеза в терапевтических целях:
Антиангиогенная терапия
Проангиогенетическая терапия
Компактность опухоли зависит, среди прочего, от роста капилляров (ангиогенез или опухолевый ангиогенез, неогенез), которые снабжают опухоль кислородом и питательными веществами. Для роста солидной опухоли от 1 до 2 мм; также требуется (сопровождающее) образование кровеносных сосудов . Ограничивая возможность образования новых кровеносных сосудов в опухоли или ограничивая опухолевую ткань неопластическим ангиогенезом , он может остановить и ограничить ее рост. [50]
В твердых новообразованиях многочисленные опухолевые клетки и новообразованные капиллярные эндотелиальные клетки представляют собой высокоинтегрированную экосистему. Опухолевые клетки выделяют эндотелиальный митоген. Фактор ангиогенеза опухоли (TAF), который постоянно стимулирует рост нового капилляра в опухоли. Если действие TAF блокировано, предотвращается неоваскуляризация и рост опухолевых узлов, что останавливает их расширение до диаметра менее 2,5 мм. Таким образом, опухолевые узлы вступают в бездействующую фазу, в которой они вынуждены жить только за счет простой диффузии питательных веществ и отходов. Таким образом, антиангиогенез может привести к тому, что популяция опухолевых клеток станет неактивной (неактивной) на небольшой поверхности. На основании этих результатов были предприняты многочисленные попытки ввести проангиогенетическую терапию (антиангиогенез), которая направлена ;;на остановку кровотока и, следовательно, циркуляцию в опухолевой ткани (путем блокирования ангиогенеза) и прекращения ее дальнейшего развития.
Первая противоопухолевая терапия VEGF (бевацизумаб), которая нейтрализует моноклональные антитела, была применена в 2004 году . основанный на одобрении FDA в США для метастазов рака толстой кишки . [51] Между тем, активный ингредиент ( бевацизумаб ) использовался при лечении рака молочной железы , [52], легкого [53] и рака почки [54] .
Применение принципа антиангиогенеза в лечении злокачественных опухолей имеет важное значение для дальнейшего изучения Джуды Фолкмана , который интенсивно работал с 1970 года . по изучению ангиогенеза и антиангиогенеза. [55] [56] [57] На сегодняшний день клинический опыт использования сорафениба и других препаратов против VEGF показал ограниченный эффект (поскольку ожидаемый ответ опухоли происходил при уменьшении опухоли примерно на> 30%) на противоопухолевую активность этих агентов. Бевацизумаб показал многообещающие результаты при использовании в сочетании с химиотерапией при нескольких типах опухолей, а низкомолекулярные ингибиторы ТК, включая сорафениб и сунитиниб, обладают пролонгированным эффектом PFS у пациентов с ПКР.
В течение следующих нескольких лет задача будет заключаться в том, чтобы определить лучшие показатели и предикторы реакции на эти новые методы лечения. Продолжение исследований также необходимо для разработки более эффективных методов борьбы с препаратами VEGF, определения оптимального режима лечения и улучшения профиля безопасности. [58]
Ангиогенез, или проангиогенез, является отличной терапевтической мишенью при лечении сердечно-сосудистых заболеваний. Это мощный физиологический процесс, который в основном является естественным способом, которым наш организм реагирует на снижение кровоснабжения жизненно важных органов, то есть процесс размножения новых коллатеральных кровеносных сосудов, которые должны преодолевать нарушения, вызванные ишемией. Большое количество доклинических исследований было проведено с белками , генами и клетками для терапии на животных моделях с ишемией сердца, а также на моделях с заболеванием периферических артерий . [59] Репродуктивные и заслуживающие доверия успехи этих ранних исследований на животных вызвали большой энтузиазм и ожидание того, что этот новый терапевтический подход может быть применен к многочисленным клиникам в интересах миллионов пациентов, страдающих сердечно-сосудистыми заболеваниями в западном мире.
Реакция сердца человека на ангиогенез после введения FGF-1 (слева) и увеличение перфузии сердечной мышцы после введения FGF-1 (SPECT-томография)
Однако десятилетия клинических испытаний генов и белков на основе терапевтических оснований, предназначенных для стимуляции ангиогенеза в условиях недостаточной перфузии тканей и органов, однако испытали многочисленные разочарования и неудачи. Хотя все доклинические заверения предполагали и обещали, что терапию ангиогенезом у животных можно назначать людям и тем или иным способом, включенным в раннюю фазу клинических испытаний, регулярные агентства (например, FDA в США ) считали, что провести ряд доклинических исследований, прежде чем этот метод будет внедрен в повседневную практику [19] [60] .
Принципы антиангиогенной терапии
Первоначально знание того, что ангиогенез жизненно важен для роста солидных опухолей, дало надежду на возможную разработку эффективных методов лечения опухолей, которые остановили бы рост и прогрессирование опухолей, то есть стабилизировали здоровье пациентов со злокачественным заболеванием. Так возникла идея использования антиангиогенной терапии, которая должна была предотвращать (ингибировать) рост новых кровеносных сосудов и вытягивать (регрессировать) новые, незрелые кровеносные сосуды, опухоли путем блокирования проангиогенных факторов. [21] Сложный баланс между проангиогенными и антиангиогенными факторами существует во всех микрососудистых системах и действует как фактор увеличения или уменьшения образования кровеносных сосудов. [61]
Основные антиангиогенные и проангиогенные факторы, которые были выяснены до сих пор, перечислены в таблице ниже, хотя не все их взаимные механизмы полностью понятны:
Стимуляторы (проангиогенные) и ингибиторы (антиангиогенные) ангиогенеза. [62]
Стимуляторы ангиогенеза Ингибиторы ангиогенеза
Фактор роста эндотелиальной системы (VEGF)
Фактор роста фибробластов (FGF)
Антиангиогенная терапия
Антиангиогенная терапия является относительно новым методом лечения злокачественных новообразований. Дело в том, что быстрый рост размеров злокачественного новообразования должен обеспечиваться регулярной доставкой обильного количества питательных веществ и кислорода. Есть данные, свидетельствующие о том, что на каждый миллиметр опухолевой ткани требуется построение новой капиллярной сети. Если этого не произойдет, бесконтрольный рост новообразования будет невозможен.
Образование капиллярной сети реализуется посредством ангиогенеза, который регулируется множеством факторов, стимулирующих и блокирующих его. Если влиять на эти факторы, можно контролировать этот процесс, тем самым влияя на развитие новообразования. Более подробно остановимся на этом.
Ангиогенез — это процесс образования новых кровеносных сосудов путем выпячивания стенки уже существующего сосуда. Во взрослом организме этот процесс обеспечивает восстановление поврежденных тканей — заживление ран, ушибов, восстановление после инсультов, инфарктов и других патологических процессов.
Активация ангиогенеза происходит и при патологических процессах, например, при развитии злокачественных опухолей. Чтобы они могли интенсивно размножаться, им необходимо большое количество кислорода и питательных веществ, которые они получают из крови. Соответственно, по мере роста размера опухоли, ее ткань прорастает новыми кровеносными сосудами. А если это по каким-либо причинам невозможно, рост новообразования также невозможен.
Чтобы обеспечить процесс ангиогенеза, опухолевые клетки вырабатывают специальные молекулы — факторы роста (ФР), которые будут стимулировать прорастание новых капилляров. Самая важная из них — это фактор роста эндотелия сосудов VEGF. А вообще, открыто более 20 молекул, которые стимулируют образование новых капилляров.
Как это происходит
На поверхности эндотелиальных клеток (клетки, которые выстилают кровеносный сосуд изнутри) образуются рецепторы к ФР. В норме в клетках взрослого организма их нет. Возникают они только при определенных условиях, в нашем случае под действием опухоли. Как только ФР свяжется с рецептором, запускается каскад биохимических реакций, и начинают синтезироваться особые ферменты — металлопротеазы. Они расщепляют внеклеточное вещество, которое окружает эндотелиальные клетки и образует в нем «дырки». Через них эндотелиальные клетки выходят за пределы сосуда и мигрируют к опухоли. При этом, металлопротеазы как бы расчищают для них дорогу, облегчая миграцию. Когда формирование сосуда закончится, в дело вступают факторы, угнетающие ангиогенез — ингибиторы ангиогенеза.
Весь процесс образования капилляра можно представить следующим образом:
- Разрушение стенки кровеносного сосуда под действием металлопротеаз, синтезируемых опухолью.
- Выход эндотелиальных клеток из сосудов и их миграция по направлению к опухоли.
- Пролиферация (размножение) эндотелиальных клеток по мере продвижения в строме.
- Образование новых капиллярных трубок.
- Образование анастамозов между трубками и формирование новой капиллярной сети.
- Угнетение процесса ангиогенеза под действием антиангиогенных факторов.
Факторы, стимулирующие ангиогенез
Пока нет единой классификации факторов, которые стимулируют ангиогенез. Мы их разделим на биомеханические и физические.
Биомеханические факторы
Из биомеханических факторов наибольшее значение имеет ток крови. Постоянный ламинарный (ровный) поток крови способствует стабилизации кровеносных сосудов. И наоборот, турбулентности, циклические деформации и другие сбои приводят к активации эндотелия.
Химические факторы
- Главным стимулятором роста кровеносных сосудов является семейство факторов роста кровеносных сосудов VEGF. Они представлены несколькими видами:
- VEGF А — отвечает за миграцию и деление эндотелиальных клеток,
- VEGF B — обеспечивает эмбриональный ангиогенез. У взрослых людей его максимальная концентрация обнаруживается в сетчатке, ткани головного и спинного мозга и миокарде. Оказывает мощное нейропротекторное действие, поэтому на него возлагают большие надежды в лечении болезни Альцгеймера и инсультов. На проницаемость кровеносных сосудов и их пролиферацию он не влияет.
- VEGF С — в максимальной концентрации обнаруживается в клетках лимфатических сосудов, обеспечивает их рост. В онкологическом процессе играет роль маркера метастазирования.
- VEGF D — отвечает за развитие лимфатических сосудов в легких.
- PLGF — плацентарный фактор роста.
- FGF2 фактор роста фибробластов — при взаимодействии с рецепторами FGFR стимулирует деление эндотелиальных клеток и их миграцию.
- IGF-1 инсулиноподобный фактор роста — стимулирует рост сосудов за счет активации синтеза IL-8.
- Ангиопоэтины — способствуют выживанию мигрировавших эндотелиоцитов, формированию между ними связей, их взаимодействию с перицитами. Таким образом, стабилизируются вновь образованные сосуды.
- Тромбоцитарный фактор роста также отвечает за стабилизацию сосудов.
Факторы, угнетающие ангиогенез
- Тромбоспондины TSP. Эти факторы были открыты и описаны одними из первых. Они имеют два механизма действия — один реализуется за счет прямого действия на эндотелиоциты, а второй за счет подавления проангиогенных факторов. При прямом действии оказывается подавляющий эффект на деление клеток и их миграцию, помимо этого активируется апоптоз. Вторым механизмом действия является угнетение VEGF за счет связывания его и препятствования его выходу в межклеточное пространство. Помимо этого, тромбоспондины угнетают активность и биодоступность фактора роста фибробластов и других стимуляторов роста кровеносных сосудов.
- Ангиостатины. Они подавляют опухолевый ангиогенез, пролиферацию и миграцию эндотелиоцитов, активируют их апоптоз (гибель), блокируют внутриклеточный синтез VEGF.
- Эндостатины — подавляют размножение эндотелиоцитов и тубулогенез.
- Вазогибин — подавляет экспрессию рецепторов VEGF.
- Некоторые цитокины, например, IL4 (интерлейкин-4).
Антиангиогенные препараты
Эффект антиангиогенных препаратов основан на блокировании действия факторов роста кровеносных сосудов. Тем самым процесс образования новых капилляров замедляется, опухоль не получает достаточного количества питательных веществ и соответственно не может наращивать свою массу. С этой целью используется большое количество препаратов.
- Бевацизумаб — гуманизированные моноклональные антитела, которые избирательно связываются с биологически активной формой VEGF и блокируют его действие. Антиангиогенную терапию бевацизумабом применяют для лечения метастатических форм колоректального рака (вместе с химиотерапией), рака груди, немелкоклеточного рака легких, почечно-клеточного рака и глиобластомы.
- Афлиберцепт. Он действует как ловушка для VEGF. При соединении, он образует более прочные связи, и мешает VEGF соединяться с внеклеточным рецептором. Благодаря этому, блокируется передача внутриклеточных сигналов, запускающих процессы образования новых сосудов. Доказал свою эффективность при метастатическом колоректальном раке.
- Рамуцирумаб — блокирует рецепторы второго типа эндотелиального фактора роста и, соответственно, мешает его связыванию с VEGF. В результате становится невозможным синтез митогенактивируемых протеинкиназ, нейтрализуется размножение клеток эндотелия. Антиангиогенную терапию рамуцирумабом применяют при аденокарциномах желудка (совместно с паклитакселом или в монорежиме), немелкоклеточном раке легких и метастатическом колоректальном раке.
- Акситиниб — блокирует тирозин-киназные рецепторы эндотелиального фактора роста VEGFR, PDGFR, KIT. Применяется в рамках терапии второй линии при лечении больных распространенным раком почки.
- Вандетаниб. Подавляет активность рецептора VEGF, тем самым угнетая размножение, пролиферацию эндотелиоцитов, подавляет образование новых кровеносных сосудов, проницаемость опухолевых сосудов и уменьшает плотность сосудистой сетки. Применяется при распространенных формах медуллярного рака щитовидной железы.
- Ниндетаниб. Блокирует ангиокиназу, рецепторы VEGF 1-3 типа, рецепторы к тромбоцитарному фактору роста и фактору роста фибробластов. Применяется при рецидивирующих формах немелкоклеточного рака легкого.
- Пазопаниб. Блокирует рецепторы VEGF 1-3 типа, рецепторы к тромбоцитарному фактору роста и фактору роста фибробластов, рецепторы к фактору роста стволовых клеток. Антиангиогенная терапия пазопанибом используется при раке почки и лечении сарком мягких тканей.
- Регорафениб. Оказывает комплексное противоопухолевое действие, влияя не только на факторы роста кровеносных сосудов, но и на процессы канцерогенеза, метастазирования и на опухолевое микроокружение. Применяется при колоректальном раке, ГИСО и раке печени.
- Сорафениб — блокирует тирозин-киназные рецепторы эндотелиального фактора роста VEGFR 2,3, PDGFR, FGFR. В настоящее время применяется для лечения диссеминированного рака почки, который уже не чувствителен к стандартной терапии. Увеличивает время до прогрессирования заболевания и общую выживаемость пациентов. Также может применяться для лечения немелкоклеточного рака легких, меланомы, рака печени и предстательной железы, рака яичников и др.
- Сунитиниб. Блокирует рецепторы тромбоцитарного фактора роста, факторов роста эндотелия и стволовых клеток и колониестимулирующего фактора. Антиангиогенная терапия сунитинибом используется при ГИСО (гастроинтестинальлных стромальных опухолях).

Метрономная терапия
Метрономная химиотерапия представляет собой длительное и регулярное применение цитостатиков в низких дозировках. Препараты могут назначаться еженедельно, несколько раз в неделю и даже ежедневно. Такое лечение оказывает комплексное воздействие на опухоль:
- Оказывает антиангиогенное действие, блокируя рост опухолевых сосудов.
- В некоторой степени уничтожает или останавливает размножение злокачественных клеток.
- Стимулирует противоопухолевый иммунитет.
Антиангиогенное действие метрономной химиотерапии основано на следующих эффектах:
- Подавляют циркуляцию эндотелиальных стволовых клеток.
- Подавляет деление эндотелиальных клеток.
- Увеличивает уровень тромбоспондина — антиангиогенного фактора.
В метрономных режимах назначается винкрестин, капецитабин, циклофосфамид, метотрексат, фторурацил и многие другие препараты.
Читайте также:
- Жалобы при инфаркте миокарда. Типы дебюта инфаркта миокарда
- Психические условия внутренних болезней. Эмоциональное напряжение и болезни
- Рентгенограмма, КТ при измененениях корней зубов
- Диагностика сочетанной травмы артерий и костей конечности. Методы
- Головокружение при транзиторной ишемической атаке (ТИА): клиника, диагностика, лечение
