Диастолическая ригидность (жесткость) левого желудочка. Оценка диастолической ригидности миокарда
Добавил пользователь Владимир З. Обновлено: 28.01.2026
К настоящему времени доказано, что примерно в 30-40% всех случаев сердечной недостаточности (СН) в основе данного синдрома лежит диастолическая дисфункция левого желудочка (ЛЖ). Вместе с тем лечение диастолической дисфункции в отличиеот систолической до сих пор остается плохо изученной областью кардиологии. На сегодняшний день основным направлением в лечении диастолической дисфункции является воздействие на подлежащее (основное) сердечно-сосудистое заболевание. Помимо этого, тактика лечения определяется тяжестью симптоматики, степенью выявленных диастолических нарушений и давлением наполнения ЛЖ. Большое значение придается своевременному обнаружению и коррекции предрасполагающих факторов (профилактика тахиаритмии, восстановление синусового ритма и др.).
Полный текст
К настоящему времени доказано, что примерно в 30-40% всех случаев сердечной недостаточности (СН) в основе данного синдрома лежит диастолическая дисфункция левого желудочка (ЛЖ) [1]. Вместе с тем лечение диастолической дисфункции в отличие от систолической до сих пор остается плохо изученной областью кардиологии. И тому есть определенные причины. Так, в большинстве крупных контролируемых испытаний по СН наличие сохраненной систолической функции ЛЖ было критерием исключения. Кроме того, существуют определенные сложности неинвазивной оценки диастолической функции ЛЖ, обусловленные рядом технических трудностей и отсутствием четких верифицированных критериев диагностики. Ситуация еще больше осложняется тем, что диастолическая дисфункция в изолированной форме встречается сравнительно редко, чаще же наблюдается сочетание диастолических нарушений с той или иной степенью систолической дисфункции. На сегодняшний день основным направлением в лечении диастолической дисфункции является воздействие на подлежащее (основное) сердечно-сосудистое заболевание. Поскольку диастолическая СН может развиться в результате ишемии миокарда, артериальной гипертонии, гипертрофии миокарда и констриктивного поражения миокарда/перикарда, все эти состояния следует выявлять и лечить согласно принятым схемам. Помимо этого, тактика лечения определяется тяжестью симптоматики, степенью выявленных диастолических нарушений и давлением наполнения ЛЖ. Большое значение придается своевременному обнаружению и коррекции предрасполагающих факторов (профилактика тахиаритмии, восстановление синусового ритма и др.). В таблице перечислены основные лечебные меры, направленные на улучшение диастолической функции ЛЖ. Диастолическая дисфункция: цели и методы лечения (адаптировано из: [2]) Контроль венозного легочного давления (снижение давления наполнения ЛЖ) Ограничение соли Диуретики Ингибиторы АПФ Поддержание и/или восстановление синусового ритма (сохранение сократительной функции левого Электрическая или медикаментозная кардиоверсия Медикаментозное поддержание синусового ритма при высоком риске предсердия - ЛП)мерцательной аритмии Последовательная двухкамерная стимуляция Контроль ЧСС -Адреноблокаторы Радиочастотная абляция и постановка электрокардиостимулятора (ЭКС) Лечение и предотвращение миокардиальной ишемии Нитраты, -адреноблокаторы, антагонисты Са2+ Реваскуляризация миокарда Адекватный контроль за артериальным давлением (АД), регресс гипертрофии ЛЖ Антигипертензивные препараты Подавление нейрогуморальной активации -адреноблокаторы, ингибиторы АПФ Предотвращение и/или регресс фиброза миокарда Ингибиторы АПФ, спиронолактон Антиишемические препараты Улучшение активной релаксации Ингибиторы фосфодиэстеразы Систолическая разгрузка ЛЖ (уменьшение постнагрузки) Лечение ишемии миокарда Контроль венозного легочного давления (снижение давления наполнения ЛЖ). Поскольку тяжесть клинической картины у пациента с диастолической СН во многом определяется тяжестью диастолической дисфункции (степенью повышения давления наполнения ЛЖ), важным принципом лечения диастолической СН является снижение преднагрузки на ЛЖ (с помощью диуретиков, нитратов) [3], однако следует помнить, что по мере прогрессирования диастолической дисфункции возрастает значимость высокого давления в ЛП в обеспечении надлежащего сердечного выброса, а у пациентов с рестриктивным трансмитральным диастолическим потоком (ТМДП), т.е. с крайне выраженными нарушениями пассивных свойств миокарда, наполнение ЛЖ определяется исключительно высоким давлением в ЛП. Поэтому чрезмерное снижение преднагрузки на ЛЖ (избыточный диурез при применении мочегонных препаратов или венодилатация в случае нитратов) у таких больных чревато резким уменьшением объема наполнения ЛЖ и, соответственно, снижением сердечного выброса. В этих случаях оправдана тактика аккуратного снижения давления в ЛП (преднагрузки на ЛЖ) до появления первых признаков "фиксации" сердечного выброса (быстрой утомляемости при физической нагрузке). Поскольку прием диуретиков сопровождается избыточной активацией ренин- ангиотензин-альдостероновой системы (РААС), целесообразно их сочетание с ингибиторами АПФ и/или спиронолактоном. Поддержание и/или восстановление синусового ритма (сохранение сократительной функции ЛП) У пациентов с диастолической дисфункцией большое значение имеет "удержание" синусового ритма. Это продиктовано той большой ролью, которая отводится миокарду ЛП в обеспечении нормальной переносимости физических нагрузок. В норме, во время физической нагрузки, сопровождающейся повышением частоты сердечных сокращений (ЧСС) и укорочением времени диастолического заполнения, для обеспечения адекватного прироста сердечного выброса требуется быстрое и достаточное заполнение ЛЖ. Организм успешно справляется с этой задачей за счет использования своего так называемого диастолического резерва - активизации насосной функции ЛП. В условиях значительного укорочения диастолы (в момент физической нагрузки) кровь чисто механически не успевает перетечь в ЛЖ за время ранней диастолической фазы и акцент заполнения ЛЖ смещается на позднюю диастолу, т.е. на систолу ЛП. К началу предсердного сокращения в полости ЛП скапливается избыточное количество крови, что через универсальный механизм Франка-Старлинга сопровождается сильным и энергичным сокращением миокарда ЛП - происходит "предсердная подкачка". Весьма важным, с гемодинамической точки зрения, представляется тот факт, что поддержание необходимого наполнения ЛЖ с помощью предсердной подкачки происходит без сколько-нибудь значимого повышения легочного венозного давления. Кроме того, именно ЛП является камерой основной "гемодинамической атаки" при диастолической дисфункции, что резко увеличивает вероятность возникновения мерцательной аритмии. Поэтому появление последней требует как можно быстрого восстановления синусового ритма (электрическая или медикаментозная кардиоверсия) с последующим как можно более долгим его удержанием (-адреноблокаторы, амиодарон). Купирование/предотвращение тахикардии Вместе с поддержанием синусового ритма у больных с диастолической дисфункцией ЛЖ большое значение имеет создание оптимальных условий для заполнения ЛЖ, что достигается с помощью адекватного урежения ЧСС. Данная мера является одним из самых простых и одновременно эффективных способов улучшения диастолической функции ЛЖ, поскольку автоматически приводит к увеличению продолжительности диастолы и, соответственно, нормализации диастолического заполнения ЛЖ. При тахикардии фаза диастазиса (временной промежуток между ранним диастолическим наполнением и систолой предсердий), как правило, отсутствует и сокращение ЛП наступает до того, как завершится раннее диастолическое заполнение ЛЖ. Это приводит к снижению толерантности к физическим нагрузкам, поскольку предсердная подкачка уже частично задействована в условиях покоя. Как известно, для урежения и/или контролирования ЧСС используют -адреноблокаторы или антагонисты Са2+. С учетом их высокой антиангинальной и антигипертензивной эффективности (что само по себе оказывает благоприятное воздействие на диастолическое наполнение ЛЖ, см. далее) препараты данных групп служат весьма эффективными средствами лечения диастолической СН. Однако урежение ЧСС должно являться первоочередной мерой лишь у пациентов с изолированным нарушением активной релаксации, поскольку у таких лиц акцент заполнения ЛЖ смещен на систолу предсердий и удлинение диастолы создаст условия для полного завершения процессов активной релаксации (исходно замедленных) к моменту систолы ЛП. Это будет способствовать гемодинамической разгрузке ЛП, восстановлению "диастолического резерва" и повышению толерантности к физическим нагрузкам [4]. Сложнее дело обстоит с пациентами, имеющими псевдонормальный или рестриктивный ТМДП, где акцент заполнения ЛЖ приходится уже на фазу ранней диастолы. При этом сократительной функции ЛП в обеспечении эффективного наполнения ЛЖ как в покое, так и во время физической нагрузки отводится незначительная роль, поскольку длительное воздействие высокого давления на стенку ЛП и постоянное сокращение последнего против высокой постнагрузки (со стороны ригидного ЛЖ) приводит к истощению его сократительной способности. В этой связи удлинение периода диастолического наполнения ЛЖ не только не улучшит клинический статус таких пациентов, но и может сопровождаться гемодинамическим ухудшением, поскольку удлинение диастолы в условиях ригидного ЛЖ создаст предпосылки для диастолической митральной регургитации и еще большего повышения давления в ЛП. Следовательно, первоочередной мерой у пациентов с псевдонормальным или рестриктивным ТМДП должна являться гемодинамическая разгрузка ЛП (с помощью мочегонных и/или нитратов), и лишь только после того, как удастся добиться снижения давления в ЛП (что на ТМДП отразится появлением спектра с нарушенной релаксацией), оправдано использование отрицательных хронотропных препаратов. Лечение и предотвращение миокардиальной ишемии Поскольку одним из ранних событий ишемического каскада является диастолическая дисфункция, наличие ишемической болезни сердца (ИБС) считается одним из главных факторов, предрасполагающих к возникновению диастолических нарушений. Действительно, более чем у 90% пациентов с ИБС выявляются те или иные диастолические нарушения [5], в основе которых могут лежать как нарушение активной релаксации (главным образом как следствие нарушения соотношения потребность/доставка кислорода непосредственно при ишемии миокарда), так и фибротические процессы в миокарде (постинфарктный или атеросклеротический кардиосклероз). Таким образом, улучшению активной релаксации при ИБС во многом будет способствовать использование антиангинальных/антиишемических средств: нитратов, -адреноблокаторов и антагонистов Са2+, а также принятие мер по своевременной реваскуляризации миокарда. Артериальная гипертония (АГ) У пациентов с АГ диастолическая дисфункция ЛЖ является самым ранним проявлением кардиальной дисфункции (т.е. гипертонического сердца) [6], причем даже при отсутствии гипертрофии миокарда ЛЖ. В принципе нарушение активной релаксации ЛЖ сопровождает любое повышение АД, поскольку скорость расслабления ЛЖ напрямую зависит от величины постнагрузки на ЛЖ: чем выше постнагрузка (АД), тем медленнее релаксация и наоборот. Кроме того, одним из самых распространенных осложнений гипертонической болезни является развитие гипертрофии миокарда ЛЖ - фактора, независимо от уровня АД как замедляющего скорость активной релаксации, так и способствующего повышению жесткости миокарда ЛЖ. Поскольку практически все гипотензивные препараты способны уменьшать гипертрофию ЛЖ, частичную нормализацию диастолической функции ЛЖ следует ожидать в случае эффективного контролирования АД вне зависимости от используемого гипотензивного препарата. Возможно, что на гипертрофию ЛЖ наиболее эффективно воздействуют ингибиторы АПФ [7]. Возможно, это связано не только с устранением гемодинамических стимулов роста миокарда (универсальное свойство всех гипотензивных препаратов), но и специфическим воздействием на патогенетические звенья диастолической дисфункции (см. далее). Специфическое медикаментозное воздействие на диастолу Все сказанное касалось общих мероприятий, направленных главным образом на косвенную коррекцию диастолических расстройств. Существуют ли на сегодняшний день какие-либо возможности патогенетического лечения, т.е. лечения, непосредственно воздействующего на основные детерминанты диастолического наполнения: активную релаксацию и пассивные свойства миокарда? Сразу следует оговориться, что серьезных крупномасштабных исследований, посвященных этой проблеме, в мире практически не проводилось. Поэтому любые заключения по патогенетической терапии диастолической дисфункции во многом носят спекулятивный характер. Теоретически патогенетическое лечение может быть направлено как на процессы активной релаксации, так и на пассивные (жесткостные) свойства миокарда. Однако все большее число специалистов приходит к убеждению, что непосредственное воздействие на процессы активного расслабления миокарда с целью его улучшения на современном этапе не представляется таким уж однозначно позитивным эффектом. Блокада РААС На современном этапе патогенетическое лечение диастолических расстройств должно предусматривать прежде всего воздействие на жесткостные характеристики миокарда. В этой связи большие перспективы связываются с препаратами, блокирующими активность РААС (ингибиторы АПФ, блокаторы рецепторов к ангиотензину (А-II), антагонисты рецепторов к альдостерону), поскольку именно эффекторам данной нейрогуморальной системы (А-II и альдостерону) отводится одна из ключевых ролей в активизации фибротических процессов в миокарде [8]. Ремоделирование интерстициального компонента управляется главным образом нейрогуморальными факторами, прежде всего РААС и ее эффекторами - А-II и альдостероном [9]. К настоящему времени можно утверждать следующее: 1) ведущая роль в повышении жесткостных характеристик миокарда отводится избыточному накоплению коллагена в интерстициальном пространстве, а не гипертрофии миоцитов (хотя последняя тоже задействована в формировании жесткого ЛЖ); 2) если в условиях имеющейся гипертрофии миокарда удается предотвратить появления фиброза, то жесткость миокарда остается в пределах нормы; 3) регрессия фиброза (но не гипертрофии) сопровождается нормализацией жесткостных характеристик миокарда. И именно в воздействии на процессы интерстициального ремоделирования следует ожидать определенного превосходства блокаторов рецепторов к А-II над ингибиторами АПФ. К настоящему времени накоплен достаточный объем экспериментальных данных, позволяющих предполагать преимущество блокаторов рецепторов к А-II над ингибиторами АПФ, прежде всего относительно воздействия на процессы фиброза в миокарде. Считается, что доступность АТ2-рецепторов действию А-II, имеющее место при использовании блокаторов рецепторов к А-II, но отсутствующее у ингибиторов АПФ, приводит к более выраженному антипролиферативному эффекту, связанному со стимуляцией данного типа ангиотензиновых рецепторов [10]. Данное предположение усиливается тем фактом, что при многих патологических состояниях в миокарде отмечается увеличение относительной плотности АТ2-рецепторов, причем, как было показано в исследованиях, выполненных как на животных, так и на человеке, основным местом их экспрессии как раз и являются фибробласты, ответственные за синтез коллагенового матрикса [11, 12]. Кроме того, сама изолированная блокада АТ1-рецепторов по механизму отрицательной обратной связи приводит к увеличению образования A-II, что загружает и без того свободные действию А-II АТ2-рецепторы, способствуя усилению антиростовому эффекту их стимуляции. Вместе с тем подавление активности АПФ сопровождается увеличением содержания А- I (по механизму отрицательной обратной связи), причем как на тканевом, так и на циркуляторном уровне (в последнем случае хронический прием ингибиторов АПФ сопровождается повышением плазменной концентрации А-I в 3-5 раз). В результате этого в большей степени начинают "загружаться" АПФ-независимые ферментные системы образования А-II в миокарде, что в определенной степени может приводить к нейтрализации ингибиторного влияния АПФ на синтез A-II. -Блокаторы и антагонисты Са2+ Долгое время -блокаторам и антагонистам Са2+ приписывалась способность оказывать прямое благоприятное действие на диастолическую функцию ЛЖ (помимо их антигипертензивного и антиишемического эффекта). Выводы были сделаны на основании того, что в ходе лечения препаратами данных классов ТМДП с нарушенной релаксацией приобретал черты нормального. Однако как было выяснено позже, при интерпретации динамики показателей ТМДП следует учитывать феномен его "псевдонормализации", при котором дальнейшее прогрессирование диастолических нарушений приводит к тому, что ТМДП по своему внешнему виду становится неотличимым от нормального [13]. Проведение же исследований с одновременной катетеризацией левых отделов сердца показало, что по крайней мере в острую фазу -блокаторы и антагонисты Са2+ нисколько не влияют на податливость ЛЖ и в действительности ухудшают процессы активной релаксации 16. Нормализация же ТМДП в таких случаях отражала не улучшение диастолических свойств ЛЖ, а, наоборот, свидетельствовала о росте давления его наполнения.
Эхокардиографические признаки нарушения диастолической функции левого желудочка при гипертонической болезни
Нормальная диастолическая функция сердца подразумевает способность левого желудочка принимать в диастолу количество крови, необходимое для поддержания сердечного выброса, заключается в способности ее расслабления после этапа изгнания крови.
Под диастолической дисфункцией (ДД) понимают невозможность левого желудочка принимать кровь под низким давлением и наполняться без компенсаторного повышения давления в левом предсердии вследствие структурной и функциональной перестройки миокарда.
Диастолическая дисфункция левого желудочка является достаточно распространенным явлением. Нарушение диастолических свойств негипертрофированного миокарда, возможно, обусловлено развитием в нем интерстициального фиброза и наблюдается после 45 лет, как вариант возрастной нормы.
Этот тип изменения диастолы характерен для стареющего сердца (даже при отсутствии какого-либо сердечнососудистого заболевания) в связи с закономерно возникающими при нормальном старении нарушениями растяжимости, жесткости и податливости миокарда левого желудочка, обусловленными изменениями, происходящими в тканях (прежде всего увеличением содержания коллагена), пониженной рецепторной функцией, эндотелиальной дисфункцией и пр.
Для эхографической оценки диастолической функции левого желудочка применяют импульсное допплеровское исследование трансмитрального кровотока и тканевое допплеровское исследование диастолического подъема основания левого желудочка.
По данным трансмитрального кровотока исследуют максимальную скорость раннего диастолического наполнения левого желудочка (Е), максимальную скорость наполнения левого желудочка в систолу предсердия (А).
Методом тканевой допплерографии измеряют максимальную скорость диастолических волн, соответствующие раннему (е`) и позднему (а`) наполнению левого желудочка.
Метод тканевой допплерэхокардиографии относится к наиболее информативным способам диагностики диастолических нарушений ЛЖ и позволяет регистрировать раннюю диастолическую дисфункцию левого желудочка у всех больных гипертонической болезнью 1-2 ст.
При гипертонической болезни развитие диастолической дисфункции ассоциировано с увеличением тяжести гипертензии: умеренные нарушения диастолической функции наблюдаются уже при I стадии артериальной гипертензии.
Общепринято определять наличие диастолической дисфункции левого желудочка методом эхокардиографии, при этом используется комбинированная оценка трансмитрального диастолического потока и скорости движения митрального кольца.
Выделяют три типа наполнения левого желудочка: с замедленной релаксацией, псевдонормальный и рестриктивный, которые соответствуют незначительной, умеренной и тяжелой диастолической дисфункции.
Выделяют следующие типы диастолической дисфункции
- нарушение релаксации, псевдонормальный и рестриктивный тип. Первые два могут не сопровождаться симптомами, в то время как последний тип соответствует тяжелой степени ХСН с выраженными симптомами.
Диастолическая дисфункция левого желудочка по 1 типу - релаксационному типу характеризуется нарушением способности миокарда левого желудочка расслабиться для полноценного заполнения кровью.
Рабочей группой Европейского общества кардиологов разработаны ультразвуковые диагностические нормативы определения диастолической дисфункции.
Первый тип соответствует начальному нарушению диастолического наполнения, он характеризуется удлинением изоволюмического расслабления левого желудочка, снижением скорости и объема раннего диастолического наполнения, увеличением кровотока во время систолы предсердий. Другими словами, происходит перераспределение трансмитрального кровотока: большая часть крови поступает в желудочек в систолу предсердий. Заметим, что диастолическое давление в левом желудочке при этом может оставаться на нормальном уровне. Сейчас такой тип диастолической дисфункции принято называть Замедленным расслаблением левого желудочка.
Одной из причин ДДЛЖ является Гипертоническая болезнь - при которой нарушается активное расслабление и податливость, увеличение массы и жесткость миокарда, увеличение массы желудочков за счет утолщения их стенки,
Факторы, приводящие к развитию диастолической дисфункции, ухудшают процесс расслабления, уменьшают эластичность стенок левого желудочка, главным образом, вследствие развития гипертрофии (утолщения) миокарда.
При артериальной гипертонии нарушение релаксации выявляется у 90% больных с гипертрофией левого желудочка и у 25% - без таковой. Значительная диастолическая дисфункция иногда наблюдается у больных с весьма умеренным и локализованным утолщением стенки желудочка и без обструкции.
Диастолическое наполнение левого желудочка в норме и при патологии определяется двумя основными факторами — расслаблением миокарда и податливостью (или жесткостью) камеры желудочка
Нарушение диастолического расслабления миокарда. Уменьшению скорости и полноты активного диастолического расслабления принадлежит ведущая роль в патогенезе диастолической дисфункции
Расслабление миокарда представляет сложный энергозависимый процесс, который, согласно современным представлениям, регулируется следующими основными факторами: 1) нагрузкой на миокард во время его сокращения и 2) расслабления, 3) полнотой разъединения акто-миозиновых мостиков в результате обратного захвата ионов кальция саркоплазматическим ретикулумом и 4) равномерностью распределения нагрузки на миокард и разъединения акто-миозиновых мостиков в пространстве и времени. Нагрузка на миокард во время расслабления, в свою очередь, определяется: 1) конечно-систолическим стеночным напряжением в период быстрого наполнения, 2) стеночным напряжением, 3) наполнением венечных артерий в период изоволюмического расслабления и 4) энергией конечно-систолической деформации желудочка (D. Brutsaert с соавт., 1984).
Для раннего выявления диастолической дисфункции левого желудочка у больных гипертонической болезнью необходимо выполнение эхокардиографическое исследование включая проведение тканевого допплеровского исследования
Исследование функции левого желудочка «в покое» включает как определение его глобальной сократимости, так и оценку диастолического наполнения, характеризуемого по трансмитральному кровотоку. Особо подчеркнем целесообразность оценки диастолической функции, так как убедительно доказано, что диастолическая функция левого желудочка изменяется уже на ранних стадиях артериальной гипертензии тесно связана со степенью его гипертрофии. В связи с этим необходимо определять количественные показатели трансмитрального кровотока и тип нарушения (если он имеется) диастолы - нарушение релаксации, псевдонормальный, рестриктивный. На основании этих данных лечащий врач будет в дальнейшем производить дифференциальную диагностику между нарушением релаксации, диастолической дисфункцией левого желудочка и диастолической недостаточностью.
Нарушения диастолической функции левого желудочка часто выявляются у больных с гипертонической болезнью даже при отсутствии гипертрофии левого желудочка. Метод тканевой допплерэхокардиографии в импульсно-волновом режиме является хорошим дополнением к обычной допплерэхокардиографии трансмитрального потока в ранней диагностике диастолической дисфункции левого желудочка, в отсутствие выраженных изменений его геометрии, так как результаты, полученные с помощью данного метода не зависят от гемодинамических условий.
Хроническая перегрузка сердца давлением сопровождается комплексом структурных изменений, включающих диастолическую дисфункцию (ДД) левого желудочка, увеличение массы его миокарда.
Заведующая функциональной и ультразвуковой диагностикой Чибрикова Лилия Медихатовна и врач функциональной диагностики Лютков Евгений Степанович.
Диастолическая дисфункция левого желудочка
Под диастолической дисфункцией подразумевают патологию, которая сопровождается нарушением кровообращения во время расслабления сердца. Подобная проблема диагностируется преимущественно среди женщин престарелого возраста. И чаще встречается именно диастолическая дисфункция левого желудочка.
Что это такое?

Сердце осуществляет свою работу в режиме систолы (сокращения) и диастолы (расслабления). О дисфункции говорят, если существуют сбои функционирования органа.
Когда нарушена диастолическая функция левого желудочка, мышечные ткани миокарда утрачивают способность расслабляться в момент диастолы. В результате этого желудочек не получает необходимое количество крови. Чтобы компенсировать ее недостаток, левое предсердие вынуждено усиливать свою работу, пытаясь вобрать в себя больше крови.
Все это негативно сказывается на состоянии предсердия, постепенно приводит к перегрузке, его увеличению в размерах. На фоне систолической дисфункции может произойти застой в венозной системе и легких, что влечет за собой сбои кровоснабжения всех органов человеческого организма. Переход данного патологического состояния в более тяжелую форму способен привести к возникновению сердечной недостаточности хронического характера.
Диастола имеет важное значение, потому что благодаря ей сердечная мышца получает необходимый кислород, который разносится по кровеносной системе через коронарные артерии.
Если она не способна в полной мере выполнять свои задачи, левый желудочек страдает от дефицита кислорода. Это ведет к нарушению обмена в тканях миокарда и ишемии.
Затяжная ишемия губительна по отношению к клеткам, вместо которых образуется соединительная ткань. Такой процесс называют склерозом или фиброзом. Измененная структура тканей становится причиной затрудненного сокращения левого желудочка. В конечном итоге происходит и сбой систолы.
Классификация
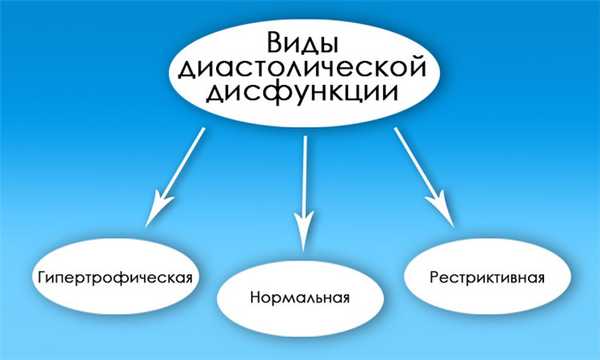
Первый вид заболевания - самый распространенный. Он таит в себе серьезную опасность, поскольку на начальной стадии развития протекает практически без каких-либо симптомов. Для него характерно снижение способности перегонять кровь в желудочек из парного кровеносного сосуда легочного ствола. Причиной тому становится недостаточная эластичность стенок миокарда.
Второй вид недуга проявляется на фоне увеличения давления со стороны левого предсердия, что ведет к нарушению функции диастолы. Также его называют псевдонормальным.
Самым тяжелым считается рестриктивный вид патологии, когда существует угроза жизни человека, в связи с серьезными нарушениями в сердце. В подобных ситуациях обычно проводится трансплантация сердца.
Если у человека имеется диастолическая дисфункция левого желудочка по 1 типу, об этом могут свидетельствовать отеки, которые наблюдаются преимущественно вечером. Подобное состояние обусловлено застоем жидкости в организме. Отечность обычно отмечается на нижних конечностях.
При этом пациент может жаловаться на боли в сердце, вызванные ишемией миокарда. Нередко после физической активности появляется одышка. Диастолическая дисфункция левого желудочка 1 типа не должна оставаться без внимания, она требует медикаментозной коррекции.
На начальном этапе развития болезнь может даже не проявляться. При отсутствии должного лечения она будет прогрессировать, в результате чего могут появиться следующие признаки диастолической дисфункции левого желудочка:

- одышка в состоянии покоя или после незначительных физических нагрузок;
- учащение сердечного ритма;
- чувство сдавленности в области грудной клетки и нехватки кислорода;
- отечность нижних конечностей;
- синюшный окрас кожных покровов;
- быстрая утомляемость;
- сердечная боль.
Крайне редко у пациентов может отмечаться кашель, который возникает вечером. Его появление указывает на наличие застойных явлений в легких.
Кровоток в сердце проходит 3 этапа:
- мышечное расслабление (диастола);
- медленное наполнение левого желудочка кровью, обеспеченное разницей давления внутри предсердий;
- заполнение левого желудочка оставшейся кровью после сокращения сердца.
Речь идет о диастолической дисфункции, когда происходит какой-либо сбой в такой отлаженной системе. Патология данного типа может возникать по причине наличия следующих факторов:
- престарелый возраст;
- перенесенный инфаркт миокарда;
- нарушение кровотока в сердечно-сосудистой системе;
- избыточная масса тела;
- гипертония;
- дисфункция миокарда.
Отклонения в работе сердца провоцируют пагубные привычки в виде курения и употребления алкоголя. Не лучшим образом на состоянии сердечной мышцы сказывается любовь к кофеиносодержащим напиткам.
Как утверждают специалисты в области медицины, основным провоцирующим фактором данного заболевания является ухудшение сокращающей и расслабляющей способности миокарда. Это обычно обусловлено плохой эластичностью его мышечных тканей. Подобное состояние может привести к возникновению ряда болезней, включая инфаркт, гипертрофию миокарда и артериальную гипертонию.
Диастолическая дисфункция также может поражать новорожденных детей. Если у ребенка отмечается усиленное кровоснабжение легких, это может стать причиной того, что:
- увеличится размер сердца;
- случится перегрузка предсердий;
- появится тахикардия;
- ухудшится сокращение сердца.
Такое состояние не считается патологическим, поэтому не требует особого лечения, если возникает у детей сразу после появления на свет. Но если ребенок перенес гипоксию, либо был рожден раньше положенного срока, такая проблема может сохраняться в течение двух недель.
Лечение
Поставить диагноз «диастолическая дисфункция левого желудочка» по 1 типу, 2 или 3, можно только после прохождения пациентом ряда обследований. Для этого необходимо будет сдать общий анализ мочи, биохимию крови. Также может потребоваться проверка работы щитовидной железы, почек, печени.
Самый информативный способ исследования при наличии аномалии сердца - это ЭКГ.
Продолжительность процедуры составляет всего 10 минут. Во время ее проведения на область грудной клетки больного крепятся электроды, которые считывают необходимую информацию. При этом важно, чтобы тело было расслабленным, а дыхание - спокойным. Исследование рекомендуется проводить по прошествии 2-3 часов после еды.
Дополнительно может быть назначено проведение УЗИ сердца. Этот метод диагностики позволяет определить состояние органа, а также проверить кровоток. Никакой подготовки ультразвуковое исследование не требует.
Только после получения результатов комплексного обследования доктор ставит диагноз и определяет дальнейшую тактику лечения. Основные задачи терапии заключаются в следующем:
- нормализовать сердечный ритм;
- не допустить возникновение аритмии;
- вылечить ишемическую болезнь сердца;
- стабилизировать давление.
Для нормализации сердечного ритма используются бета-блокаторы, представленные такими препаратами, как «Конкор» и «Атенололл». Ишемия сердца лечится нитратами. Артериальное давление позволяют привести в норму диуретики типа «Гипотиазида» или «Спиронолактона».
При диастолической дисфункции также показан прием ингибиторов АПФ. Их действие направлено на нормализацию давления. Они обычно назначаются гипертоникам. Ингибиторы, помимо снижения давления, защищают сердце и способствуют расслаблению стенок миокарда. К препаратам этой группы относятся «Каптоприл» и «Фозиноприл».
В профилактических целях врачом может быть рекомендован прием «Аспирина Кардио». С его помощью разжижается кровь, благодаря чему сводятся к минимуму риски закупорки сосудов.
Прогноз
Случаи повторной госпитализации пациентов с диагнозом диастолическая дисфункция составляют 50%. Смертность при такой патологии - 3-7% в год.
Чтобы не допустить развития необратимых процессов, следует повышенное внимание уделять профилактическим мероприятиям. Очень важно правильно питаться, ограничить потребление соли, контролировать прием воды. В рационе должны преобладать свежие овощи, мясо нежирных сортов, крупы и кисломолочные продукты. Блюда будут полезнее, если их готовить на пару или запекать в духовке. Также необходимо полностью отказаться от жареной и острой пищи, алкоголя, курения.
Для подготовки материала использовались следующие источники информации.
Диастолическая ригидность (жесткость) левого желудочка. Оценка диастолической ригидности миокарда
предоставляем актуальную медицинскую информацию от ведущих специалистов, помогая врачам в ежедневной работе
Влияние физической нагрузки на диастолическую и систолическую функции левого желудочка у больных гипертрофической кардиомиопатией
- Джанашия П.Х. ,
- Николенко С.А. ,
- Назаренко В.А. ,
- Крылова Н.С. ,
- Стерлигов А.А. ,
- Огмрцян Л.С.
Для цитирования: Влияние физической нагрузки на диастолическую и систолическую функции левого желудочка у больных гипертрофической кардиомиопатией. РМЖ. 2006;10:786.
Гипертрофическая кардиомиопатия (ГКМП) представляет собой одно из наиболее частых генетически детерминированных заболеваний человека и, по современным эпидемиологическим данным, встречается примерно у 0,2 % населения [Maron B.J. et al., 1994, 1995 г.]. Снижение толерантности к физической нагрузке (ФН) является типичным проявлением ГКМП. Среди причин, вынуждающих пациентов ограничивать физическую активность, на первый план выступают головокружения и синкопальные состояния, одышка, быстрая утомляемость, приступы стенокардии. Одним из факторов, определяющих клинические проявления ГКМП, является наличие диастолической дисфункции левого желудочка (ЛЖ), приводящей к нарушению процессов активного расслабления и недостаточному заполнению полости ЛЖ и, как следствие, неадекватному сердечному выбросу [Brutsaert D.L., Sys S.U., Gillebert T.C., 1993; Pravin M. Shah, 2003].
Цель исследования: оценить возможные взаимосвязи между развитием анемии и ремоделированием миокарда левого желудочка (ЛЖ) у пациентов с аксиальными спондилоартритами (аксСпА).
Материал и методы: обследовано 92 пациента (65 (70,6%) мужчин) с аксСпА, возраст — 37 [31; 45] лет, длительность аксСпА — 16 [9; 21] лет. Рассчитаны индексы BASDAI, ASDAS-CРБ, исследованы гемограмма, скорость оседания эритроцитов (СОЭ), параметры феррокинетики, уровень С-реактивного белка (СРБ), всем пациентам выполнена трансторакальная эхокардиография (Эхо-КГ). В зависимости от наличия анемии и/или артериальной гипертензии (АГ) сформировано 4 группы пациентов: 1-я группа — пациенты без анемии и АГ (n=25), 2-я группа — пациенты с анемией без АГ (n=34), 3-я группа — пациенты с АГ без анемии (n=22), 4-я группа — пациенты с анемией и АГ (n=11).
Результаты исследования: доля пациентов с нормальной геометрией сердца по данным Эхо-КГ имела тенденцию к снижению в 3-й и 4-й группах по сравнению с 1-й и 2-й группами (50% и 46% против 80% и 73% соответственно, p=0,056). Частота встречаемости различных типов ремоделирования миокарда ЛЖ в группах: концентрическое ремоделирование — у 12% пациентов 1-й группы, 12% — 2-й группы, 27% — 3-й группы и 18% — 4-й группы; концентрическая гипертрофия ЛЖ — у 4% пациентов 1-й группы, 6% — 2-й группы, 5% — 3-й группы, у больных 4-й группы данный тип ремоделирования сердца отсутствовал; эксцентрическая гипертрофия ЛЖ — у 4% пациентов 1-й группы, 9% — 2-й группы, 18% — 3-й группы и 36% — 4-й группы (p=0,165 для всех).
Заключение: в ходе исследования не получены статистически значимые различия в частоте встречаемости ремоделирования миокарда ЛЖ у пациентов с аксСпА в зависимости от наличия анемического синдрома, однако наиболее высокая частота эксцентрической гипертрофии ЛЖ регистрировалась у пациентов с АГ и анемией.. Частота встречаемости ремоделирования миокарда ЛЖ закономерно нарастала у пациентов с более длительным течением аксСпА, для которых было характерно накопление традиционных факторов сердечно-сосудистого риска, прежде всего АГ, ожирения и дислипидемии.. В связи с этим основополагающей стратегией модификации риска развития и прогрессирования кардиоваскулярной патологии у пациентов с аксСпА следует считать подавление активности системного воспаления и контроль традиционных факторов сердечно-сосудистого риска.
Ключевые слова: анемия, воспаление, аксиальный спондилоартрит, ремоделирование миокарда левого желудочка, гипертрофия левого желудочка.
Anemia and left ventricular remodeling in patients with axial spondyloarthritis — is there any association?
K.N. Safarova 1 , V.I. Makhina 2 , A.P. Rebrov 1
1 Saratov State Medical University named after V.I. Razumovsky, Saratov
2 Regional Clinical Hospital, Saratov
Aim: to evaluate the possible association between anemia occurrence and left ventricular (LV) remodelling in patients with axial spondyloarthritis (axSpA).
Patients and Methods: 92 patients with axSpA were examined: 65 (70.6%) men; age — 37 [31; 45] y.o.; axSpA duration — 16 [9; 21] years. BASDAI and ASDAS-CRP indices were calculated, as well as hemogram, erythrocyte sedimentation rate (ESR), ferrokinetic parameters, C-reactive protein (CRP) level were studied. All patients underwent transthoracic echocardiography (EchoCG). The following 4 groups of patients were formed depending on the anemia and/or hypertension presence: group 1 — patients without anemia and hypertension (n=25), group 2 — patients with anemia without hypertension (n=34), group 3 — patients with hypertension without anemia (n=22), group 4 — patients with anemia and hypertension (n=11).
Results: the proportion of patients with normal LV g eometry according to EchoCG data tended to decrease in groups 3 and 4 versus groups 1 and 2 (50 and 46% vs. 80 and 73%, respectively; p=0.056). The incidence of various types of LV remodeling in groups: LV concentric remodelling — 12% of patients of group 1, 12% of group 2, 27% of group 3 and 18% of group 4; concentric LV hypertrophy — 4% of patients of group 1, 6% of group 2, 5% of group 3, in patients of group 4, this type of LV remodeling was absent; eccentric LV hypertrophy — 4% of patients of group 1, 9 % of group 2, 18% of group 3 and 36% of group 4 (p=0.165 for all).
Conclusion: the study did not show statistically significant differences in the incidence of LV remodeling in patients with axSpA, depending on the presence of anemia. However, the highest incidence of eccentric LV hypertrophy was recorded in patients with hypertension and anemia. The incidence of LV remodeling naturally increased in patients with a longer course of axSpA, which was characterized by the accumulation of traditional cardiovascular risk factors (primarily hypertension, obesity and dyslipidemia). In this regard, the fundamental strategy for modifying the risk of cardiovascular pathology occurrence and progression in patients with axSpA should be considered the inhibition of the systemic inflammation activity and the control of traditional cardiovascular risk factors.
Keywords: anemia, inflammation, axial spondyloarthritis, left ventricular remodeling, left ventricular hypertrophy.
For citation: Safarova K.N., Makhina V.I., Rebrov A.P. Anemia and left ventricular remodeling in patients with axial spondyloarthritis — is there any association? RMJ. 2021;7:18-23.
Введение
Аксиальные спондилоартриты (аксСпА) — группа ревматических заболеваний, характеризующихся формированием аутовоспалительного статуса и специфическим поражением осевого скелета, периферических суставов и энтезисов, возможным вовлечением органа зрения, кожи и желудочно-кишечного тракта [1]. Персистирующее системное воспаление и накопление традиционных факторов сердечно-сосудистого риска (ССР) выступают основными причинами, определяющими раннее формирование и быстрое прогрессирование кардиоваскулярной патологии, приводя к увеличению сердечно-сосудистой смертности пациентов с аксСпА по сравнению с общей популяцией 4.
Негативная роль воспаления реализуется в развитии миокардиальной дисфункции с последующим ремоделированием сердца, включая гипертрофию левого желудочка (ГЛЖ), наличие которой является независимым предиктором неблагоприятных сердечно-сосудистых событий и смертности от всех причин 7. В ряде исследований продемонстрировано, что анемия также выступает самостоятельным фактором неблагоприятного прогноза и увеличивает риск смертности пациентов с хронической сердечной недостаточностью (ХСН) [8] и хронической болезнью почек [9]. Несмотря на высокую частоту встречаемости в популяции аксСпА, вклад анемии в формирование кардиоваскулярной патологии у пациентов с воспалительными заболеваниями позвоночника на настоящий момент не определен. В связи с этим представляет интерес изучение влияния уровня гемоглобина на процессы ремоделирования сердца у пациентов с аксСпА.
Цель исследования: оценить возможные взаимосвязи между развитием анемии и ремоделированием миокарда левого желудочка (ЛЖ) у пациентов с аксСпА.
Материал и методы
В исследование включено 92 пациента (возраст 37 [31; 45] лет, 65 (71%) мужчин) с аксСпА, соответствующих критериям Международного общества по изучению спондилоартритов (The Assessment of Spondyloarthritis International Society, 2009) [10]. Все пациенты находились на стационарном лечении в отделении ревматологии ГУЗ «Областная клиническая больница» (г. Саратов) в 2017-2020 гг.. Пациенты соответствовали критериям включения в исследование (возраст 18 лет и старше, подписанное информированное согласие на участие в исследовании) и не имели критериев исключения из исследования.. На момент включения в исследование у пациентов не было сердечно-сосудистых заболеваний, кроме медикаментозно контролируемой артериальной гипертензии (АГ) I-II стадии. В исследование не включали пациентов с неконтролируемой или резистентной АГ, тяжелой АГ (III стадии), заболеваниями позвоночника врожденного или приобретенного характера (остеохондропатии и др.) за исключением слабовыраженных стигм дисплазии соединительной ткани (сколиоз I-II стадии и др.), вирусными гепатитами, ВИЧ-инфекцией, туберкулезом, хроническими заболеваниями в фазе обострения (язвенная болезнь желудка и двенадцатиперстной кишки, холецистит), с онкологическими и лимфопролиферативными заболеваниями, почечной или печеночной недостаточностью, беременных.
Определяли стандартные показатели гемограммы, биохимического анализа крови, параметры феррокинетики, оценивали уровень С-реактивного белка (СРБ), скорость оседания эритроцитов (СОЭ). Расчетная скорость клубочковой фильтрации определялась по формуле CKD-EPI (Chronic Kidney Desease Epidemiology Collaboration). Активность аксСпА оценивалась с помощью индексов BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) и ASDAS (Ankylosing Spondylitis Disease Activity Score) с использованием СРБ.
В зависимости от наличия анемии и/или АГ сформировано 4 группы пациентов: 1-я группа включала пациентов без анемии и АГ (n=25), 2-я группа — с анемией без АГ (n=34), 3-я группа — с АГ без анемии (n=22), 4-я группа — с анемией и АГ (n=11).
Для оценки структурно-функционального состояния сердца в стандартных эхокардиографических позициях на комплексе Acuson 128 XP/10 выполнялась трансторакальная эхокардиография (Эхо-КГ) в М-модальном режиме, двухмерном (В) режиме, режимах импульсной и постоянно-волновой допплерографии с определением показателей ЛЖ: конечный диастолический размер ЛЖ, конечный систолический размер ЛЖ, толщина задней стенки ЛЖ (ТЗСЛЖ), толщина межжелудочковой перегородки. Наличие ГЛЖ устанавливали путем расчета массы миокарда ЛЖ (ММЛЖ) и индекса массы миокарда ЛЖ (ИММЛЖ) к площади поверхности тела (S).
Критерием ГЛЖ в соответствии с рекомендациями Американского общества эхокардиографии (American Society of Echocardiography) и Европейской ассоциации эхокардиографии (European Association of Echocardiography) считали ИММЛЖ более 115 г/м 2 у мужчин и 95 г/м 2 у женщин. Типы гипертрофии и ремоделирования ЛЖ определялись в зависимости от значений ИММЛЖ и индекса относительной толщины (ИОТ) стенки ЛЖ: нормальная геометрия (нормальный ИММЛЖ и ИОТ≤0,42), концентрическое ремоделирование (нормальный ИММЛЖ и ИОТ>0,42), концентрическая гипертрофия (увеличение ИММЛЖ и ИОТ>0,42), эксцентрическая гипертрофия (увеличение ИММЛЖ и ИОТ≤0,42).
Статистический анализ полученных данных выполняли с применением пакета прикладных программ статистической обработки данных IBM SPSS Statistics 23. Оценка характера распределения данных проводилась с использованием критериев Колмогорова — Смирнова и Шапиро — Уилка. Для описания количественных признаков приведены медиана, 1-й и 3-й квартили — Ме [Q1; Q3]. Для сравнения количественных переменных между двумя группами использовался критерий Манна — Уитни, для сравнения трех и более групп — критерий Краскела — Уоллиса. Для сравнения номинальных переменных использовался точный критерий Фишера.. Различия считались статистически значимыми при р
Одобрение этического комитета ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава России на проведение исследования получено.
Результаты исследования
Клинико-лабораторная характеристика пациентов с аксСпА и особенности проводимой терапии представлены в таблице 1. Пациенты были сопоставимы по полу, длительности заболевания и базисной противовоспалительной терапии, за исключением того, что пациенты 1-й группы существенно реже использовали системные глюкокортикостероиды, а пациенты с АГ были существенно старше.. Активность заболевания по индексам BASDAI и ASDAS-СРБ статистически значимо не различалась, однако у пациентов с анемией лабораторная активность аксСпА, согласно значениям СОЭ и концентрации СРБ, была выше, чем у пациентов без анемического синдрома (табл. 2). Пациенты с АГ имели более высокие значения систолического и диастолического артериального давления, у них чаще встречались ожирение и гиперхолестеринемия.
При сравнении гематологических параметров (см. табл.. 2) у пациентов с анемией регистрировалось статистически значимое снижение уровня гемоглобина, гематокрита, отмечалась тенденция к снижению сатурации трансферрина и более низкому значению эритроцитарного индекса MCH (среднее содержание гемоглобина в эритроците).
Сравнительный анализ основных показателей Эхо-КГ включенных в исследование пациентов представлен в таблице 3. Глобальная сократимость миокарда у пациентов исследуемых групп соответствовала норме, статистически значимых различий во фракции выброса (ФВ) ЛЖ не выявлено.. Среди пациентов 3-й и 4-й групп отмечена тенденция к увеличению ММЛЖ по сравнению с пациентами без АГ.. Размеры предсердий и правого желудочка, толщина стенок ЛЖ, межжелудочковой перегородки, передней стенки правого желудочка статистически значимо отличались у пациентов с АГ.
При оценке частоты встречаемости ремоделирования миокарда у пациентов исследуемых групп по данным Эхо-КГ отмечена тенденция к снижению доли пациентов с нормальной геометрией сердца в группах с АГ и/или анемией (p=0,056). Частота встречаемости различных типов ремоделирования миокарда ЛЖ у пациентов в группах статистически значимо не различалась (p=0,165), однако доля пациентов с концентрическим ремоделированием ЛЖ была выше в группах с АГ, а самая высокая частота эксцентрической гипертрофии отмечена у пациентов 4-й группы, имевших как АГ, так и анемию (рис. 1).
Хроническое воспаление считается ключевым независимым фактором формирования сердечно-сосудистой патологии у пациентов с ревматическими заболеваниями, однако взаимосвязи между воспалением, традиционными факторами риска, генетическими предиспозициями и влиянием медикаментозной терапии до сих пор четко не обозначены [3]. Помимо воспаления к добавочным факторам ССР относится анемия. Несмотря на доказанную негативную роль анемии в прогрессировании поражения миокарда у пациентов кардиологического профиля, четкие позиции в отношении анемического синдрома при воспалительных заболеваниях позвоночника не определены.
Ведущей причиной развития анемии у пациентов с аксСпА является цитокин-индуцированное нарушение метаболизма железа в рамках персистирующего системного воспаления [11]. Частота встречаемости анемического синдрома при спондилоартритах варьирует, по разным данным, от 11,1% до 39,3%, преобладающим патогенетическим вариантом является анемия хронических заболеваний с истинным железодефицитным компонентом или без такового [12, 13]. Вклад анемии в формирование ремоделирования миокарда обусловлен следующими патогенетическими механизмами. Гемическая гипоксия, возникающая на фоне анемии, запускает гемодинамические и не ассоциированные с нарушениями гемодинамики адаптивные механизмы, позволяющие на ранних стадиях компенсировать недостаточный газообмен.. Гемодинамические механизмы реализуются в повышении сократительной способности миокарда, снижении постнагрузки за счет индуцированного гипоксией снижения сосудистого сопротивления ввиду повышенной секреции оксида азота, увеличения преднагрузки в результате повышения венозного возврата, а также положительного хроно- и инотропного влияния [14]. При длительно существующем анемическом синдроме данные процессы приводят к дезадаптивному ремоделированию миокарда ЛЖ и развитию сердечной недостаточности.
В ряде исследований показана отягощающая роль анемии у пациентов как с наличием, так и без имеющихся сердечно-сосудистых заболеваний (ССЗ). В исследовании ARIC (Atherosclerosis Risk in Communities) с участием 14 410 лиц без ССЗ было продемонстрировано самостоятельное значение анемии в качестве неблагоприятного прогностического маркера развития кардиоваскулярной патологии [15]. Снижение уровня гемоглобина выявлялось практически у каждого второго пациента с ХСН вне зависимости от ФВ ЛЖ, по данным анализа когорты MAGGIC (Metaanalysis Global Group in Chronic Heart Failure), и было ассоциировано с увеличением функционального класса заболевания и смертности от всех причин [16].
Патогенетические механизмы, лежащие в основе развития АГ у пациентов с аутоиммунными ревматическими заболеваниями, являются многофакторными.. Установлено, что иммунная дисрегуляция и хроническое воспаление играют ключевую роль в формировании АГ в результате запуска генерализованной эндотелиальной дисфункции, увеличения артериальной ригидности, преждевременного развития и прогрессирования атеросклеротического поражения сосудистой стенки [17]. Следует отметить, что, по данным исследования H. Midtbø et al. [18], увеличение встречаемости ремоделирования ЛЖ у пациентов с анкилозирующим спондилитом выявлялось независимо от наличия таких традиционных факторов ССР, как АГ, ожирение и сахарный диабет. В нашем исследовании у всех пациентов 1-й группы с изменением геометрии сердца отсутствовали другие факторы ССР, помимо высокоактивного системного воспаления.. В то же время частота встречаемости ремоделирования миокарда ЛЖ закономерно нарастала у пациентов с более длительным течением аксСпА, для которых было характерно накопление традиционных факторов ССР, прежде всего АГ, ожирения и дислипидемии.
Наше исследование имело некоторые ограничения. Небольшая выборка пациентов, вероятно, не позволила обнаружить статистически значимые различия частоты встречаемости ремоделирования миокарда ЛЖ в исследуемых группах, в связи с чем полученные результаты следует считать предварительными.. Требуется дальнейшее исследование и анализ взаимосвязей между наличием анемии и развитием ремоделирования сердца на большей когорте пациентов, а также изучение самостоятельного вклада анемии в развитие и прогрессирование сердечно-сосудистой патологии у пациентов со спондилоартритами.
Заключение
В нашем исследовании не получены статистически значимые различия в частоте ремоделирования миокарда ЛЖ у пациентов с аксСпА в зависимости от наличия анемического синдрома, однако наиболее высокая частота эксцентрической ГЛЖ регистрировалась у пациентов с АГ и анемией.. Безусловно, у пациентов с аксСпА имеется сочетание нескольких факторов, приводящих к формированию патологической геометрии сердца. Основополагающей стратегией модификации риска развития и прогрессирования ССЗ у пациентов с воспалительными заболеваниями позвоночника следует считать подавление активности системного воспаления и контроль традиционных факторов ССР.
Читайте также:
