Хирургический доступ при операции на верхушке пирамиды височной кости
Добавил пользователь Евгений Кузнецов Обновлено: 22.01.2026
Холестеатома - образование, сформированное ороговевающим эпителием, остатками кератина и различной толщины периматриксом с окружающей воспалительной реакцией или без таковой. У 2,9% пациентов с холестеатомой встречается холестеатома, которая распространяется в пирамиду височной кости. Агрессивный рост холестеатомы пирамиды височной кости может привести к деструкции подлежащих костных структур с распространением образования на скат черепа, клиновидную пазуху, подвисочную ямку, носоглотку с возможным проникновением в субдуральное пространство.
Цель: детализация существующих классификаций холестеатомы пирамиды височной кости.
Материал и методы: в данное проспективное исследование вошли 22 пациента с хроническим гнойным средним отитом, у которых была диагностирована холестеатома пирамиды височной кости. Диагноз поставлен на основании отоларингологического обследования, мультиспиральной компьютерной томография (МСКТ) височных костей, МРТ cреднего уха, диффузно-взвешенной МРТ головного мозга. Средний возраст пациентов составил 39,2±7 лет. В работе использовали классификацию холестеатомы пирамиды височной кости Moffat - Smith 2008 г.
Результаты: МСКТ височной кости с достаточной точностью и специфичностью выявляет различные деструктивные процессы, что важно для определения границы распространения образования и соответственно соотнесения данных границ c классификацией холестеатомы пирамиды височной кости. На основании КТ-снимков и обновленной классификации холестеатомы пирамиды височной кости Moffat - Smith образования были распределены в зависимости от локализации по отношению к лабиринту на супралабиринтную (n - 9), супралабиринтную-апикальную (n - 3), инфралабиринтную (n - 3), инфралабиринтную-апикальную (n - 5), массивную лабиринтную (n - 1) и массивную лабиринтную с апикальным распространением (n - 1). Таким образом, в данной статье мы попытались описать границы типов холестеатом пирамиды височной кости на основании МСКТ височных костей.
Заключение: использование предложенной классификации предоставит возможность определить тип холестеатомы пирамиды височной кости и окажет помощь в выборе тактики хирургического лечения данной патологии.
Ключевые слова: холестеатома пирамиды височной кости, хронический гнойный средний отит, классификация, компьютерная томография.
On the classification of the petrous pyramid cholesteatoma
Anikin I.A. 1 , Khamgushkeeva N.N. 1 , Ilin S.N. 1 , Bokuchava T.A. 2
1 Saint-Petersburg Scientific Research Institute of Ear, Nose, Throat and Speech
2 Murmansk Regional Clinical Hospital named after P.A. Bayandin
Cholesteatoma is the tumor formed by keratinizing epithelium, keratin residues and perimatrix of various thicknesses with or without surrounding inflammatory reaction. In 2.9% of patients with cholesteatoma it spreads to the petrous pyramid. Aggressive growth of the petrous pyramid cholesteatoma can lead to the destruction of the underlying bone structures with the spread of the tumor to the clivus, the sphenoid sinus, the infratemporal fossa, the nasopharynx with possible penetration into the subdural space.
Aim: the detailed classification of the petrous pyramid cholesteatoma.
Patients and Methods: this prospective study included 22 patients with chronic suppurative otitis media who had a petrous pyramid cholesteatoma. The diagnosis is based on an otolaryngological examination, multispiral computed tomography (MSCT) of temporal bones, MRI of the middle ear, diffuse-weighted MRI of the brain. The average age of the patients was 39.2 ± 7 years. The Moffat-Smith 2008 classification of the petrous pyramid cholesteatoma was used in the work.
Results: MSCT of the temporal bone reveals various destructive processes with high accuracy and specificity, that is important for determining the boundaries of the tumor and thus the classification of the petrous pyramid cholesteatoma. Based on CT images and updated Moffat-Smith petrous pyramid cholesteatoma classification, depending on the location in relation to the labyrinth the tumors were distributed on the supra-labyrinth (n-9), supra-labyrinth-apical (n-3), infra-labyrinth (n-3), infra-labyrinth-apical (n-5), massive labyrinth (n-1) and massive labyrinth petrous pyramid cholesteatoma with apical proliferation (n-1). Thus, in this article we have attempted to describe the boundaries of various types of the petrous pyramid cholesteatoma on the basis of the MSCT of the temporal bones.
Conclusion: the use of the proposed classification will provide an opportunity to determine the type of the petrous pyramid cholesteatoma and will help in choosing the tactics of surgical treatment of this pathology.
Key words: the petrous pyramid cholesteatoma, chronic suppurative otitis media, classification, computed tomography.
For citation: Anikin I.A., Khamgushkeeva N.N., Ilin S.N., Bokuchava T.A. On the classification of the petrous pyramid cholesteatoma // RMJ. 2017. № 23. P. 1698-1702.
Для цитирования: К вопросу о классификации холестеатомы пирамиды височной кости. РМЖ. 2017;23:1699-1702.
Статья посвящена вопросам классификации холестеатомы пирамиды височной кости. В исследование вошли 22 пациента с хроническим гнойным средним отитом, у которых была диагностирована холестеатома пирамиды височной кости. В работе использовали классификацию холестеатомы пирамиды височной кости Moffat - Smith 2008 г. Показано, что использование предложенной классификации предоставит возможность определить тип холестеатомы пирамиды височной кости и окажет помощь в выборе тактики хирургического лечения.
Холестеатома - опухолевидное образование, представляющее собой эпидермальную кисту, которая является результатом агрессивного роста ороговевающего плоскоклеточного эпителия 2.
По данным литературы, холестеатома пирамиды височной кости является очень сложным образованием для диагностики и лечения. Данная особенность связана с бессимптомной картиной развития заболевания, расположением холестеатомы близко к основанию черепа и жизненно важным нервно-сосудистым структурам височной кости, склонностью холестеатомы к рецидивам 2. Это одна из немногих патологий, которые имеют тенденцию к прогрессирующему росту. При массивном распространении может привести к костной эрозии верхушки пирамиды височной кости и развитию вне- и внутричерепных осложнений [1-3, 5, 6]. Частота встречаемости холестеатомы пирамиды височной кости составляет 4-9% от всех патологических образований в пирамиде височной кости [4], 0,2% - от всех случаев хронического среднего отита, осложненного холестеатомой [7].
Холестеатома пирамиды височной кости по происхождению может быть врожденной и приобретенной. Появление врожденной холестеатомы пирамиды височной кости объясняется сохранением эктодермального зачатка в пирамиде височной кости или в среднем ухе, из которого образование далее распространяется по направлению к верхушке пирамиды височной кости. Приобретенная холестеатома, в отличие от врожденной, чаще всего развивается вследствие инвазии эпидермиса в результате ретракции (первичная приобретенная холестеатома) или перфорации барабанной перепонки (вторичная приобретенная холестеатома). Ряд авторов также выделяют ятрогенную холестеатому, развившуюся после хирургических манипуляций на непораженном холестеатомным процессом ухе, и посттравматическую, возникающую в результате эпидермального заноса, вызванного травмой уха [2, 4].
За последнее время предложены несколько классификаций, основанных на локализации холестеатомы в каменистом отделе височной кости. U. Fish выделил супралабиринтный и инфралабиринтный-апикальный типы холестеатомы пирамиды височной кости [8]. В 1993 г. M. Sanna et al. создали классификацию холестеатомы пирамиды височной кости в зависимости от локализации образования по отношению к лабиринту, выделив: супралабиринтную, инфралабиринтную, массивную, инфралабиринтную-апикальную и апикальную [2].
По данным M. Sanna, cупралабиринтная холестеатома чаще всего бывает врожденной, но также может быть и результатом глубокого врастания эпидермиса в эпитимпанум. Она чаще поражает переднее эпитимпанальное пространство и простирается медиально к внутреннему слуховому проходу и вперед по направлению к сонной артерии. Также холестеатома может распространяться к заднему отделу лабиринта и в ретролабиринтные клетки сосцевидного отростка с поражением базального завитка улитки и лицевого нерва. В большинстве случаев супралабиринтная холестеатома клинически проявляется развитием пареза (паралича) мимической мускулатуры. Инфралабиринтная холестеатома возникает в гипотимпануме и в инфралабиринтных клетках сосцевидного отростка и распространяется вперед к внутренней сонной артерии и сзади к задней черепной ямке. Массивная лабиринтная холестеатома диффузно поражает височную кость с вовлечением в патологический процесс всего заднего и переднего отдела лабиринта и чаще является результатом роста супра- и инфралабиринтной холестеатомы, а также инвазивного роста первичной приобретенной холестеатомы. Она обычно протекает бессимптомно, но может вызвать паралич мимической мускулатуры и частичную или полную сенсоневральную тугоухость. Инфралабиринтная-апикальная холестеатома встречается в инфралабиринтных и в верхушечных отделах пирамиды височной кости. Изначально поражает передние отделы пирамиды височной кости, горизонтальную часть внутренней сонной артерии, после поражает апикальный отдел пирамиды височной кости, а затем распространяется или вверх к клиновидной пазухе, или кзади и вниз в инфралабиринтный отдел височной кости. Данная холестеатома чаще всего бывает врожденной и при ее распространении во внутреннее ухо у пациентов развивается хроническая сенсоневральная тугоухость IV степени. Функция лицевого нерва, как правило, у пациентов не нарушена. Апикальная холестеатома занимает только верхушку пирамиды височной кости и при массивном своем росте может привести к деструкции костной стенки внутреннего слухового прохода с дальнейшим распространением в сторону задней черепной ямки или к тройничному нерву [2, 9, 10].
В 2008 г. D. Moffat и W. Smith предложили классификацию холестеатомы пирамиды височной кости, которая, по данным авторов, более всеобъемлющая, чем существующие классификации. В классификации Moffat - Smith различают супралабиринтную, супралабиринтную-апикальную, инфралабиринтную, инфралабиринтную-апикальную, апикальную и массивную лабиринтную холестеатому пирамиды височной кости с апикальным распространением [11].
При планировании хирургического вмешательства хирургу необходимо иметь представление о локализации холестеатомы в пирамиде височной кости, ее расположении по отношению к сосудисто-нервным образованиям височной кости, наличии костно-деструктивных изменений структур среднего и внутреннего уха. С этой целью на предоперационном этапе обследования пациентов проводится анализ полученных результатов МСКТ-исследований височных костей, включающих серию томограмм и протокол исследования [12].
Целью данной работы послужила детализация существующих классификаций холестеатомы пирамиды височной кости.
Материал и методы
На базе ФГБУ «СПб НИИ ЛОР» Минздрава России с 2012 г. по март 2017 г. у 22 пациентов (13 женщин и 9 мужчин) с хроническим гнойным средним отитом диагностирована холестеатома пирамиды височной кости.
Диагноз был поставлен на основании отоларингологического и радиологического обследования, включающего МСКТ височных костей, МРТ cреднего уха, диффузно-взвешенную МРТ головного мозга. Средний возраст пациентов составил - 39,2±7 лет.
У 10 пациентов (45%) в анамнезе были радикальные операции на среднем ухе. Два пациента (9%) в прошлом прооперированы нейрохирургами с удалением холестеатомы верхушки пирамиды височной кости из экстрадурального подвисочного и инфралабиринтного доступов соответственно. У 10 пациентов (45%) с хроническим эпитимпано-антральным средним отитом оперативные вмешательства на ушах ранее не выполнялись.
Для более детального описания границ холестеатомы пирамиды височной кости за основу была взята классификация M. Sanna 2016 г., где на основании МСКТ височной кости определены границы только для супралабиринтной, инфралабиринтной, массивной, инфралабиринтной-апикальной и апикальной холестеатомы пирамиды височной кости [10]. Супралабиринтная-апикальная и массивная-апикальная холестеатомы пирамиды височной кости в данной системе не представлены. Таким образом, мы попытались описать границы для всех ее типов расположения в височной кости, взяв за основу классификацию Moffat и Smith 2008 г. [11].
Результаты обследования и обсуждение

На основании детального анализа МСКТ височной кости, обзора современной литературы, а также опыта хирургического лечения данной патологии нами детализирована классификация холестеатомы пирамиды височной кости (табл. 1).
Применение радиологических методов исследования височной кости (МРТ среднего уха, КТ височной кости, диффузионно-взвешенная МРТ головного мозга) в совокупности позволяют диагностировать холестеатому.
МСКТ височной кости с достаточной точностью и специфичностью выявляет различные деструктивные процессы, что важно для определения границы распространения образования и соответственно соотнесения данных границ с классификацией холестеатомы пирамиды височной кости. Использование предложенной классификации предоставит возможность определить тип холестеатомы пирамиды височной кости и окажет помощь в выборе тактики хирургического лечения данной патологии.
Заключение
В результате проведенного анализа данных МСКТ пациентов с холестеатомой пирамиды височной кости была детализирована классификация этой патологии в зависимости от расположения образования по отношению к структурам и окружающим тканям височной кости. Классификация холестеатомы пирамиды височной кости позволит выбрать оптимальный хирургический подход санации патологического процесса, а также поможет в стандартизации отчетности по данному заболеванию.
Хирургический доступ при операции на верхушке пирамиды височной кости
Московский научно-практический центр оториноларингологии Департамента здравоохранения Москвы
Московский научно-практический центр оториноларингологии ДЗ Москвы
Федеральный медико-биологический Центр им. А.И. Бурназяна ФМБА России, Москва, Россия, 123098
Хирургическое лечение холестеатомы пирамиды височной кости
Журнал: Вестник оториноларингологии. 2015;80(3): 57‑60
Кратко представлена эпидемиология, классификация, диагностика и современные тенденции хирургического лечения холестеатомы пирамиды височной кости. Описан клинический случай диагностики и хирургического лечения холестеатомы верхушки пирамиды височной кости.
Из всех заболеваний верхушки пирамиды височной кости холестеатома встречается в 3,4—9% случаев. Наиболее часто (в 60%) в этой зоне выявляется холестероловая гранулема. В то же время имеются случаи диагностики мукоцеле, арахноидальных кист, менингиомы, хордомы, ксантомы, кавернозной гемангиомы, аневризм внутренней сонной артерии, фиброзной дисплазии, хондросаркомы и метастатической карциномы. Может симулировать заболевание верхушки пирамиды и асимметричная пневматизация этой локализации [1—5].
Среди больных с холестеатомой височной кости у 2,9% встречается холестеатома пирамиды височной кости. Холестеатома этой локализации может быть первичной (врожденной), происходящей из остатков эмбриональной или аберрантной эпителиальной ткани, или вторичной вследствие инвазии холестеатомы из среднего уха или сосцевидного отростка. Вторичная холестеатома выявляется у 58%, а первичная — у 12% пациентов [2, 6]. В зависимости от локализации холестеатомы в пирамиде височной кости по классификации M. Sanna [7] выделяют пять ее видов: супралабиринтная, инфралабиринтная, массивная лабиринтная, инфралабиринтная с апикальным распространением и апикальная [7]. Наиболее часто встречается супралабиринтная (26,7—67%), массивная лабиринтная (20—38%) и инфралабиринтная (7—40%) холестеатомы [1, 6, 8].
При холестеатоме пирамиды височной кости часто наблюдается бессимптомное течение при значительном ее объеме. В зависимости от локализации ранними симптомами могут быть выраженное снижение слуха или глухота (у 9—69%), дисфункция лицевого нерва (у 29—53%), оторея (у 66,7%), периферическое головокружение (у 33,3%) или центральные неврологические осложнения вследствие эрозии рядом расположенных важных анатомических структур [1, 2, 6, 8, 9].
Применение в диагностике высокоинформативных методов исследования: мультиспиральной компьютерной томографии (МСКТ) и магнитно-резонансоной томографии (МРТ) с контрастным усилением, в том числе в non- EPY режиме, позволяет определить локализацию, распространение холестеатомы и на дооперационном этапе планировать хирургический подход.
В литературе имеются единичные обзоры, посвященные диагностике и хирургии холестеатомы пирамиды височной кости, освещающие значительное количество клинических случаев [1, 6, 8—11]. Основными задачами операции являются тотальное макроскопическое удаление холестеатомы, сохранение ствола лицевого нерва, предупреждение ликвореи и менингита и сохранение слуховой функции. Поэтому современный алгоритм выбора хирургического подхода строится на локализации холестеатомы, состоянии слуховой функции и лицевого нерва. Большинство авторов отдают предпочтение закрытым вариантам с облитерацией зоны операции и ушиванием наружного слухового прохода по Rambo, учитывая современные средства реабилитации слуха. Так, при супралабиринтной холестеатоме и нормальном слухе используют транстемпоральный супралабиринтный подход через среднюю черепную ямку, а при сенсоневральной тугоухости — выполняют субтотальную петрозэктомию транслабиринтным и транскохлеарным подходом. При инфралабиринтной холестеатоме и нормальном слухе применяют субтотальную петрозэктомию трансмастоидальным и ретролабиринтным подходами, а при сенсоневральной тугоухости — транслабиринтным и транскохлеарным подходами [6, 11, 12]. В то же время стремление сохранить слух после операции в ущерб радикальному удалению холестеатомы может привести к резидуальной патологии и необходимости повторного вмешательства. В тех случаях, когда холестеатома распространяется медиальнее капсулы лабиринта, сохранить слух невозможно, и на выбор хирургического подхода влияет состояние лицевого нерва. При этих локализациях холестеатомы при сохранной функции лицевого нерва применяют транслабиринтный и транскохлеарный или инфратемпоральный доступы, а при дисфункции лицевого нерва — транскохлеарный. Для лечения дисфункции лицевого нерва в зависимости от места компрессии выполняют декомпрессию ствола нерва, нейропластику или VII—XII анастомоз одновременно (или на втором этапе) [1, 6, 10]. Лучшие результаты операции отмечают при длительности дисфункции лицевого нерва менее 12 мес. В результате лечения глухота оперированного уха наблюдается у 18—83%, рецидив холестеатомы в разные сроки — у 2—19% и интракраниальные осложнения у 2—6% больных [6, 8].
В последние годы некоторые авторы выполняют модифицированную субтотальную петрозэктомию различными подходами, в зависимости от локализации холестеатомы, с тимпанооссикулопластикой для сохранения или улучшения функции слуха. По их данным, преимуществами открытой реконструкции являются функциональный результат, ранняя диагностика рецидива холестеатомы и менее сложная ревизионная хирургия в условиях необлитерированной полости. При этой методике после удаления холестеатомы пирамиды височной кости у 90% пациентов выполнялась тимпанопластика и у 52% — оссикулопластика. В результате операции слух улучшился у 38% пациентов, сохранился на прежнем уровне — у 29% и у 33% отмечено его ухудшение [8].
В нашей стране хирургией пирамиды височной кости занимаются преимущественно нейрохирурги. Однако и их возможности ограничены при распространенной холестеатоме пирамиды височной кости.
Представляем случай диагностики и хирургического лечения холестеатомы верхушки пирамиды височной кости.
Пациентка М., 32 года, обратилась в отделение нейрохирургии клиники ФГБУ ФМБЦ им. А.И. Бурназяна с жалобами на отсутствие слуха на правое ухо, периодические выделения из него, асимметрию лица.
Из анамнеза известно, что пациентка с детства страдает хроническим гнойным правосторонним средним отитом с периодическими обострениями в виде выделений из правого уха на фоне ОРВИ или попадания воды в ухо. Регулярно проводилась местная антибактериальная терапия с временным положительным эффектом. С 16-летнего возраста стала отмечать головокружения системного характера. В 2006 г. обратилась в клинику МОНИКИ, где выполнена КТ височных костей, по данным которой выявлено новообразование правой пирамиды височной кости. В той же клинике выполнена санирующая операция на правой височной кости с удалением задней стенки слухового прохода. В послеоперационном периоде головокружения купировались, но сохранялись выделения из этого уха. В 2009 г. стала отмечать подергивание мышц правой половины лица, эпизоды по типу гемифациального спазма до нескольких раз в день. В НИИ нейрохирургии им. Н.Н. Бурденко выполнена ретросигмовидным доступом операция на пирамиде височной кости с удалением холестеатомы правой пирамиды височной кости. После операции у пациентки полностью восстановилась функция лицевого нерва справа. Однако в 2012 г. у пациентки вновь развился парез лицевого нерва справа. Обратилась в отделение нейрохирургии клиники ФМБЦ им. А.И. Бурназяна для обследования и лечения.
При поступлении: общее состояние больной удовлетворительное. Температура тела нормальная. Кожные покровы обычной окраски. В легких дыхание везикулярное, без хрипов. АД — 120/80 мм рт.ст. Пульс 90 в 1 мин, ритмичный, удовлетворительных свойств.
При осмотре имеются спокойные, безболезненные послеоперационные рубцы в правой заушной и ретросигмовидной области. При отомикроскопии справа — наружный слуховой проход широкий, свободный, без отделяемого. Барабанная перепонка сохранена только в передних отделах. Слизистая оболочка в мезогипотимпануме утолщенная, полипозно-измененная. Полость в мастоидальном отделе небольшая, покрыта утолщенной слизистой оболочкой без эпидермиса. Слуховая труба проходима по Вальсальва. Слева наружный слуховой проход широкий, свободный. Барабанная перепонка серого цвета, опознавательные знаки дифференцируются.
В неврологическом статусе: сознание ясное. Контактная. Менингеальных знаков нет. Гипостезия в зоне иннервации V нерва справа (больше по 1—2 ветвям), корнеальный рефлекс снижен справа. Определяется грубый парез правого лицевого нерва справа (V степень по шкале House—Brackmann). Координаторные пробы выполняла удовлетворительно.
При тональной пороговой аудиометрии (ТПА) выявлена правосторонняя глухота. Слух слева в пределах возрастной нормы.
По данным электронейромиографии отмечались признаки умеренного поражения правого лицевого нерва по смешанному типу (аксональному и демиелинизирующему), проводимость по всем ветвям составляла 30—40% от нормы по типу неврита.
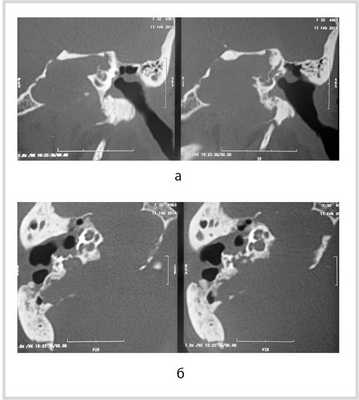
Рис. 1. КТ височных костей пациентки М. а — коронарная проекция: деструктивная полость в пирамиде височной кости, заполненная субстратом неоднородной плотности, капсула лабиринта значительно разрушена на уровне базального и апикального завитков улитки, латерального и верхнего полукружных каналов; б — аксиальная проекция: деструктивная полость с разрушением задней грани пирамиды, передневерхней и нижней поверхности.
По результатам МРТ головного мозга правая пирамида височной кости деформирована, увеличена в объеме, выполнена субстратом размером до 5,5—2,8—3 см, распространяющимся на область внутреннего слухового прохода, заднего полукружного канала, медиальные отделы барабанной полости, сосцевидный отросток. Описанный субстрат изо-гипоинтенсивен в режиме Т1, гиперинтенсивен — в Т2 и non-EPI DWI (рис. 2). Заключение: признаки рецидива холестеатомы с деструктивными изменениями структур внутреннего и среднего уха на фоне хронических воспалительных изменений.
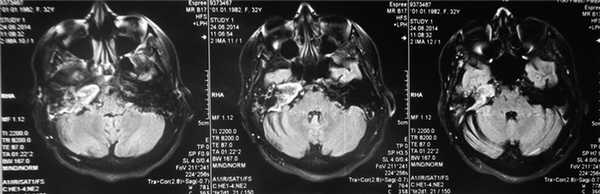
Рис. 2. Магнитно-резонансная томография головного мозга пациентки М. Деформированная, увеличенная в объеме пирамида височной кости выполнена мягкотканым субстратом.
Учитывая анамнез заболевания, ранее выполненные операции, клинические проявления (глухота, явления периферического пареза лицевого нерва) и локализацию процесса по данным КТ височных костей и МРТ, свидетельствующие о массивной лабиринтной холестеатоме, пациентке была выполнена реоперация. Транслабиринтным подходом произведена субтотальная петрозэктомия (частичная лабиринтэктомия) с удалением холестеатомы и пластикой дефекта височной кости жиром. При ревизии определялась послеоперационная неэпидермизированная мастоидальная полость, которая была заполнена утолщенной слизистой оболочкой. В барабанной полости также определялась утолщенная полипозная слизистая оболочка. Барабанная перепонка сохранена только в передних отделах. Цепь слуховых косточек отсутствовала. За счет удаления перилабиринтных клеток, заднего верхнего и латерального полукружных каналов был открыт широкий доступ в сторону верхушки пирамиды, где выявлена большая холестеатома, распространявшаяся от верхушки сосцевидного отростка до верхушки пирамиды височной кости. Выявлено обнажение луковицы яремной вены, мозговых оболочек задней черепной ямки, нисходящей части канала лицевого нерва. Холестеатома удалена с образованием большой полости внутри пирамиды височной кости. При удалении холестеатомы из области внутреннего слухового прохода (который не дифференцировался) отмечалась ликворея. Эпидермальные оболочки оставлены на луковице яремной вены, у верхушки пирамиды височной кости, под улиткой. Произведена герметизация твердой мозговой оболочки двухкомпонентным фибриновым клеем. В область верхушки пирамиды височной кости уложена подкожно-жировая клетчатка, которая была взята с передней брюшной стенки. Выполнена пластика полости свободным миофасциальным лоскутом. В барабанную полость, под остатки барабанной перепонки, уложена аутофасция. Слуховой проход не ушивался для возможности контроля за созданной полостью.
По данным гистологического исследования удаленного образования от 29.07.14: в присланном материале бесструктурные холестеатомные массы и мелкий пласт многослойного плоского эпителия с рыхлой подэпителиальной стромой с кровоизлияниями.
При наблюдении в послеоперационном периоде отмечена длительная эпителизация послеоперационной полости и сохранение пареза правого лицевого нерва (V степень по шкале House—Brackmann). Неврологический статус — без отрицательной динамики.
Представленный случай свидетельствует о возможности успешного применения транслабиринтного подхода для удаления холестеатомы верхушки пирамиды височной совместно с нейрохирургами.
Применение эндоскопической ассистенции в хирургическом лечении больных с опухолями мосто-мозжечкового угла
Данная работа посвящена проведению описательно-сравнительного анализа серии из 33 оперативных вмешательств по поводу опухолей мосто-мозжечкового угла, проведенных в НИИ нейрохирургии им. Н.Н. Бурденко с 2010 по 2012 год, в ходе которых была применена методика эндоскопической ассистенции. Все пациенты были оперированы посредством ретросигмовидного субокципитального доступа в положении «полусидя». Применение ЭА в хирургии опухолей ММУ позволило увеличить радикальность проводимых вмешательств, снизить риск развития послеоперационных осложнений путем сохранения анатомической целостности черепных нервов и важных сосудистых образований, и обеспечением сохранности костных структур основания задней черепной ямки. Данные преимущества позволили сохранить и улучшить качество жизни пациентов с опухолями ММУ в послеоперационном периоде.
Введение.
Применение эндоскопической техники в хирургии опухолей основания черепа является одной из наиболее современных технологий на сегодняшний день. За последние 10 лет значительно возрос интерес к изучению эффективности применения эндоскопической ассистенции (ЭА) в хирургии опухолей задней черепной ямки и в частности, опухолей мостомозжечкового угла (ММУ). Несмотря на большое количество публикаций по данной теме 9, не существует единого мнения насчет пользы эндоскопии в хирургии новообразований данной области. При этом, лишь в незначительной доли публикаций приводится сравнение результатов применения эндоскопии со схожими по нозологическим характеристикам группами больных, где ЭА не применялась. Целью настоящего исследования являлось проведение сравнительно-описательного анализа результатов лечения в НИИ нейрохирургии пациентов с опухолями мосто-мозжечкового угла, подвергшихся оперативному лечению с применением ЭА.
Материалы и методы.
Исследуемая серия включала 33 пациентов (24 женщины, 9 мужчин), оперированных по поводу опухолей ММУ с применением ЭА в НИИ нейрохирургии им. Н.Н. Бурденко с 2010 по 2012 гг. В нее вошли 23 пациента с вестибулярной шванномой (70%), 4 пациента с менингиомами задней черепной ямки (ЗЧЯ) различной локализации (12%), а также 5 пациентов с эпидермоидной кистой (15%) и 1 пациент с липомой мостомозжечкового угла (3%). Медиана возраста пациентов составила 44 года (возрастной диапазон 15 - 68 лет). Включение пациентов в исследуемую группу осуществлялось проспективно, при условии, что удаление опухолей производилось одной бригадой хирургов (В.Ш; В.П.). Основным критерием исключения из группы служили тяжелые соматические заболевания, наличие которых могло повлиять на исход оперативного вмешательства, вне зависимости от особенностей хирургического вмешательства. Данные о пациентах отражены в таблице 1.
Для анализа эффективности применения эндоскопической ассистенции при удалении опухолей ММУ, была сформирована контрольная группа пациентов, которым также проводилось удаление опухолей ММУ без применения эндоскопии. Данная группа состояла из 25 пациентов с невриномами слухового нерва и 5 пациентов с менинигиомами ЗЧЯ (9 мужчин, 21 женщина, возраст 15-70 лет, медиана - 47,4 лет). Включение пациентов в обе группы производилось рандомизированно, с применением соответствующего программного обеспечения.
Все пациенты контрольной группы были также оперированы в период с 2010 по 2012 гг. в НИИ нейрохирургии им. акад. Н.Н. Бурденко (Табл.1).
Всем пациентам была выполнена МРТ головного мозга. У пациентов с вестибулярными шванномами и менингиомами, распространявшимися в область внутреннего слухового прохода, была выполнена КТ в «костном» режиме для оценки внутреннего слухового прохода (ВСП) на стороне опухоли и визуализации положения верхней луковицы внутренней яремной вены.
Для проведения эндоскопической ассистенции использовались ригидные эндоскопы 30° и 70° с системой линз Hopkins, диаметром 2.7 мм и длиной 12 см. Для фиксации эндоскопа при проведении эндоскопически-контролируемых манипуляций, в 5 случаях был использован механический фиксатор эндоскопа.
Послеоперационное наблюдение и выполнение контрольной МРТ головного мозга с контрастным усилением выполнялось у пациентов обеих групп через 3, 6, 12 месяцев после операции. Критерием тотальности удаления опухоли являлось отсутствие как интракраниального, так и интраканального компонента (для вестибулярных шванном) опухоли.
Для статистического анализа использовался пакет «STATISTICA for Windows v. 10». Объектом обработки являлись результаты хирургического лечения. Для проведения анализа использовались следующие методы: χ², χ² Пирсона, максимального правдоподобия χ² и др. для таблиц сопряженности. Критерием статистической достоверности получаемых данных нами считалась общепринятая величина p
Результаты.
Все пациенты обеих групп были оперированы с применением ретросигмовидного субокципитального доступа, производимого в положении полусидя на операционном столе. При подготовке пациента к оперативному вмешательству в 23 случаях производилась установка стимулятора лицевого нерва (Medtronic NIM 3.0), не требующая применения в операционной специального нейрофизиологического оборудования и присутствия специалиста. Стойка с эндоскопическим оборудованием подготавливалась также до проведения операционного доступа, с учетом длины световода и провода камеры эндоскопа.
После проведения основного этапа вмешательства - удаления большей части опухоли и трепанации задней стенки внутреннего слухового прохода (ВСП), производилась эндоскопическая инспекция ложа удаленной опухоли и просвета ВСП с целью контроля тотальности удаления внутриканальной части опухоли. При удалении эпидермоидных кист мостомозжечкового угла инспекция области ВСП не требовалась, однако существовала необходимость проведения контроля арахноидальных цистерн на наличие остатков опухоли. В случае обнаружения остатков новообразования в цистернах ММУ, производилось эндоскопически-контролируемое их удаление, а также, при необходимости осуществлялся контроль положения волокон лицевого нерва под контролем эндоскопа. Необходимо отметить, что проведенная эндоскопическая инспекция устранила необходимость проведения дополнительной ретракции гемисферы мозжечка и манипуляций со нейроваскулярными структурами для инспекции цистерн ММУ, получения дополнительного угла обзора и усиления освещенности операционной раны.
В нашей основной, исследованной группе, применить эндоскопическую ассистенцию удалось у всех пациентов. В одном случае, после удаления парастволовой части капсулы холестеатомы, отмечались эпизоды нестабильной гемодинамики, сопровождавшиеся значительным снижением pCO2 крови. Данное обстоятельство потребовало ускорения проведения заключительного этапа операции и не позволило в полной мере провести эндоскопическую инспекцию цистерн мостомозжечкового угла.
Необходимо также отметить, что в 23 случаях при проведении эндоскопической ассистенции без дополнительной тракции мозжечка, был обнаружен остаток опухоли. Удаление резидуальной части опухоли выполнено у 18. В одном случае проведение тотальной резекции опухоли было затруднено ввиду наличия выраженного, распространенного в область внутреннего слухового прохода матрикса опухоли у пациентки с менингиомой задней поверхности пирамиды височной кости, в другом - крайне плотным сращением капсулы опухоли и корешком лицевого нерва у пациентки с вестибулярной шванномой. Во всех случаях дополнительной резекции опухоли нами использовалась как эндоскопическая эксплорация ложа опухоли, так и эндоскопически-контролируемые хирургические манипуляции (удаление опухоли, локация лицевого нерва в месте вхождения его во внутренний слуховой проход и пр.).
В этой группе добиться тотального удаления опухоли удалось в 72% случаев. Факторами, не позволившими произвести тотальное удаление опухоли, были не технические характеристики микрохирургической техники или эндоскопа, а особенности роста опухоли, ее распространение на основание черепа и интимное сращение с нейроваскулярными структурами. Последний факт во всех случаях был выявлен только при помощи эндоскопической ассистенции.
Более важным является тот факт, что в 70 % случаев только эндоскопическая ассистенция позволила выявить остаток опухоли. Например, у пациентов с вестибулярными шванномами, именно применение методики позволило на интраоперационном этапе обнаружить остаток опухоли во внутреннем слуховом проходе, убедиться в безопасности планируемого дополнительного рассверливания задней стенки внутреннего слухового прохода и удалить остаток опухоли под контролем эндоскопа. У пациентов с холестеатомами мосто-мозжечкового угла применение методики позволило выявить и удалить недоступные обзору микроскопа фрагменты новообразования (нередко находившиеся на задней поверхности корешков черепных нервов).
Данные манипуляции, несомненно, также имели важное значение для предотвращения развития послеоперационного асептического менингита.
При сравнении основной и контрольной групп пациентов по частоте развития пареза лицевого нерва, данное осложнение чаще отмечалось у пациентов из контрольной группы (p=0,0035). При этом, за благоприятный исход принималась оценка от 1 до 2 баллов по шк. Хаус-Бракманн, остальные результаты (3-6 баллов) оценивались, как развитие значимого пареза лицевого нерва.
Также в контрольной группе пациентов отмечалась меньшая радикальность удаления опухоли (в 57% по данным контрольной МРТ отмечался остаток опухоли) по сравнению с исследуемой (30% вмешательств носили субтотальный характер), при проведении теста χ2 показатель p=0,0179 (Табл. 2).
При проведении анализа исходов по шкале Карновского, медиана оценки качества жизни у пациентов контрольной группы равнялась 75,33 (ст. отклонение ± 8,60), в то время как у пациентов основной группы - 80,6. (Рис.2). Проведенное с помощью теста Мана-Уитни исследование показало статистическую достоверность данного отличия (p=0,01).
В мировой литературе приведено достаточно иллюстративных работ, подтверждающих эффективность применения эндоскопии в хирургии опухолей мостомозжечкового угла [1,2,3,5,8,9]. Основным преимуществом метода выделяется возможность инспекции «слепых» для микроскопа зон, в частности - внутреннего слухового прохода. Ряд авторов также выдвигает гипотезу о необязательности резекции задней стенки ВСП в случае применения ЭА [4]. Следует отметить, что данное предложение справедливо только для опухолей с незначительным распространением во внутренний слуховой проход. Поскольку таких пациентов в нашей серии не было, в 100% случаев трепанация задней стенки ВСП была необходимостью.
Несмотря на большое количество существующих публикаций, сравнение результатов лечения пациентов с применением ЭА и без нее, проводилось лишь в единичных случаях. Более того, за последние 10 лет не встречается публикаций, описывавших результаты, полученные в смешанных группах больных. Это обстоятельство может отчасти объяснить отсутствие четко сформулированных показаний к применению ЭА в зависимости от типа опухоли. По данным Y. Kumon и соавт., в группе с применением методики отмечалась как большая радикальность вмешательств, так и меньшее количество рецидивов в послеоперационном периоде [6]. Авторами не получено статистически-достоверной разницы в частоте сохранения «полезного» слуха и функции лицевого нерва. В нашей серии такая разница получена (p<0,05), что также отразилось на сравнении исходов операций с точки зрения качеств жизни пациентов. Сохранение функции лицевого являлось важным также с той точки зрения, что большинство оперированных нами пациентами являются женщинами.
На основании полученных результатов, нами отработан алгоритм проведения ЭА при удалении опухолей мосто-мозжечкового угла (Рис. 1). Следует отметить, что первичная инспекция образований данной локализации возможна только при размерах опухоли не более 20 мм. Также, применение эндоскопической техники при удалении опухолей больших и гигантских размеров нередко затруднено ввиду выраженного кровотечения. Поскольку существующий инструментарий не позволяет выполнить эффективный гемостаз при использовании только эндоскопа, хирургу приходится возвращаться к стандартной микрохирургической методике. Более того, изначально подразумеваемый субтотальный характер вмешательств в случае большого размера опухоли, делает применение ЭА нецелесообразным.
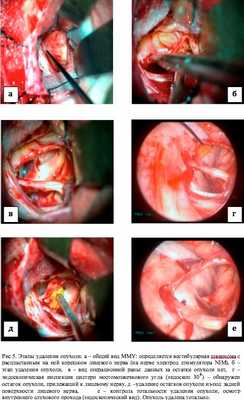
Наибольшая эффективность применения ЭА отмечалась нами в хирургии эпидермоидных кист мостомозжечкового угла. Этому способствуют особенности послеоперационного ложа опухоли - деформированный мозг на протяжении всей операции сохраняет свое положение и тем самым, создает необходимо для проведения инспекции протранство. Применение эндоскопа позволяло обнаружить фрагменты опухоли в цистернах мосто-мозжечкового угла, недоступных для инспекции с помощью операционного микроскопа (Рис. 3). Применение методики в случае удаления вестибулярных шванном позволяло инспектировать внутренний слуховой проход и в случае обнаружения остатков опухоли производить их удаление, тем самым, добиваться радикального характера вмешательства. Осмотр области трепанации задней стенки внутреннего слухового прохода с целью обнаружения костных дефектов побуждал нас применять меры профилактики ликвореи и в некоторых случаях, проводить пластику сформировавшихся дефектов (Рис. 5). При удалении менингиом задней поверхности височной кости, в том числе с распространением в область внутреннего слухового прохода, применение эндоскопической техники позволяло оценить степень инвазии опухолевой ткани в костные структуры, а также установить источник кровотечения, нередко выпадающий из «поля зрения» микроскопа (Рис. 4).
Радикальность проводимых операций зависела не только от размеров опухоли, ее связи с мозговыми структурами, но и от степени внедрения образования в область внутреннего слухового прохода. Применение ЭА было эффективным способом выявления остатков опухоли и в ряде случаев, именно проведение эндоскопической инспекции позволяло изменять тактику операции, ввиду повышения риска травматизации черепных нервов в результате дальнейшего удаления опухоли.
Эндоскопическая ассистенция является эффективной методикой, используемой в хирургии опухолей мосто-мозжечкового угла. Она позволяет провести безопасную инспекцию мостомозжечкового угла, оценить степень радикальности удаления новообразований и протяженность резекции кости в случае трепанации внутреннего слухового прохода. Данные возможности позволяют снизить риск развития послеоперационных осложнений и добиться большей радикальности удаления опухолей, а следовательно, сохранить и в некоторых случаях, улучшить качество жизни пациентов.
Одновременная работа с микрохирургической техникой и эндоскопом требует навыка, а эндоскопический вид анатомии ММУ - особого восприятия. Поэтому наш первый опыт подтверждает необходимость прохождения специального тренинга.
Особенности трансмаксиллярного трансназального доступа к опухолям основания черепа
Трансмаксиллярный трансназальный подход наиболее целесообразен при экстрадуральной локализации опухолей основания черепа.

Опухоли основания черепа, вовлекающие глазницу, околоносовые пазухи, носоглотку, являются сложной, комплексной проблемой, требующей специального подхода при определении тактики лечения. Анатомические особенности основания черепа с проходящими через него нервными и сосудистыми структурами представляют собой значительные ограничения для проведении хирургических подходов. Вовлечение в неопластический процесс указанных выше анатомических образований вызывает сложности при удалении этих новообразований ринохирургами, офтальмохирургами или нейрохирургами. При этом объем хирургических вмешательств, как правило, ограничен "зоной интереса" специалиста - хирурга. Следствием этого является нерадикальность операций, а также необоснованное расширение понятия "неоперабельность". В настоящее время, как новое направление в медицине, развивается хирургия основания черепа, задачей которой является разработка и внедрение методов лечения больных с опухолями основания черепа на основе опыта накопленного в ринохирургии, офтальмохирургии, нейрохирургии, хирургической стоматологии и пластической хирургии. Как правило, больные с опухолями основания черепа, распространяющимися в глазницу и околоносовые пазухи направляются после определения внутричерепного распространения процесса на компьютерных томограммах в нейрохирургическое учреждение. Таким образом, ответственность за дальнейшую судьбу больного ложится на специалистов нейрохирургического учреждения. При этом возникает ряд специальных проблем, связанных со спецификой этих больных: предоперационная подготовка, послеоперационное ведение, в которых большую роль играет совместная работа отоневрологов, офтальмологов, нейрохирургов.
При существующем большом разнообразии как транскраниальных, так и трансфациальных (и их комбинаций) передних доступов к основанию черепа, ни один из них не является идеальным. В частности, группа транскраниальных подходов к основанию черепа предполагает краниотомию, что негативно сказывается на эффекте проведенной операции вследствие тракции и компрессии вещества мозга. Трансфациальные доступы также имеют большое количество разнообразных недостатков, представленных ограниченностью доступа и обзора, высокой потенциальной возможностью инфицирования, косметическими дефектами.
Проблема выбора оптимального трансфациального доступа к опухолям основания черепа по следующим критериям: 1) минимальной травматизации сосудисто-нервных образований, 2) полноте визуализации области операции 3) манипуляционной свободе хирурга 4) косметическому эффекту, до сих пор остается нерешенной.
Учитывая анатомическую сложность данного подхода и высокую вероятность травматизации нервно-сосудистых образований основания черепа без специальной подготовки, трансмаксиллярный трансназальный доступ к опухолям основания черепа должен быть отработан отработан на блок-препаратах, приготовленных по специальной методике. Исследования проводится на препаратах, изъятых во время аутопсии у людей, при жизни не имевших опухолей основания черепа. Препараты должны представлять участок основания черепа, передней границей передней границей которого являлась задняя поверхность верхнечелюстных пазух, боковые границы проходили по латеральным отделам больших крыльев основной кости, по верхушке пирамиды височной кости и включали овальные отверстия. Задней границей препаратов являлась середина ската основной кости. Компьютерное моделирование этапов оперативного доступа в трехмерном изображении осуществляется с помощью компьютерной рабочей станции с программным обеспечением для построения объемной реконструкции.
Клинические проявления у пациентов с опухолями основания черепа манифестируют четырьмя основными группами симптомов: носовыми, слуховыми, глазничными и неврологическими.
В группу назальных симптомов включены одно- (и двухстороннее) ощущение заложенности носа и нарушение носового дыхания, различные по характеру выделения из носовых ходов (слизистые, слизисто-гнойные, гнойные) и носовые кровотечения. Нарушение обоняния вызывается как нарушением носового дыхания, так и распространением опухоли на слизистую оболочку решетчатой кости с деструкцией обонятельных хеморецепторов.
Слуховые симптомы возникают вследствие нарушения дренажной функции евстахиевой трубы опухолевой тканью и представляются ощущением периодической заложенности в ухе, снижением слуха и болью. Указанные клинические проявления имеют преимущественно односторонний характер.
Симптомы поражения глазницы и ее содержимого больных могут быть представлены различными клиническими вариантами, обусловленными непосредственным внедрением опухолевого узла в орбитальную полость. Наиболее часто отмечался экзофтальм, отличительной особенностью которого являлись отсутствие костных деструктивных изменений лицевого скелета, вызванный венозным застоем в орбите из-за нарушения проходимости кавернозного синуса и глазничных вен. Экзофтальм, сопровождающийся деструкцией стенок орбиты встречается реже. Нарушения движения глазного яблока, сопровождающиеся диплопией сопровождают все указанные наблюдения. Офтальмоскопически в этих группах больных выявляются застойные явления на глазном дне, сужение полей зрения. Очень редко встречается амавроз, одно-или двусторонний из-за опухолевого прорастания в каналы зрительных нервов и интраканальной компрессии нервных волокон.
Неврологические нарушения, обусловленные компрессией и (или) инфильтрацией опухолевой тканью лицевого скелета, были представлены в анализируемом материале различной степени парезами ветвей тройничного нерва. Клинические симптомы заключались в возникновении боли, парестезий и гипестезии в щеке, крыле носа, верхней губе и передних 4-х зубах. Односторонняя нейропатия проявляется сенсорными феноменами и дополняется гипо- или атрофией жевательных мышц. Изменение вкуса обусловлено нейродистрофическими изменения слизистой оболочки ротовой полости вследствие поражения мандибулярной ветви тройничного нерва.
Проведенное нейроанатомическое исследование позволяет уточнить особенности строения основания черепа для практического применения доступа, подготовить варианты хирургических манипуляций при предполагаемых осложнениях, разработать технические нюансы взависимости от локализации опухоли в конкретном случае.
После резекции передней стенки верхнечелюстной пазухи с сохранением инфраорбитального нерва, лобного отростка верхнечелюстной пазухи, верхней и средней носовых раковин, образуется полость, отграниченная с одной стороны латеральной стенкой верхнечелюстной пазухи, а с противоположной -латеральной стенкой носовой полости. На данном этапе достижимы нижне-медиальная поверхность ипсилатеральной орбиты, медиальная стенка контралатеральной орбиты. Возможно расширение объема вмешательства путем резекции медиальной стенки контралатеральной верхнечелюстной пазухи.
После удаления задней стенки верхнечелюстной пазухи открывается крылонебная ямка. В последней располагаются крылонебный узел, крылонебная артерия и верхнечелюстной нерв. Крылонебная артерия после идентификации может быть коагулирована для предупреждения риска интраоперационного повреждения и кровотечения. Верхнечелюстной нерв может быть использован как указатель расположения округлого отверстия и задне-латеральных отделов кавернозного синуса.
После удаления задних отделов решетчатой кости и передней стенки сфеноидальной пазухи удаляется слизистая оболочка последней. Поскольку к верхне-латеральной стенке пазухи прилежит канал зрительного нерва, необходимо крайне осторожно выполнять данную манипуляцию во избежание повреждения зрительного нерва в случае прорастания опухолью стенки костного канала. После удаления слизистой оболочки сфеноидальной пазухи обнажается задняя ее стенка, представляющая собой переднюю границу средних отделов ската основной кости. Резекция боковой стенки основной пазухи позволяет осуществить доступ к медиальнам отделам кавернозного синуса. Удалением задне-нижних отделов сошника и костных структур ската визуализируется твердая мозговая оболочка базальных отделов задней черепной ямки.
Для удобства оценки хирургического вмешательства трансмаксиллярный трансназальный подход к опухолям основания черепа можно разделить на четыре этапа: 1) антромаксиллярный, 2) назальный, 3) сфеноидально-кавернозный, 4) кливусный.
Выполнение антромаксиллярного этапа заключается в сублабиальном доступе к верхнечелюстной пазухе и крылонебной ямке с сохранением инфраорбитального нерва, визуализацией нервно-сосудистых образований крылонебной ямки. Возможен доступ к круглому отверстию основания черепа, руководствуясь, как направляющим, ходом инфраорбитального нерва.
При назальном этапе доступа, после резекции латеральной стенки носовой полости, выполняется удаление носовых раковин и формируется большая полость через которую возможен подход к медиальной стенке контралатеральной орбиты, решетчатой и основной кости.
Сфенокавернозный этап включает резекцию передней стенки основной пазухи с удалением ее слизистой. На данном этапе возможно проведение декомпрессии канала зрительного нерва, а после резекции латеральной стенки основной пазухи достижима медиальная стенка кавернозного синуса.
На кливусном этапе доступа доступна средняя и частично нижняя треть ската, а после удаления задней стенки пазухи основной кости визуализируется твердая мозговая оболочка ба-зальных отделов задней черепной ямки
Степень радикальности удаления опухоли определяется при контрольном радиологическом исследовании, при этом тотальным удалением считалось отсутствие на КТ и МРТ снимках остатков опухоли, субтотальным менее 10% от дооперационных снимков, а остальные случаи относятся к частичному удалению.
Вывод: трансмаксиллярный трансназальный подход наиболее целесообразен при экстрадуральной локализации опухолей основания черепа. Данным оперативным доступом возможно удаление опухолей решетчатой кости, медиальных и нижних отделов глазницы, основной пазухи и ската, а также гайморовой и носовой полостей. Представленная хирургическая методика может быть также использована при распространенных экстра-интракраниальных новообразованиях как один из этапов комплексного хирургического вмешательства.
Читайте также:
- Эффективность перевязки легочной артерии. Пневмэктомия при раке легкого
- Алгоритм обследования при краниосиностозе по Европейским рекомендациям
- Примитивная нейроэктодермальная опухоль глазницы: признаки, гистология, лечение, прогноз
- Примеры семейной кавернозной гемангиомы сетчатки
- Врожденные пороки сердца. Диагностика и лечение врожденных пороков сердца
