Изменения эндометрия при имплантации. Отношение плода к матке и оболочкам
Добавил пользователь Skiper Обновлено: 21.01.2026
Федеральный специализированный перинатальный центр ФГБУ "ФЦСКЭ им. В.А. Алмазова"
К вопросу о роли эндометрия в имплантации эмбрионов
Журнал: Проблемы репродукции. 2016;22(2): 33‑36
Статья оспаривает значение «окна имплантации» как ведущего фактора, определяющего наступление беременности, в программах ВРТ. В качестве аргумента, ставящего под сомнение сложившееся к настоящему времени представление о механизмах имплантации, представлен случай доношенной брюшной беременности с имплантацией плодного яйца в большой сальник.
Согласно принятой сегодня точке зрения, для успешной имплантации эмбрионов необходимо определенное состояние эндометрия, которое получило название «окно имплантации». «Окно имплантации» существует несколько дней в лютеиновую фазу менструального цикла и ассоциируется с появлением ряда морфологических, функциональных и биохимических изменений в эндометрии. Считается, что перенос эмбрионов за пределами «окна имплантации», когда структура эндометрия не соответствует стадии развития эмбриона, является одной из основных причин неудач ВРТ. Эндометрий рассматривается как уникальное образование, способное претерпевать прегравидную трансформацию и обеспечить условия для имплантации эмбриона в виде «окна имплантации». Тем более удивительными и заслуживающими внимания представляются факты, которые радикальным образом не соответствуют такому взгляду на уникальность эндометрия.
В сентябре 2015 г. я рассказал моему институтскому преподавателю доценту Людмиле Валентиновне Александровой о предстоящем докладе, посвященном роли эндометрия для исходов циклов вспомогательных репродуктивных технологий (ВРТ). Она с особым интересом расспросила об «окне имплантации», «пиноподиях» и в конце беседы показала опубликованную ею в 1954 г. в камбоджийском журнале статью о случае доношенной живым плодом абдоминальной беременности, в ведении которого она принимала непосредственное участие. Сохранившиеся фотографии (рис. 1, 2, 3, 4, 5, 6, 7) позволили включить этот материал в доклад, с которым я выступил на форуме «Мать и дитя» 24 сентября в Москве, на совместном симпозиуме ASPIRE-ASRM в Балтиморе, США, 22 октября; конференции Казахстанской ассоциации репродуктивной медицины 31 октября 2015 г. в Алматы. Присутствовавшие во всех перечисленных аудиториях коллеги отнеслись с большим интересом к этому редкому, но не единственному подобному случаю, но никто из участников этих заседаний не смог высказать каких-либо суждений о механизмах, которые обеспечили при этом имплантацию эмбриона, формирование материнской части плаценты и плацентарный кровоток, благодаря которым плод смог нормально развиваться. Мои обращения к литературе, гистологам и патанатомам также не позволили пока найти какого-либо объяснения этому феномену. Предлагаю перевод публикации более чем полувековой давности вниманию читателей журнала «Проблемы репродукции», с надеждой на обсуждение вышепоставленных вопросов.
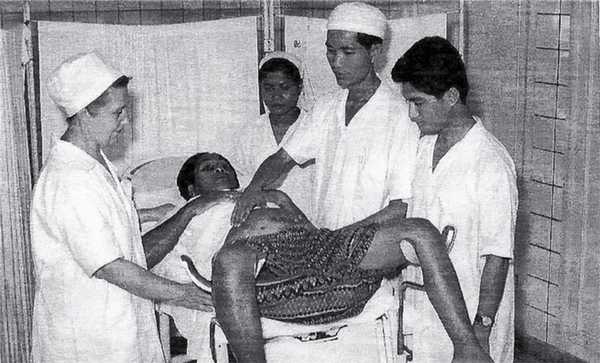
Рис. 1. Осмотр беременной (слева Л.В. Александрова).
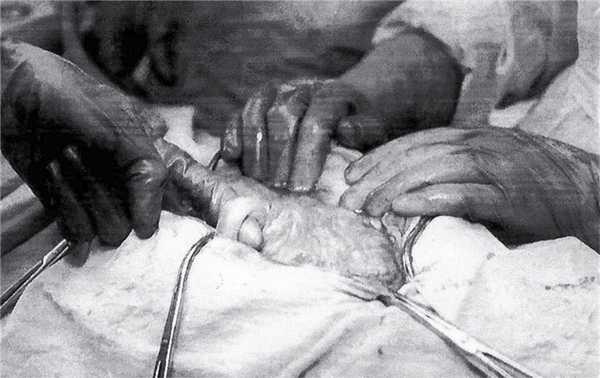
Рис. 2. Пуповина, выведенная в рану.
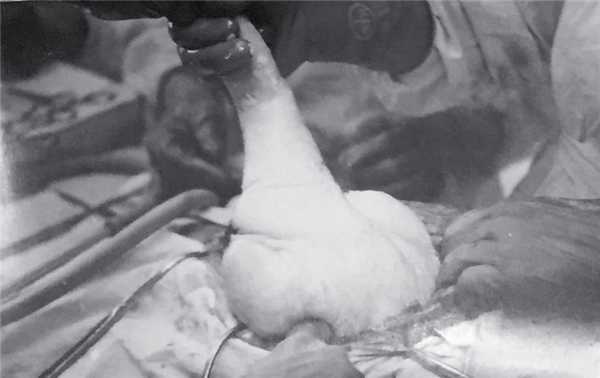
Рис. 3. Извлечение плода.
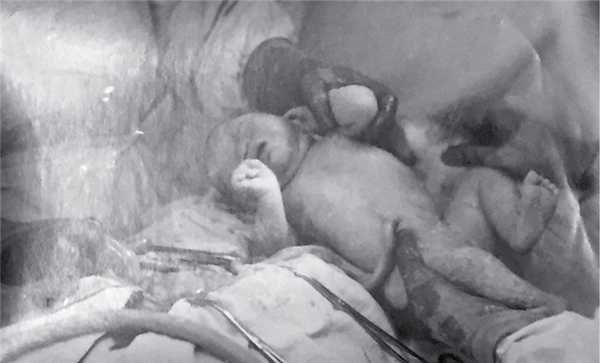
Рис. 4. Извлечена живая доношенная девочка.
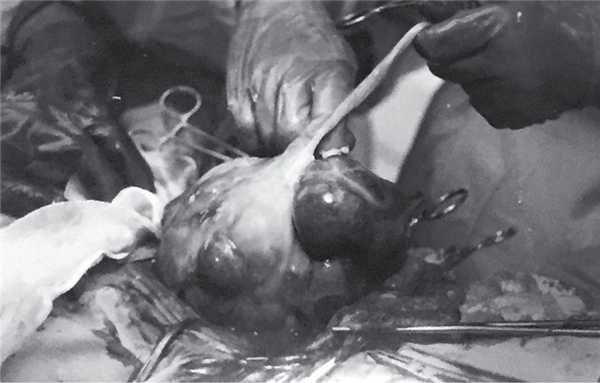
Рис. 5. Послед выведен в рану.
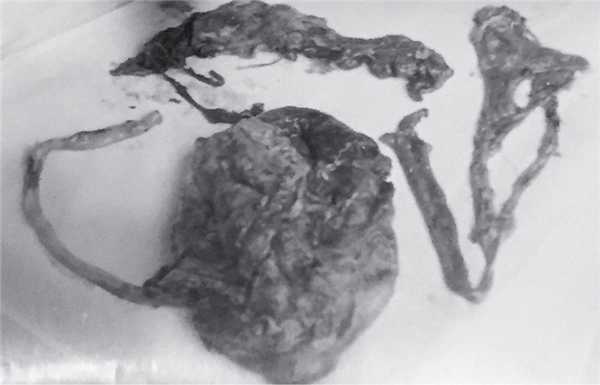
Рис. 6. Послед и удаленные фрагменты сальника.
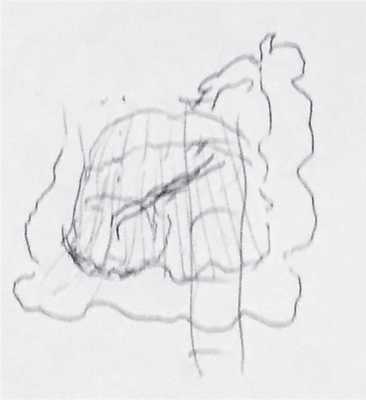
Рис. 7. Схема расположения плаценты (рис. Л.В. Александровой).
Orossesse extra uterine a terme avec le foetuse vivant
Par Dr. L.V. Alexandrova, Mr. Chhea-Tralong, Seak-san
Revue Medico-Chirurgigale de LâHopital de Lâamitie Khmero Sovietique, Phnom Penn, Cambodge. Anniversaire 1964, p.132−133
«Пациентка T.S., 31 год, поступила в акушерское отделение госпиталя Кхмеро-Советской дружбы г. Пномпеня (Камбоджа) 7 июня 1964 г. с жалобами на сильные боли в животе, рвоту и задержку газов. Из анамнеза известно, что инфекционных и гинекологических заболеваний не было. Месячные регулярные через 29 дней по 3—4 дня умеренные, безболезненные. Последние месячные в конце октября 1963 г. Первая беременность в возрасте 20 лет закончилась срочными родами без осложнений, вторая беременность — настоящая, наступила через 10 лет. От беременности не предохранялась. С середины ноября 1963 г. периодически беспокоили кровяные выделения из влагалища и боли в животе (в январе 1964 г. с потерей сознания). В конце марта (через 5 мес) почувствовала шевеление плода, кровяные выделения полностью прекратились. В конце мая 1964 г. беременная была госпитализирована в больницу провинции Симреап с болями в животе, возникавшими при шевелениях плода, который находился в поперечном положении. Попытки поворота плода в продольное положение оказались неэффективными. Через 7 дней пациентка была переведена в госпиталь Кхмеро-Советской дружбы.
Объективно: состояние удовлетворительное. АД 120/80 мм рт.ст., пульс 120 уд/мин удовлетворительного наполнения. Кожные покровы и конъюнктивы бледные. Живот увеличен до размеров доношенной беременности. Части плода легко пальпируются через брюшную стенку. Сердцебиение плода отчетливое, ритмичное, выслушивается на уровне пупка. В зеркалах: без патологии. Анализ крови: гемоглобин 42 г%; эр. 2,4 млн; л. 10400; СОЭ 65 мм/ч. Анализ мочи: следы белка, гиалиновые цилиндры, л. 1—3 в поле зрения. Рентгенологическое исследование, выполненное без подготовки, показало наличие в брюшной полости доношенного плода в неправильном положении.
Диагноз: абдоминальная доношенная беременность живым плодом. Анемия.
В течение 5 дней была проведена подготовка к операции, которая включала: гемотрансфузии, антибиотикотерапию и витаминотерапию.
Через год после операции Л.В. Александрова навестила пациентку в ее деревне: мать была здорова, девочка развита нормально и начала ходить.
Описание случая заканчивалось следующим заключением: «принимая во внимание приступы болей с потерей сознания на ранних сроках беременности, наличие сращения правых придатков с сальником, можно предположить, что у нашей пациентки была вторичная абдоминальная беременность, которая сформировалась в результате изгнания плодного яйца из правой маточной трубы (правосторонний трубный аборт)».
При обсуждении этой истории в начале ноября 2015 г. Людмила Валентиновна согласилась со мной о возможности первичной имплантации эмбриона в сальник. В качестве обоснования этого предположения мною были выдвинуты следующие аргументы:
— учитывая, что 12 июня ребенок родился доношенным, беременность могла наступить в августе—сентябре (до октября могли продолжаться менструальноподобные кровотечения). Если ориентироваться на приступ болей с потерей сознания, который был у пациентки в январе, и предположить, что так проявился трубный аборт, то срок беременности в то время должен был быть в сроки 14—16 нед. В этом случае плацента, которая вышла из маточной трубы, должна была бы остаться и окончательно сформироваться в малом тазу. В этой концепции сращение сальника с правыми придатками не может рассматриваться как следствие трубного аборта.
Расположение плаценты на передней поверхности сальника в области поперечной ободочной кишки и верхней части нисходящего отдела толстого кишечника позволяет предположить, что имела место первичная абдоминальная беременность с имплантацией эмбриона в сальник.
Главные вопросы, которые сегодня вызывает описанный случай и на которые специалисту, связанному с репродуктологией, хотелось бы получить ответы, можно свести к следующим:
— как произошла имплантация эмбриона в сальник, который по своему строению, функциональным возможностям не имел пиноподий и, конечно, никакого «окна имплантации»?
— как произошло формирование кровотока в лакунах плаценты, т. е. трансформация артериального и венозного сосудов сальника по аналогии спиральных сосудов эндометрия?
— каким образом была ограничена инвазия трофобласта, что сохранило интактным стенку толстого кишечника и позволило отделить плаценту от сальника без его травмы и удаления на большой его части?
Заключение
Очевидно, что любую эктопическую беременность, как и данный случай, можно рассматривать в качестве доказательства относительного значения эндометрия для имплантации и развития беременности. О преимущественном значении «качества» эмбриона и малой роли эндометрия для исхода ВРТ всегда говорил Юрий Верлинский.
Имплантация эмбриона
Через несколько дней после зачатия происходит имплантация эмбриона в матку. С этого момента плод начинает интенсивно развиваться, женщина считается беременной. В ее организме происходит гормональная перестройка. Спустя некоторое время появляются тошнота, слабость, сонливость. Можно ли почувствовать имплантацию эмбриона, что предпринять, чтобы повысить вероятность стать родителями — об этом будет материал.
Имплантация эмбриона: содержание статьи
Что такое имплантация эмбриона
Яйцеклетка созревает в фолликуле. В определенный момент оболочка фолликула разрывается, ооцит попадает в брюшную полость, затем в маточную трубу. Если происходит незащищенный половой акт, сперматозоиды попадают в женские половые пути и начинают движение по трубам. Там один из них встречается с яйцеклеткой, растворяет ее оболочку и оплодотворяет ее.
Дальше начинается процесс деления, в ходе которого количество клеток постоянно удваивается. Одновременно зигота движется по фаллопиевой трубе в сторону матки. Ее клетки формируют внутренний слой — эмбриобласт, и наружный — трофобласт. За счет трофобласта при имплантации после зачатия зародыш прикрепляется к стенке матки, врастая в эндометрий, связываясь с организмом матери.
Этот процесс тоже происходит поэтапно. Сначала эмбрион прилепляется к слизистой оболочке — это стадия адгезии. Затем из трофобласта образуются ворсинки, которые врастают в эндометрий, выделяя при этом вещества, размягчающие и разрушающие внутреннюю оболочку матки: сосуды, соединительную ткань. Таким образом на поверхности матки образуется выемка, или углубление, в которую полностью погружается зародыш — это инвазия.
Ворсинки трофобласта в дальнейшем формируют хорион, который обеспечивает поступление полезных веществ и кислорода, выделяет гормоны. Благодаря этому плод получает всё необходимое для роста и развития.
Когда происходит имплантация эмбриона. Сроки
От оплодотворения до прикрепления проходит примерно 8 — 9 дней. Разбивка по этапам такая:
Получается, в среднем прикрепление может произойти на 25 — 27 день менструального цикла.
Например, если имплантация эмбриона после зачатия случилась на 6 день, к этому времени эндометрий может быть «незрелым», тонким. Как итог — зародыш не полностью погружается в эндометрий, из-за чего высока вероятность прерывания и фетоплацентарной недостаточности. Подобное отклонение чаще всего встречается при избыточной продукции прогестерона.
А если зародыш попадает в полость матки слишком поздно, внутренняя оболочка претерпевает некоторые изменения, что также может привести к выкидышу в первом триместре. Причиной задержки продвижения эмбриона может быть патология фаллопиевых труб, когда сокращения стенок слишком слабые, спайки и сужения органа, сбой в делении клеток зародыша.
Симптомы
Признаков, которые бы со 100%-ной достоверностью говорили об имплантации эмбриона, нет. Но судя по отзывам многих женщин, они физически ощущали изменения, происходящие в организме в этот момент. Очевидно, эти ощущения были связаны с гормональной перестройкой, которая вызывает каскад изменений в организме.
Характерные субъективные симптомы имплантации после зачатия следующие:
- боли внизу живота — тянущие, скручивающие, сопровождающиеся усиленной пульсацией;
- слабость, недомогание, рвота, тошнота, головокружение;
- небольшое повышение температуры до 37,5 градусов;
- эмоциональная неустойчивость, раздражительность;
- изменение вкуса.
Есть и объективные симптомы, которые определяет врач на осмотре. Далее расскажем о них.
Базальная температура
Базальная температура — температура в полости прямой кишке, которую измеряют по утрам, зависит от уровня гормонов. В течение цикла ее значения меняются. Так, в первой фазе, когда происходит созревание фолликула под влиянием эстрогенов, термометр показывает цифры до 36,4 градусов. Перед овуляцией температура становится ниже — 36,2 градусов.
После разрыва фолликула на его месте образуется желтое тело — временная структура, которая синтезирует прогестерон (гормон беременности). Гормон нужен для созревания эндометрия. Кроме этого, он повышает температуру до 37,0 — 37,2 градусов. Если происходит зачатие, а после него — имплантация эмбриона, уровень прогестерона кратковременно снижается. На температурной кривой вы увидите резкое западение: в районе 36,4 — 36,6 градусов. Затем концентрация прогестерона вновь повышается, и базальная температура остается в пределах 37,0 градусов всю беременность.
Эти изменения ректальной температуры характерны только для нормальной протекающей беременности. Если у женщины имеются гормональные нарушения, повышена общая температура тела вследствие воспалительного процесса, колебания температуры нельзя считать симптомом имплантации после зачатия.
Кровотечение
Имплантационное кровотечение обусловлено повреждением мелких кровеносных сосудов во время врастания нитей трофобласта в эндометрий. Проходит в течение двух суток. Объем кровопотери небольшой: на белье просто появляются розоватые пятна. Женщина может даже не заметить выделения.
Обильного кровотечения при имплантации эмбриона не бывает. Если вы увидели, что количество выделений значительное — обратитесь к врачу. Нужно исключить маточное кровотечение, нарушения свертываемости и другие состояния, при которых требуется адекватная терапия.
Все перечисленные симптомы — как объективные, так и субъективные, необходимо оценивать в комплексе. Например, повышение только базальной температуры, или только тошнота и слабость не являются доказательством состоявшейся имплантация эмбриона после зачатия.
Изменения молочных желез и шейки матки
Хорионический гонадотропин, который начинает выделяться после зачатия и имплантации эмбриона, влияет на состояние молочных желез. Он стимулирует развитие железистой ткани молочных желез, таким образом подготавливая организм к лактации. Грудь болит, соски темнеют, становится видна сосудистая сеточка.
Кровоснабжение репродуктивных органов после зачатия усиливается. Поэтому шейка матки становится мягкой, меняет цвет с розового на синюшный. При осмотре врач определит ее низкое расположение, что связано с увеличением размеров матки.
Имплантация при ЭКО
При ЭКО оплодотворение проводится вне организма женщины: в пробирке в лабораторных условиях. На первом этапе врачи стимулируют овуляцию, чтобы получить больше яйцеклеток. Затем пунктируют яичники и проводят забор ооцитов, оплодотворяют их спермой мужа или донора. Когда эмбрионы достигают определенной степени зрелости, переносят 1 или 2 из них в полость матки.
Имплантация эмбриона в цикле ЭКО происходит иначе, чем при естественном зачатии, да и продолжительность самого процесса дольше 40 часов. Прикрепление 3-дневных эмбрионов возможно не раньше 3-х дней после переноса. Если используются криоконсервированные зародыши, процесс длится еще дольше. А вот 5-дневные материал способен врастать уже через несколько часов. При этом вероятность удачной подсадки выше также у более взрослых зародышей.
Непосредственно имплантация эмбриона происходит так же, как и при естественном зачатии. Так как у женщин, которые решаются на искусственное оплодотворение, проблема часто заключается в патологии эндометрия, важно правильно подготовиться к протоколу. Нежелательна как слишком большая толщина, так и слишком тонкая. Поэтому женщина проходит обследование, в ходе которого выясняют состояние репродуктивных органов.
Если внутренняя оболочка матки тоньше, чем нужно для имплантации эмбриона после зачатия, ее наращивают с помощью гормональных препаратов. Все процессы должны проходить синхронно, чтобы к моменту пересадки оболочка была нужной толщины.
Почему прикрепление не происходит
В некоторых случаях у пары происходит зачатие, а с имплантацией эмбриона возникают проблемы. Разберем, какие причины могут привести к такому результату.
- эндокринная патология — болезни щитовидной железы, дефицит женских гормонов, из-за которых эндометрий не созревает до нужной толщины;
- иммунная патология — в результате сбоя в работе иммунной системы клетки начинают воспринимать зародыш как инородное тело и атакуют его;
- дефектный эндометрий — вследствие операций, травм, выскабливаний и прерывания беременности;
- болезни матки — эндометрит, кисты, эндометриоз, миома больших размеров, аномалии развития;
- сопутствующая патология женщины — болезни сердечно-сосудистой и нервной системы, избыточный вес;
- вредные привычки — ухудшают состояние репродуктивных органов, снижают качество ооцитов;
- дефектные сперматозоиды вследствие вредных привычек, сопутствующих заболеваний мужчины.
- хромосомные аномалии;
- замедленное развитие эмбриона.
Имплантация эмбриона после зачатия зависит еще от одной структуры — пиноподий. Это выросты на поверхности матки, к которым непосредственно прикрепляется будущий плод. При снижении количества пиноподий, прикрепление может не произойти.
Аномальное прикрепление эмбриона
Имплантация эмбриона вне тела матки называется внематочной беременностью. Зародыш может прикрепиться к стенке фаллопиевой трубы (в большинстве случаев), к поверхности яичников и брюшины, в шейке матки. К аномальному процессу приводят гормональные нарушения, воспалительные процессы, непроходимость труб, объемные образования матки.
Женщина будет жаловаться на боли, интенсивность которых нарастает по мере прогрессирования беременности. Возможны кровотечения, слабость. Чтобы предотвратить разрыв и внутреннее кровотечение, необходима ранняя диагностика (УЗИ органов малого таза) и своевременная хирургическая операция.
Как увеличить шансы на успешную имплантацию
Таким образом, в процессе оплодотворения и последующего прикрепления участвуют:
- Яйцеклетка — нужно, чтобы произошла овуляция, яйцеклетка была здоровой. Для того, чтобы ооцит был высокого качества, необходимо нормализовать гормональный фон. В периоде подготовки к беременности рекомендуется проходить обследование, по результатам которого врач назначит коррекцию обнаруженных нарушений. Важно также устранить другие факторы, которые могут негативно повлиять на имплантацию эмбриона: избавиться от лишнего веса, убрать из рациона крепкий кофе и чай, консервированные продукты. Вместо них полезно употреблять больше овощей и фруктов, зелени. При необходимости доктор может назначить витаминно-минеральные комплексы. Обязательно нужно принимать фолиевую кислоту (фолаты) для профилактики пороков развития нервной системы;
- Эндометрий — самым важным параметром является толщина. Эндометрий под действием гормонов созревает, утолщается. Момент, когда эта оболочка максимально готова «принять» зародыш, называется «окно имплантации». Парам, которые планируют беременность, следует определить благоприятный для них период. Он длится не более 2 суток, значит, в этот период должен состояться половой контакт. На состояние внутренней оболочки влияет патология репродуктивной системы. Если есть какие-либо нарушения, то необходимо пройти курс лечения задолго до предполагаемого зачатия;
- Пиноподии — выпячивания клеток эндометрия. Максимальное количество этих структур наблюдается в середине цикла, то есть по времени совпадает с «окном имплантации». А возникают они на 6 — 9 после овуляции, исчезают через 1 — 2 суток. Для точного определения пиноподий врач может назначить биопсию — забор внутренней оболочки матки и ее исследование;
- Сперматозоиды — важны такие качества, как жизнеспособность, подвижность, количество. На качество спермы влияют общее состояние здоровья мужчины, перенесенные заболевания, операции, травмы. Следует обратить особое внимание на эпидемический паротит: детская инфекция поражает железистые органы, к которым относятся яички. Также будущему папе необходимо пройти обследование, а при выявлении болезней — своевременно пролечиться. Врачи рекомендуют отказаться от вредных привычек, наладить образ жизни, питание. Мужчина также должен принимать фолиевую кислоту для профилактики аномалий нервной системы будущего малыша.
Что делать после секса?
При естественном зачатии ограничений в сексуальной жизни нет. Если проводилось искусственное оплодотворение, необходимо соблюдать половой покой: как возбуждение, так и коитус с оргазмом повышают тонус матки, из-за чего вероятность успешной имплантации эмбриона снижается. Будущей маме в первые сутки рекомендуется строгий постельный режим, затем она может начать потихоньку вставать и двигаться, соблюдая осторожность. Ей нельзя поднимать тяжести, совершать резкие движения.
Любые препараты в этот период можно принимать только после согласования с врачом.
Покажут ли тесты беременность?
После прикрепления зародыша к стенке матки формируется хорион, который синтезирует ХГЧ — хорионический гонадотропин. Тесты на беременность реагируют именно на них: на тест-полоску нанесет реактив, который при контакте с гормоном беременности окрашивается.
Дело в том, что тест может «уловить» гормон только с определенного уровня. В самом начале беременности концентрация очень низкая, поэтому исследование покажет отрицательный результат. Если взять самый чувствительный тест, он достоверно покажет положительный результат спустя 7 — 9 дней после имплантации эмбриона. Низкочувствительные тест-полоски информативны только с 14 дня после оплодотворения.
Советы будущим родителям
Если вы планируете стать родителями — задумайтесь о своем здоровье задолго до зачатия. Эта рекомендация актуальна и для будущей мамы, и для папы. Имплантация эмбриона — сложный, многоэтапный процесс, на который влияют множество факторов. Целесообразно заранее пройти обследование, наладить режим дня и рацион питания, отказаться от вредных привычек. Пройдя эти шаги, вы намного повысите шансы на успешное оплодотворение и имплантацию.
Роль эндометрия в имплантации (обзор литературы)
Цель статьи - рассмотреть вопросы, касающиеся хронологической анатомии имплантации бластоциста, некоторых особенностей эндометрия, а также главных клеточных и молекулярных изменений, присущих эндометрию в течение преимплантационной фазы менструального цикла человека.
Хронологическая анатомия имплантации
Оплодотворенный ооцит на 4-й день после овуляции внедряется в полость матки на стадии морулы. На 5-й день после овуляции морула превращается в бластоцист. У человека процесс имплантации начинается от 7-го дня после овуляции, хотя его точное время остается до конца неизвестным. В начале имплантации бластоцист имеет 100-120 клеток. Более подробно о деталях имплантации бластоциста описано в работах [33, 47].
Контакт бластоциста с эпителием
На этой стадии пиноподы (микробугорки), находящиеся на апикальной поверхности покровного эпителия, выделяют особую жидкость, свободно распространяющуюся по полости матки. Этот процесс носит название «пиноцитоз». Как следствие этого процесса, бластоцист входит в тесный контакт с эпителием матки.
Внедрение бластоциста (адгезия)
У людей эта стадия начинается с 6-го дня после овуляции [4]. Адгезия бластоциста может быть определена как стадия тесных функциональных взаимоотношений, формирующихся между наружными мембранами клеток трофобласта и покровного эпителия. Бластоцист входит в тесный контакт с эпителием. В экспериментах на животных отмечено смещение зоны пелюцида в течение этой стадии. У человека смещение зоны пелюцида не происходит.
Инвазия трофобласта
Стадия характеризуется пенетрацией плодного яйца в маточный эпителий. У людей синцитиотрофобласт вторгается между эпителиальными клетками и прорастает в сторону базального слоя. Это так называемый интерстициальный вид инвазии. Трофобласт проникает в строму так глубоко, что покровный эпителий полностью смыкается над ним.
Реакция эндометрия
В течение преимплантационной фазы менструального цикла различные компоненты эндометрия: железистый эпителий, покровный эпителий, стромальные клетки, стромальные сосуды и межклеточная матрица, претерпевают морфологические, клеточные и молекулярные изменения. Некоторые их них имеют ограниченный жизненный цикл. Хотя каждый компонент эндометрия это отдельная анатомическая структура, в совокупности они функционально и паракринно взаимосвязаны. В последующих разделах представлены главные изменения каждого компонента эндометрия.
Железистый эпителий. Анатомические изменения. Молекулярные изменения
Плацентарный протеин 14 (ПП14) является главным секреторным продуктом желез эндометрия в течение второй половины лютеиновой фазы цикла и I (раннего) триместра беременности. ПП14 -гликопротеин с мол. м. 42 кД, содержащий 17% карбогидрата. Под влиянием прогестерона железистый секреторный эпителий синтезирует и выделяет ПП14. Показано, что ПП14 - прогестеронзависимый эндометриальный белок, отмечен его недостаток в ановуляторных циклах [11]. Ген ПП14 содержит прогестеронрегулирующие элементы [46]. ПП14 препятствует лимфопролиферации и подавляет активность природных клеток киллеров, которые присутствуют в больших количествах в эндометрии на стадии ранней беременности. Предположено, что ПП14 защищает имплантируемый эмбрион от отторжения материнской иммунной системой. Исследования биоптата эндометрия в период овуляции показали, что при окраске область эндометрия, содержащая ПП14, значительно меньше прокрашивается у женщин с поврежденным эндометрием по сравнению с пациентками, имеющими его нормальное строение [20, 21]. Женщины, перенесшие повторные внутриматочные манипуляции, имеют пониженные концентрации ПП14 в маточной жидкости по сравнению с контрольной группой.
Покровный эпителий. Анатомические изменения
Покровный эпителий - эпителий, покрывающий полость матки. Он первым контактирует с бластоцистом и в нем происходят анатомические и молекулярные изменения, повышающие рецепторную активность эндометрия к нидации бластоциста. В период имплантации главной анатомической особенностью покровного эпителия является появление микропротрузионов (микробугорков) от апикальной поверхности эпителия к слизистой оболочке матки. Эти микропротрузионы называются «пиноподы». Они появляются на 6-й день после пика ЛГ (ЛГ+6) с продолжительностью жизни 48-72 ч. Пиноподы ингибируются эстрогенами и стимулируются прогестероном. Возникновение пинопод совпадает с окном имплантации, которое появляется в период максимальной рецепторной активности эндометрия. P.Rogers и S.Murphy [49] исследовали морфологическую картину эндометрия у пациенток, получавших заместительную гормонотерапию по поводу преждевременного истощения функции яичников. Авторы проводили сканирующую электронную микроскопию и биопсию эндометрия. Выявлены 7 эпителиальных морфологических характеристик у 23 пациенток, каждая из которых получала в течение 28 дней заместительную гормонотерапию. В результате проведенного исследования сделано заключение об отсутствии корреляции между 7 изученными морфологическими чертами эндометрия и его рецепторной активностью на основании того, что у женщин с недостаточным развитием этих потенциальных анатомических маркеров в последующих циклах ЭКО и ПЭ наступала беременность.
Молекулярные изменения Гепарин-сульфат-протеоглюкан (ГСПГ)
ГСПГ - молекула, которая может играть роль в соприкосновении бластоциста с эпителием матки в фазу имплантации. D.Carson и соавт. [7] сообщили, что рецепторы ГСПГ наиболее выражены в апикальной мембране покровных эпителиальных клеток мышей в период имплантации. ГСПГ также ярко выражен на наружной поверхности мышиного бластоциста во время прикрепления бластоциста к поверхностному эпителию in vivo и in vitro. Можно предположить, что мышиный бластоцист использует рецепторы ГСПГ покровного эпителия для облегчения своего прикрепления к матке. У людей эндометриальный ГСПГ присутствует на основных мембранах сосудов и желез во время лютеиновой фазы менструального цикла.
Гликокаликс
Электроотрицательный заряд клеток покровного эпителия и толщина гликокаликса уменьшаются во время периимплантационной фазы менструального цикла. Уменьшение электрического заряда может понизить электростатическую пульсацию между бластоцистом и эндометрием в течение чувствительной (сенситивной) фазы прикрепления бластоциста к матке. Уменьшение заряда покровного эпителия, однако, не является единственным условием для адгезии бластоциста. В некоторых исследованиях, хотя поверхностный заряд покровного эпителия матки был уменьшен введением эстрогенов, прикрепление бластоциста к маточному эпителию не произошло [35]. Уменьшение поверхностного заряда является следствием повторного распределения гликоконъюгатов, находящихся на поверхности клетки. С.Murphy и соавт. [36] выявили заметное увеличение числа, формы и агрегации внутри мембранных частиц в апикальной поверхности мембраны крысиных эпителиальных клеток эндометрия в течение имплантации у крыс, получавших гормоны яичников. Авторы предположили, что внутримембранные частицы могут относиться к группам мембранных карбогидратов, и изменения в имплантации можно контролировать по уровню гликоконъюгатов, находящихся в слизистой матки. Число лектинов и моноклональных антител было использовано в аналитических пробах для оценки наличия и клеточного распределения некоторых гликоконъюгатов на поверхности эпителиальных клеток [6, 16]. При приближении имплантации гликокаликс покровного эпителия накапливает гликопротеины, содержащие N-ацетилглюкозаминовые и b1-галастозаминовые цепи, где число молекул с альфасиаликовым кислотным компонентом заметно понижено. В серии экспериментов на мышах авторы 13 выявили в крови группы антигенов карбогидратов, которые присутствовали в эпителии эндометрия, но не на стромальных клетках. Один из антигенов являлся олигосахаридным детерминантом H-типа, т.е. лакто-Н-фукопендозом-1 (ЛНФ-1). Этот карбогидрат присутствует на всех слизистых и железистых эпителиальных клетках до 4-го дня беременности. Его наличие стимулируется эстрогеном и прогестероном. Эндометриальный ЛНФ-1 связан с бластоцистом посредством рецепторов, находящихся на трофобласте. Рецепторы выявляются до и в период имплантации [32].
Мuc-1 - циклозависимый гликопротеин, выявленный на покровном эпителии в экспериментальных исследованиях у мышей [5] и у человека [9]. Исследователями продемонстрированы диаметрально противоположные образцы его протеинового воздействия у мышей и человека. У мышей синтез Мuc-1 mRNA и белков в покровном эпителии заметно уменьшается в течение диэструса и становится незаметным перед адгезией бластоцисты. В эндометрии человека синтез Мuc-1 достигает своего максимума во время имплантации. Из этих исследований следует, что у мышей исчезновение Мuc-1 связано с открытием имплантационного окна, в то время как у людей появление Мuс-1 очерчивает имплантационное окно.
Стромальные клетки
Стромальные сосуды
Во время имплантации проницаемость стромальных сосудов больше всего увеличивается в местах имплантации. Эта реакция наблюдалась у всех особей изучавшихся млекопитающих, включая крыс, хомяков, мышей, кроликов и хорьков. Визуально оценить увеличение сосудистой проницаемости можно после внутривенной инъекции макромолекулярного красящего вещества [38]. Многие исследователи доказывают роль простагландинов в реактивности сосудов эндометрия. В последнее время большое внимание уделяют другому показателю - кортикотропин-рилизинг-гормону (КРГ). По сравнению с межимплантационными местами имплантационные территории имеют более высокие концентрации КРГ и белков [34]. Количественные пробы, взятые у пациенток, показали повышение уровня концентрации КРГ в местах имплантации в 3,5-5 раз по сравнению с межимплантационными. С помощью иммуногистохимическиго анализа была изучена локализация КРГ. Исследования показали, что стромальные клетки положительно реагируют на КРГ только в местах имплантации. Этимология этого феномена не ясна. А.Psychoyos и соавт. [39] выяснили, что эмбрионные факторы, такие, как интерлейкин-1, стимулируют производство эпителиальными клетками простагландинов Е и F, которые в свою очередь стимулируют синтез КРГ стромальными клетками.
Внеклеточная матрица
Большинство компонентов внеклеточной матрицы производится стромальными фибробластами. Эпителиальные клетки участвуют в формировании внеклеточной матрицы. В течение пролиферативной фазы менструального цикла фибронектин, витронектин и коллагены типов III, V и VI являются главными интерстициальными компонентами. По приближении имплантации интерстициальные коллагеновые волокна свободно рассасываются, и межклеточная матрица становится менее вязкой и богатой в субстанциях. Сокращается стромальная иммунореактивность для коллагенов типов III и V. У людей главным изменением интерстициума являются большие потери коллагенов типа VI, начинающиеся в среднесекреторную фазу цикла и продолжающуюся после имплантации [1]. Предполагается, что отсутствие коллагенов типа VI является главным фактором, позволяющим в дальнейшем способствовать отеку, а также увеличению внеклеточного пространства. Основные мембраны перидецидуальных клеток демонстрируют структурные сходства с основными мембранами железистого или покровного эпителия [1]. На ранней стадии лютеиновой фазы цикла вокруг стромальных клеток появляются ламинин и фибронектин. ГСПГ и коллаген типа IV появляются во время поздней лютеиновой фазы цикла, когда стромальные клетки полностью трансформируются в перидецидуальные клетки. Согласно предположению J.Aplin и соавт. [1], внеклеточная матрица четко очерчивает границы, в пределах которых происходят разнообразные клеточные процессы: миграция, имплантация, а также плацентация.
Молекулы адгезии и эндометрий
Цитокины и эндометрий
В течение периимплантационного периода в тканях эндометрия присутствует широкий спектр цитокинов и факторов роста. Они выделяются эпителиальными клетками, макрофагами и лимфоцитами. После изучения структуры и действия цитокинов была установлена их идентичность и факторам роста. Цитокины проявляют свою активность в аутокринном, паракринном и юкстракринном эффекте. Хотя эндометрий человека имеет множество цитокинов, их точное воздействие и роль в имплантации у людей остаются неизвестными. Эксперименты, направленные на «вытеснение» гена или генного продукта (белка) определенного цитокина, могли бы ответить на множество вопросов. У людей такие эксперименты запрещены из этических и практических соображений, однако у мышей жизненная роль трех цитокинов, носящих название интерлейкина-1, лейкемия-ингибирующего фактора и колониестимулирующего фактора-1, была точно изучена.
Интерлейкин-1 (ИЛ-1)
ИЛ-1 состоит из двух субъединиц (ИЛ-1a и ИЛ-1b), являющихся агонистами, и двух рецепторов (ИЛ-1R типов I и II), а также рецептора антагониста ИЛ-1 (РА-ИЛ). Последний связан с ИЛ-1R типа I, предотвращая трансиндукцию и блокировку многих функций, связанных с активацией ИЛ-1R типа I in vivo и in vitro. В эндометрии человека ИЛ-1 и ИЛ-1b присутствуют в макрофагах и эндометриальных клетках. Экспрессия ИЛ-1b mRNA наблюдается в среднелютеиновую фазу цикла. ИЛ-1R типа I mRNA выделяется человеческим эпителием в увеличенной концентрации в течение лютеиновой фазы [41]. Наличие полной системы ИЛ-1 на белковом уровне было подтверждено в человеческом эмбрионе. В эндометрии мышей ИЛ-1a, ИЛ-1b mRNA и белок были обнаружены в макрофагах и эпителиальных клетках. Клетки покровного эпителия содержат ИЛ-1R типа I, а также обладают рецепторной иммунореактивностью, увеличивающейся в периимплантационный период. ИЛ-1 вырабатывается человеческими и мышиными эмбрионами. Показано, что эмбрионный ИЛ-1 и эндометриальный ИЛ-1R типа I вовлечены на ранних стадиях в эмбрио-материнский «диалог». Их вовлечение было подтверждено в исследованиях C.Simon и соавт. [44]. Авторы блокировали эндометриальный ИЛ-1R типа I у мышей его антагонистом - человеческим рекомбинантным ИЛ-1Ra. На 7-й день беременности имплантации мышиного эмбриона не происходило. Неудачная имплантация не была связана с ненормальным развитием бластоциста.
Лейкемия-ингибирующий фактор (ЛИФ)
ЛИФ - гликопротеин с мол. м. 45-56 кД, первоначально выявленный в течение индукции дифференциации и пролиферации миелоидных клеток лейкемии линии М1. У мышей ЛИФ присутствует и в матке на протяжении беременности и в бластоцисте в течение периимплантационного периода. В мышиных маточных эндометриальных железах выделение ЛИФ mRNА увеличивается только до имплантации (4-й день беременности), и это увеличение находится под материнской регуляцией. C.Stewart и соавт. [43] в своих исследованиях подтвердили жизненную роль эндометриального ЛИФ в имплантации эмбриона. Кодирующий ген ЛИФ был изменен. Репродуктивная функция гомозиготных -/- трансгенных мышей имела следующие характеристики: происходила овуляция, их ооциты оплодотворялись, но развившийся бластоцист не мог успешно имплантироваться в матке особи с измененным геном. Однако он успешно имплантировался у особей с изначальным геном. Когда гомозиготным мышам с измененным геном ЛИФ были сделаны инъекции экзогенного ЛИФ, места имплантации стали наблюдаться на 6-й день беременности. В человеческом эпителии уровень ЛИФ mRNА и белка увеличивается от средней до поздней секреторной фаз цикла [8]. Протеин локализуется в железистом эпителии. Белок расположен на человеческом железистом эпителии. ЛИФ mRNА присутствует в человеческом бластоцисте [8]. Эти факты говорят о том, что ЛИФ может являться одним из эндометриальных факторов, вовлеченных в имплантацию человека. Для подтверждения этой гипотезы необходимо продолжение экспериментов, подобных проводившимся C.Stewart и соавт. на мышах [43].
Колониестимулирующий фактор (КСФ-1)
КСФ-1 является гликопротеином с мол. м. 60 кД. Первоначально он был описан как фактор роста, индуцирующий пролиферацию и дифференциацию моноядерных фагоцитов. Роль КСФ-1 в имплантации была продемонстрирована в модельных экспериментах на мышах c остеопорозом [37]. Исследователи достигли инактивирующей мутации в 5-й области гена КСФ-1. Мыши обладали следующими характеристиками: полное отсутствие системы КСФ-1 mRNA и белков, дефекты скелета, низкое число макрофагов, отсутствие КСФ-1 в матке и бесплодие. У нормальных фертильных мышей с интактным геном КСФ-1 его маточная концентрация увеличивалась до 5 в день имплантации и до 100 на 15-й день беременности. Рецепторы КСФ-1 присутствуют в мышиных бластоцистах. Авторы предположили, что взаимодействие эмбрионного рецептора КСФ и эндометриального белка КСФ-1 облегчает инициальную стадию имплантации бластоциста. Эксперименты других исследователей также показали неблагоприятный эффект КСФ-1 в имплантации. Введение КСФ-1 нормальным мышам в течение периимлантационного периода препятствовало имплантации и редуцировало эмбрион [45]. У людей воздействие эндометриального КСФ-1 на эмбрион очень схоже с таковым у мышей. Уровень КСФ-1 mRNA и белка увеличивается от пролиферативной к секреторной фазе цикла и достигает максимума в I триместре беременности. Главное место синтеза КСФ-1 - маточный эпителий. КСФ-1 также синтезируется цитотрофобластом. Рецепторы КСФ-1 присутствуют и на эндометриальных клетках и на преимплантационном эмбрионе.
Lucas D. Klentzeris
Отдел молекулярной медицины, отдел биологических наук Университета Варвик; отдел акушерства и гинекологии госпиталя Валсграв, Ковентри, Великобритания
Перевод Н.В. Баркалиной, И.Е. Корнеевой
Автор благодарит «Organon Laboratories UK» за предоставление материалов для обзора
Когда эндометрий готов к имплантации?
Имплантацией называют процесс внедрения эмбриона в эндометрий (слизистую оболочку матки), в результате чего будущий малыш сможет продолжать развиваться, получая кислород и питательные вещества от мамы.
Цораева Юлия Руслановна
Гинеколог-репродуктолог сети центров репродукции и генетики "Нова Клиник"
Существует понятие «неполноценная имплантация», когда эмбрион проникает в эндометрий недостаточно глубоко, хорион развивается тонким и слабым, часто случается отслойка хориона и потеря беременности.
Как происходит успешная имплантация и можно ли ее прогнозировать
Глубина и полноценность инвазии (погружения) часто зависят от самого эмбриона.
Прогнозировать успех имплантации можно на основании оценки качества трофэктодермы (той части эмбриона пятого дня развития, которая впоследствии станет хорионом и плацентой).
Попадая в полость матки, эмбрион сначала "прилипает" к эндометрию и "вступает в диалог". Так называемые сигнальные молекулы вызывают трансформацию слизистой оболочки матки. Выпячиваются пиноподии (выросты эндометрия), которые обхватывают эмбрион, как пальчики. Он погружается все глубже, и сосуды слизистой оболочки начинают питать малыша.
Как изменяется эндометрий
Эндометрий — единственная ткань в организме, которая полностью обновляется каждый месяц, что необходимо для наступления беременности.
Происходит трансформация слизистой оболочки матки под действием гормонов яичников.
С первого дня цикла начинает расти один доминантный фолликул. Он выделяет эстрадиол, который с током крови достигает базального слоя эндометрия.
Под действием эстрадиола клетки слизистой оболочки матки начинают делиться и эндометрий растет. Адекватность роста легко оценить в ходе ультразвукового исследования.
Эндометрий вырастает на 1-1,5 мм за день. К моменту созревания фолликула (то есть на 13-14 день цикла) он достигает 12 мм.
До момента овуляции можно оценить и структуру базального слоя, и отсутствие прерывания линии смыкания переднего и заднего листков эндометрия. Все эти тонкие моменты очень важны. На первом же приеме есть возможность прогнозировать шансы на имплантацию.
Сразу после овуляции из лопнувшего фолликула (точнее, из желтого тела, образовавшегося на его месте после выхода яйцеклетки) выделяется прогестерон, который достигает клетки эндометрия (рецепторы).
Под действием прогестерона выросший эндометрий начинает меняться.
Перестают делиться клетки эндометрия, возникает апоптоз (поэтому часто можно заметить уменьшение толщины эндометрия во второй фазе).
Формируются выпячивания (пиноподии), достигающие своего максимума через 120 часов после начала действия прогестерона. На их верхушках образуются микроворсинки, за которые эмбрион цепляется и прилипает. Такие мельчайшие изменения на УЗИ не увидеть.
Расширяются сосуды, миометрий становится более "спокойным", не восприимчивым к сокращениям под действием окситоцина.
Успокаивающий эффект и снижение чувства тревоги также являются следствием выработки прогестерона.
Очень важное действие оказывает прогестерон на иммунную систему, формируя толерантность к эмбриону. Зачем это нужно? Благодаря гормону беременности наполовину чужеродный эмбрион не отторгается.
С первого дня действия прогестерона в ходе УЗИ видно, как эндометрий белеет. По интенсивности «побеления» можно оценить, хватает ли прогестерона (то есть выявить недостаточность желтого тела).
Если к пятому дню после овуляции эндометрий прошел все эти стадии и выглядит пышным и белым, то он готов к имплантации и можно делать перенос эмбриона. Конечно, это субъективные признаки, оценка которых зависит от опыта и знаний врача.
Как оценить рецептивность эндометрия
Через 120 часов после овуляции эндометрий становится максимально восприимчивым к имплантации (рецептивным).
Определить рецептивность слизистой оболочки можно и другими методами. Материал для исследования получают в ходе пайпель-биопсии или гистероскопии и оценивают:
- гистологически (под микроскопом считают железы и их наполненность слизью, пиноподии и сосуды);
- иммуногистохимически (рецепторы к эстрадиолу и прогестерону);
- молекулярно-генетически (проводится ЭРА-тест).
Чем больше информации, тем легче врачу оценить рецептивность эндометрия и рассчитать сдвиг окна имплантации, а соответственно, максимально повысить шансы на положительный результат программы ЭКО.
Особенности соотношения процессов пролиферации и гибели клеток эндометрия при имплантации плодного яйца на передней и задней стенках матки

Децидуальная ткань выполняет специализированные функции в течение беременности, которые обеспечивают её прогрессирование и развитие эмбриона. Эти специализированные функции обеспечиваются участием нескольких типов клеток. Децидуальные клетки развиваются в маточном эпителии и формируют новый клеточный барьер между организмом матери и плодом. Пролиферативная активность клеток эндометрия передней и задней стенок матки различным образом изменяется в ответ на имплантацию. Имплантация плодного яйца на заднюю стенку матки служит сигналом для усиления пролиферативной активности клеток эндометрия передней стенки. В отличие от этого, имплантация плодного яйца на переднюю стенку матки не сопровождается усилением пролиферативной активности клеток эндометрия задней стенки матки. Прогрессирование беременности и начало процесса плацентации сопровождается снижением пролиферативной активности клеток эндометрия задней стенки матки. Плацентация на переднюю стенку матки приводит к повышению уровня гибели клеток эндометрия передней стенки матки.
Ключевые слова
Полный текст
Имплантация зародыша и образование плаценты являются важнейшими этапами развития млекопитающих. При беременности в матке возникают существенные структурные изменения со стороны всех её компонентов (в первую очередь эндометрия), которые обуславливаются имплантацией плодного яйца, интенсивным ростом зародыша и формированием плаценты. Ведущая роль в регуляции начальной гравидарной трансформации эндометрия принадлежит жёлтому телу яичников, которое служит основным продуцентом прогестерона в 1-ом триместре беременности. Развёртывание прогестеронового эффекта в структуре эндометрия во многом зависит от особенностей тканевого распределения половых гормонов. Отсюда становится понятным, почему первые признаки лютеинового эффекта возникают в артериолах слизистой оболочки матки. Эти признаки выражаются в быстром увеличении общей площади артериально-капиллярного русла и активной артериальной гиперемии эндометрия, что способствует образованию отёка стромы эндометрия. К моменту имплантации бластоцисты в эндометрии имеется развитая система спиралевидных артериол и пилообразных железистых крипт на фоне незавершённой децидуальной трансформации клеток стромы, которые в связи с этим обозначаются предецидуальными клетками [1]. Имплантация плодного яйца является сигналом для начала процесса децидуализации эндометрия независимо от места имплантации [16]. Предецидуальные изменения касаются, прежде всего, клеток эндомет-рия, лежащих под эпителием и вокруг спиральных артерий [17]. Имеются исследования о зависимости структурной трансформации эндометрия от области васкуляризации различных слоёв эндометрия. В частности, децидуальная реакция в первую очередь возникает в месте имплантации эмбриона.
Успех имплантации зависит от взаимодействия плодного яйца с эпителием матки и предподготовленности эндометрия. Предподготовленность эндометрия включает в себя степень развития спи-ральных артерий и пролиферативную активность эндометрия. Эти процессы определяют формирование полноценного маточно—пла-центарного комплекса в период имплантации и плацентации [2, 3, 5-7, 11, 14]. Исследования, проведенные на кафедре акушерства, гинекологии и перинатологии № 2 Государственной медицинской академии им. И.И. Мечникова, показали связь прогрессирования плацентации с интенсивностью развития спиральных артерий эндометрия и местом имплантации плодного яйца на передней или задней стенках матки.
В результате проведённой работы установлено, что толщина децидуализирующегося эндометрия при имплантации плодного яйца на заднюю стенку матки достоверно выше, чем толщина де-цидуализирующегося эндометрия при имплантации на переднюю стенку матки. Однако при имплантации плодного яйца на заднюю
стенку матки, диаметр неизменённых спиральных артерий достоверно выше, чем диаметр неизменённых спиральных артерий при имплантации плодного яйца на переднюю стенку матки. Поэтому имплантация на заднюю стенку матки предпочтительнее с точки зрения предподготов- ленности децидуализирующегося эндометрия к формированию полноценного маточно-плацентарного кровообращения, вследствие большего диаметра неизменённых спиральных артерий эндометрия задней стенки матки по сравнению с передней стенкой [3].
Успехи технологии культивирования клеток и тканей позволили перейти к анализу развития клеточных популяций децидуализирующегося эндометрия in vitro.
Однако вопросу об изменении процессов пролиферации и гибели клеток эндометрия в связи с имплантацией и плацентацией при физиологически протекающей беременности in vivo в современной литературе уделяется не-достаточно внимания. Актуальность изучения пролиферации клеток эндометрия и клеточной гибели (апоптоза) велика вследствие того, что клетки эндометрия являются растущей популяцией. Её клетки-предшественники не обладают свойствами стволовых клеток [10, 18]. Известно, что большие децидуальные клетки (БДК), которые формируют основную массу клеточной популяции децидуальной ткани, выходят из пролиферации и прекращают синтез ДНК [10]. Однако в течение беременности дифференцированные децидуальные клетки, предлежащие к трофобласту, гибнут, что позволяет рассматривать популяцию децидуальных клеток, как популяцию обновляющегося типа [18]. Поэтому важно изучить соотношение процессов пролиферации и гибели на каждом этапе функционирования клеток децидуальной ткани.
В этой связи исследования, которые помогут прояснить роль этих процессов в зависимости от места локализации плодного яйца в период имплантации и плацентации, представляются весьма актуальными и современными.
Целью исследования является анализ изменений пролиферативной активности и гибели (апоптоза) клеток эндометрия в процессах имплантации и плацентации при физиологической беременности в зависимости от имп-лантации зародыша на передней или задней стенках матки.
Материалы и методы
1) коэффициент вариации для диплоидных клеток эндометрия, формирующих Gl(0) пик, который показывает вариабельность содержания ДНК в клетках эндометрия;
2) долю клеток эндометрия, находящихся в фазе синтеза ДНК (S-фазе клеточного цикла), по которому судили о пролиферативной активности клеток децидуальной ткани;
3) долю клеток эндометрия, находящихся в фазе клеточного цикла Gl(0);
4) долю клеток эндометрия, находящихся в фазе G2 клеточного цикла;
5) долю фрагментированных клеток эндометрия, находящихся в стадии гибели (апоптоза) [9].
Все полученные результаты цитологических исследований были обработаны статистически с вычислением средних величин ошибки X±Sx, критерия Стьюдента и показателя достоверности различия (Р). Различия считали достоверными при р < 0,01. Все полученные результаты обработаны на персональном компьютере с использованием прикладных статистических программ «STATGRAPHICS».
Результаты и обсуждение
Уровень пролиферативной активности клеток эндометрия до имплантации был неизвестен. Поэтому за исходный уровень для пролиферативной активности и других параметров клеточного цикла был принят показатель пролиферативной активности клеточной популяции задней стенки матки при имплантации зародыша на переднюю стенку. В этом случае уровень пролиферативной активности клеток эндометрия на задней стенке матки составил 3,9±0,6 %. В случае имплантации на заднюю стенку матки пролиферативная активность клеток эндометрия задней стенки возрастала до 8,2±1,0 % (р < 0,01).
При имплантации плодного яйца на переднюю стенку матки, пролиферативная активность клеток эндометрия передней стенки матки возрастала до 7,3±1,2 %. Особенностью реакции матки на имплантацию является то, что при имплантации на заднюю стенку матки в пролиферативный процесс вовлекаются клетки эндометрия передней стенки матки, тогда как при имплантации на переднюю стенку матки рост пролиферативной активности был ограничен только клетками эндометрия передней стенки матки. Таким образом, при имплантации пролиферативная активность клеток эндометрия возрастает в зависимости от места имплантации (табл. 1). Место имплантации различным образом сказывается на пролиферативных процессах, протекающих на передней и задней стенках матки при последующей плацентации.
Таблица 1. Уровень пролиферативной активности клеток эндометрия при имплантации и плацентации, X±Sx, %
Читайте также:
- PC-вирус и бронхиальная астма. Интерфероны при вирусных инфекциях.
- Лучевой сиаладенит
- Агенезия мозолистого тела. Отсутствие (агенезия) черепных нервов
- Врожденная вирилизирующая гиперплазия коры надпочечников: причины и механизмы развития
- Перикард и перикардиальный выпот на рентгенограмме. Однофотонная эмиссионная компьютерная томография (ОФЭКТ) сердца
