Мультицентрический механизм множественного рака толстой кишки. Предраковые изменения в толстой кишке
Добавил пользователь Евгений Кузнецов Обновлено: 22.01.2026
Ростовский научно-исследовательский онкологический институт Минздрава РФ
Ростовский научно-исследовательский онкологический институт, Ростов-на-Дону, Россия
ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздрава России, Ростов-на-Дону, Россия
Первично-множественный колоректальный рак: клинические аспекты
Резюме Цель исследования. Определить некоторые клинические особенности синхронного и метахронного колоректального рака (КРР). Материалы и методы. Объектом исследования послужили данные о 150 больных первично-множественным КРР T1-4N0-2M0-1. Проведен анализ клинических, биологических, морфологических особенностей синхронных и метахронных опухолей. Результаты. Первично-множественные опухоли составили 6,01% от всех форм КРР. Преобладал синхронный КРР (63,75%) с локализацией опухоли в сигмовидной и прямой кишке. Синхронные колоректальные опухоли у женщин чаще сочетались с раком молочной железы, метахронные выявлялись после лечения опухолей половых органов. У мужчин синхронные колоректальные опухоли чаще сочетались с раком почки, метахронные выявлялись после лечения рака желудка. Заключение. Выявленные особенности первично-множественных колоректальных опухолей возможно учитывать в программах как первичной диагностики, так и диспансерного наблюдения после лечения больных со злокачественными опухолями, что позволит улучшить раннее выявление и результаты лечения онкологических больных.
КРР - колоректальный рак
МКО - метахронная колоректальная опухоль
Проблема колоректального рака (КРР) на протяжении нескольких десятилетий продолжает оставаться актуальной, что обусловлено как ростом заболеваемости, так и прогрессивными достижениями в лечении [1]. Наряду с увеличением общей онкологической заболеваемости наблюдается увеличение заболеваемости первично-множественными опухолями толстой и прямой кишки [2], которые в настоящее время составляют 17% от всех первично-множественных злокачественных новообразований и являются одной из наиболее частых локализаций первично-множественных злокачественных опухолей после первично-множественного рака кожи [3, 4].
В настоящее время проводится изучение как клинических, так и онкобиологических аспектов первичной множественности опухолей толстой и прямой кишки 7, тем не менее многие аспекты в этой проблеме остаются открытыми, что и побудило нас коснуться некоторых вопросов первично-множественного КРР.
Цель исследования: определить некоторые клинические особенности синхронного и метахронного КРР.
Материалы и методы
Из 2497 больных КРР T1-4N0-M0-1, подвергшихся хирургическому лечению в клинике ФГБУ «РНИОИ» МЗ РФ за последние 5 лет, первично-множественный рак выявлен у 150 (6,01%), данные о которых мы и использовали для анализа. Статистическую обработку результатов выполняли с применением пакетов программ Microsoft Excel 2010 и Statistica 8.0. Оценку различий проводили с использованием критерия χ 2 , статистически значимыми считали различия при р
Результаты
Анализ клинических проявлений первично-множественного КРР показал, что отдельные симптомы многообразны и соответствуют таковым при одиночной опухоли толстой или прямой кишки. Известно, что при локализации опухоли в правой половине ободочной кишки это чаще всего хроническая анемия, нарушение общего состояния (слабость, похудание), кишечный дискомфорт (снижение аппетита, чувство тяжести в верхней половине живота, иногда рвота через несколько часов после еды), боли в животе и наличие пальпируемой опухоли. При локализации опухоли в левой половине ободочной кишки преобладают: кишечные расстройства (запоры, поносы и их чередование), патологические выделения (кровь, слизь) при дефекации. При локализации опухоли в прямой кишке основными симптомами являются тенезмы, выделение крови и слизи при дефекации, боли в прямой кишке.
При синхронных колоректальных опухолях наблюдаются симптомы, соответствующие локализации опухоли в кишке. Так, анемия в течение нескольких лет, пальпируемая опухоль в правой подвздошной области и тенезмы свидетельствуют о синхронной опухоли слепой и прямой кишки. Оценка клинической картины заболевания с обязательным обследованием всех отделов толстой и прямой кишки позволят выявить синхронный КРР и избежать диагностических ошибок. В большинстве случаев нераспознанной синхронная колоректальная опухоль остается в случае, если в связи со стенозирующим характером дистальной опухоли эндоскоп не проходит в проксимальные отделы кишки и не позволяет произвести их осмотр. Об этом следует помнить, и в таких случаях производить дополнительное обследование вышележащих отделов толстой кишки (это может быть исследование пассажа бария по кишке, спиральная рентгеновская компьютерная томография органов брюшной полости и малого таза с пероральным контрастированием).
Следует отметить возможность развития одновременно опухоли колоректальной локализации и других органов. В этом плане важным является наличие в клинической картине симптомов, не характерных для КРР, даже если диагноз уже установлен. При этом следует продолжить обследование больного для исключения опухоли другой локализации. Анализ преимущественного поражения других органов синхронным раком будет произведен далее.
В случае метахронного развития опухолей как толстой и прямой кишки, так и других органов после излечения КРР диагностика не вызывает особых трудностей. Это связано с регулярной диспансеризацией и обследованием излеченных больных, приводящей к своевременной постановке диагноза.
Оценка частоты проявления симптомов заболевания показала, что при одиночном КРР преобладали боли (60%), кровь в кале (56,7%) и запоры (46,7%). При синхронных колоректальных опухолях наиболее частыми симптомами были боль (56,7%), слабость (53,3%) и похудание (40%). При метахронном КРР в клинической картине преобладали слабость (63,6%) и боль (56,7%) (табл. 1).
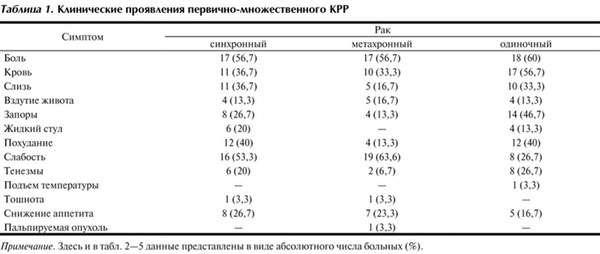
Таблица 1. Клинические проявления первично-множественного КРР Примечание. Здесь и в табл. 2-5 данные представлены в виде абсолютного числа больных (%).
В нашем исследовании время от появления первых клинических симптомов до момента обращения в специализированный онкологический стационар у больных одиночным раком составило преимущественно 6-12 мес (40% больных), а первично-множественным раком - 2-3 мес (48,3% больных).
Среди больных первично-множественным КРР синхронные и метахронные опухоли, локализующиеся только в толстой и прямой кишке, выявлены у 80 (53,3%). В этой группе больных преобладал синхронный КРР - 51 (63,75%) больной. Средний возраст пациентов составил 62,9 года. Преобладали мужчины - 32 (62,75%), средний возраст 63,2 года, женщин 19 (37,25%), средний возраст 62,5 года. Локализация синхронных опухолей в толстой и прямой кишке представлена в табл. 2. Согласно представленным данным синхронные опухоли преимущественно локализовались в сигмовидной (у 32 больных, 62,75%) и прямой кишке (у 29 больных, 56,86%). При этом сочетание опухолей в прямой и сигмовидной кишке выявлено у (35,29%). Половые различия по локализации синхронных опухолей в толстой и прямой кишке отсутствовали.

Таблица 2. Локализация синхронных опухолей в толстой и прямой кишке Примечание. Здесь и в табл. 3-5 * - различия между подгруппами достоверны (р<0,05).
У 34 (66,67%) мужчин и женщин распространение синхронных колоректальных опухолей ограничено только кишкой, без регионарных и отдаленных метастазов. Опухоли с регионарными метастазами имелись у 11 (21,57%) больных, с отдаленными - у 6 (11,76%). Распределение синхронных колоректальных опухолей по гистологической структуре свидетельствует о преобладании синхронных умереннодифференцированных аденокарцином (у 25, 49,02%), в основном у мужчин (у 17, 53,13%). У женщин часто встречались и слизеобразующие аденокарциномы (у 6, 31,58%).
Таким образом, синхронные опухоли составили 34% от всего первично-множественного КРР. Средний возраст больных достигал 62,9 года. Среди заболевших преобладали мужчины (62,75%). Синхронные опухоли преимущественно локализовались в сигмовидной (62,75%) и прямой кишке (56,86%), представлены в основном умереннодифференцированными аденокарциномами (49,02%), без регионарных и отдаленных метастазов (66,67%).
Метахронный КРР среди первично-множественного рака с локализацией опухолей только в толстой и прямой кишке выявлен у 29 (36,25%) больных (средний возраст 64,7 года). В этой группе было 16 (55,17%) женщин (средний возраст 66,9 года). Метахронная колоректальная опухоль (МКО) выявлена у них в среднем через 8,3 года после выявления первой опухоли. Среди больных метахронным первично-множественным КРР было 13 (44,83%) мужчин (средний возраст 62,5 года), метахронная опухоль выявлена у них в среднем через 4,5 года после первой опухоли.
Данные по локализации метахронных опухолей в толстой и прямой кишке отражены в табл. 3, представляющей распределение по локализации опухоли в следующем порядке: прямая кишка (51,72%, 15 больных), сигмовидная и правая половина ободочной кишки (по 48,28%, 14 больных), левая половина ободочной кишки (37,93%, 11 больных). В группе больных метахронным первично-множественным КРР наблюдались половые различия по локализации опухоли. Так, у женщин метахронные опухоли чаще локализовались в правой половине ободочной кишки - у 9 (56,25%) и прямой кишке - у 8 (50%). У мужчин МКО преимущественно локализовались в прямой и сигмовидной кишке - по 7 (53,85%) больных.

Таблица 3. Локализация метахронных опухолей в толстой и прямой кишке
У 14 (48,28%) больных распространение МКО ограничено только кишкой, без регионарных и отдаленных метастазов. Статистически значимых половых различий МКО по стадии TNM мы не наблюдали. Распределение МКО по гистологической структуре свидетельствует о значительном преобладании метахронных умереннодифференцированных аденокарцином - у 22 (75,86%) больных, как у мужчин, так и у женщин.
Итак, метахронный КРР составил 19,33% от всего первично-множественного рака толстой и прямой кишки. Средний возраст больных достигал 69,9 года, женщины были на 4 года старше мужчин. Среди заболевших было одинаковое число мужчин и женщин. Интервал между первой и последующей колоректальной опухолью у женщин в 2 раза больше (8,31 года), чем у мужчин (4,5 года). Метахронные опухоли у женщин преимущественно локализовались в правой половине ободочной кишки (56,25%) и прямой кишке (50%), у мужчин - в прямой и сигмовидной кишке (по 53,85%). МКО представлены в основном умереннодифференцированными аденокарциномами (75,86%), без регионарных и отдаленных метастазов (48,28%).
Среди больных первично-множественным КРР синхронные и метахронные опухоли, локализующиеся помимо толстой или прямой кишки, также в других органах, выявлены у 70 (46,7%). В этой группе синхронный первично-множественный рак наблюдался у 26 (37,14%) больных. Средний возраст пациентов составил 67,1 года. Женщин и мужчин было поровну - по 13 больных. Женщины на 7 лет моложе мужчин (63,6 и 70,5 года соответственно).
Локализация синхронных первично-множественных опухолей представлена в табл. 4, из которой видно, что синхронные колоректальные опухоли у женщин чаще сочетались с опухолями гениталий - у 8 (61,5%), причем у 5 - с раком молочной железы. У половины 7 (53,8%) мужчин синхронный КРР сочетался с опухолями мочевыделительной системы, причем у 6 из них - с раком почки.
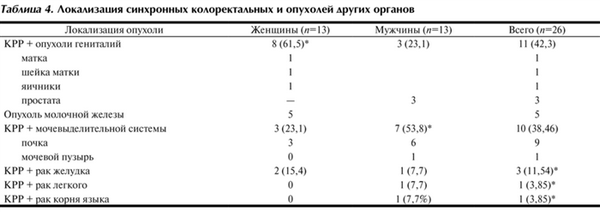
Таблица 4. Локализация синхронных колоректальных и опухолей других органов
У 65,4% больных опухоль была местно-распространенной, с наличием регионарных метастазов у одной из опухолей. Статистически значимых половых различий по стадии TNM синхронных колоректальных опухолей и других локализаций рака мы не наблюдали.
Распределение синхронных колоректальных опухолей при наличии и другой локализации рака по гистологической структуре свидетельствует о значительном преобладании синхронных умереннодифференцированных аденокарцином (80,8%) у мужчин и женщин.
Итак, синхронный КРР с другими локализациями опухолей составил лишь 17,33% от всего первично-множественного рака толстой и прямой кишки. Средний возраст больных достигал 67,1 года, женщины были на 7 лет моложе мужчин. Среди заболевших было одинаковое число женщин и мужчин. Синхронные колоректальные опухоли у женщин чаще сочетались с раком молочной железы. У мужчин синхронный КРР чаще сочетался с раком почки. Синхронные колоректальные опухоли представлены в основном умереннодифференцированными аденокарциномами (80,8%), местно-распространенными, с наличием регионарных метастазов (65,4%).
Метахронный КРР после лечения первой опухоли, локализующейся в других органах, составил 44 (29,33%) случая среди первично-множественных КРР и 62,86% среди первично-множественного КРР, сочетающегося с опухолями других органов. Средний возраст больных достигал 65,1 года. В этой группе больных было 24 (54,55%) женщины (средний возраст 61,3 года) и 20 (45,45%) мужчин (средний возраст 69 лет) на 8 лет старше женщин. Среднее время выявления МКО после лечения опухоли другой локализации у женщин составило 5,7 года, у мужчин - 4,4 года.
Локализация метахронных первично-множественных опухолей показана в табл. 5. Согласно представленным данным МКО у женщин чаще сочетались с опухолями половых органов - у 19 (79,23%), преимущественно матки и молочной железы. У мужчин метахронный КРР чаще сочетался с раком желудка - у 11 (55%).
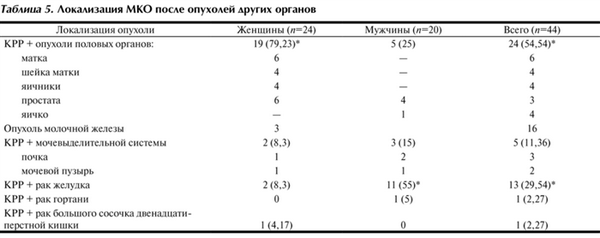
Таблица 5. Локализация МКО после опухолей других органов
28 (63,6%) больных имели местно-распространенную форму МКО и других локализаций рака, без отдаленных метастазов. Половые различия при этом отсутствовали.
Распределение МКО при наличии и другой локализации рака свидетельствует о значительном преобладании метахронных умеренно дифференцированных аденокарцином у мужчин и женщин - 33 (75%) больных.
Итак, метахронный КРР с другими локализациями опухолей составил 29,33% от всего первично-множественного рака толстой и прямой кишки. Средний возраст больных достигал 65,1 года, женщины на 8 лет моложе мужчин. Среди заболевших одинаковое число женщин и мужчин. Среднее время выявления МКО после лечения опухоли другой локализации у женщин составило 5,7 года, у мужчин - 4,4 года. МКО у женщин преимущественно выявлялись после лечения опухолей половых органов (79,23%). У мужчин метахронный КРР чаще наблюдался после лечения рака желудка (55%). МКО представлены в основном умереннодифференцированными аденокарциномами (75%), местно-распространенными, без отдаленных метастазов (63,64%).
Заключение
Клиническая картина первично-множественного КРР характеризуется наличием симптомов, не свойственных только одной локализации рака. Это обусловливает необходимость расширения диагностического поиска для исключения синхронной опухоли. При этом более выраженное клиническое проявление симптомов первично-множественного заболевания приводит к уменьшению до 3 мес сроков от появления клинической картины недуга до обращения за специализированной помощью у большинства больных (50% больных синхронным и 70% больных метахронным раком). В этот срок при одиночном КРР обращаются лишь 30% больных.
Диагностика метахронных опухолей облегчается наличием диспансеризации и регулярного обследования больных после излечения первой опухоли.
Первично-множественный КРР с локализацией опухолей только в толстой и прямой кишке составил 53,33% от всех форм первично-множественного КРР. В этой группе больных преобладал синхронный КРР (63,75%), которым заболевают чаще в 62,9 года, несколько чаще мужчины (62,75%). Синхронные опухоли преимущественно локализовались в сигмовидной (62,75%) и прямой кишке (56,86%). Средний возраст больных при выявлении МКО был старше, чем синхронных - 69,9 года. Интервал между выявлением первой и последующей колоректальной опухоли у женщин был в 2 раза больше, чем у мужчин (8,3 и 4,5 года соответственно). Метахронные опухоли у женщин преимущественно локализовались в правой половине ободочной кишки (56,25%) и прямой кишке (50%), у мужчин - в прямой и сигмовидной кишке (по 53,85%).
Если КРР выявлялся одновременно с опухолями других органов, то средний возраст больных (67,1 года) был на 4,2 года больше, чем при выявлении синхронного КРР, а женщины при выявлении опухолей на 7 лет моложе мужчин. Синхронные колоректальные опухоли у женщин чаще сочетались с раком молочной железы, у мужчин - с раком почки. Выявление колоректальной опухоли после лечения опухоли другой локализации наблюдается примерно в том же возрасте, что и синхронное (65,1 года), но несколько чаще, чем их одновременное выявление (62,86%). МКО у мужчин выявлялась в среднем через 4,4 г, чаще после лечения рака желудка (55%). У женщин колоректальная опухоль выявлялась в среднем через 5,7 года, преимущественно после лечения опухолей половых органов (79,17%).
Все первично-множественные колоректальные опухоли представлены в основном умереннодифференцированными аденокарциномами (как наиболее распространенного гистологического типа колоректальной опухоли), местно-распространенными, без отдаленных метастазов (возможно, в связи с тем что больные отобраны для хирургического лечения). Преобладание при первично-множественном КРР, сочетающемся с опухолями других органов, регионарных метастазов, возможно, свидетельствует о его более агрессивном течении по сравнению с другими видами первично-множественных колоректальных опухолей.
Выявленные особенности первично-множественных колоректальных опухолей можно учитывать в программах как первичной диагностики, так и диспансерного наблюдения после лечения больных со злокачественными опухолями, что позволит улучшить раннее выявление и результаты лечения больных с первично-множественными опухолями.
Мультицентрический механизм множественного рака толстой кишки. Предраковые изменения в толстой кишке
Гематологический научный центр Минздравсоцразвития РФ, Москва
Научно-клиническое отделение гематологической хирургии Гематологического научного центра Минздрава РФ, Москва
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
Хирургическое лечение злокачественной опухоли толстой кишки с поздним рецидивом
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2013;(10): 56‑59
Карагюлян С.Р., Данишян К.И., Гржимоловский А.В., Ковригина А.М., Гласко Е.Н., Прасолов Н.В., Силаев М.А. Хирургическое лечение злокачественной опухоли толстой кишки с поздним рецидивом. Хирургия. Журнал им. Н.И. Пирогова. 2013;(10):56‑59.
Karagiulian SR, Danishian KI, Grzhimolovskiĭ AV, Kovrigina AM, Glasko EN, Prasolov NV, Silaev MA. The surgical treatment of the late recurrence of the colon cancer. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2013;(10):56‑59. (In Russ.).
Наиболее распространенной формой рака ободочной кишки является аденокарцинома (75-80% наблюдений) [2, 4]. Значительно реже (10-12%) встречается муцинозная аденокарцинома, характеризующаяся гиперпродукцией слизи опухолевыми клетками [5]. Муцинозная аденокарцинома является одним из гистологических вариантов аденокарциномы желудочно-кишечного тракта. Прогноз при муцинозных аденокарциномах менее благоприятен, чем при обычных аденокарциномах, секретирующих небольшое количество слизи. Такие опухоли диагностируют в основном после возникновения осложнений: кишечных кровотечений, частичной или полной кишечной непроходимости. Установить диагноз обычно удается лишь при экстренной операции. Часто опухоли выявляют пальпаторно лишь тогда, когда они достигают большого размера и становятся неоперабельными.
В прогностическом отношении слизистый рак тонкой кишки намного хуже злокачественных опухолей толстой кишки. Причиной этого отчасти является позднее обращение больных за помощью, в результате чего операции производят на грани операбельности. Обширная резекция пораженного отдела толстой кишки является частью условно-радикального метода лечения этих пациентов. Редкий характер слизистой аденокарциномы толстой кишки служит причиной недостаточного исследования преимуществ адъювантной химиотерапии [1,6]. Нейроэндокринные раки толстой кишки чаще диагностируют в слепой и восходящей ободочной кишке, крупноклеточную морфологию новообразований - в толстой и прямой кишке, мелкоклеточные раки - в анальном канале [8].
Приводим клиническое наблюдение больной, дважды оперированной на протяжении 9 лет по поводу обширного (T4M0Nx) поражения злокачественной комбинированной опухолью - муцинозной аденокарциномой и нейроэндокринным раком толстой кишки.
Больная Л., 53 лет, в течение 3 лет лечилась по поводу железодефицитной анемии и поступила в ГНЦ в 2001 г. с жалобами на периодическую гипертермию, снижение массы тела, опухолевидное образование в левой подреберной области.
Считает себя больной с лета 1998 г., когда появились одышка, потливость, по ночам чувство удушья. Впервые глубокая железодефицитная анемия выявлена в 1998 г., ускорение РОЭ до 60 мм/ч. При проведенном тогда обследовании толстой кишки, желудка патологических изменений не обнаружено. Уровень гемоглобина вырос с 56 до 98 г/л. В сентябре 1999 г. при колоноскопии в городской клинической больнице выявлено и удалено три полипа. Терапия препаратами железа дала положительный эффект.
С апреля 2000 г. вновь появились признаки анемии и обнаружено опухолевидное образование в левом подреберье. Однако в отделение хирургической гематологии ГНЦ больная поступила лишь 28.05.01 с направительным диагнозом: хроническая постгеморрагическая железодефицитная анемия, недифференцированная опухоль брюшной полости. Предъявляет жалобы на тошноту, боли в животе, чувство дискомфорта. Состояние относительно удовлетворительное. Семейный анамнез отягощен: мать умерла от рака кишечника, отец - от рака легкого. После длительной подготовки 21.06 выполнена операция: при лапаротомии и ревизии выявлена плотная бугристая опухоль, представлявшая конгломерат с вовлечением петель тощей кишки, поперечной ободочной кишки, корня брыжейки тонкой кишки, мезоколон
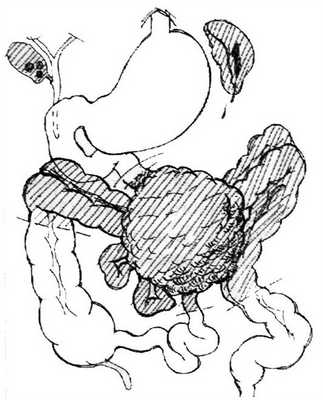
(рис. 1, а). Рисунок 1. Схема операции. а - штриховкой обозначены границы резекции органов.
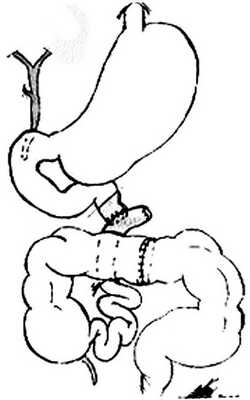
Опухоль удалена единым блоком вместе с петлями тонкой и тощей кишки, большим сальником, частью поперечной ободочной и селезеночным углом толстой кишки, селезенкой. Кроме того, в связи с наличием конкрементов в желчном пузыре выполнена холецистэктомия. Наложены анастомозы: тонко-тонкокишечный конец в бок на уровне связки Трейтца и асцендо-десцендо конец в конец (см. рис. 1, б). Рисунок 1. Схема операции. б - реконструкция кишечника.
При срочном гистологическом исследовании биоптата характер опухоли был неясен.
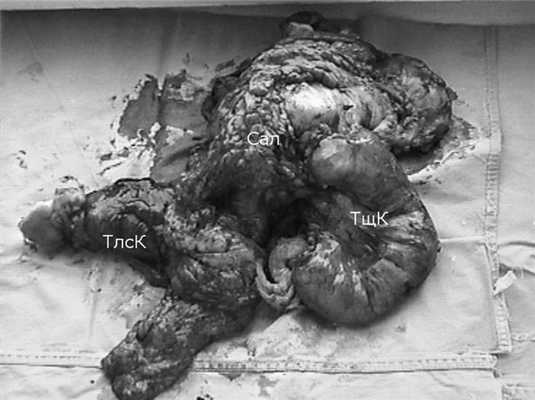
Макроскопически: опухоль располагалась в центре резецированного участка толстой кишки, граница между стенкой кишки и опухолью четкая как с проксимального, так и с дистального конца (рис. 2). Рисунок 2. Препарат: удаленная опухоль с резецированными петлями тощей кишки (ТщК), толстой кишки (ТлсК) и большим сальником (Сал). На участке около 12 см стенка кишки резко утолщена (до 2 см), хрящевой плотности, на разрезе белого цвета, полупрозрачная. Дно опухоли неровное, выстлано свертками крови. Со стенкой кишки в области опухолевого перерождения были спаяны большой сальник и петля подвздошной кишки, на ограниченном участке - селезенка.
Микроскопически: опухоль имела комбинированное строение, низкодифференцированный нейроэндокринный рак G3 с инфильтрацией подслизистого слоя (рис. 3, а), Рисунок 3. Микрофотографии опухоли. а - нейроэндокринный рак. Окраска гематоксилином и эозином. Ув. 100. опухолевыми эмболами в лимфатических сосудах подслизистого слоя, частично - муцинозной аденокарциномой с инфильтрацией мышечной оболочки (см. рис. 3, б). Рисунок 3. Микрофотографии опухоли. б - муцинозная аденокарцинома. Окраска гематоксилином и эозином. Ув. 200. Нейроэндокринный рак представлен крупными клетками с частыми митозами (2-3 в одном поле зрения, ув. 400), участками трабекулярного, органоидного строения, наличием псевдорозеток.
В удовлетворительном состоянии больная была выписана под амбулаторное наблюдение онколога. По месту жительства проведено три курса полихимиотерапии: лейковорин + 5-фторурацил, 6 пятидневных курсов с перерывом на 20 дней.
Спустя 2,5 года состояние удовлетворительное. Рецидива опухоли нет. Восстановлена нормальная масса тела (60 кг). 26.01.04 больная перенесла пластическую операцию по поводу послеоперационной грыжи.
В марте 2010 г. у больной появились жалобы на боли в эпигастральной области, признаки частичной кишечной непроходимости. Вновь госпитализирована в ГНЦ 01.04.10. При КТ в области ранее наложенного асцендо-десцендоанастомоза визуализируется опухоль размером 79×55×65 мм, суживающая просвет кишки, не дифференцирующаяся от левой поясничной мышцы и нижнего полюса левой почки (рис. 4). Рисунок 4. Компьютерные томограммы. а - фронтальный срез. Рисунок 4. Компьютерные томограммы. б - аксиальный срез.
13.03 произведена лапаротомия. В левой половине брюшной полости выявлен опухолевый конгломерат с вовлечением левой почки и селезеночного угла толстой кишки. При дальнейшей ревизии и в процессе выделения из сращений толстой кишки пальпаторно в ней обнаружено два опухолевых узла: в 5 см от баугиниевой заслонки в слепой кишке и в 3 см правее от ранее наложенного толсто-толстокишечного анастомоза. Произведено выделение опухолевого конгломерата единым блоком. Отсечена нисходящая толстая кишка в месте ее перехода в сигмовидную, на 12 см ниже опухоли. Пересечена подвздошная кишка в 15 см от илеоцекального угла. Опухоль вместе с левой почкой удалена единым блоком.
Прорастания опухоли в подвздошно-поясничную мышцу нет. Наложен анастомоз бок в бок между подвздошной и сигмовидной кишкой.
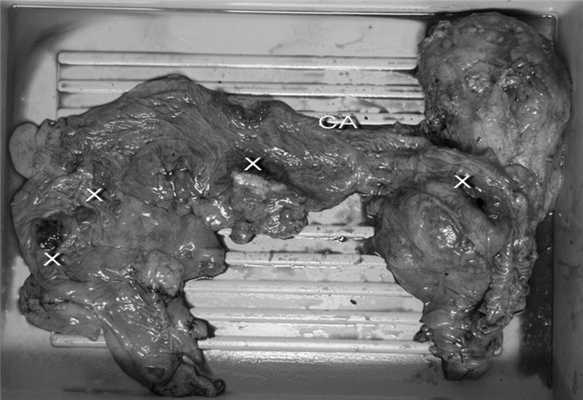
Макроскопически: в слепой кишке в 5 см от баугиниевой заслонки блюдцеобразная опухоль диаметром 3 см с язвой, в 6 см проксимальнее анастомоза опухоль диаметром 4 см, в 9 см от края резекции опухоль размером 8×7,5×7 см, прорастающая все слои стенки кишки, околопочечную клетчатку, капсулу почки. На разрезе большая часть опухоли представлена сообщающимися между собой полостями, максимально до 5 см в диаметре (рис. 5). Рисунок 5. Препарат удаленной ободочной кишки (вскрыта продольно) единым блоком с левой почкой. Х - места рецидива опухоли, СА - старый анастомоз. Внутренняя поверхность полостей выстлана мягкими розоватыми слизистоподобными структурами. Микроскопически: во всех очагах опухоли картина слизистого рака с поражением всех слоев стенки кишки.
Течение послеоперационного периода осложнилось послеоперационным панкреатитом, перфорацией тонкой кишки с ограниченным перитонитом. 18.04 произведена релапаротомия, резекция петли тонкой кишки с формированием тонко-тонкокишечного анастомоза, санация брюшной полости. На фоне проводимой терапии перитонит регрессировал, уровень амилазы нормализовался. Однако в результате отека поджелудочной железы и спаечного процесса в брюшной полости длительно отмечался парез верхних отделов пищеварительного тракта (гастростаз). Ежедневно из желудка эвакуировали до 1500 мл застойного отделяемого. 31.05 наложена эндоскопическая гастростома, проведен энтеральный зонд. На фоне антибактериальной терапии и энтерального зондового питания состояние больной улучшилось. Частично восстановлен пассаж пищи естественным путем. 21.06 больная выписана под амбулаторное наблюдение. На фоне зондового питания состояние больной улучшилось, через 3 мес при контрольном обследовании отмечено восстановление пассажа пищи. Гастростомическая трубка удалена. Через 24 мес после операции состояние больной удовлетворительное, жалоб не предъявляет, питание не нарушено.
В данном наблюдении имело место сочетание двух форм злокачественных опухолей, имеющих эпителиальный и нейроэндокринный генез и получивших в новой классификации ВОЗ (2010) название комбинированного аденонейроэндокринного рака (MANEC) [9]. Он характеризуется сочетанием аденогенного и нейроэндокринного компонентов при условии выраженности каждого компонента не менее 30%. MANEC толстой кишки, в частности комбинированная муцинозная аденокарцинома и нейроэндокринный рак, - крайне редкая злокачественная опухоль, в связи с чем течение заболевания и прогноз мало изучены.
Вопреки распространенному мнению о том, что муцинозная аденокарцинома толстой кишки имеет склонность к более быстрому росту и более раннему метастазированию, в нашем наблюдении заболевание протекало относительно доброкачественно. Это, с одной стороны, препятствовало ранней диагностике, с другой - не помешало полному удалению опухоли. Своевременное радикальное хирургическое лечение и химиотерапия, проведенная впоследствии, позволяли надеяться на благоприятный прогноз [3].
По данным литературы, прогноз заболевания тесно связан с распространенностью процесса. При наличии только первичной опухоли (нейроэндокринная опухоль - NET) 5-летняя выживаемость составляет в среднем 94% (от 75% при нейроэндокринных опухолях тонкой кишки до 99% при поражении аппендикса). При вовлечении в процесс регионарных лимфоузлов 5-летняя выживаемость равна 64%, при нейроэндокринной опухоли желудка этот показатель значительно хуже - 23%. При наличии отдаленных метастазов выживаемость в среднем не превышает 18% [7]. При слизистом раке 5-летняя выживаемость после радикального хирургического лечения составляет 61,4%, при комбинированном лечении этот показатель достигает 78,4%. Основные причины неудач как хирургического, так и комбинированного методов лечения - локорегиональные рецидивы и метастазы в отдаленные органы, наиболее часто наблюдающиеся в первые 2 года после радикальной операции. После расширенных хирургических вмешательств 3- и 5-летняя выживаемость достигает 72,4±6,4 и 65,6±8,2% соответственно [4], что является несомненным доказательством целесообразности выполнения данных вмешательств.
Аденокарцинома кишки - симптомы и лечение
Что такое аденокарцинома кишки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Мешечкиной Виктории Геннадьевны, онколога со стажем в 9 лет.
Над статьей доктора Мешечкиной Виктории Геннадьевны работали литературный редактор Вера Васина , научный редактор Вячеслав Михайличенко и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Аденокарцинома толстой кишки — это самая распространённая форма рака прямой кишки, опухоль развивается в толстой кишке и может метастазировать, как и большинство злокачественных новообразований.
Распространённость аденокарциномы толстой кишки
Аденокарцинома толстой кишки составляет около 95 % от всех случаев колоректального рака, который считается третьим по распространённости среди различных видов рака [19] . Риск развития рака толстой кишки в популяции достигает 5-6 % [1] . Каждый год в мире диагностируется около миллиона новых случаев.
Пятилетняя выживаемость для этого типа опухоли составляет около 60 % и зависит в первую очередь от степени распространения опухоли и уровня злокачественности [1] .
Факторы риска
Основной фактор риска аденокарциномы толстой кишки — возраст старше 65 лет. Риск развития аденокарциномы толстой кишки также возрастает при наличии некоторых наследственных синдромов:
- MutYH-ассоциированный полипоз (вызванный мутациями в гене MutYH);
- семейный аденоматоз толстой кишки;
- синдром Линча.
Благоприятным фоном для злокачественного перерождения клеток являются единичные или множественные полипы толстой кишки. Высокий риск перерождения в раковую опухоль имеют аденоматозные полипы. Отказ от их удаления может привести к развитию аденокарциномы.
Хронические воспалительные заболевания толстой кишки, такие как неспецифический язвенный колит и болезнь Крона, также повышают риск развития аденокарциномы.
К дополнительным факторам риска относят:
- высокое содержание в рационе красного мяса; ;
- сахарный диабет 1-го и 2-го типа; ;
- гиподинамию.
Радиационный фон и работа с химическими реагентами к развитию этого вида рака не приводят [1] [2] [3] [4] [6] [9] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы аденокарциномы кишки
Клинические проявления аденокарциномы толстой кишки зависят от расположения опухоли, её типа, темпа роста и наличия сопутствующей патологии. Ранние формы рака являются случайной находкой, так как могут никак себя не проявлять. Их выявляют при эндоскопическом исследовании кишечника по поводу других заболеваний (например, колита, дивертикулита, холецистита, гастрита и др.) или при полостных или гинекологических операциях — аппендэктомии, миомэктомии и кесаревом сечении.
Наиболее частые симптомы аденокарциномы толстой кишки:
- кровь в стуле;
- запоры или поносы;
- постоянные умеренные боли в животе;
- слабость;

Опухоли левого фланка (сигмовидной и прямой кишки, селезёночного угла, нисходящего отдела) чаще манифестируют с запоров, примеси прозрачной или розоватой слизи и тёмной крови в кале, болезненных позывов, отдающих в промежность.
Опухоли правого фланка (слепой кишки, восходящего отдела и печёночного угла) выявляют позднее, так как первые симптомы проявляются не сразу, а при обширном распространении опухоли, и носят общий характер: слабость, снижение аппетита, похудение, анемия, субфебрильная температура (37,1—38,0 °C). В некоторых случаях пациент самостоятельно обнаруживает плотное образование в животе, справа от пупка [12] .
Поиск причины анемии невыясненной этиологии часто приводит к обнаружению рака правой половины толстой кишки.
Патогенез аденокарциномы кишки
Аденокарцинома — это злокачественная опухоль, возникающая из железистых клеток и способная образовывать метастазы (вторичные очаги опухолевого роста). Чаще всего заболевание развивается на фоне длительно существующих полипов, или разрастаний слизистой.
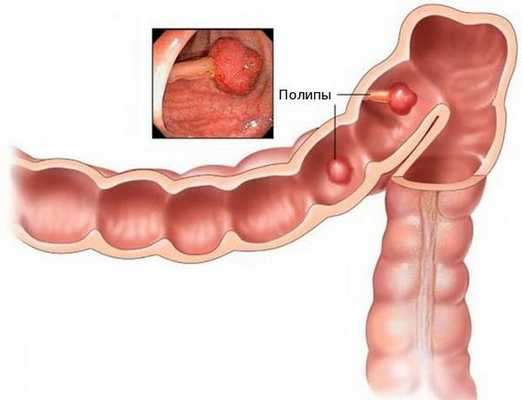
При хроническом повреждении полипов плотными каловыми массами и воспалении развивается дисплазия эпителия (нарушение деления и дифференцировки клеток), переходящая в рак. У кого-то этот процесс может занять десятки лет, у других развивается за два-три года.
Среди пациентов с раком проксимальных отделов толстой кишки преобладают женщины — вероятно, это связано с наличием гормональных рецепторов эстрогенов в этих отделах. Дистальный рак толстой кишки более характерен для мужчин.
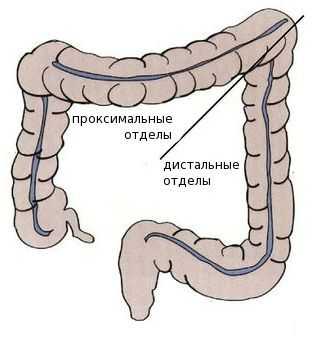
В отличии от опухолей правого фланка, для которых нехарактерны генетические мутации, левосторонним локализациям присущи комплексные хромосомные аномалии, например множественные мутации в генах системы исправления повреждений ДНК. Эти особенности важны при подборе лечения и режима химио-, таргетной (целенаправленно воздействующей на специфические мишени в опухолевых клетках) или иммунотерапии [1] [5] [6] [7] [8] .
Классификация и стадии развития аденокарциномы кишки
Виды аденокарциномы толстой кишки в зависимости от локализации:
- рак слепой кишки;
- рак восходящей ободочной кишки;
- рак поперечной ободочной кишки;
- рак печеночного изгиба ободочной кишки;
- рак селезеночного изгиба ободочной кишки;
- рак нисходящей ободочной кишки;
- рак червеобразного отростка;
- рак сигмовидной кишки;
- рак ректосигмоидного отдела толстой кишки;
- рак прямой кишки.
Согласно последней классификации ВОЗ, гистологически выделяют две степени злокачественности аденокарциномы толстой кишки, опираясь на долю железистых структур в составе опухоли: высокую и низкую.
Стадирование новообразований толстой кишки по системе TNM-8 (2017 г.) представлено схемой:
Исходя из этих данных, опухоли присваивают определенную стадию, и далее она уже не меняется. Дальнейшее распространение процесса обозначается как прогрессирование.
- I и II стадия — опухоль ограничена толстой кишкой;
- III стадия - наличие метастазов в лимфоузлах;
- IV стадия - наличие отдалённых метастазов [13][14] .
Осложнения аденокарциномы кишки
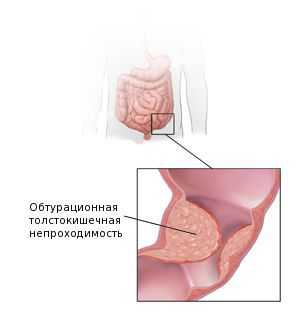
Наиболее частым осложнением аденокарциномы толстой кишки является обтурационная толстокишечная непроходимость. Она развивается у 26-69 % пациентов. Это осложнение наиболее характерно для опухолей левых отделов толстой кишки [15] . Поэтому перед началом лечения для минимизации рисков кишечной непроходимости пациентам рекомендуется формирование колостомы — специального отверстия, выводящего край кишки на переднюю брюшную стенку до опухолевого сужения. Решение о формировании колостомы принимается по данным колоноскопии.
Также среди частых причин осложнений выделяют перфорацию и кровотечение из повреждённой опухоли. Это может явиться первым симптомом заболевания. Часто таких пациентов экстренно оперируют в условиях многопрофильного стационара, а не специализированного учреждения, и только при обследовании органов брюшной полости становится понятна причина перфорации.
При нарушении питания опухолевого узла и развитии его ишемии возможно воспаление в зоне роста опухоли, что тоже требует неотложной хирургической помощи [15] [16] [17] . Воспаление сопровождается общей слабостью и повышенной температурой тела.
Диагностика аденокарциномы кишки
Сбор анамнеза
Помимо описанных выше жалоб, с которыми первично обращаются пациенты, важны данные анамнеза. На первичном осмотре терапевту или онкологу следует отметить наличие наследственных синдромов, ассоциированных с раком толстой кишки, и хронических неспецифических воспалительных процессов толстой кишки, например неспецифического язвенного колита или болезни Крона.
Физикальное обследование
При физикальном обследовании, помимо общего осмотра и пальпации брюшной полости, обязательно проведение ректального пальцевого исследования, выявляющего изменения в области прямой кишки. Это один из самых простых диагностических приёмов, не требующий дополнительной подготовки и оборудования.
Лабораторная диагностика
Лабораторная диагностика включает:
- развёрнутый клинический и биохимический анализы венозной крови;
- коагулограмму (исследование белков системы свёртывания крови);
- анализ мочи.
Это анализы необходимы для исключения возможной сопутствующей патологии.
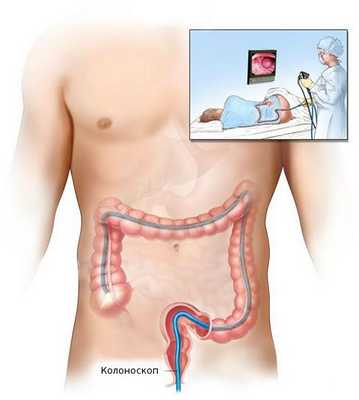
Биопсия
После общеклинического обследования проводят уточняющее исследование (биопсию) для определения гистологической структуры опухоли. Чаще всего биопсия выполняется во время колоноскопии — процедуры, при которой врач с помощи эндоскопа осматривает внутреннюю поверхность толстой кишки.
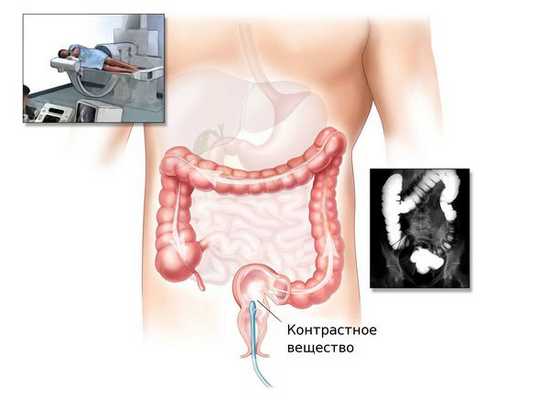
Ирригоскопия и КТ-колонография
При невозможности проведения колоноскопии врач может назначить ирригоскопию или КТ-колонографию.
Ирригоскопия — это рентгенологический метод обследования толстого кишечника с помощью контрастного вещества, вводимого через прямую кишку.
КТ-колонография — разновидность компьютерной томографии, проводимая при помощи компьютерного томографа.
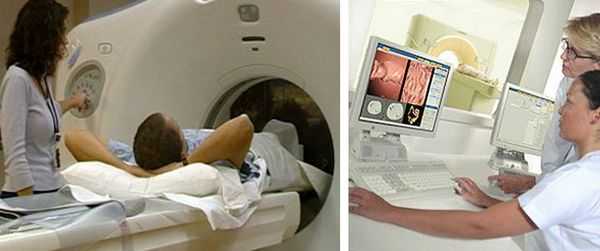
Компьютерная томография (КТ)
КТ органов грудной клетки и брюшной полости с контрастом — стандарт обследования при раке ободочной кишки. Компьютерную томографию проводят для исключения метастазов в лёгких, лимфоузлах средостения, брюшной полости, канцероматоза (переноса раковых клеток из первичного очага), асцита (скопления жидкости в брюшной полости) и вторичного поражения печени.
Магнитно-резонансная томография (МРТ)
МРТ органов брюшной полости с внутривенным контрастированием применяют для планирования операции на печени при её вторичном поражении.
Для точной оценки размеров опухоли перед операцией и правильного стадирования по TNM проводится МРТ малого таза c применением контраста.
Дополнительно, при наличии болевого синдрома или изменений по КТ, проводится остеосцинтиграфия (ОСГ) — исследование состояния костей скелета.
При подозрении на вторичное поражение головного мозга (исходя из жалоб, осмотра и анамнеза) назначается МРТ головного мозга с внутривенным контрастированием.
Позитронно-эмиссионная томография, совмещённая с компьютерной томографией (ПЭТ/КТ)
ПЭТ-КТ не применяется как рутинный метод при первичной диагностике. Обследование проводят при подозрении на вторичные изменения по данным КТ или МРТ для получения дополнительных данных.
Обязательным этапом планирования лечения является пересмотр биопсийного или операционного материала на наличие MSI (микросателитной нестабильности, нарушении системы восстановления ДНК) и мутации генов семейства BRAF и RAS [18] .
Лечение аденокарциномы кишки
Выбор метода лечения аденокарциномы толстой кишки обусловлен стадией онкологического процесса и наличием или отсутствием соматической патологии.
0-I стадия
На ранних стадиях рака ободочной кишки проводятся органосохраняющие операции, например эндоскопическую резекцию слизистой с удалением в подслизистом слое. При поражении краёв резекции, сосудистой, лимфатической или периневральной инвазии (проникновении раковых клеток в периневрий — слои соединительной ткани, образующие оболочку вокруг пучков нервных волокон), как факторах неблагоприятного прогноза, рекомендуется проведение расширенной операции — повторной резекции краёв.
II-III стадия
При резектабельном (c возможностью удаления) локализованном и местнораспространённом раке ободочной кишки II-III стадий на первом этапе предпочтительно оперативное лечение. Объём хирургического вмешательства определяется индивидуально.
Химиотерапия проводится при поражении лимфатических узлов, прорастании опухолью серозной оболочки и соседних органов, наличии факторов риска.
При нерезектабельном раке ободочной кишки на первом этапе рекомендуется сформировать обходные анастомозы , колостому (выведение участка толстой кишки) или илеостому (выведение участка тонкой кишки). Эти методы снижают вероятность развития кишечной непроходимости на фоне предоперационной химиолучевой и химиотерапии.
При распространённом раке ободочной кишки с резектабельными или потенциально резектабельными синхронными метастазами в печени или лёгких выполняют R0-резекцию (в пределах здоровых тканей).
Радиочастотная абляция и стереотаксическая лучевая терапия применяются как дополнительные методы к резекции печени и как самостоятельные методы лечения. Действие радиочастотной абляции основано на нагревании с помощью радиоволн поражённых тканей до высоких температур (90-100 °С).
Стереотаксическая лучевая терапия — это один из видов радиохирургии, который состоит в применении высокоточного излучения, воздействующего на опухоли.
При резектабельных очагах рекомендуется их одномоментное хирургическое удаление.
На послеоперационном этапе при резектабельных метастатических очагах показано проведение адъювантной (следующей за операцией) химиотерапии. Также возможно проведение дооперационной химиотерапии до шести циклов, удаление метастазов и первичной опухоли с дальнейшим продолжением химиотерапии до достижения шестимесячной суммарной продолжительности лечения.
IV стадия
Основная цель лечения на IV стадии заболевания — перевод при помощи химиотерапии нерезектабельных метастазов в резектабельные. Хороший эффект даёт добавление к основному лечению таргетной терапии ( целенаправленно воздействующей на специфические мишени в опухолевых клетках) и иммунотерапии.
При проведении нерадикальной резекции возможно продолжение терапии предоперационной комбинацией химиопрепаратов и моноклональных антител (препаратов, избирательно воздействующих на определённую молекулу, от которой зависит развитие болезни ) до достижения суммарной шестимесячной продолжительности лечения.
При генерализованном раке ободочной кишки с нерезектабельными метастазами применяют комбинацию химиопрепаратов. Возможно добавление таргетных препаратов. Цель лечения — максимально долго контролировать развитие заболевания при сохранении качества жизни.
При проведении химиотерапии каждые 1,5-2 месяца оценивают резектабельность опухоли (по данным КТ, МРТ). При преобладании метастатического поражения печени проводят:
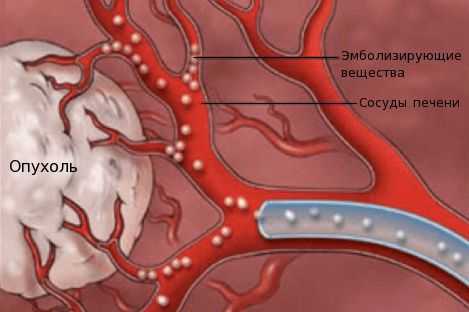
- химиоэмболизацию — введение в просвет сосудов, питающих опухоль, эмболов (специальных мелких частиц) для прекращения кровоснабжения новообразования;
- химиоинфузию в сосуды печени — установка катетера в сосуде, питающем опухоль, с последующим введением химиопрепаратов.
При наличии тяжёлой сопутствующей патологии, препятствующей проведению радикального лечения, рекомендуется проведение симптоматической терапии, паллиативной химиотерапии или химиолучевой терапии [1] [10] [18] .
Прогноз. Профилактика
Пятилетняя выживаемость при раке толстой кишки составляет 63 % [20] . Высокие показатели смертности связаны с поздней диагностикой заболевания. При развитии болезни метастазы чаще всего выявляются в печени, что обусловлено особенностями венозного оттока от кишечника через систему воротной вены печени.
Другой частой локализацией аденокарциномы толстой кишки является брюшина. Опухоль брюшины выявляется примерно у 10 % первичных пациентов. Вторичные метастазы брюшины выявляются примерно в 60 % случаев [10] .
Пятилетняя выживаемость у пациентов с метастазами рака толстой кишки в печень на симптоматической терапии не превышает 2 %. Медиана выживаемости (промежуток времени с момента постановки диагноза, в течение которого половина пациентов остаются живы) составляет 6—10 месяцев [10] .
Рак толстой кишки ( Колоректальный рак )
Рак толстой кишки - это злокачественная опухоль различных отделов толстого кишечника (слепой, ободочной, сигмовидной, прямой кишки), происходящая из эпителия кишечной стенки. Симптоматика при раке толстой кишки включает абдоминальные боли, метеоризм, кишечные расстройства, нарушение кишечной проходимости, патологические примеси в каловых массах, слабость, исхудание. Рак толстой кишки может определяться при пальпации живота; для подтверждающей диагностики проводится колоноскопия с биопсией, ультрасонография, ирригоскопия, КТ, ЯМР, ПЭТ. Радикальными методами лечения являются одномоментные или поэтапные резекционные вмешательства.
МКБ-10


Общие сведения
Рак толстой кишки (колоректальный рак) - злокачественное новообразование, развивающееся из эпителиальной выстилки стенки толстого кишечника. Статистика по заболеваемости неутешительна: ежегодно в мире выявляется свыше 500 тыс. новых случаев колоректального рака, причем большая часть из них приходится на индустриально развитые страны - США, Канаду, страны Западной Европы, Россию. В структуре женской онкопатологии рак толстой кишки занимает 2-ое место после рака молочной железы, а у мужчин по частоте уступает лишь раку предстательной железы и раку легкого. Большинство случаев заболевания колоректальным раком приходится на лиц старше 50 лет; мужчины болеют в 1,5 раза чаще женщин. Тревожным фактором является поздняя выявляемость: у 60-70% больных рак толстой кишки обнаруживается на III-IV стадии.

Причины
Многолетнее изучение и анализ проблемы позволили назвать наиболее значимые этиологические факторы, способствующие повышению риска развития рака толстой кишки, - это семейно-наследственные и алиментарные факторы, а также предраковые заболевания. В числе генетически детерминированных причин наибольшее значение имеет семейный полипоз, который практически в 100% случаев приводит к развитию рака толстой кишки. Кроме этого, повышенный риск развития колоректального рака имеют пациенты с синдромом Линча - в этом случае опухолевое поражение обычно развивается у лиц моложе 45 лет и локализуется в правых отделах ободочной кишки.
Исследуя зависимость частоты рака толстой кишки от характера питания и образа жизни, можно констатировать, что возникновению онкопатологии способствует преобладание в пищевом в рационе животных белков, жиров и рафинированных углеводов при дефиците растительной клетчатки; ожирение и метаболические нарушения, гипокинезия. Мутагенным и канцерогенным действием на клетки кишечного эпителия обладают различные химические соединения (ароматические углеводороды и амины, нитросоединения, производные триптофана и тирозина, стероидные гормоны и их метаболиты и др.).
Вероятность колоректального рака прогрессивно возрастает в условиях хронических запоров, длительного стажа курения, хронических заболеваний кишечника. В частности, к предраковым заболеваниям в колопроктологии отнесены: хронические колиты (НЯК, болезнь Крона), дивертикулярная болезнь толстого кишечника, одиночные полипы толстой кишки (аденоматозные и ворсинчатые полипы диаметром более 2 см озлокачествляются в 45-50% случаев).
Классификация
Рак толстой кишки может возникать в различных анатомических отделах толстого кишечника, однако частота их поражения неодинакова. По наблюдениям специалистов в сфере абдоминальной онкохирургии, преобладающей локализацией является нисходящая ободочная и сигмовидная кишка (36%); далее следует слепая и восходящая ободочная кишка (27%), прямая кишка и анальный канал (19 %), поперечная ободочная кишка (10%) и др.
По характеру роста опухоли толстой кишки подразделяются на экзофитные (растущие в просвет кишки), эндофитные (распространяющиеся в толщу кишечной стенки) и смешанные (опухоли-язвы, сочетающие экзо- и эндофитную форму роста). С учетом гистологического строения рак ободочной кишки может быть представлен аденокарциномой различного уровня дифференцировки (более 80%), слизистой аденокарциномой (мукоидный рак), мукоцеллюлярным (перстневидноклеточным) раком, недифференцированным и неклассифицируемым раком; рак прямой кишки и анального канала дополнительно - плоскоклеточным, базальноклеточным и железисто-плоскоклеточным раком.
В соответствии с международной системой TNM, на основании критериев глубины инвазии первичной опухоли, регионарного и отдаленного метастазирования, выделяют стадии:
- Тх - данных для оценки первичной опухоли недостаточно
- Тis - определяется опухоль с интраэпителиальным ростом или инвазией слизистой оболочки
- Т1 - инфильтрация опухолью слизистого и подслизистого слоя толстой кишки
- Т2 - инфильтрация опухолью мышечного слоя толстой кишки; подвижность кишечной стенки не ограничена
- Т3 - прорастание опухолью всех слоев кишечной стенки
- Т4 - прорастание опухолью серозной оболочки или распространение на соседние анатомические образования.
С учетом наличия или отсутствия метастазов в регионарных лимфоузлах различают следующие степени рака толстой кишки: N0 (лимфатические узлы не поражены), N1 (метастазами поражено от 1 до 3 лимфатических узлов), N2 (метастазами поражены 4 и более лимфатических узла). Отсутствие отдаленных метастазов обозначается символом М0; их наличие - M1. Метастазирование рака толстой кишки может осуществляться лимфогенным путем (в регионарные лимфатические узлы), гематогенным путем (в печень, кости, легкие и др.) и имплантационным/контактным путем с развитием карциноматоза брюшины и ракового асцита.
Симптомы рака
Клинические признаки рака толстой кишки представлены 5 ведущими синдромами: болевым, кишечными расстройствами, нарушением кишечной проходимости, патологическими выделениями, ухудшением общего состояния больных. Абдоминальные боли являются наиболее ранним и постоянным признаком рака толстой кишки. В зависимости от локализации опухоли и стадии злокачественного процесса они могут быть различными по характеру и интенсивности. Пациенты могут характеризовать боли в животе, как давящие, ноющие, схваткообразные. При выраженной болезненности в правом подреберье необходимо исключить у больного холецистит и язвенную болезнь 12-перстной кишки; в случае локализации боли в правой подвздошной области дифференциальный диагноз проводится с острым аппендицитом.
Уже в начальных стадиях рака толстой кишки отмечаются симптомы кишечного дискомфорта, включающие отрыжку, тошноту, рвоту, потерю аппетита, ощущение тяжести и переполнения желудка. Одновременно развиваются кишечные расстройства, свидетельствующие о нарушении моторики кишечника и пассажа кишечного содержимого: диарея, запоры (или их чередование), урчание в животе, метеоризм. При экзофитно растущем раке толстой кишки (чаще всего левосторонней локализации) в конечном итоге может развиться частичная или полная обтурационная кишечная непроходимость.
О развитии рака дистальных отделов сигмовидной и прямой кишки может свидетельствовать появление в испражнениях патологических примесей (крови, слизи, гноя). Обильные кишечные кровотечения возникают редко, однако длительная кровопотеря приводит к развитию хронической постгеморрагической анемии. Нарушение общего самочувствия при раке толстой кишки связано с интоксикацией, вызванной распадом раковой опухоли и застоем кишечного содержимого. Больные обычно жалуются на недомогание, утомляемость, субфебрилитет, слабость, исхудание. Иногда первым симптомом рака толстой кишки становится наличие пальпаторно определяемого образования в животе.
В зависимости от клинического течения выделяют следующие формы рака толстой кишки:
- токсико-анемическую - в клинике преобладают общие симптомы (лихорадка, прогрессирующая гипохромная анемия).
- энтероколитическую - основные проявления связаны с кишечными расстройствами, что требует дифференциации рака толстой кишки с энтеритом, колитом, энтероколитом, дизентерией.
- диспепсическую - симптомокомплекс представлен желудочно-кишечным дискомфортом, напоминающим клинику гастрита, язвенной болезни желудка, холецистита.
- обтурационную - сопровождается прогрессирующей кишечной непроходимостью.
- псевдовоспалительную - характеризуется признаками воспалительного процесса в брюшной полости, протекающего с повышением температуры, абдоминальными болями, лейкоцитозом и пр. Данная форма рака толстой кишки может маскироваться под аднексит, аппендикулярный инфильтрат, пиелонефрит.
- атипичную (опухолевую) - опухоль в брюшной полости выявляется пальпаторно на фоне видимого клинического благополучия.
Диагностика
Целенаправленный диагностический поиск при подозрении на рак толстой кишки включает клиническое, рентгенологическое, эндоскопическое и лабораторное обследование. Ценные сведения могут быть получены при объективном осмотре, пальпации живота, перкуссии брюшной полости, пальцевом исследовании прямой кишки, гинекологическом исследовании.
Рентгенологическая диагностика предполагает обзорную рентгенографию брюшной полости, ирригоскопию с применением контрастного вещества. С целью визуализации опухоли, взятия биопсии и мазков для цитологического и гистологического исследования проводится ректосигмоскопия и колоноскопия. К числу информативных методов топической диагностики принадлежат ультрасонография толстого кишечника, позитронно-эмиссионная томография.
Лабораторная диагностика рака толстой кишки предусматривает исследование общего анализа крови, кала на скрытую кровь, определение раково-эмбрионального антигена (РЭА). С целью оценки распространенности злокачественного процесса выполняется УЗИ печени, МСКТ брюшной полости, УЗИ малого таза, рентгенография грудной клетки, по показаниям - диагностическая лапароскопия или эксплоративная лапаротомия.

Рак толстой кишки требует дифференциации со многими заболеваниями самого кишечника и смежных с ним органов, в первую очередь, - хроническим колитом, неспецифическим язвенным колитом, болезнью Крона, актиномикозом и туберкулезом толстой кишки, доброкачественными опухолями толстой кишки, полипозом, дивертикулитом, кистами и опухолями яичников.
Лечение рака толстой кишки
Радикальный способ лечения патологии предполагает проведение резекционных вмешательств на ободочной, сигмовидной или прямой кишке. Характер операции и объем резекции зависит от локализации и распространенности опухолевой инвазии. При раке толстой кишки возможно проведение как одномоментных, так и поэтапных оперативных вмешательств, включающих резекцию кишки и наложение колостомы с последующей реконструктивной операцией и закрытием кишечной стомы. Так, при поражении слепой и восходящего отдела ободочной кишки показана правосторонняя гемиколэктомия; при раке поперечно-ободочной кишки - ее резекция, при опухоли нисходящего отдела - левосторонняя гемиколэктомия, при раке сигмовидной кишки - сигмоидэктомия.
Хирургический этап лечения рака толстой кишки дополняется послеоперационной химиотерапией. В запущенных неоперабельных случаях производится паллиативная операция (наложение обходного кишечного анастомоза или кишечной стомы), химиотерапевтическое и симптоматическое лечение.
Прогноз
Прогноз рака толстой кишки зависит от стадии, на которой был диагностирован опухолевый процесс. При выявлении онкопатологии на стадии Т1 отдаленные результаты лечения удовлетворительные, 5-летняя выживаемость составляет 90-100 %; на стадии Т2 - 70%, Т3N1-2 - около 30%. Профилактика рака толстой кишки предполагает диспансерное наблюдение групп риска, лечение предраковых и фоновых заболеваний, нормализацию питания и образа жизни, проведение скрининговых исследований (кала на скрытую кровь и колоноскопии) лицам старше 50 лет. Пациенты, оперированные по поводу колоректального рака, для своевременной диагностики рецидива рака толстого кишечника в первый год каждые 3 месяца должны проходить осмотры у онколога, включающие пальцевое исследование прямой кишки, ректороманоскопию, колоно- или ирригоскопию.
3. Современное лечение колоректального рака / Цивенко А. И., Томин М. С. // Вестник Харьковского национального университета имени В.Н. Каразина. Серия «Медицина» - 2004 - №6
Читайте также:
- Гормоны в лечении остеопороза у женщин. Эстрогенотерапия
- Векторный анализ нормальной ЭКГ. Принципы анализа электрокардиограммы
- Знание векторного анализа ЭКГ. Нормальная электрокардиограмма
- Толерантность иммунитета. Устойчивость иммунной системы. Механизмы поддержания толерантности иммунитета.
- Частота травм сердца. Причины
