Судороги после нейрохирургических операций. Лечение и профилактика
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
Судороги - это внезапно возникающие непроизвольные сокращения, охватывающие отдельные группы мышц или все тело. Тонико-клонические пароксизмы сопровождаются потерей сознания, мочеиспусканием, нарушением дыхания. Причины судорог включают органическую патологию ЦНС, токсические и метаболические повреждения нейронов, гипертермию и другие нарушения. Диагностику проводят с помощью КТ и МРТ головного мозга, ЭЭГ, лабораторных исследований. В комплексном лечении применяют противосудорожные средства, патогенетическую и этиотропную терапию, хирургическую коррекцию.
Общая характеристика
Различные судорожные синдромы занимают третье место по общей заболеваемости в популяции после сердечно-сосудистой патологии и сахарного диабета. На их долю отводится 20% всех неврологических расстройств. Патологическая симптоматика чаще возникает в детском (до 15 лет) и пожилом возрасте. Судороги ощущаются как непроизвольные спастические сокращения скелетной мускулатуры - отдельных мышечных групп или всего тела - различной интенсивности, кратковременные или длительные. Они возникают спонтанно либо провоцируются острой патологией, действием внешних факторов.
Выраженные судорожные подергивания мышц конечностей и туловища нарушают опорно-двигательную функцию, влекут за собой падения и травмы. Спастическое напряжение болезненно, часто сопровождается выгибанием или поворотом тела, девиацией головы и глаз в одну сторону. Тонико-клонические приступы проявляются нарушениями сознания и дыхания, недержанием мочи, некоторые предваряются очаговой неврологической симптоматикой. Единичные эпизоды имеют благоприятный прогноз, но частые судороги нарушают привычную активность, снижают качество жизни пациента.
Классификация
По механизму образования судороги относятся к быстрым гиперкинезам, в структуре которых преобладает фазный компонент. Они подразделяются на эпилептические и неэпилептические, первичные (идиопатические) и симптоматические (вторичные). По характеру преимущественного вовлечения скелетной мускулатуры существует несколько видов судорожных сокращений:
- Тонические. Резкое и длительное (до нескольких десятков секунд) напряжение мышц, вызванное поступлением нервного импульса большой продолжительности. Ведет к «застыванию» конечностей или тела в вынужденном положении.
- Клонические. Мышечные спазмы носят кратковременный и нерегулярный характер с быстрым чередованием периодов сокращения и расслабления. Оказывают локомоторный эффект, сопровождаясь двигательными актами.
- Смешанные. Судорожные приступы, характеризующиеся сменой тонического компонента клоническим или наоборот, называются смешанными. В большинстве случаев они носят генерализованный (распространенный) характер.
Тонические спазмы лежат в основе атетоза, разновидностью клонических являются миоклонии - внезапные и резкие (длительностью до секунды) сокращения мышц-сгибателей. Исходя из группы затронутых мышц, судороги бывают сгибательными (флексорными), разгибательными (экстензорными), смешанными. Важным критерием, нашедшим место в клинической классификации, является распространенность судорог, что позволяет выделить два типа пароксизмов:
- Парциальные (фокальные). Возникают по причине локальной активности, охватывающей группу двигательных нейронов. Сопровождаются сокращениями клонического или тонического характера. Бывают простыми (без утраты сознания), сложными, вторично-генерализованными.
- Генерализованные. Возбуждение сразу охватывает всю кору без наличия изолированного очага, поэтому в припадок вовлечены мышцы всего тела. Пароксизмы бывают клоническими, тоническими, тонико-клоническими. Также выделяют миоклонические, атонические приступы.
Отдельные состояния сочетают в себе признаки фокальных и генерализованных пароксизмов или же имеют неуточненный характер. В педиатрической практике выделяют афебрильные и фебрильные судороги, неонатальные, инфантильные пароксизмы. Международной классификацией для некоторых судорожных приступов учитывается прогноз (доброкачественные, тяжелые).

Почему возникают судороги
Причины тонических судорог
Длительное мышечное напряжение возникает на фоне чрезмерной возбудимости церебральных структур, в условиях нарушения корковой регуляции сегментарных функций. Очень часто нейроны подвергаются негативному воздействию токсических, метаболических факторов, эндокринно-обменных расстройств. Причинами тонических судорог выступают следующие состояния:
- Инфекции: столбняк, бешенство, лихорадочный синдром.
- Электролитные нарушения: гипокальциемия, гиперкалиемия, гипомагниемия.
- Эндокринные расстройства: гипер- и гипогликемия, гиперинсулинизм.
- Наследственные болезни обмена: аминокислотного (лейциноз, фенилкетонурия), углеводного (гликогеноз, галактоземия), липидного (болезнь Гоше, Нормана-Вуда).
- Сердечно-сосудистая патология: полная атриовентрикулярная блокада, острая гипотензия.
- Почечная и печеночная недостаточность: уремия, билирубиновая энцефалопатия.
- Психогенные расстройства: гипервентиляционный синдром, истерия.
- Эпилептические синдромы детского возраста: энцефалопатии Леннокса-Гасто, Отахара, инфантильные спазмы.
- Интоксикации: алкогольная, отравление угарным газом, стрихнином.
- Передозировка лекарственных средств: морфина, нейролептиков.
- Действие физических факторов: тяжелое перегревание или переохлаждение, электротравмы, влияние радиации.
Иногда болезненные спазмы имеют профессиональный характер, возникая при длительном мышечном напряжении у стенографисток, музыкантов, доярок. Судороги ног характерны для спортсменов и людей, работа которых связана с длительным стоянием. Они часто наблюдаются во время беременности, при сосудистой патологии нижних конечностей - варикозной болезни, облитерирующем атеросклерозе, эндартериите.
Причины клонических судорог
Патологические импульсы, провоцирующие кратковременные спазмы скелетных мышц, формируются в высших корковых центрах, экстрапирамидной системе либо периферических мотонейронах. Некоторые клонические припадки развиваются из-за очагового поражения стволовой области или спинного мозга при опухолях, инсультах. Другими причинами таких судорог становятся:
- Фокальные эпилептические приступы.
- Детские инфекции: корь, ветряная оспа, грипп, парагрипп.
- Тяжелая миоклоническая эпилепсия младенчества (синдром Драве).
- Диффузное поражение серого вещества: болезнь Крейтцфельдта-Якоба, подострый склерозирующий панэнцефалит.
- Нейродегенеративные состояния: болезни Тея-Сакса, Альперса.
- Непрогрессирующие энцефалопатии: при синдроме Дауна., туберозном склерозе.
- Неонатальные пароксизмы: «судороги пятого дня», доброкачественная семейная эпилепсия.
- Отравления: препаратами (пиперазином, эрготамином), химическими веществами (формальдегидом, мышьяком).
Причины тонико-клонических судорог
Часто в клинической картине наблюдается смена тонических судорожных сокращений клоническими. Генерализованные смешанные приступы являются типичным признаком эпилепсии и ее тяжелого осложнения - эпистатуса. Возникновение пароксизмальной электрической активности нейронов головного мозга обусловлено широким набором повреждающих факторов:
- Церебральная патология: сосудистые нарушения (ОНМК, артериовенозные мальформации, аневризмы), черепно-мозговые травмы, опухоли.
- Инфекционные заболевания: полиомиелит, холера, нейроинфекции (менингит, энцефалит, абсцессы).
- Артериальная гипертензия: почечная эклампсия, судорожная форма гипертонического криза.
- Токсикозы беременности: эклампсия.
- Наследственная патология: лейкодистрофии.
- Интоксикации: никотиновая, наркотическая (амфетамином, кокаином), отравления (фосфорорганическими соединениями, щавелевой кислотой, свинцом).
- Передозировка медикаментов: кофеина, атропина, амитриптилина и др.
Диагностика
Первичное обследование пациента предполагает анализ анамнестической информации (времени начала заболевания, наличия предрасполагающих факторов), выявление объективных признаков. Но с учетом полиморфизма причин судорог лишь по клиническим данным установить верный диагноз не представляется возможным. Поэтому пациенту рекомендуют пройти комплексное обследование:
- Томографию. Для выявления ишемически-геморрагических, воспалительных очагов предпочтительнее делать МРТ мозга. КТ головы хорошо визуализирует опухоли, повреждения и аномалии костей черепа, расширение желудочковой системы. Сосудистые дефекты - мальформации, тромботическую окклюзию, аневризмы - диагностируют при помощи неинвазивной КТ- или МР-ангиографии церебральных артерий.
- Электроэнцефалографию. Исследование биопотенциалов головного мозга дает возможность выявить патологическую активность в виде локальных или генерализованных разрядов (пики, острые волны, комплексы «спайк-волна»). Нарушения оценивают при выполнении провокационных проб - фотостимуляции, гипервентиляции. Для лучшего документирования пароксизмов рекомендуют проводить видео-ЭЭГ-регистрацию с миографией.
- Лабораторные анализы. Причины некоторых судорог устанавливаются на основании анализа крови с определением биохимических показателей (электролитов, глюкозы, почечных, печеночных проб), токсикологического исследования. Подозрение на инфекционную этиологию эпилептиформных пароксизмов требует выполнения серологических тестов (ИФА, РИФ), молекулярно-генетического анализа (ПЦР). Часто проводят клинический и бактериологический анализ ликвора.
Для исключения вероятной кардиальной патологии делают ЭКГ, при токсикозах беременности назначают общий анализ мочи, структурную патологию почек и печени выявляют по результатам УЗИ. Диагностика судорожного синдрома осуществляется врачом-неврологом, но исходя из предполагаемых этиологических факторов, могут привлекаться специалисты смежного профиля. Необходимо дифференцировать первичные и симптоматические эпилептические приступы, отличать их от других пароксизмальных состояний - синкопе, мигрени, тремора и пр.

Лечение судорог
Помощь до постановки диагноза
Независимо от причин, судороги являются острым состоянием, требующим квалифицированной медицинской помощи. Локальные болезненные спазмы можно устранить самомассажем, пощипыванием, растяжением мышцы. При развитии генерализованного приступа важно оказать пострадавшему первую помощь: подложить под голову валик или подушку, повернув ее на бок, очистить полость рта от пены и слизи, обеспечить доступ свежего воздуха. Бригада скорой помощи купирует пароксизм противосудорожными препаратами, при высокой лихорадке у детей вводят жаропонижающие средства.
Консервативная терапия
Госпитализация необходима всем, у кого припадок развился впервые, при тяжелых и длительных пароксизмах, наличии отягощающей патологии. После верификации диагноза, наряду с симптоматической коррекцией, лечение судорог предполагает устранение причин, воздействие на основные патогенетические моменты их развития. Исходя из клинической ситуации, для купирования приступов и терапии основного заболевания, могут использоваться такие группы медикаментов:
- Антиконвульсанты. Лечение парциальных и генерализованных эпилептических припадков проводится ламотриджином, карбамазепином - в монотерапии или комбинации с другими препаратами. Судорожный синдром при органической патологии ЦНС могут лечить вальпроатами, клоназепамом, в неонатальном периоде препаратами выбора являются фенобарбитал, дифенин. Рефрактерный эпистатус требует введения средств для наркоза (тиопентала натрия, пропофола).
- Электролиты. Купирование спазмофилии и гиперкалиемии осуществляется препаратами кальция. Хлоропривную тетанию и гипонатриемию лечат инфузиями натрия хлорида, коррекцию гипомагниемии проводят сульфатом магния. Для устранения метаболического алкалоза применяют физиологический раствор, калия хлорид.
- Гипотензивные. Для коррекции артериального давления при эклампсии, включая почечную, гипертонических кризах используются периферические вазодилататоры (нитропруссид натрия), бета-блокаторы (эсмолол), ганглиоблокаторы (пентамин, арфонад). Устранить сопутствующий отек мозга помогают диуретики - осмотические (маннит, мочевина), петлевые (фуросемид).
При отравлениях осуществляют антидотную, дезинтоксикационную, инфузионную терапию, абстинентные формы эпистатуса лечат комбинацией антиконвульсантов и нейролептиков. Выявление нейроинфекций требует проведения соответствующей противомикробной (антибактериальной, противовирусной) коррекции, гипогликемию купируют введением глюкозы, пиридоксин-зависимые судороги - витамином B6. В ряде случаев для ослабления судорожной симптоматики рекомендуют кетогенную диету с повышенным содержанием жиров.
Хирургическое лечение
Фармакорезистентные варианты эпилепсии являются показанием для более радикального лечения. Среди нейрохирургических вмешательств практикуют резекции (темпоральную и экстратемпоральную, гемисферэктомию), операции разобщения (субпиальные транссекции, каллозотомию), транскраниальные стимулирующие методы. В результате можно добиться полного прекращения приступов в течение года или существенного снижения их частоты с достижением адекватного контроля.
Хирургическим путем лечат и некоторые симптоматические судорожные приступы. При черепно-мозговых травмах и инсультах необходимо раннее вмешательство, направленное на эвакуацию внутричерепной гематомы, декомпрессию церебральных структур. Абсцессы и опухоли мозга также подлежат удалению. Операции внутрисосудистой реканализации - интраартериальный тромболизис, тромбэктомия, ангиопластика со стентированием - призваны восстановить кровоток в ишемизированных участках мозговой ткани.
2. Судорожный синдром у детей: рекомендации по оказанию неотложной помощи на догоспитальном этапе/ Шайтор В.М.// Скорая медицинская помощь. - 2015 — № 2.
3. Пароксизмальные состояния эпилептического и неэпилептического генеза у детей. Принципы диагностики и терапии/ Кузенкова Л.М., Шайтор В.М., Глоба О.В., Тепаев Р.Ф.// Педиатрическая фармакология. - 2016 - Т. 13, №1.
4. Неонатальные судороги: особенности клинической диагностики/ Заваденко А.Н., Дегтярева М.Г., Заваденко Н.Н., Медведев М.И.// Детская больница. - 2013. - № 4(54).
Судороги после нейрохирургических операций. Лечение и профилактика
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
ФГАУ «Национальный медицинский исследовательский центр нейрохирургии им. акад. Н. Н. Бурденко» Минздрава России, 125047, Москва, Россия
ФГБУ "НИИ нейрохирургии им. акад. Н.Н. Бурденко" РАМН, Москва
ФГАУ «Национальный медицинский исследовательский центр нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России
Краевая клиническая больница, Барнаул
ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России , Москва, Россия
ФГАУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России, Москва, Россия
Тактика ведения пациентов с впервые эпилептическими приступами в раннем периоде после удаления опухолей больших полушарий: два наблюдения и обзор литературы
Журнал: Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2017;81(5): 96‑103
Эпилептические приступы, возникшие впервые после нейрохирургического вмешательства (приступы de novo), представляют значительную проблему в плане выбора оптимальной лечебной тактики. Патогенез таких приступов нередко обусловлен факторами, действие которых ограничивается ранним послеоперационным периодом. Такие приступы не дают оснований ставить диагноз «симптоматическая эпилепсия» и должны расцениваться как реакция мозга на хирургическое вмешательство, а больные — как не нуждающиеся в назначении длительной противосудорожной терапии, снижающей качество жизни. Однако в некоторых ситуациях впервые возникшие ранние послеоперационные приступы являются дебютом симптоматической эпилепсии и требуют назначения длительного противосудорожного лечения. На сегодняшний день одним из основных методов, позволяющих предположить характер впервые развившегося приступа и определить показания к назначению противосудорожной терапии, служит видеоэлектроэнцефалографический мониторинг (видео-ЭЭГ-мониторинг). Мы приводим два клинических наблюдения, когда в сходных ситуациях после удаления внутримозговой опухоли в раннем послеоперационном периоде развились судорожные приступы de novo. Использование видео-ЭЭГ-мониторинга позволило нам избежать неоправданного назначения противосудорожной терапии у одного из этих больных.
Симптоматическая эпилепсия 1 наблюдается у 20—80% больных с опухолями головного мозга [1, 2]. В подавляющем большинстве случаев эпилептические приступы возникают до операции и к моменту ее проведения больные уже получают противосудорожную терапию, которая продолжается и после нейрохирургического вмешательства. При отсутствии приступов в анамнезе профилактическая противосудорожная терапия в настоящее время не назначается [3]. В этой связи особую проблему представляют эпилептические приступы, которые впервые развиваются после нейрохирургической операции (приступы de novo). С одной стороны, эти приступы могут быть спровоцированы самим фактом операции и самостоятельно прекратиться без противосудорожной терапии, с другой — могут быть дебютом симптоматической эпилепсии, что требует длительной медикаментозной терапии. Единого алгоритма принятия решения в таких ситуациях не существует. Одни авторы предлагают в любом случае начинать противосудорожную терапию [4, 5], другие, в соответствии со стандартами эпилептологии, рекомендуют начинать лечение лишь после постановки диагноза «симптоматическая эпилепсия» [3].
Очевидно, что необоснованное назначение противосудорожной терапии значительно снижает качество жизни пациента. Если же впервые развившийся после операции эпилептический приступ является проявлением симптоматической эпилепсии, то отсутствие терапии приведет к развитию осложнений и ухудшит прогноз [2, 3]. Помощь в принятии решения может оказать видеоэлектроэнцефалографический мониторинг (видео-ЭЭГ-мониторинг).
Мы представляем два клинических наблюдения, в которых видео-ЭЭГ-мониторинг повлиял на выбор тактики дальнейшего ведения больных.
Наблюдение 1. У пациентки 70 лет за 2 мес до госпитализации появилась и стала нарастать слабость в левых конечностях, ухудшилась память на текущие события, снизилась критика собственного состояния. При магнитно-резонансной томографии (МРТ) была диагностирована внутримозговая опухоль правой височной доли с зоной перифокального отека (рис. 1).
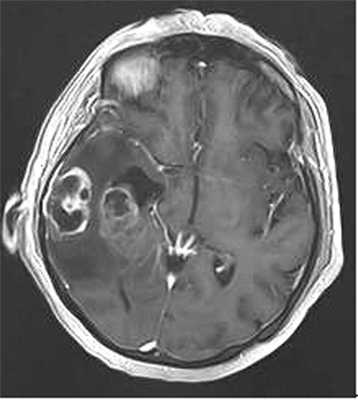
Рис. 1. Наблюдение 1. МРТ перед операцией. Внутримозговая опухоль правой височной доли с зоной перифокального отека.
Опухоль, оказавшаяся при гистологическом исследовании глиобластомой (Grade IV), удалена 02.02.16. После операции пациентка была переведена в палату пробуждения отделения реанимации, где спустя 4,5 ч (через 2 ч после экстубации) развился вторичный генерализованный судорожный приступ продолжительностью около 2 мин. Приступ был купирован внутривенным болюсным введением диазепама 10 мг и вальпроевой кислоты (конвулекс) 500 мг. Экстренное КТ-исследование выявило послеоперационные изменения правой височной доли и отсутствие хирургических осложнений (рис. 2).
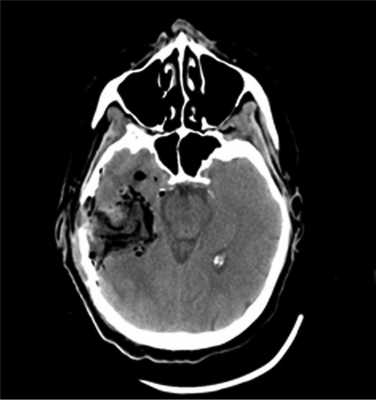
Рис. 2. Наблюдение 1. СКТ в 1-е сутки после удаления опухоли правой височной доли. Выявлены послеоперационные изменения в зоне хирургического вмешательства.
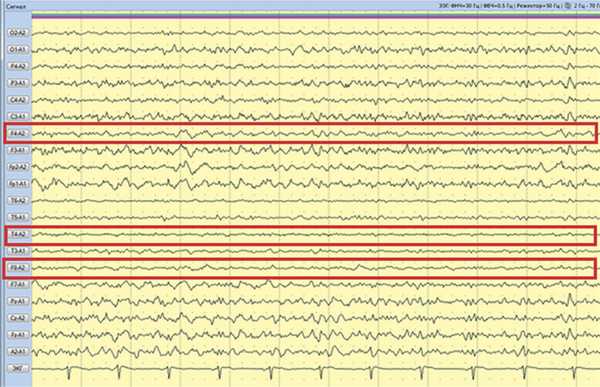
Рис. 3. Наблюдение 1. Фрагмент 13-часового ЭЭГ-мониторинга. Диффузное снижение амплитуды биопотенциалов мозга. Замедление в правой лобно-височной области на дезорганизованном фоне. Типичная эпилептиформная активность не регистрируется.
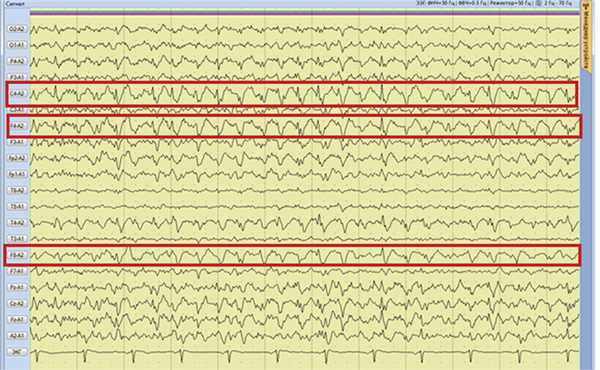
Рис. 4. Наблюдение 1. Фрагмент 13-часового ЭЭГ-мониторинга. Эпилептиформные потенциалы в виде комплексов острая—медленная волна в правой лобно-центрально-височной области.
Учитывая данные видео-ЭЭГ-мониторинга, пациентке была назначена противосудорожная терапия в виде внутривенного введения вальпроевой кислоты (конвулекс) через перфузор в дозе 1500 мг/сут. На 2-е сутки после операции эпилептиформная активность на ЭЭГ прекратилась, больная переведена в клиническое отделение, где была продолжена противосудорожная терапия вальпроевой кислотой (конвулекс) в таблетированной форме в дозе 2000 мг/сут. Через 11 дней после операции пациентка в удовлетворительном состоянии выписана из клиники с рекомендацией продолжить прием 1500 мг/сут вальпроевой кислоты под контролем ЭЭГ и концентрации препарата в плазме крови.
Наблюдение 2. Пациентка 64 лет за 10 мес до настоящей госпитализации была оперирована и проходила комбинированное лечение по поводу глиобластомы (Grade IV) левой лобной доли. В течение всего срока заболевания приступов с нарушением сознания или иных пароксизмальных состояний не наблюдалось. Противосудорожную терапию не получала. При контрольной МРТ за 3 нед до госпитализации выявлено увеличение размеров опухоли. Принято решение о повторном хирургическом вмешательстве. После операции 14.03.16 пациентка была переведена в палату пробуждения, где спустя 1,5 ч на фоне выхода из наркозного сна развился вторичный генерализованный судорожный приступ, который самостоятельно купировался в течение 1 мин. Проведенное КТ-исследование выявило послеоперационные изменения и отсутствие хирургических осложнений (рис. 5). В ходе суточного видео-ЭЭГ-мониторинга были выявлены диффузные изменения биопотенциалов в виде умеренновыраженной дезорганизации корковой активности, при отсутствии типичных эпилептиформных потенциалов (рис. 6). Было принято решение не назначать больной противосудорожную терапию и оставить ее на сутки под наблюдением в отделении реанимации. Клинических приступов или иных пароксизмальных проявлений не отмечено, при видео-ЭЭГ-мониторинге эпилептиформная активность не зафиксирована. После перевода в клиническое отделение приступов также не наблюдалось. Спустя 8 дней после операции пациентка в удовлетворительном состоянии выписана для продолжения химиотерапии по месту жительства.
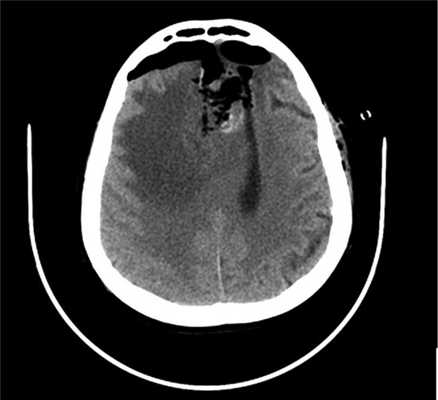
Рис. 5. Наблюдение 2. СКТ в 1-е часы после удаления опухоли левой лобной доли. Послеоперационные изменения с зоной перифокального отека, скопления воздуха и небольшой зоной имбибиции кровью в области операции.
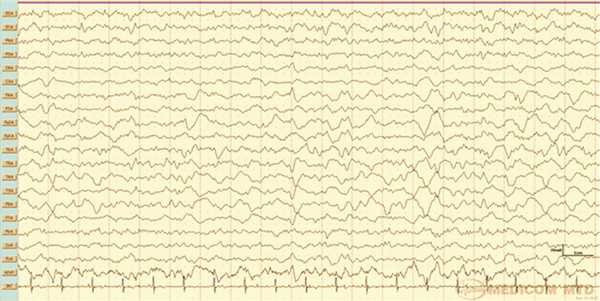
Рис. 6. Наблюдение 2. Фрагмент ЭЭГ-мониторинга. Умеренновыраженный дезорганизованный фон, с преобладанием медленных форм активности и острых потенциалов в лобно-передневисочной области, больше справа.
Впервые возникшие эпилептические приступы (de novo) в зависимости от срока их развития после операции разделяют на ранние (acute postoperative seizures) и поздние [6, 7]. К ранним приступам как правило, относят те, которые возникают в течение 48 ч после операции, но ряд авторов считают, что к ранним эпилептическим приступам следует относить все приступы, возникающие в 1-ю неделю после операции [8].
Частота ранних впервые возникших приступов после удаления опухоли мозга варьирует в разных сериях наблюдений от 4,3 до 23,6% [7, 9] и зависит от локализации, гистологического диагноза, удаленного объема, выраженности отека, геморрагической имбибиции мозга, пневмоцефалии и наличия осложнений [6, 9]. В среднем считается, что вероятность возникновения эпилептических приступов после удаления полушарной опухоли составляет 5—10% [7, 9].
Патогенез впервые возникших в раннем после-операционном периоде эпилептических приступов окончательно не установлен. Одним из механизмов может быть раздражение коры мозга компонентами крови и продуктами распада гемоглобина. Возможно также, что накапливающиеся в очаге повреждения перекисные соединения снижают концентрацию гамма-аминомасляной кислоты, которая ингибирует нейрональную активность коры и таламуса [6]. Наконец, в ишемизированной перитуморозной ткани мозга за счет снижения синтетаз АТФ нарушается трансмембранный транспорт воды и ионов, что приводит к изменению потенциала клеточной мембраны [11]. В любом случае патогенез впервые возникших ранних послеоперационных приступов обусловлен механизмами, действие которых, как правило, прекращается в раннем послеоперационном периоде. Соответственно такие приступы, особенно единичные, не дают оснований диагностировать симптоматическую эпилепсию и должны расцениваться как реакция мозга на хирургическое вмешательство [6, 8].
В ряде исследований [6, 11] показано, что ранние впервые возникшие послеоперационные приступы не повышают риск развития симптоматической эпилепсии и не являются поводом для назначения противосудорожной терапии. Менее распространено мнение о том, что приступы в раннем послеоперационном периоде увеличивают риск развития послеоперационной симптоматической эпилепсии [12].
Профилактическое 2 назначение противосудорожных средств после нейрохирургических вмешательств широко практиковалось в ХХ веке и сегодня рутинно осуществляется во многих отечественных и зарубежных клиниках. Вопрос о профилактическом применении противосудорожных препаратов в настоящее время остается дискуссионным. Обзор Американской ассоциации нейрохирургов (AANS) за 2005 г. показал, что чаще противосудорожные препараты для профилактики используют длительно практикующие нейрохирурги [13]. Некоторые авторы [14] предлагают для профилактики ранних приступов назначение противосудорожных препаратов в первую неделю после операции. Комитет качества и стандартизации Американской академии неврологов (AAN) в рекомендациях 2000 г. не рекомендует продолжать противосудорожную терапию дольше одной недели после операции, так как медикаментозная профилактика неэффективна для предотвращения развития позднего приступа [15].
Всего, по данным литературы [17], проведено 5 рандомизированных контролируемых испытаний трех противоэпилептических препаратов: фенитоина, фенобарбитала и вальпроатов. Разницы между действием этих средств и плацебо относительно предотвращения первого приступа у пациентов с опухолями головного мозга не выявлено. Более того, в одном исследовании результаты в группе больных, профилактически получавших фенитоин, оказались хуже, чем в группе плацебо (10 и 8% ранних послеоперационных приступов соответственно), причем побочные эффекты препарата отмечены у 18% получавших его пациентов [17]. Следует подчеркнуть, что исследования высшего уровня доказательности проведены только по трем упомянутым препаратам, и нет оснований предполагать аналогичный результат при изучении новых противосудорожных средств.
В литературе [17, 18] доминирует мнение, что побочные эффекты профилактической противосудорожной терапии превосходят возможную пользу и однозначно снижают качество жизни больных. Очевидно, что в определенных ситуациях ранние послеоперационные приступы бывают первым проявлением симптоматической эпилепсии и промедление с назначением соответствующей терапии может иметь негативные последствия. Дифференциальный диагноз между ранними послеоперационными приступами, возникшими как реакция мозга на повреждение, и ранними приступами, являющимися дебютом симптоматической эпилепсии, затруднен, и однозначного алгоритма принятия решения в такой ситуации в современной литературе не представлено.
Методом, помогающим принять верное решение, служит видео-ЭЭГ-мониторинг. Продолженный видео-ЭЭГ-мониторинг более информативен по сравнению с рутинной записью ЭЭГ [3, 19]. Мы использовали рекомендации ESICM (Европейское общество интенсивной терапии) по проведению видео-ЭЭГ-мониторинга в отделениях нейрореанимации [19]. В соответствии с ними видео-ЭЭГ-мониторинг проводили сразу после выявления приступа.
Заключение
На основании анализа данных литературы можно говорить о том, что развитие эпилептических приступов de novo после нейрохирургических вмешательств — нередкое явление, требующее не только быстрой реакции врача для купирования приступа, но и осмысления ситуации относительно дальнейшего ведения пациента. Развитие симптоматической эпилепсии может привести к ухудшению исходов хирургического лечения, повышению летальности, увеличению срока пребывания пациента в стационаре. С другой стороны, неоправданное использование противоэпилептических препаратов в ситуации, когда единственный приступ является реакцией мозга на операционную травму, существенно снижает в дальнейшем качество жизни пациента. Дискуссия, имеющая место на сегодняшний день в литературе, подтверждает нерешенность этих проблем (это касается и профилактического назначения препаратов, и выбора конкретного противоэпилептического средства, и сроков его использования).
Приведенные нами клинические наблюдения отражают различные варианты подхода к терапии впервые развившихся эпилептических приступов у пациентов после удаления внутримозговой опухоли. По нашему мнению, одним из важных на сегодняшний день критериев для принятия решения о назначении противосудорожной терапии являются данные видео-ЭЭГ-мониторинга, который необходимо проводить после однократно возникшего эпилептического приступа в первую неделю после операции.
Авторы заявляют об отсутствии конфликта интересов.
Комментарий
Статья посвящена актуальной проблеме — тактике ведения пациентов с эпилептическими приступами denovo после удаления внутримозговых опухолей. Ведение пациентов с так называемыми «острыми симптоматическими приступами» является предметом активных обсуждений в последние годы. Казалось бы все просто: возникли эпилептические приступы у больных с поражением головного мозга — необходимо длительное назначение антиэпилептических препаратов. Однако это далеко не так и не во всех случаях.
Авторы приводят два клинических наблюдения. У обеих пациенток после удаления злокачественных опухолей головного мозга развились билатеральные тонико-клонические эпилептические приступы. В первом случае при проведении видео-ЭЭГ мониторинга (ВЭМ) было выявлено региональное замедление, эпилептиформная активность и множественные ЭЭГ паттерны фокальных приступов. Во втором — лишь однократный приступ с отсутствием эпилептиформной активности на ЭЭГ. В первом случае авторы рекомендовали длительный прием антиэпилептических препаратов, во втором — только наблюдение.
Таким образом, главным достоинством публикации является дифференцированный и комплексный подход к данной категории пациентов. На основании данных анамнеза, клиники, нейровизуализации и проведения ВЭМ в раннем послеоперационном периоде, авторы определяют группу пациентов с высоким риском развития эпилепсии, рекомендуя им длительную терапию, и группу с низким риском, оставляя ее без лечения, но под наблюдением. Такой подход позволяет избавить часть пациентов от необходимости необоснованного длительного приема антиэпилептических препаратов, которые являются потенциально токсичными.
Статья написана хорошим научным языком, является актуальной, обе пациентки обследованы современными методами, выводы адекватны. Авторами представлен обзор современной зарубежной литературы по данной тематике.
Единственное пожелание, касающееся этой работы, — проведение хотя бы минимального катамнестического наблюдения за пациентками.
Гемифациальный спазм ( болезнь Бриссо , лицевой гемиспазм )
Гемифациальный спазм — пароксизмальное одностороннее спастическое сокращение мышц лица, обусловленное различными раздражающими воздействиями на центральный интракраниальный участок лицевого нерва. Диагностируется по особенностям клинической симптоматики, характерному паттерну электромиографии. Этиология устанавливается при помощи магнитно-резонансной томографии мозга и церебральных сосудов. В лечении применяются консервативные (фармакотерапия, введение ботулотоксина) и оперативные (декомпрессия нервного ствола, удаление сдавливающих нерв образований) методики.
МКБ-10

Общие сведения
Термин «гемифациальный» означает «затрагивающий половину лица». Гемифациальный спазм (ГФС) впервые был описан в 1975 году. Подробная характеристика заболевания дана в 1894 году французским невропатологом Э. Бриссо, в связи с чем в литературных источниках по неврологии встречается синонимичное название — болезнь Бриссо. Гемифациальный спазм диагностируется с частотой 0,8 случаев на 100 тыс. населения, преимущественно в возрасте 40-50 лет. Женщины заболевают в 2 раза чаще мужчин. Среди лиц монголоидной расы заболеваемость выше, что обусловлено особенностями анатомии черепной коробки. Двусторонний гемифациальный спазм наблюдается в исключительных случаях.

Причины гемифациального спазма
Заболевание развивается вследствие раздражения корешка лицевого нерва, выходящего из мозгового ствола. Последние исследования показали, что, наряду с типичной локализацией зоны раздражения в месте выхода корешка, патологическое воздействие на нерв возможно на всем протяжении его центрального отрезка. Основными этиофакторами, обуславливающими неблагоприятное воздействие на лицевой нерв, являются:
- Нейроваскулярный конфликт. Возникает при особом анатомическом взаиморасположении нервного корешка и близлежащих артерий (нижних мозжечковых, базилярной, позвоночной). Тесный контакт нервного ствола с артериальной стенкой обуславливает его раздражение вследствие сосудистой пульсации. Избыточное возбуждение нервных волокон вызывает гипериннервацию мышц соответствующей половины лица.
- Аневризмы церебральных сосудов. Аневризматические расширения сосудов мостомозжечковой зоны оказывают сдавливающее воздействие на лицевой нерв. В результате возникает перераздражение нервных волокон, провоцирующее возникновение патологической импульсации в область лицевой мускулатуры.
- Опухоли головного мозга. Новообразования мостомозжечкового угла своей массой могут сдавливать лицевой корешок. В результате по нерву к мышцам лица идут чрезмерные возбуждающие импульсы, приводящие к спазму.
- Очаг демиелинизации. Распространение процесса деструкции миелина на ствол лицевого нерва вызывает переход возбуждения с одного нервного волокна на другие. Формируется усиленная импульсация, провоцирующая мышечный спазм.
- Зона лакунарного инфаркта. На месте ишемического участка происходит образование небольшой полости — лакуны, которая оказывает раздражающее влияние на лицевой корешок. Перераздражение нерва влечёт за собой нарушение иннервации мимических мышц, их спастическое состояние.
Патогенез
Тонус лицевой мускулатуры изменяется под воздействием эфферентных импульсов, идущих по двум лицевым нервам, каждый из которых отвечает за иннервацию гомолатеральной половины лица. Раздражающие влияния на нервный ствол вызывают перевозбуждение его волокон с усилением эфферентной импульсации, приводящей к спастическому сокращению соответствующих мышц. В патогенезе нейроваскулярного конфликта особую роль отводят артериальной гипертензии и прогрессирующему атеросклерозу, обуславливающим утолщение артериальной стенки, формирование извитости сосудов. Поскольку в мостомозжечковой области из ствола выходят корешки нескольких черепных нервов, то патологические процессы этой локализации могут провоцировать раздражение двух и более нервных стволов одновременно. Вследствие этого гемифациальный спазм иногда сочетается с патологией слухового нерва, тройничной невралгией.
Разделение лицевого гемиспазма на две этиологические формы сложилось исторически в связи с недостаточной изученностью этиопатогенетических механизмов патологии. Внедрение нейровизуализирующих методов диагностики позволило выявить причину идиопатической формы заболевания, однако разделение сохранилось. Соответственно этиологии, гемифациальный спазм классифицируют на:
- Первичный — обусловленный нейроваскулярным конфликтом. Ранее первичный гемиспазм считался идиопатическим (не имеющим установленной причины).
- Вторичный — вызванный сдавливающим воздействием объёмного образования (аневризмы, опухоли, лакуны), демиелинизирующим процессом.
Особенности клинической картины, связанные с последовательностью вовлечения в спазм мускулатуры лица, легли в основу клинической классификации. Клинически выделяют:
- Типичный ГФС — спастический пароксизм начинается с отдельных сокращений круговой мышцы глаза. Характерен для первичной формы.
- Атипичный ГФС — спазм возникает в мышцах щеки, распространяется на околоорбитальную область, лоб. Встречается при вторичной форме.
Симптомы гемифациального спазма
В классическом (типичном) варианте спастический приступ стартует сокращениями мышцы, расположенной вокруг глаза. Возникают отдельные зажмуривания глаза, частота которых нарастает. Постепенно спастические сокращения распространяются на все мышцы одной половины лица. Зажмуривания становятся настолько частыми, что больной утрачивает возможность видеть поражённым глазом. Атипичный гемифациальный пароксизм начинается с щёчных мышц, далее спазм охватывает мышцы губ, периорбитальной зоны и лба. Мышечные сокращения безболезненны, возникают внезапно.
Гемифациальный приступ провоцируется психо-эмоциональным напряжением, переутомлением. В отличие от других гиперкинезов, исчезающих во сне, гемифациальный спазм может наблюдаться у спящего пациента. Патогномоничным считается симптом синкинезии Бабинского: на стороне поражения смыкание век сопровождается подниманием брови, что обусловлено одновременным сокращением круговой мышцы глаза и фронтальной мышцы лба.
Заболевание имеет хроническое течение, сопровождается постепенным формированием умеренного пареза лицевой мускулатуры. В ряде случаев ГФС сочетается с патологией других черепно-мозговых нервов. У 5% пациентов отмечается невралгия тройничного нерва, у 15% - тугоухость различной выраженности, обусловленная поражением слухового корешка. Отдельные больные жалуются на шум в ухе с поражённой стороны, который возникает вследствие вовлечения в спазм мышцы, перемещающей слуховые косточки.
Осложнения
Не представляя серьёзной опасности для здоровья, ГФС значительно ухудшает качество жизни больного. Основные осложнения имеют психологический характер, связаны с психо-эмоциональным дискомфортом, испытываемым пациентов вследствие возникновения эстетического дефекта. Заболевание ограничивает социальную активность, является препятствием в профессиональной деятельности, может стать причиной депрессии. У 60% больных наблюдается ухудшение зрительной функции.
Гемифациальный спазм диагностируется неврологом по клиническим данным: характеру приступов, наличию симптома синкинезии, присутствию пароксизмов в период сна. Важное значение имеет отсутствие другой неврологической симптоматики. Пациентам с нарушением слуха требуется консультация отоларинголога. С целью подтверждения диагноза, установления этиологии ГФС проводятся дополнительные исследования:
- Электромиография. Описано два типа характерных для ГФС миографических паттернов. Патогномоничным признаком выступает феномен аномального мышечного ответа — при электростимуляции одной из ветвей лицевого нерва происходит сокращение мышц, иннервируемых другими его ветвями.
- МРТ головного мозга. Позволяет диагностировать причину компрессии корешка: опухоль, очаг демиелинизации, сосудистую мальформацию, лакуну. По МРТ данным можно судить о первичном или вторичном характере ГФС.
- Церебральная МР-ангиография. Проводится в дополнение к МРТ мозга для визуализации нейроваскулярного конфликта. Выявляемость последнего зависит от калибра конфликтующего сосуда: для крупных сосудов она составляет 100%, для более мелких — 76%.
Дифференцировать ГФС необходимо от идиопатического блефароспазма, начальные проявления которого зачастую носят односторонний характер. Основной отличительный признак — расположение брови при спастическом смыкании век: при ГФС бровь приподнята, при блефароспазме — втянута в глазницу. Дифдиагностику также проводят с лицевой миокимией, психогенным спазмом, пароксизмами фокальной эпилепсии.
Лечение гемифациального спазма
Возможно применение консервативных и нейрохирургических методик. Консервативная терапия проводится длительно, в связи с чем приводит к побочным эффектам. Нейрохирургическое лечение позволяет радикально устранить причину заболевания, но не исключает рецидивирования.
- Фармакотерапия. Осуществляется антиэпилептическими средствами (карбамазепин, леветирацем, клоназепам), миорелаксантами (баклофен). Долгосрочные результаты медикаментозной терапии недостаточно изучены, некоторыми авторами считаются сомнительными.
- Введение ботулотоксина. Инъекции препарата производятся каждые 3-4 месяца подкожно и внутримышечно в область поражённых мышечных групп. Метод эффективен у 75% пациентов, даёт хорошие результаты при старте терапии в начальных стадиях болезни.
- Микроваскулярная декомпрессия. Проводится при нейроваскулярном конфликте. Операция заключается в разделении нервного ствола и сосуда тефлоновым протектором в месте их соприкосновения. Основными послеоперационными осложнениями являются дисфункция вестибулокохлеарного нерва (2-3%), лицевой парез (3,5-4,8%), зачастую имеющий преходящий характер.
- Оперативное лечение аневризм. Осуществляется путём клипирования шейки аневризмы или её эндоваскулярной окклюзии. Позволяет предотвратить разрыв истончённой сосудистой стенки в месте выпячивания, приводящий к внутримозговому кровоизлиянию.
- Удаление церебральной опухоли. Производится с помощью микрохирургической техники. Объём операции зависит от размеров и вида новообразования, корректируется интраоперационно по результатам гистологического исследования.
Прогноз и профилактика
Гемифациальный спазм характеризуется хроническим течением. Известны случаи самопроизвольного регресса симптоматики, составляющие до 10%. Рецидивы первичной формы заболевания после проведения микроваскулярной декомпрессии, по различным данным, доходят до 20%. Прогноз вторичной формы зависит от причиной патологии. Специфическая профилактика отсутствует. Предупреждение сосудистых изменений, способствующих возникновению нервно-васкулярного конфликта, включает меры профилактики гипертонии и атеросклероза.
Нейроваскулярный конфликт
Нейроваскулярный конфликт - это сдавление и нарушение функции черепного нерва вследствие его контакта с близлежащим сосудом. Чаще всего в практике встречается повреждение тройничного, лицевого нерва, реже наблюдается компрессия других пар ЧМН, помимо обонятельного. Клиническая картина зависит от пораженного нерва, степени сдавления и локализации патологического очага. Основу диагностики нейроваскулярной патологии составляет церебральная МРТ с МР-ангиографией. Лечение конфликта консервативное: противоэпилептические и дофаминергические препараты, инъекции ботулотоксина. При неэффективности фармакотерапии показана нейрохирургическая коррекция.



Нейроваскулярный конфликт (НВК) - мультидисциплинарная проблема, встречающаяся в 15-20 случаев на 100 тыс. населения. Термин введен в медицинскую лексику еще в 1936 г. Наибольшие заслуги по изучению и разработке методов коррекции этого синдрома принадлежат американскому неврологу П. Джанетта. Ученый создал авторскую методику нейрохирургической декомпрессии, которая известна как «Jannetta Procedure». Однако до сих пор в практической неврологии существует ряд сложностей при диагностике и эффективном лечении НВК, поэтому заболевание не теряет своей актуальности.

Причины
Пусковым фактором симптоматики нейроваскулярного конфликта является длительное сдавление определенного участка нерва артериальным, реже венозным сосудом. Основной причиной выступает механическое воздействие за счет передачи сосудистой пульсации либо формирование пароксизмальной активности вследствие взаимодействия нерва с артерией или веной. Предрасполагающие условия для нейроваскулярного конфликта:
- Атеросклероз. При отложении липидных бляшек и кальция в сосудистых стенках они становятся более плотными и ригидными, увеличиваются в диаметре. Даже минимальных изменений достаточно для механического влияния на окружающие ткани. Риск нейроваскулярного заболевания повышается при сопутствующей артериальной гипертензии.
- Сосудистые аномалии. Изменения нормальных размеров, структуры и локализации сосуда вызывает компрессию внутри ограниченного пространства черепной коробки. НВК развивается при артериовенозных мальформациях, сосудистых опухолях.
- Патологии строения черепа. При уменьшении объема задней черепной ямки повышается вероятность сдавления нервов и других структур. Нейроваскулярная компрессия в 3 раза чаще встречается в группе пациентов с аномалией Арнольда-Киари. Провоцирующим фактором конфликта выступают родовые травмы черепа, тяжелые ЧМТ.
В зоне компрессии происходит демиелинизация волокон типа А, которые передают сигналы о механических раздражителях и проводят стартовые болевые импульсы. Область поражения становится очагом генерации спонтанных импульсов, которые распространяются на медленные С-волокна, отвечающие за чувствительность к боли. В результате в кору головного мозга поступают болевые сигналы, которые не ингибируются антиноцицептивной системой.
Болевые пароксизмы спровоцированы раздражением кожи, которая иннервируется пораженными отделами А-волокон. При этом интенсивность симптоматики зависит от объема демиелинизации нервных волокон и активности физиологических противоболевых механизмов. При одновременной нейроваскулярной компрессии двумя сосудами (феномен «сэндвича») вероятность конфликта возрастает с 2,3-6,25% до 30-50%.

Симптомы нейроваскулярного конфликта
Тригеминальная невралгия
Самый распространенный вариант НВК связан с поражением тройничного нерва. Он встречается с частотой 5:100000 у женщин и в 2 раза реже среди мужчин. Пациенты жалуются на приступы жгучей боли в области лица, которая длится от нескольких секунд до пары минут. Боли сопровождаются спазмами лицевой мускулатуры, слезотечением, слюнотечением. Число приступов колеблется от одного до нескольких десятков в течение суток.
При тригеминальной невралгии пациенты замирают, пережидая боль, поскольку малейшее движение усугубляет ситуацию. Пароксизмы нейроваскулярного конфликта провоцируются воздействием на болевые (триггерные) точки тройничного нерва. Большинство приступов связаны с механическим раздражением этих зон: неаккуратной чисткой зубов, бритьем, пережевыванием пищи и разговором с активной мимикой.
Гемифациальный спазм
Клиническая картина вызвана компрессией лицевого нерва в зоне выхода из ствола мозга. В большинстве случаев происходит одностороннее поражение, у 0,6-5% пациентов наблюдается двухсторонний нейроваскулярный конфликт. Заболевание чаще встречается у женщин среднего и старшего возраста. Мужчины страдают гемифациальным спазмом в 2 раза реже, у них нет четкой закономерности межу возрастом и риском развития НВК.
У большинства людей первым признаком патологии является кратковременное подергивание век, которое постепенно переходит в тонические спазмы мышц, самопроизвольное зажмуривание глаза. Далее спастические явления распространяются по всей половине лица и шеи. Пароксизмы возникают в любое время, даже во сне, провоцируются активной мимикой, переизбытком эмоций, физическим утомлением.
Вестибулярная пароксизмия
Нейроваскулярный конфликт с преддверно-улитковым нервом проявляется приступами головокружения. Они продолжаются от нескольких секунд до нескольких минут, усиливаются при запрокидывании головы. Во время пароксизма наблюдается тошнота, шатающаяся походка с отклонением в сторону патологического очага. В 30% случаев вестибулярные нарушения сопровождаются поражением слуховых волокон, поэтому больные жалуются на снижение слуха, ощущение звона в ушах.
Языкоглоточная невралгия
При сдавлении IX пары ЧМН возникают жалобы на резкие приступообразные боли, которые начинаются в корне языка или в области миндалин. Болевой синдром быстро распространяется на глотку и мягкое небо, отдает в ухо, нижнюю челюсть и шею. Пароксизмы продолжаются до 2 минут, по силе и характеру ощущений симптомы сходны с проявлениями тригеминальной невралгии.
Языкоглоточная невралгия провоцируется движениями языка при разговоре и глотании, употреблением слишком горячей или холодной пищи. Пароксизмы развиваются по стереотипному сценарию, от приступа к приступу симптоматика не меняется. В межприступный период пациенты не предъявляют неврологических или других жалоб. В 2-3% случаев наблюдается сочетанное поражение блуждающего нерва, поэтому приступы сопровождаются нарушениями сердечного ритма.
Спастическая кривошея
Симптомы вызваны компрессией добавочного нерва, которая встречается в 1-3 случаев на 100000 населения. Больные жалуются на болезненные спазмы шейных мышц с одной стороны. При этом происходит насильственный поворот головы в сторону, ее наклон к плечу. Приступы спастической кривошеи при нейроваскулярном поражении провоцируются неосторожными движениями, эмоциональными стрессами.
Редкие варианты НВК
При конфликте глазных нервов (глазодвигательный, блоковый, отводящий) возникают жалобы на двоение предметов, косоглазие, сложности при движениях глазами. Для компрессии подъязычного нерва типичны приступообразные нарушения глотания и речевой функции, слабость язычных мышц. Изредка при осмотре определяется отклонение языка на сторону поражения.
В 2,8% случаев наблюдаются множественные поражения ЧМН. Возможно одномоментное развитие нейроваскулярного конфликта с участием двух нервов и двух разных сосудов либо компрессия структур одной извитой артерией. В основном диагностируется сочетанное поражение тройничного и лицевого нервов, которое имеет более тяжелое клиническое течение, с трудом поддается терапии.
Болевые пароксизмы значительно ухудшают качество жизни пациента, вызывают неврозы и тревожное расстройство, становятся причиной депрессии. При частых и интенсивных приступах человек утрачивает работоспособность, испытывает ограничения в повседневной жизни. При хроническом течении нейроваскулярной патологии наблюдается паралич лицевых мышц, асимметрия лица, нарушение слуха и зрения.
В отдельную группу выделяют осложнения после нейрохирургического лечения конфликта. Наиболее тяжелым последствием операции является инфаркт мозжечка, который встречается в 1-2% случаев. Нередко возникает стойкое (3-8%) или преходящее снижение слуха (20%), ухудшение лицевой чувствительности (5-30%), парез лицевых мышц (5-6%). Осложнения радиохирургии включают сухость склер, нарушение памяти, снижение вкуса и расстройство глотания.
При подозрении на нейроваскулярный конфликт показано расширенное обследование у врача-невролога. Для определения интенсивности болевых ощущений используют клинические шкалы: вербальную описательную, лицевую, визуальную аналоговую. Далее проводится оценка неврологического статуса, выяснение анамнеза заболевания и жизни, полный физикальный осмотр. Для подтверждения диагноза потребуются результаты исследований:
- МРТ головного мозга. В режиме МР-ангиографии удается визуализировать сосуд, который стал причиной нейроваскулярных нарушений. Для исключения объемных новообразований, инфекционного процесса и прочих причин невралгии назначается МРТ по протоколам 3D-T2-FSE и FIESTA.
- Электромиография. При анализе результатов электрофизиологического исследования обращают внимание на пароксизмальные мышечные разряды. Они состоят из быстрых и нерегулярных всплесков клонической активности. Зачастую такая картина развивается в условиях контролируемой нервной стимуляции.

Лечение нейроваскулярного конфликта
Лечение невралгии, вызванной компрессией нервов, начинают с медикаментозных методов. В качестве препаратов первой линии используют противосудорожные средства, которые показывают эффективность около 90%. В течение всего периода лечения проводится контроль содержания противоэпилептических медикаментов в организме, чтобы предупредить осложнения фармакотерапии: токсический гепатит, нарушение клеточного состава крови.
При нейроваскулярном конфликте лицевого нерва наилучшую эффективность демонстрирует ботулинотерапия. Контролируемое введение ботулотоксина в мимические мышцы на стороне поражение вызывает их парез длительностью 5-12 месяцев. При этом у пациента полностью исчезают или значительно уменьшаются клинические проявления заболевания, улучшается качество жизни. Инъекции ботулотоксина рассматриваются как метод выбора на ранних стадиях НВК.
При неэффективности или невозможности проведения консервативной терапии больных переводят в отделение нейрохирургии. Для устранения причины симптоматики показана операция микроваскулярной декомпрессии: разграничение ЧМН и сдавливающего его сосуда, установка специальной прокладки для предупреждения рецидивов нейроваскулярного конфликта. Эффективность операции составляет 70-90%.
Если имеются противопоказания к нейрохирургическому вмешательству, используется малоинвазивный метод стереотаксической радиохирургии: к пораженному участку подводится контролируемая доза облучения. Эффективность методики ниже, по сравнению с микроваскулярной декомпрессией. Спустя год после манипуляции эффект сохраняется у 60% пациентов, в последующие 2 года результативность снижается до 34-40%.
При своевременном начале терапии успешность лечения составляет более 90%. Менее оптимистичный прогноз при сочетанном поражении ЧМН, отсутствии эффекта от хирургического вмешательства, развитии тяжелых послеоперационных последствий. Профилактика нейроваскулярных конфликтов заключается в своевременном выявлении и терапии сосудистой патологии. Способы предупреждения врожденных аномалий головного мозга не разработаны.
1. Неврология. Национальное руководство/ под ред. Е.И. Гусева, А.Н. Коновалова, В.И. Скворцова. - 2018.
2. Нейроваскулярные конфликты задней черепной ямки/ В.Г. Дашьян, А.С. Никитин// Журнал неврологии и психиатрии им. С.С. Корсакова. - 2017. - №117.
3. Нейроваскулярный конфликт преддверно-улиткового нерва. Этиология, диагностика, методы хирургического и консервативного лечения/ А.И. Крюков, Н.Л. Кунельская, Е.В. Гаров, В.В. Мищенко// Вестник отоларингологии. - 2015. - №5.
4. Особенности нейроваскулярного конфликта, предрасполагающие к развитию невралгического статуса/ Е.В. Балязина // Саратовский научно-медицинский журнал. - 2012. - №8.
Читайте также:
