Возраст и частота опухолей. Возраст как причина канцерогенеза.
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Согласно статистике, около 10% онкологических заболеваний имеют наследственный характер. По наследству передается не сама болезнь, а генные мутации, которые обуславливают предрасположенность к возникновению рака.
Механизмы реализации наследственной предрасположенности к раку
Каждый носитель мутированного гена наследственного рака - это потенциальный онкологический пациент. При формировании половых клеток человек получает 50% отцовских и 50% материнских копий гена. Таким образом поврежденный ген достается человеку или от отца, или от матери. Этот ген имеет два признака (две аллели) - один здоровый, другой раковый. Поврежденный аллель содержится только в 50% гамет, следовательно, и риск передачи по наследству дефектного гена составляет 50%. Такая же вероятность наследования мутированного гена существует у родных сестер и братьев пациента. Для отдаленных родственников опасность получения ракового гена снижается прямо пропорционально степени родства.
Человек, с 50% дефектным геном здоров и является только носителем. Чтобы запустился процесс канцерогенеза, необходима еще одна мутация - уже здоровой части гена (аллели). При этом ген полностью инактивируется и не способен выполнять свои функции по контролю и сдерживанию клеточного деления, поддержанию целостности генома - на этом фоне развивается злокачественная трансформация здоровых клеток в раковые. Эта теория получила название «двойного удара».
Рак и генетика
Наследование дефектных генов происходит несколькими путями:
- Наследуется конкретный ген, несущий код определенной формы рака.
- Передаются гены, обуславливающие предрасположенность к развитию онкологических заболеваний под воздействием неблагоприятных факторов внешней среды.
- Наследуется группа генов, склонных к мутациям, которые затем индуцируют формирование злокачественных опухолей.
Запустить процесс онкогенеза в организме способны три группы наследственных нарушений:
- При массивном воздействии средовых факторов (канцерогенов) нормальные гены мутируют в онкогены.
- Когда замедляется процесс ликвидации мутированных генов на клеточном уровне, например, неполная регенерация участков ДНК при их повреждении.
- При наследственных заболеваниях, характеризующихся иммуносупрессией.
Понятие о наследственном и спорадическом раке
Гипотеза о возможном существовании наследственных форм рака была выдвинута еще в начале XX века на примере наблюдения за четырьмя семьями, у которых рак желудка прослеживался в пяти поколениях. Но истинная роль генетических/наследственных факторов онкологических заболеваний была доказана в 60-90 годах XX века после проведения специальных генетических исследований.
Опухоли различных анатомических локализаций бывают наследственными и ненаследственными (спорадическими).
Наследственные (семейные) формы рака составляют 5-10% от всех случаев рака. В основе наследственных опухолей лежат генные мутации в половых клетках, передаваемые из поколения в поколение, они обладают тенденцией скапливаются в семье - отсюда и название «семейный рак».
Разработаны критерии, по которым возможно идентифицировать семейный рак от спорадических случаев:
- Клинические проявления злокачественных опухолей обнаруживаются в молодом возрасте.
- Одновременно поражается несколько разных органов (рак молочной железы и рак яичников).
- Онкологический процесс захватывает сразу оба парных органа (рак обеих почек).
- Тип наследования признаков по законам Менделя.
Не все эти признаки встречаются одновременно, существует много вариаций в их проявлениях даже среди членов одной семьи. Для накопления критического количества мутаций, которые могут спровоцировать развитие онкологии, необходимо время.
У пациентов с наследственными раковыми синдромами одна мутация уже получена от родителей, поэтому «путь к раку» у них занимает меньше времени. Заболевания возникают на 20-25 лет раньше, чем спорадические раки.
Передается ли рак по наследству
Многие полагают, что, если факт наследования рака установлен, то заболевание возникнет обязательно. Наследственная предрасположенность не является 100% неизбежностью заболевания раком. Присутствие одних и тех же мутаций у одних оборачивается развитием рака в молодом возрасте, а другие остаются здоровыми до преклонных лет.
Проводимые исследования не выявили решающего влияния каких-либо внешних факторов на проявления онкологического заболевания. Ученые пришли к выводу, что в развитии рака большую роль играют особенности генетического фона человека.
Выявлены многочисленные варианты последовательности расположения нуклеотидов в цепочке ДНК, которые увеличивают или уменьшают вероятность образования злокачественных опухолей.
Виды передачи наследственных форм рака
Выявлено 8 наследственных синдромов, проявляющиеся семейной предрасположенностью к раку по женской линии.
К наиболее частым формам наследственных опухолевых синдромов относятся рак молочной железы, эндометрия и яичников. На долю рака молочных желез приходится до 5% заболеваемости, на рак яичников - 15%, на рак эндометрия - 3%.
Далее по распространенности следуют злокачественные опухоли желудочно-кишечного тракта, легких, толстого кишечника.
Прохождение генетического тестирования рекомендуется лицам, у кого имеется высокий риск носительства врожденной генетической мутации, определяющий вероятность развития злокачественных новообразований.
В настоящее время невозможно определить у кого из членов семьи с повышенным риском развития злокачественных опухолей разовьется рак, а у кого нет. Поэтому в группу риска включаются все близкие кровные родственники.
- У кровных родственников рак диагностировали в возрасте до 50 лет.
- Локализация опухолей совпадает у разных членов семьи.
- У одного из представителей рода был выявлен рецидивирующий злокачественный процесс.
- Присутствие хотя бы одного из факторов в семейном анамнезе человека является основанием для проведения молекулярно-генетического анализа.
Рак по мужской линии
У мужчин - первые места по распространенности и частоте поражения занимают злокачественные опухоли легких, толстого кишечника, простаты и яичка. Эти формы рака и предшествующие им состояния наследуются по мужской линии:
- аденоматозный полипоз кишечника;
- саркоидоз легких;
- гиперплазия простаты.
Генетическое тестирование в онкологии
Точно узнать есть ли наследственные формы рака у отдельного индивидуума или у его родственников можно с помощью проведения тестов ДНК. Основной целью ДНК-тестов является выделение носителей мутации, которые нуждаются в диагностических и профилактических мерах. Существующий на сегодняшний день перечень ДНК-тестов выявляет признаки онкологической предрасположенности у 1-2% людей.
Генетический прогноз - это основа для выбора дальнейшей тактики клинико-лабораторного мониторинга.
Генетический скрининг у взрослых выявляет предрасположенность к раку следующих органов:
- молочная железа;
- яичники;
- матка;
- кишечник (тонкий, толстый);
- желудок;
- легкие;
- поджелудочная железа;
- щитовидная железа;
- простата;
- кожа.
Это не полный перечень наследственных форм рака, науке на настоящий момент известно более 50 видов.
У представителей некоторых этнических групп наследственная предрасположенность к раку встречается особенно часто, например, у евреев-ашкенази - рак молочных желез и рак яичников из-за присутствия мутаций в генах BRCA1, BRCA2.
Наиболее часто для изучения генов применяют метод полимеразной цепной реакции (ПЦР), которая не всегда обнаруживает мутации, даже при явных признаках «семейного рака». Поэтому в современных генетических лабораториях ДНК-тестирование проводят с помощью метода yRisk или биочипов, которые быстро считывают геном человека и точно выявляют гены, мутация в которых связана с повышенным риском развития рака. Но эти методики не получили широкого распространения на практике в связи с дороговизной.
Цель молекулярно-генетического исследования - это выявление геномных нарушений, определяющих развитие опухоли, степень ее злокачественности, метастатический потенциал и скорость прогрессирования заболевания. Составление карты индивидуального генетического обследования, в которой представлены сведения о конкретных геномных повреждениях, позволит проводить прицельную диагностику и профилактику у данного пациента.
Профилактика семейного рака
Профилактика наследственных форм рака включает раннюю диагностику, своевременное устранение опасных предраковых состояний, повышение устойчивости организма, следование здоровому образу жизни: сбалансированное питание, отказ от вредных привычек, занятия спортом.
Для людей с предрасположенностью к различным видам рака разработаны стандарты первичного обследования для ранней диагностики. Для каждого пациента с высоким риском по развитию онкозаболеваний составляется индивидуальная программа динамического наблюдения.
За рубежом при некоторых разновидностях наследственного рака, как к эффективному способу избежать заболевания, прибегают к превентивным мерам - удалению здорового органа. Ярким примером стала голливудская звезда Анджелина Джоли, которой удалили обе молочные железы и яичники, так как, по прогнозам, риск заболеть раком у нее составлял 87%. Такие радикальные меры профилактики болезни выполняются лишь при высоком уровне риска, который подтверждается генетическими исследованиями. У нас в стране отсутствует правовая база, разрешающая такие операции.
Рак и возраст
С возрастом повышается риск многих заболеваний, и рак — не исключение. Для того чтобы это понять, достаточно посмотреть на график, который составили американские ученые. Он показывает, как меняется заболеваемость и смертность от онкологических заболеваний в разных возрастных группах. Эти данные получены в конце прошлого века, но они актуальны и по сей день:
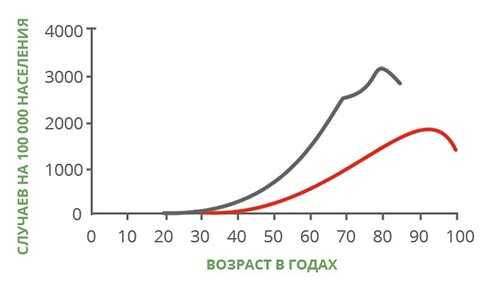
Существует много разных типов опухолей, некоторые из них относят к «детским». Но в целом рак рассматривают как возрастное заболевание. Почему же риски каждого человека повышаются с годами?
Главная причина — накопление мутаций
В течение жизни все ткани человека обновляются. Этот процесс происходит за счет деления клеток. Человеческая ДНК состоит из миллиардов азотистых оснований — «букв» генетического кода. Во время каждого клеточного деления все эти «буквы» должны быть в точности скопированы. Статья, которую вы читаете, состоит из нескольких тысяч букв, и, несмотря на то что мы ее вычитывали перед публикацией на сайте, возможно, в ней закралась пара опечаток. Неизбежны ошибки и при копировании генетического кода. В клетках работают многочисленные механизмы, чтобы это предотвратить, но они не всегда находят и устраняют «опечатки».
Мутации, которые возникают в результате деления клеток, чаще всего оказываются нейтральными и не наносят существенного вреда. Но с годами они накапливаются. Из-за нарушения в некоторых генах начинают неправильно работать белки, которые регулируют рост и размножение клеток, «чинят» поврежденную ДНК. В итоге клетка начинает бесконтрольно делиться и превращается в раковую.
Сколько мутаций носит в своем теле среднестатистический взрослый человек? «Очень много» — пока на этот вопрос нельзя дать более точного ответа.
Например, не так давно ученые из Кембриджского Университета в Соединенном Королевстве решили проверить слизистую оболочку пищевода у людей в возрасте 20-75 лет. Оказалось, что у лиц 20 лет на одну клетку приходится примерно по 100 мутаций, а в более старшем возрасте — более 2000. Некоторые из них потенциально способны привести к раку. И это только пищевод!
Подробнее о данном исследовании читайте в нашей статье "Мутации, которые способны привести к раку«.
В 2016 году в научном журнале Nature была опубликована статья, в которой ученые рассказали, что бремя соматических (не связанных с половыми клетками) мутаций у каждого человека удваивается примерно каждые 8 лет. Аналогичными темпами растет и смертность от разных причин, в том числе от онкологических заболеваний.
Рост мутационной нагрузки примерно на 15 лет опережает рост заболеваемости раком. Человек пока здоров, но в его теле уже есть опасные мутации — это можно рассматривать как доклиническую стадию онкологического заболевания. И от этого факта становится немного жутко. Кто знает, кто из нас прямо сейчас носит в своих генах «бомбу замедленного действия»?
Накопление ошибок в генах с возрастом — одна из основных причин, почему врачам, вероятно, никогда не удастся победить рак окончательно. Проблема борьбы с онкологическими заболеваниями теснейшим образом переплетена с проблемой старения.
Некоторые мутации происходят в клетках спонтанно, по воле слепого случая. Другие спровоцированы такими факторами, как ультрафиолетовое излучение, канцерогены в пище, табачном дыме, бытовых и производственных химикатах, выхлопных газах, вирусы и др. Понятное дело, чем дольше человек живет на свете — тем дольше на его организм действуют все эти факторы. Соответственно, растут и риски.
Превратности эволюции человека
Как бы стройно ни выглядели рассуждения о накоплении мутаций с возрастом, в них есть, как минимум, одна серьезная брешь. Дело в том, что деление клеток происходит наиболее быстро во время внутриутробного развития и первых лет жизни. Именно в это время в генах возникает большинство «ошибок». С возрастом ткани обновляются всё медленнее. Почему же тогда риски повышаются у пожилых?
Ответ нужно искать в теории эволюции и особенностях жизни наших первобытных предков. В каменном веке редко кто доживал до тридцатилетнего возраста. Всю свою жизнь человек тратил на то, чтобы вырасти, окрепнуть, набраться опыта. Можно сказать, рождение детей и уход за ними в первые годы был апогеем, главным смыслом жизни. Вскоре после этого многие люди погибали от инфекций, природных катастроф и зубов хищников.

Для выживания популяции было нужно, чтобы люди доживали до того момента, когда они могли оставить потомство. Все это время защитные механизмы в организме работают на пике эффективности. Этому способствовал естественный отбор.
Природа не особо старалась, чтобы человек так же эффективно выживал в более старшем возрасте. По мере угасания репродуктивной функции в тканях начинают происходить изменения: развивается хроническое воспаление, они работают менее эффективно, снижается иммунная защита. «Неправильные» клетки получают хорошие возможности для выживания и бесконтрольного размножения. Повышается риск образования клонов таких клеток и перерождения их в злокачественную опухоль.
Возможно, все это звучит жестоко. Но в противовес этой жестокости законов биологии человечество создало гуманную высокоразвитую медицину. Благодаря усилиям врачей продолжительность жизни современных людей растет, появляются все новые возможности для борьбы с раком и другими серьезными заболеваниями.
Еще один парадокс состоит в том, что риск рака достигает пика примерно к 70 годам, а затем снижается. Среди людей в возрасте 90 лет и старше распространенность онкологических заболеваний сильно снижается, и они реже становятся причиной смерти. Почему так происходит — еще предстоит разобраться. Возможно, это связано с тем, что долгожители изначально менее восприимчивы к онкогенным мутациям.
Ниже представлены средние возраста, в которых диагностируются разные типы злокачественных опухолей:
- Рак молочной железы - 62
- Рак легкого - 70
- Рак предстательной железы - 66
- Колоректальный рак - 68
- Рак мочевого пузыря - 73
- Меланома - 63
- Неходжкинская лимфома - 63
- Рак щитовидной железы - 51
- Рак почки - 64
- Лейкемия - 66
- Все типы рака - 65
Развивается ли рак у пожилых людей более медленно?
Когда-то бытовало мнение о том, что в старшем возрасте злокачественные опухоли растут медленнее и в целом ведут себя менее агрессивно. Это верно, но лишь отчасти. Да, действительно, есть данные о том, что рак молочной железы и простаты у пожилых имеют тенденцию расти медленнее.
Пожилым мужчинам, страдающим злокачественными опухолями предстательной железы, даже не всегда назначают лечение. Но врачи принимают такое решение отнюдь не из-за того, что такой рак не опасен. Просто в таких случаях человек настолько стар, что, вероятно, он не доживет до того момента, когда рак успеет сильно распространиться в организме и стать смертельно опасным. В каждой ситуации это нужно оценивать индивидуально.
Другие опухоли в пожилом возрасте, такие как рак прямой кишки, мочевого пузыря, поджелудочной железы, ведут себя очень агрессивно, и их даже сложнее лечить, чем у более молодых пациентов. Из-за слабого здоровья людям старшего возраста зачастую противопоказаны хирургические вмешательства, химиотерапия.

Никогда не поздно заняться профилактикой
Возраст — лишь один из факторов риска рака. Многие другие связаны с образом жизни, и на них вполне можно повлиять:
- Откажитесь от курения.
- Перейдите на здоровое питание.
- Оставайтесь физически активны.
- Поддерживайте здоровый вес.
- По максимуму ограничьте алкоголь.
- Используйте защитные средства, когда работаете с химикатами.
- Защищайтесь от солнечных лучей, не лежите подолгу на пляже и избегайте солярия.
- Своевременно начинайте лечение любых заболеваний.
Конечно, лучше вести здоровый образ жизни смолоду. Но никогда не поздно начать. Вы в любом случае получите пользу для здоровья.
Защититься от рака на 100% невозможно, поэтому людям старшего возраста особенно важно регулярно проверяться — проходить скрининг. Всем женщинам после 40 лет рекомендуется периодически выполнять маммографию, всем людям после 50 лет — колоноскопию. Найти патологические образования на коже поможет дерматоскопия. Заядлым курильщикам с большим стажем нужно проконсультироваться с врачом: возможно, стоит пройти компьютерную томографию. При повышенном риске рака желудка нужно провериться с помощью гастроскопии.
Посетите врача в «Евроонко», и он порекомендует скрининговую программу, подходящую в вашем случае.
Никогда не поздно лечиться
Еще лет 20 назад мало какая клиника в мире взялась бы за активное лечение рака у 90-летнего человека. Это большие риски и ответственность. Многие клиники не берутся и сейчас. Но постепенно ситуация меняется. Появляются новые препараты, подходы. Они помогают лечить злокачественные опухоли более эффективно, снижаются риски, пациенты переносят операции и химиотерапию более комфортно.

Мы считаем, что помочь можно всегда. Врачи в клиниках «Евроонко» берутся за лечение рака у людей любого возраста, с любой стадией заболевания.
Никогда не стоит сдаваться. Приезжайте и получите консультацию у наших специалистов.
В каком возрасте следует опасаться рака. Как предотвратить рак после 40 лет?

Онкологические заболевания являются второй (после сердечно-сосудистых заболеваний) причиной смерти в России. Смертность от рака составляет 16,6%, причем, это показатель растет. Так, в 2016 году она составила 200 человек на 100 000, а в 2018 году уже 203 человека на 100 тысяч населения.
Несмотря на развитие медицины, заболеваемость все еще высокая, а распознавание и эффективное лечение - неудовлетворительное. Риск возникновения всех злокачественных опухолей (рак яичников, матки, эндометрия) у женщин увеличивается с возрастом. Возможность развития тяжелого рака молочной железы также возрастает у зрелых женщин.
Почему с возрастом увеличивается частота возникновения рака?
Повышенная заболеваемость и смертность от онкологических заболеваний связана с несколькими причинами. Развитие рака увеличивается с возрастом, а наше общество все быстрее и быстрее стареет. Это связано с отрицательным естественным приростом, а также увеличением средней продолжительности жизни.
В качестве так называемого «возраста рака» определяют возраст после 40 лет у женщин и после 50 лет у мужчин. После пересечения этого возраста процент опухолей значительно увеличивается.
Помимо старения населения, очень важным фактором, который способствует развитию онкологии является образ жизни:
Почему женщины подвержены развитию раковых опухолей?
Существенным элементом, который влияет на значительный процент злокачественных опухолей именно у женщин и на неудовлетворительные эффекты лечения является низкая диагностика раковых заболеваний в их ранней стадии. Прежде всего, причиной рака служит небольшое число женщин, которые приходят на скрининг.
Среди всей онкологии, самая большая заболеваемость и смертность приходится на:
Мы видим, что онкологические заболевания, которые касаются только женщин, являются доминирующей группой среди всех новообразований. В какой-то степени это зависит от того, что большинство опухолей молочной железы или эндометрия тесно связаны с женским гормональным фоном (конкретно, с уровнем эстрогена в организме).
Но, далеко не всегда развитие опухолей связано с гормонами. Рак молочной железы более агрессивен и сложнее поддается лечению у зрелых женщин. Рак эндометрия, который появляется у женщин старшего возраста, также имеет худший прогноз, по сравнению с опухолями, которые возникают у женщин молодого возраста.
Неблагоприятным фактором, высокой смертности женщин от онкологии является тот факт, что женщины, которые прошли менопаузу, часто перестают регулярно посещать гинеколога. Они считают, что если не рожают детей и отсутствует менструация, то нет смысла ходить к врачу. Это большая ошибка, потому что только регулярные осмотры могут предотвратить развитие продвинутых стадий рака яичников или эндометрия.
Не стоит забывать о профилактических осмотрах. Это абсолютно бесплатные исследования, которые способствуют более быстрой постановки диагноза и, тем самым, эффективному лечению рака.
Как предотвратить рак после 40 лет?
Появление и накопление мутаций в генах, которые отвечают за развитие отдельных видов рака, с возрастом увеличивается. Чем дольше срок экспозиции на данный канцероген (фактор, вызывающий рак), тем больше риск заболеть.
Вместе со старением организма падает его способность к восстановлению. Снижается иммунитет, появляются хронические заболевания, которые затрудняют лечение потенциального рака. В связи с повышенным риском онкологических заболеваний, действуют программы раннего распознавания рака.
Они эффективны в следующих случаях:
- можно распознать онкологию на ранних стадиях развития;
- опухоль характеризуется длинной стадией развития и медленным периодом прогрессирования;
- опухоли связаны с возникновением так называемых маркеров, которые можно обнаружить/измерить.
Профилактические осмотры являются безопасными и неинвазивными, применяются у большой группы населения и достаточно информативны.
Для профилактики так называемых «женских опухолей» понимают предупреждение развития рака шейки матки и рака молочной железы. Профилактикой рака шейки матки является проведение цитологии, в программу раннего обнаружения включают женщин в возрасте 25-59 лет.
Необходимым исследованием для предупреждения и раннего выявления рака молочной железы является маммография, которая проводится у женщин в возрасте 50-69 лет. Конечно, это исследование должно проводиться и в других возрастных группах (минимум после 35-40 лет), тем не менее, в программу распознавания рака включены женщины этого возраста, когда чаще всего происходит развитие различных опухолей.
В настоящее время не существует программы раннего распознавания рака эндометрия и рака яичников. Развитие опухолей этого вида не связано с наличием характерных, типичных только для них маркеров. Это новообразования, развитие которых непредсказуемо, а прогрессирование их может произойти очень быстро.
Описываются опухоли яичников, которые в течение нескольких месяцев перешли в запущенную стадию, даже ежегодное ультразвуковое исследование (УЗИ) не способствовало их быстрой диагностике, доступные методы лечения оказываются неэффективны.
Разве возраст имеет значение в лечении рака?
Для большинства видов раковых опухолей, прогноз примерно одинаков как для пожилых, так и для молодых людей. Но это касается людей, у которых нет сопутствующих заболеваний. Процент хронических заболеваний, увеличивается с возрастом, отсюда, эффективность лечения рака и прогноз для выживания хуже.
Наличие патологий сердца, почек, печени, сердечно-сосудистой системы является фактором риска неблагоприятного течения заболевания. В первую очередь, нагрузка именно этими заболеваниями, затрудняет принятие адекватного лечения.
Многие препараты, которые используются для химиотерапии, характеризуется более высоким процентом развития побочных эффектов у пожилых людей. С возрастом, метаболизм фармакологических препаратов меняется, иногда нужно пересмотреть лечение, уменьшить дозировку лекарств. Пожилые люди более склонны к появлению осложнений после лечения онкологических процессов.
- невропатии;
- воспаления слизистых;
- поражения костного мозга;
- тяжелые формы анемии.
Организм пожилых людей восстанавливается гораздо дольше и обременен многочисленными болезнями, увеличивается риск послеоперационных осложнений. Иногда обширная операция связана с очень большим риском, приходится отказаться от радикального лечения. Люди среднего и пожилого возраста требуют более тщательной и длительной подготовки к операции - гидратации или наоборот, устранения дисбаланса электролитов, изменения лекарственной терапии сопутствующих заболеваний.
Лечение любого онкологического заболевания — непростая и не всегда эффективная задача. За простыми на первый взгляд мерами профилактики скрывается реальная возможность предотвратить развитие опасного для жизни заболевания. Предупредить рак легче, чем лечить.
Путь клетки «из греков в варяги». Малигнизация: причины и следствия
Обзор
Малигнизация — один из самых загадочных процессов. Что же на самом деле направляет клетку на тернистый путь перерождения?
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Недуг, прозванный чумой XXI века. В наши дни рак является одним из самых страшных заболеваний. В 2010 году более семи миллионов людей по всему свету умерли от рака. В Соединенных Штатах каждая третья женщина и каждый второй мужчина рано или поздно заболеют раком. По прогнозам ВОЗ, число случаев заболевания будет продолжать расти от 14 миллионов в 2012 году до 22 миллионов в следующие десятилетия. Пугающие числа, от которых невольно бросает в дрожь. Однако процесс ракового перерождения, или малигнизации, не только страшен, но и интересен, и в этой статье мы разберемся, почему же некоторые «избранные» клетки решают свернуть не туда и как это влияет на самого «изменника».
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
Гончие еще играют во дворе, но дичи не уйти,
как ни мчится она уже сейчас по лесам.
Франц Кафка
На «Биомолекуле» опубликовано немало статей о молекулярных основах канцерогенеза. Но каждая из них, как правило, посвящена какой-то одной стороне этого патологического процесса, в то время как среди наших читателей наверняка есть люди, которые хотели бы, прежде чем углубляться в детали, получить общее представление о раковой клетке. Обзорная статья Анны Батуевой удачно заполняет этот пробел и дает общее представления о ключевых молекулярных механизмах злокачественного перерождения. — Ред.
Под малигнизацией понимают приобретение здоровыми клетками черт злокачественности, которые мы подробно рассмотрим ниже. Процесс злокачественного изменения можно уподобить дичи из цитаты Кафки, ведь клетка, однажды встав на этот путь, не сможет вернуться и получить свое клеточное здоровье обратно. Важную роль в понимании основ перерождения клеток и их дальнейшего функционирования сыграла медицина, а следом за ней и молекулярная биология. Но начнем с истоков истории рака.
Часть 1. Биография рака
Первые упоминания о раке встречаются в папирусе Эдвина Смита, датируемом 16 веком до нашей эры [1]. Там же отмечается, что данное заболевание не поддается лечению.
Во времена Гиппократа, около 400 года до нашей эры, появилось специальное обозначение рака — karkinos. Разросшаяся опухоль напомнила Гиппократу краба, окутывающего все вокруг клешнями. Современное название онкологии произошло от греческого слова onkos, которое греки использовали для описания опухолей. Однако врачи того времени не различали доброкачественные и злокачественные новообразования, и karkinos Гиппократа не имеет ничего общего с истинным раком.
Гиппократ выдвинул гуморальную теорию, суть которой состояла в том, что каждый недуг является следствием переизбытка одного из четырех гуморов: крови, слизи, желтой желчи и черной желчи.
Гален, греческий врач, практиковавший в Риме около 160 года нашей эры, довел теорию Гиппократа до совершенства. Он заявил, что рак образуется из-за переизбытка черной желчи. Гален умер в 199 году нашей эры, но его «черная желчь» еще долго будоражила умы онкологов.
Только спустя пять столетий, в 1538 году, Андреас Везалий опроверг теорию Галена, делая вскрытия в Парижском университете. Окончательно похоронил галенову теорию лондонский анатом Мэтью Бейли, который в 1793 году опубликовал учебник «Патологическая анатомия некоторых наиболее важных частей человеческого тела» [2], в котором представил рисунки и описания раковых опухолей, где не было и следа «черной желчи».
Изобретение микроскопа повлекло за собой первые цитологические исследования рака. В 1801 году французский физиолог Франсуа Биша и в 1838 году Иоганн Мюллер определили, что опухоли имеют клеточную структуру. После этого Жан Крювелье высказал гипотезу «канцероматозной дегенерации», основанную на предположении, что клетка проходит несколько этапов, прежде чем окончательно превратиться в раковую. Немецкий хирург Карл Тирш доказал, что раковая опухоль происходит из эпителиальной ткани, а саркома — из соединительной.
Первая половина XX века породила еще одну теорию канцерогенеза, недалеко ушедшую от истины. В 1911 году Пейтон Раус, работая в Рокфеллеровском университете в Нью-Йорке, открыл вирус, способный вызывать опухоли у кур. Ученые по всему свету бросились искать вирусы, ответственные за рак именно у человека, однако ничего не могли найти. В 1974 году в Medical World News вирус рака у человека ставили в один ряд с НЛО, снежным человеком и лохнесским чудовищем. Вирус СВ-40 и вирус папилломы человека, вызывающие рак у людей, были открыты в 1960 и 1983 годах соответственно.
В 1970 году генетик Говард Темин, работавший в лаборатории Макардла в Висконсине и изучавший вирус саркомы Рауса (ВСР, или VSR), представил свою работу на Десятом Международном онкологическом конгрессе. Он открыл у ВСР обратную транскрипцию — синтез ДНК по РНК — и положил начало изучениям ретровирусов. Позднее он отказался от вирусной теории канцерогенеза, а в 1979 году ученые Майкл Бишоп и Харолд Вармус открыли первый протоонкоген — src (сарк), содержащийся в ВСР. Это положило начало новому этапу в истории онкологии, люди наконец-то поняли, как запускается процесс канцерогенеза. Но этого бы не произошло без изучения раковой клетки и ее странной физиологии.
Часть 2. Что заставляет клетку измениться?
В этой главе мы разберем причины злокачественного перерождения клетки. Первым толчком к началу этого изменения является мутация в ДНК.
Важными факторами, вызывающими мутации и провоцирующими раковое перерождение, являются ионизирующее излучение, воздействие ультрафиолетовых лучей, влияние цитотоксических веществ, повреждающих ДНК (к ним относятся наркотические вещества и некоторые лекарственные препараты — например, цисплатин, повреждающий структуру двойной спирали) и органические яды.
Но не всякие повреждения ДНК обязательно приведут к появлению раковой клетки, а лишь те, что затронут определенные гены. Наиболее важную роль в канцерогенезе играют три группы генов: протоонкогены, онкогены и гены — супрессоры опухолей.
Протоонкогены
Протоонкогены — это «здоровые» предшественники онкогенов, которые в результате мутации могут вызвать развитие опухоли. Такими причинами являются различные мутации или суперэкспрессия гена. Как правило, протоонкогены кодируют белки, участвующие в процессах жизненного цикла клетки. В результате мутаций появляются сбои в регуляции клеточного деления и дифференцировки.
Основные изменения, происходящие с протоонкогенами:
- Транслокация — перенос генетического материала с одной хромосомы на другую. Часто в результате такой перестройки появляется новый химерный ген, имеющий канцерогенные свойства. Характерным примером химерного онкогена служит BCR-ABL, появляющийся в «филадельфийской хромосоме» (рис. 1) — результате реципрокной транслокации между участками 9 и 22 хромосом [3].
Эта мутация приводит к развитию хронического миелоидного лейкоза, который сегодня успешно лечится. Также в 90-95% случаев саркомы Юинга — злокачественной опухоли костной ткани, поражающей в основном трубчатые кости, — обнаруживают транслокацию между 11 и 22 хромосомами, которая приводит к образованию гена, кодирующего патологический белок EWS/FLI1.
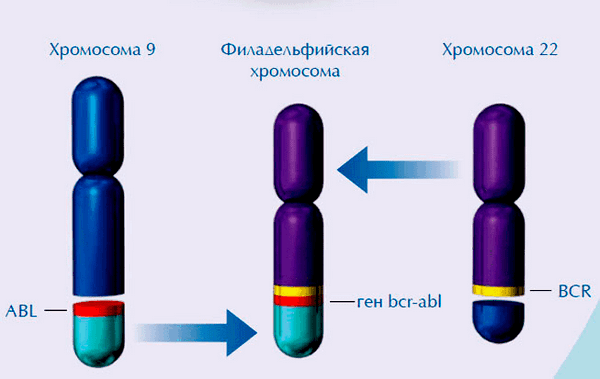
Рисунок 1. Химерный ген BCR-ABL образуется при слиянии участка 9 хромосомы, несущей ген ABL, с участком 22 хромосомы, несущей ген BCR
В некоторых случаях канцерогенез запускается вирусами. Онкогены в геноме вирусов являются ранее захваченными в клетках-хозяевах нормальными генами, которые со временем превратились в злокачественные. Когда такие онкогенные вирусы попадают в клетку, начинается считывание информации с вирусной ДНК или РНК, в цитоплазме накапливаются онкогенные белки и начинается процесс перерождения.
Онкогены
Онкогены — это гены, активность которых стимулирует образование и развитие злокачественной опухоли. Как уже было упомянуто выше, первый вирусный онкоген был открыт в 1979 году.
Биохимические продукты онкогенов
Онкогены кодируют белки с различной структурой и функциями. К основным продуктам деятельности онкогенов относят:
- Факторы роста. Раковые клетки продуцируют белки, способные вызывать пролиферацию и дифференцировку клеток. Наиболее известным фактором роста является HER2, кодируемый геном ERBB2. Мутации и гиперэкспрессия этого гена обнаружены при раке молочной железы и ассоциированы с крайней агрессивностью опухоли. Суперэкспрессия гена приводит к запуску белковых каскадов, ответственных за клеточное деление. Постоянные сигналы к делению вызывают неконтролируемую пролиферативную активность клеток и их злокачественное перерождение.
- ГТФ-связывающие белки. Гуанозинтрифосфат-связывающие белки участвуют во многих клеточных процессах: передача сигналов, транспорт метаболитов внутри клетки и др. Первыми открытыми ГТФ-связывающими белками были белки семейства Ras — продукты онкогена RAS. При постоянном производстве они вызывают злокачественный рост. Наиболее изученный эффектор Ras — это RAF, который запускает белковый каскад MAPK, отвечающий за клеточное деление и пролиферацию [6].
- Мембранные рецепторы. В онкогенезе основную роль играют рецепторы с тирозинкиназной активностью. Они служат для связывания с ростовыми факторами. К ним относится рецептор эпидермального фактора роста, повышенный синтез которого приводит к перерождению клетки.
- Онкогенные протеинкиназы. Протеинкиназы — это группа ферментов, которые модифицируют белки путем фосфорилирования (присоединения остатка фосфорной кислоты). Протеинкиназы регулируют апоптоз, процессы роста и дифференцировки клеток. Нарушения в их работе приводят к сбою в клеточном цикле и, как следствие, к развитию рака. Например, протеинкиназа AKT1, ответственная за ингибирование апоптоза, при перепроизводстве способна вызывать перерождение клеток. Также, она связана с ростом сосудов в опухоли, что помогает раковым клеткам расселяться по организму и давать метастазы.
Все вышеперечисленные продукты онкогенов являются сигналами к запуску неконтролируемого клеточного деления. Внешние факторы больше не играют никакой роли в жизни клетки, потому что пролиферацию запускают внутренние сигнальные белки.
Гены и белки — супрессоры
В здоровой клетке существуют защитные механизмы, следящие за процессами и регулирующие клеточный цикл. К таким механизмам относят деятельность белков — супрессоров опухолей: p21, p53, pRb, PTEN и др.
Белок p53 — наиболее изученный белок-супрессор. Он является продуктом гена TP53, мутации которого обнаруживаются в клетках многих опухолей [7]. p53 синтезируется во всех клетках организма, но активируется только при повреждениях ДНК. Этот белок способен остановить клеточный цикл и не допускать дальнейшее деление клетки, пока не произойдет репарация ДНК. При сильных повреждениях он также может запускать процесс апоптоза.
Одной из главных функций p53 является сохранение генетической идентичности всех клеток организма. При неправильной работе этого белка клетка получает возможность делиться даже при поврежденной ДНК, что увеличивает вероятность мутаций и накопления дефектных онкогенов. Важную роль в подавлении p53 играет белок MDM2, который в норме регулирует активность p53. Однако при повышенном синтезе он связывается с p53 и ингибирует его противоопухолевое действие.
Эпигенетические факторы рака
Важными факторами канцерогенеза являются эпигенетические события. Эпигенетика изучает процессы, затрагивающие активность генов, но не изменяющие структуру ДНК. К ним относится изменение метилирования ДНК.
Метилирование — это присоединение метильной группы к нуклеотидам в особых, строго определенных участках генома, называемых CpG-островками. Такое изменение не влияет на структуру молекулы, однако может влиять на экспрессию отдельных генов. В частности, если в участке ДНК много метильных групп, то транскрипция этого участка прекращается.
Особенно активно метилирование проходит в эмбриональный период жизни, а у взрослого человека метилировано около 2% генома. В норме баланс между метилированием и деметилированием строго регулируется и соблюдается, однако в старости начинают преобладать процессы метилирования, что может в итоге привести к канцерогенезу. В процессе онкогенеза происходит гиперметилирование CpG-островков, что приводит к общей геномной нестабильности и накоплению еще большего количества мутаций. В большинстве случаев метилированные участки являются промоторами и влияют на активацию или, наоборот, инактивацию генов, что с виду похоже на действие точечных мутаций.
Однако хотя нарушения в эпигенетической регуляции сопровождают развитие злокачественного перерождения, они, как правило, не являются его первопричиной, а лишь одним из сопутствующих факторов.
По отдельности каждое из вышеперечисленных нарушений не может спровоцировать раковое перерождение. Все они работают совместно и слаженно. Так, онкогенез запускается, только если одновременно активированы онкогены и инактивированы гены-супрессоры в обеих копиях ДНК. Впервые теорию двойного канцерогенеза высказал Альфред Кнудсон, изучавший ретинобластому: «По всей видимости, — писал он, — в возникновении рака у детей ключевую роль играют два типа генов. Первый, онкогены, действует посредством повышенной, аномальной активности. Второй же класс, антионкогены, в онкогенезе рецессивен: рак происходит лишь тогда, когда обе нормальные копии удалены или изменены» [8]. В процессе жизнедеятельности раковая клетка накапливает все большее количество мутаций, поэтому раковый геном часто очень сильно отличается от генома здоровой клетки (рис. 2).
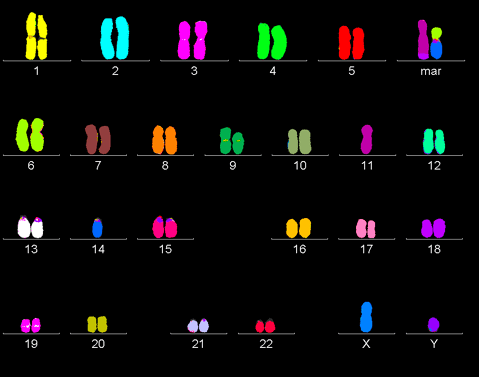
Рисунок 2. Раковый геном. В процессе жизнедеятельности раковая клетка накапливает огромное количество мутаций и нередко характиризуется полиплоидностью.
Часть 3. Физиологические последствия малигнизации
Основное последствие малигнизации — клеточное бессмертие. Оно может поддерживаться несколькими способами: активацией фермента теломеразы, блокировкой регуляторов митохондриального пути апоптоза и в некоторых случаях активацией механизма ALT (alternative lengthening of telomeres, альтернативного удлинения теломер [14]).
Обратная сторона «вечной молодости»
Впервые клеточное бессмертие раковых клеток было продемонстрировано в 1951 году на клеточной линии HeLa, взятой у Генриетты Лакс, вскоре скончавшейся от рака шейки матки (рис. 3) [9].
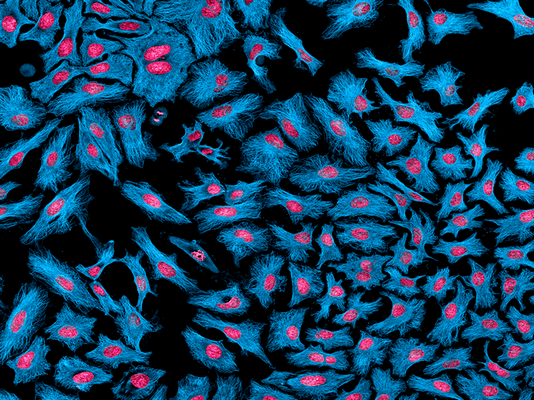
Рисунок 3. Клеточная линия HeLa — «бессмертная» линия раковых клеток. С 50-х годов прошлого столетия используется для изучения поведения раковых клеток и выявления новых противораковых препаратов.
Как правило, малигнизация сопровождается активацией фермента теломеразы. На концах хромосом находятся короткие повторяющиеся участки ДНК, названные теломерами [10]. После каждого деления теломеры укорачиваются, что в итоге приводит к их полному исчезновению и невозможности продолжать деление. Количество возможных делений для клетки названо пределом Хейфлика. Действие теломеразы заключается в восстановлении теломер и превращении клетки в фактически бессмертную, позволяя ей делиться бесконечно долго. Существуют нормальные клетки, в которых также экспрессируется теломераза. Это клетки, которым надо часто делиться: половые, стволовые и клетки эпителия кишечника. Однако теломераза активна в подавляющем большинстве раковых клеток, что играет важную роль в их жизненном цикле.
С другой стороны, в некоторых злокачественных клетках, наравне с активной теломеразой, существует так называемое альтернативное удлинение теломер, или сокращенно ALT [11]. При ALT происходит гомологичная рекомбинация концевых участков хромосом (рис. 4). В норме рекомбинация происходит в процессе мейоза, однако раковые клетки научились достраивать теломеры, используя теломеры другой хромосомы как матрицу [12].
Рисунок 4. Принцип действия ALT, основанный на гомологичном достраивании концов теломер. Такой механизм «бессмертия» является основным для ряда опухолей.
Важно отметить, что раковое бессмертие контролируется не только теломерами, но и ингибированием путей апоптоза, главным из которых является митохондриальный путь. В норме, из митохондрий в цитоплазму выходят митохондриальные белки и образуют апоптотический комплекс — апоптосому, которая и запускает апоптоз. При неправильной работе регуляторных белков, а к ним относятся белки семейства BCL-2, нарушается выход апоптотических белков, что приводит к сбою в процессе апоптоза. В раковых клетках обнаружены нарушения в работе белков BAX и BAK, а также экспрессия ингибиторов клеточной смерти.
Часть 4. Заключение
Ежедневно в нашем организме появляются клетки, вступившие на путь ракового перерождения. Но далеко не все из них дойдут до конца и образуют злокачественную опухоль. С другой стороны, интересно клеточное поведение в процессе малигнизации, когда клетка способна «выключать» отдельные гены, мешающие ее перерождению. Современные исследования в области молекулярной онкологии и раковой геномики дают повод надеяться на окончательное понимание основ малигнизации и физиологии злокачественных клеток. Также в последнее время проводятся разработки новых противораковых препаратов, направленных на исправление дефектных сторон «больных» клеток. Возможно, изучение именно особенностей раковой клетки приведет к созданию лекарства, способного снизить страшные прогнозы Всемирной организации здравоохранения.
Зависимость развития онкологического заболевания от возраста человека
Исследования показали, что в зоне риска заболевания раком находятся пожилые люди, возраст которых достиг показателя 66 лет. Предлагаемый материал будет интересен не только людям преклонного возраста, но и другим категориям, ведь по статистики, раком яичек страдают мужчины возрастом 20-34 лет, а среди детей заболеваемость достигает 1%. В зоне риска люди двадцати лет, 60% страдает острой лимфоцитарной лейкемией.
Как возраст связан с возникновением и развитием онкологических заболеваний
Доктор Дэвид Бойд обозначил, что между развитием онкологического заболевания и возрастом человека есть связь. Это он аргументирует так: с возрастом привычки человека усугубляются, плюс дополнительно появляется больше вероятных скрытых рисков, их не всегда можно контролировать, к примеру, влияние ультрафиолета, токсинов. Есть и те риски, которые подлежат устранению, например, курение, неправильные рацион и режим сна. Все эти факторы влияют на клетки, они переходят в стадию мутации, ослабляя иммунную систему, а это приводит к онкологическим заболеваниям. Рак в пожилом возрасте - распространенное заболевание. В молодости в организме человека развиваются предраковые клетки, но иммунная система человека может еще с ними бороться, защищая организм. С годами иммунитет человека слабеет, что и приводит к развитию раковых клеток.
Средний возраст диагностирования онкологии у человека
В зоне риска находятся люди от 51 до 73 лет. Для каждого возраста характерно развитие своего вида онкологического заболевания, с возрастом страдают определенные органы. Статистика значимости развития рака от возраста показывает, что у пациентов до 20 лет (средний возраст 15 лет) смертность составляет 0,3%. Среди людей старшего возраста за прошлый год такие цифры (мировая статистика): новых случаев - 18 млн. людей, смертность - 9,6 млн. пациентов. Существует 10 распространенных видов онкологических заболеваний, данные представлены в таблице ниже.
| Тип заболевания | Возраст пациента, лет |
|---|---|
| Рак груди | 62 |
| Рак легких | 70 |
| Рак простаты | 66 |
| Рак толстого кишечника и прямой кишки | 68 |
| Рак мочевого пузыря | 73 |
| Меланома | 63 |
| Неходжкинская лимфома | 63 |
| Рак щитовидной железы | 51 |
| Рак почки | 64 |
| Лейкемия | 66 |
Все виды рака характерны для людей, достигших 65-летнего возраста.
Почему в старшем возрасте чаще возникает рак
Причин возникновения рака в пожилом возрасте множество, выделим основные:
- изменение характеристик тканей;
- препятствие активации определенных генов;
- вредные привычки;
- неправильное питание;
- алкоголь.
Учеными было проведено множество исследований, помогающих понять, как возраст влияет на развитие раковых клеток. Вот что удалось определить: с возрастом не все гены активируются, это означает, что клетка не способна запускать важные для организма процессы, в связи с чем существует вероятность того, что она может стать клеткой, провоцирующей рак. Основной причиной остается ослабление иммунитета, а это приводит к увеличению в организме микробов, инфекций, воспалительных процессов.
Заключение
Столкнувшись с проблемой, люди начинают активно искать выходы из ситуации. Правильное решение - обращение в онкологический центр, где работают квалифицированные врачи.
Пациенты онкологического центра «София» получают помощь, поддержку, а также такие преимущества:
- мировые стандарты лечения;
- социальную адаптацию;
- реабилитацию.
Читайте также:
- Гиперпигментации (меланозы) после островоспалительных дерматозов
- Травма спинного мозга у детей
- Случай лечения гонартроза с протезированием синовиальной жидкости высокомолекулярным гиланом
- Фазы жизнедеятельности при гинекологической операции. Метаболические нарушения после операции
- Исследование и диагностика рака поджелудочной железы
